微波輔助提取花生紅衣和花生殼中多酚物質(zhì)及抗氧化活性對(duì)比研究
溫志英,郭清爽,劉 坤,趙 飛
(1.河北經(jīng)貿(mào)大學(xué)生物科學(xué)與工程學(xué)院,河北石家莊 050061;2.河北經(jīng)貿(mào)大學(xué)工商管理學(xué)院,河北石家莊 050061)
花生(Arachis hypogaea L.)是全球最重要的四大油料作物(油菜、大豆、花生、芝麻)之一。我國(guó)是世界花生生產(chǎn)大國(guó)和花生加工利用強(qiáng)國(guó)[1],2018 年花生年總產(chǎn)量1 733.2 萬(wàn)t,居世界首位[2]。花生殼和紅衣是花生的副產(chǎn)物,我國(guó)年產(chǎn)花生殼約520 萬(wàn)t,花生紅衣600 t,除了少部分被用作中藥、飼料和燃料外,資源浪費(fèi)極其嚴(yán)重[3-4]。
Francisco M L 等人[5]、Elsorady M E 等人[6]和Adhikari B 等人[7]研究表明花生皮、殼含有豐富的多酚類(lèi)物質(zhì)(白藜蘆醇、原花色素、黃酮類(lèi)等),具有抗氧化、降血糖、抗腫瘤等生物活性,可作為防癌、抗突變、防治心血管疾病藥物的主要有效成分和用作安全無(wú)毒的新型天然抗氧化劑。劉翠等人[8-9]的研究表明花生紅衣多酚還是有效的食品防腐保鮮劑。微波輔助提取(MAE)具有提取時(shí)間短、效率高、能耗低的特點(diǎn),同時(shí)能降低熱敏性物質(zhì)降解風(fēng)險(xiǎn),是一種環(huán)境友好的綠色提取技術(shù)[10-13]。因此,通過(guò)微波輔助工藝提取花生皮、殼中的多酚類(lèi)物質(zhì),并對(duì)其抗氧化活性進(jìn)行比較研究。試驗(yàn)參考Jayaprakasha G 等人[14]的方法,以抗壞血酸當(dāng)量濃度(mg AA/g)表示花生紅衣、花生殼DPPH 自由基的清除能力,目前在國(guó)內(nèi)未見(jiàn)報(bào)道。研究成果對(duì)于有效利用我國(guó)豐富的花生紅衣和花生殼資源中的天然多酚活性成分,實(shí)現(xiàn)循環(huán)農(nóng)業(yè)和循環(huán)經(jīng)濟(jì)具有深遠(yuǎn)意義。
1 材料與設(shè)備
1.1 材料
花生紅衣、花生殼,市售帶殼花生手工剝殼。
1.2 試劑
沒(méi)食子酸(Gallic acid,GA),抗壞血酸(Ascorbic acid,AA),1,1-二苯基-2-三硝基苯肼(DPPH),福林酚試劑,Sigma-Aldrich 公司提供;無(wú)水Na2CO3、無(wú)水乙醇、甲醇、硫酸亞鐵、水楊酸,均為分析純。
1.3 儀器與設(shè)備
HH-4 型恒溫水浴鍋、RA-8 微波萃取儀、DFY-300 g 搖擺式高速中藥粉碎機(jī)、SHD-Ⅲ型循環(huán)水式多用真空泵、722E 型分光光度計(jì)、72-1 型電熱恒溫干燥箱、800 型離心沉淀器、Synergy HT 多功能酶標(biāo)儀等。
1.4 試驗(yàn)方法
1.4.1 花生皮、殼預(yù)處理
花生皮、殼→50 ℃下恒溫鼓風(fēng)干燥箱干燥4 h→粉碎機(jī)粉碎→過(guò)40 目篩→正己烷浸提脫脂24 h→-20 ℃冰箱密封避光儲(chǔ)存,備用。
1.4.2 花生紅衣、花生殼多酚提取
花生皮殼粉末→稱(chēng)量→乙醇水溶液恒溫浴振蕩(160 r/min,60 ℃)10 min→微波萃取→離心→取上清液→定容→測(cè)定吸光度→計(jì)算花生紅衣、花生殼多酚得率(以當(dāng)量沒(méi)食子酸(GA)表示)。

式中:A——吸光度;
m——稀釋倍數(shù);
n——提取液體積,mL;
G——花生紅衣、花生殼質(zhì)量,g。
1.4.3 多酚含量的測(cè)定
多酚的含量測(cè)定采用Folin-Ciocalteu 法[15]。沒(méi)食子酸回歸方程:Y=0.006 1X+0.077 7,R2=0.999 6。
沒(méi)食子酸標(biāo)準(zhǔn)曲線見(jiàn)圖1。

圖1 沒(méi)食子酸標(biāo)準(zhǔn)曲線
1.4.4 花生紅衣、花生殼多酚類(lèi)化合物的體外抗氧化活性研究
(1)DPPD 自由基清除能力測(cè)定。以抗壞血酸(AA,0.02 mg/mL)作為對(duì)照標(biāo)準(zhǔn),其體外抗氧化活性作用以抗壞血酸當(dāng)量表示mg AA/g,采用Jayaprakasha G 等人[14]的方法測(cè)定DPPD 自由基清除能力測(cè)定。
抗壞血酸標(biāo)準(zhǔn)曲線見(jiàn)圖2。

圖2 抗壞血酸標(biāo)準(zhǔn)曲線
(2)羥基自由基的清除能力測(cè)定。采用水楊酸法[16-17]。
1.5 數(shù)據(jù)處理
采用SPSS 25.0 統(tǒng)計(jì)軟件進(jìn)行數(shù)據(jù)分析,應(yīng)用單因素方差分析(ANOVA)及Duncan's 多重檢驗(yàn)進(jìn)行顯著性分析,以p<0.05 為差異具有統(tǒng)計(jì)學(xué)意義。數(shù)值以均質(zhì)±標(biāo)準(zhǔn)差SD 表示。
2 結(jié)果與分析
2.1 單因素試驗(yàn)結(jié)果
2.1.1 乙醇體積分?jǐn)?shù)對(duì)花生紅衣、花生殼多酚得率的影響
準(zhǔn)確稱(chēng)取2 g 花生紅衣、花生殼粉末,料液比1∶40,加入不同體積分?jǐn)?shù)的乙醇溶液,微波功率240 W,微波提取時(shí)間30 s,其余步驟同1.4.2。
乙醇體積分?jǐn)?shù)對(duì)花生紅衣、花生殼多酚得率的影響見(jiàn)圖3。
由圖3 可知,花生紅衣多酚在乙醇體積分?jǐn)?shù)為80%時(shí)得率最高為137.11 mg GA/g,而花生殼多酚在乙醇體積分?jǐn)?shù)為60%時(shí)得率最高為15.34 mg GA/g。得率先升高后下降是由于不同體積分?jǐn)?shù)乙醇極性不同,根據(jù)相似相溶原理,多酚在極性最相似的溶液中溶出最高,得率最大。由于花生紅衣與花生殼二者多酚的具體成分差異較大,花生紅衣中的酚類(lèi)物質(zhì)以原兒茶酸、兒茶素、原花青素為主[9],而花生殼中主要為木犀草素[18-19],故而乙醇體積分?jǐn)?shù)對(duì)二者的影響不同。

圖3 乙醇體積分?jǐn)?shù)對(duì)花生紅衣、花生殼多酚得率的影響
2.1.2 微波功率對(duì)花生紅衣、花生殼多酚得率的影響
分別以80%,60%的乙醇為提取劑提取花生紅衣、花生殼多酚,微波功率為160,320,480,640,800 W,其余條件同2.1.1 進(jìn)行微波提取。
微波功率對(duì)花生紅衣、花生殼多酚得率的影響見(jiàn)圖4。
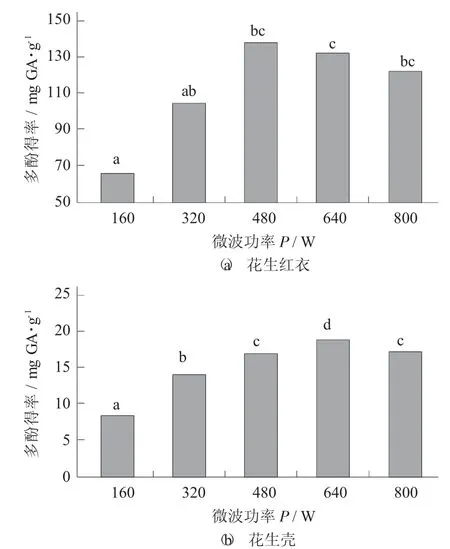
圖4 微波功率對(duì)花生紅衣、花生殼多酚得率的影響
由圖4 可知,隨微波功率的增大,總多酚得率增加,但繼續(xù)增大微波功率,多酚得率下降。花生紅衣在微波功率達(dá)到480 W 時(shí),多酚得率最大為138.07 mg GA/g,花生殼在微波功率640 W時(shí)達(dá)到最大為18.96 mg GA/g。可能是因?yàn)檫m當(dāng)?shù)奈⒉üβ视欣诨ㄉt衣中多酚的溶出,但過(guò)高的微波功率則有可能破壞多酚類(lèi)化合物,致使其得率下降。
2.1.3 料液比對(duì)花生紅衣、花生殼多酚得率的影響
花生紅衣(80%乙醇,480 W),花生殼(60%乙醇、640 W),料液比為1∶20,1∶30,1∶40,1∶50,1∶60,其余條件同2.1.1 進(jìn)行微波提取。
料液比對(duì)花生紅衣、花生殼多酚得率的影響見(jiàn)圖5。

圖5 料液比對(duì)花生紅衣、殼多酚得率的影響
由圖5 可知,隨著料液比的增加,多酚得率逐漸增加,當(dāng)料液比為1∶40 時(shí),花生紅衣、花生殼多酚得率均最大,之后增加料液比,多酚得率有所下降,由此可見(jiàn)增大料液比有利于多酚物質(zhì)溶出,當(dāng)料液比為1∶40 時(shí),多酚溶出達(dá)到最高,當(dāng)料液比繼續(xù)增大會(huì)造成雜質(zhì)過(guò)多的流出從而阻止了多酚類(lèi)化合物的溶解,影響得率。料液比為1∶40 時(shí),花生紅衣、花生殼的多酚得率分別為145.02 mg GA/g和19.82 mg GA/g。
2.1.4 微波時(shí)間對(duì)多酚得率的影響
花生紅衣(80%乙醇,480 W),花生殼(60%乙醇,640 W),料液比為1∶40,其他條件同2.1.1。
微波時(shí)間對(duì)花生殼多酚得率的影響見(jiàn)圖6。

圖6 微波時(shí)間對(duì)花生殼多酚得率的影響
由圖6 可知,在10~40 s 內(nèi)隨著微波時(shí)間增加,總多酚得率也隨之增加,在40~60 s 內(nèi)得率下降,當(dāng)微波時(shí)間為40 s 時(shí)多酚得率最高,這是因?yàn)槲⒉ㄓ欣诙喾拥娜艹觯?dāng)微波時(shí)間過(guò)長(zhǎng)則會(huì)降解或破壞已溶出的多酚類(lèi)化合物,導(dǎo)致總多酚得率下降,這與Ekezie F G 等人[10]和Zhang G 等人[12]的研究結(jié)果一致。微波時(shí)間40 s 時(shí),花生紅衣、花生殼多酚得率分別為145.96 mg GA/g 和20.55 mg GA/g。
2.2 正交試驗(yàn)
2.2.1 花生紅衣多酚正交試驗(yàn)
根據(jù)正交試驗(yàn)設(shè)計(jì)原理,結(jié)合單因素試驗(yàn)結(jié)果,選取乙醇體積分?jǐn)?shù)、料液比、微波時(shí)間3 個(gè)對(duì)花生紅衣多酚得率影響顯著的因素,采用三因素三水平的正交試驗(yàn)L9(34)優(yōu)化提取工藝[19]。
花生紅衣多酚正交試驗(yàn)結(jié)果見(jiàn)表1,花生紅衣正交試驗(yàn)方差分析見(jiàn)表2。
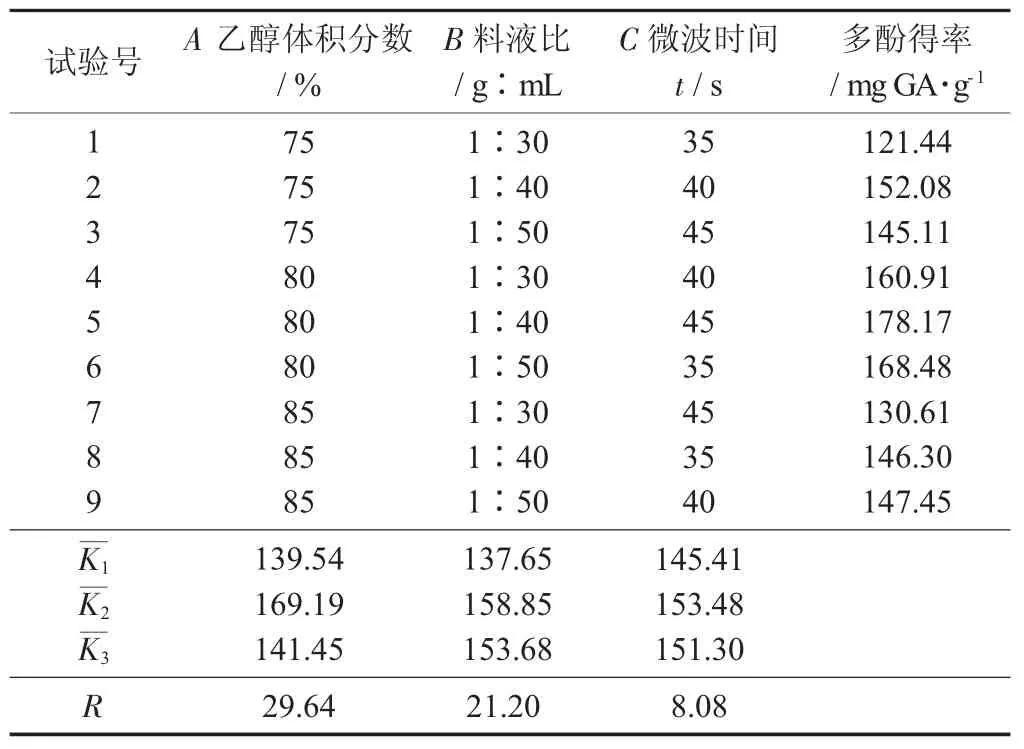
表1 花生紅衣多酚正交試驗(yàn)結(jié)果
由表2 可知,影響花生紅衣多酚得率的因素從大到小為A>B>C,A 和B 對(duì)提取有極顯著影響,C對(duì)提取有顯著影響。最佳工藝條件為A2B2C2,即乙醇體積分?jǐn)?shù)80%,料液比1∶40,微波時(shí)間40 s。按照1.4.2 方法進(jìn)行提取,試驗(yàn)重復(fù)3 次,花生紅衣多酚得率為179.20 mg GA/g,高于李娜等人[18]報(bào)道的147.72 mg GA/g,與Francisco M L 等人[20]研究報(bào)道花生紅衣中的多酚含量在110~280 mg GA/g 試驗(yàn)結(jié)果一致。

表2 花生紅衣正交試驗(yàn)方差分析
2.2.2 花生殼多酚正交試驗(yàn)
根據(jù)正交試驗(yàn)設(shè)計(jì)原理,結(jié)合單因素試驗(yàn)結(jié)果,選取微波功率、料液比、微波時(shí)間為三因素,采用三因素三水平的正交試驗(yàn)L9(34)優(yōu)化提取工藝。
花生殼多酚正交試驗(yàn)結(jié)果見(jiàn)表3,花生殼正交試驗(yàn)方差分析見(jiàn)表4。
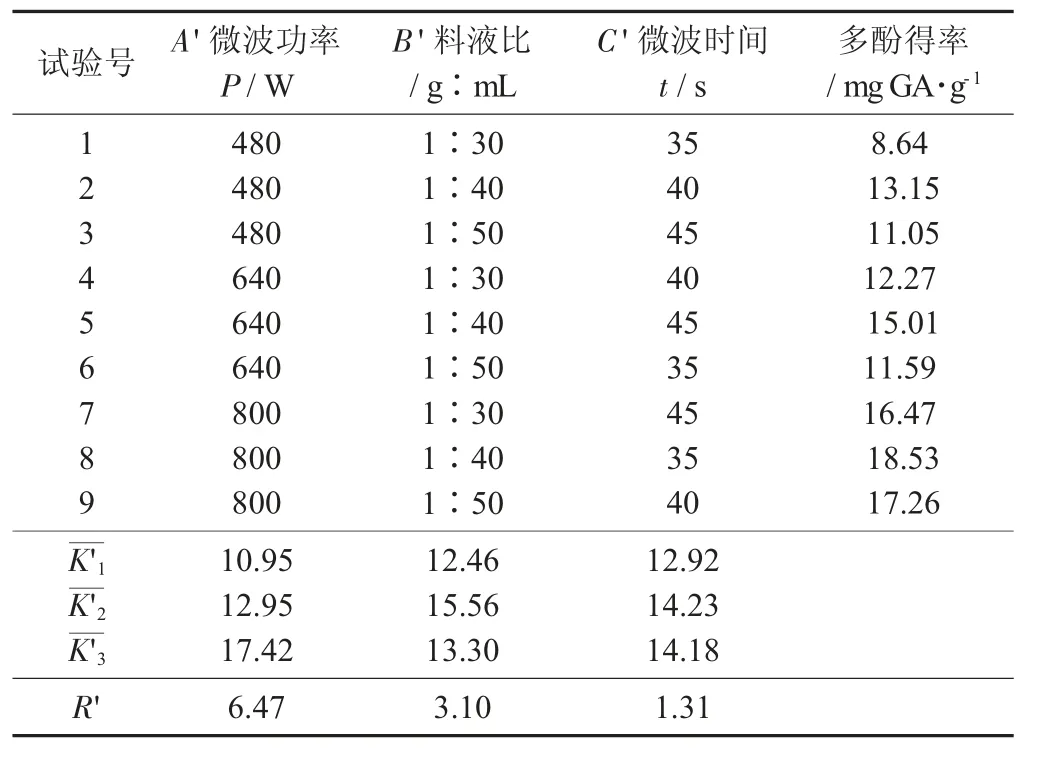
表3 花生殼多酚正交試驗(yàn)結(jié)果
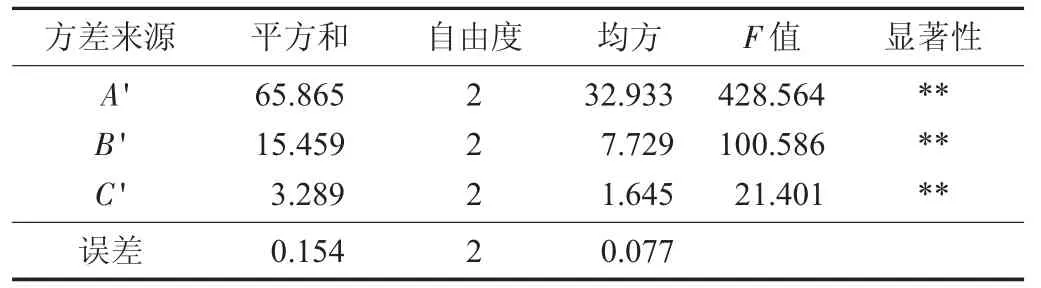
表4 花生殼正交試驗(yàn)方差分析
由表4 可知,影響花生紅衣多酚得率的因素從大到小為A'>B'>C',三者對(duì)提取有極顯著影響。最佳工藝條件為A'3B'2C'2,即微波功率800 W,料液比1∶40,微波時(shí)間40 s。以60%乙醇為提取液,按照1.4.2 方法進(jìn)行提取,試驗(yàn)重復(fù)3 次,得花生殼多酚得率為20.63 mg GA/g。
2.3 花生紅衣、花生殼多酚類(lèi)對(duì)DPPH 自由基的清除能力
花生紅衣、花生殼多酚抗氧化活性比較見(jiàn)圖7。
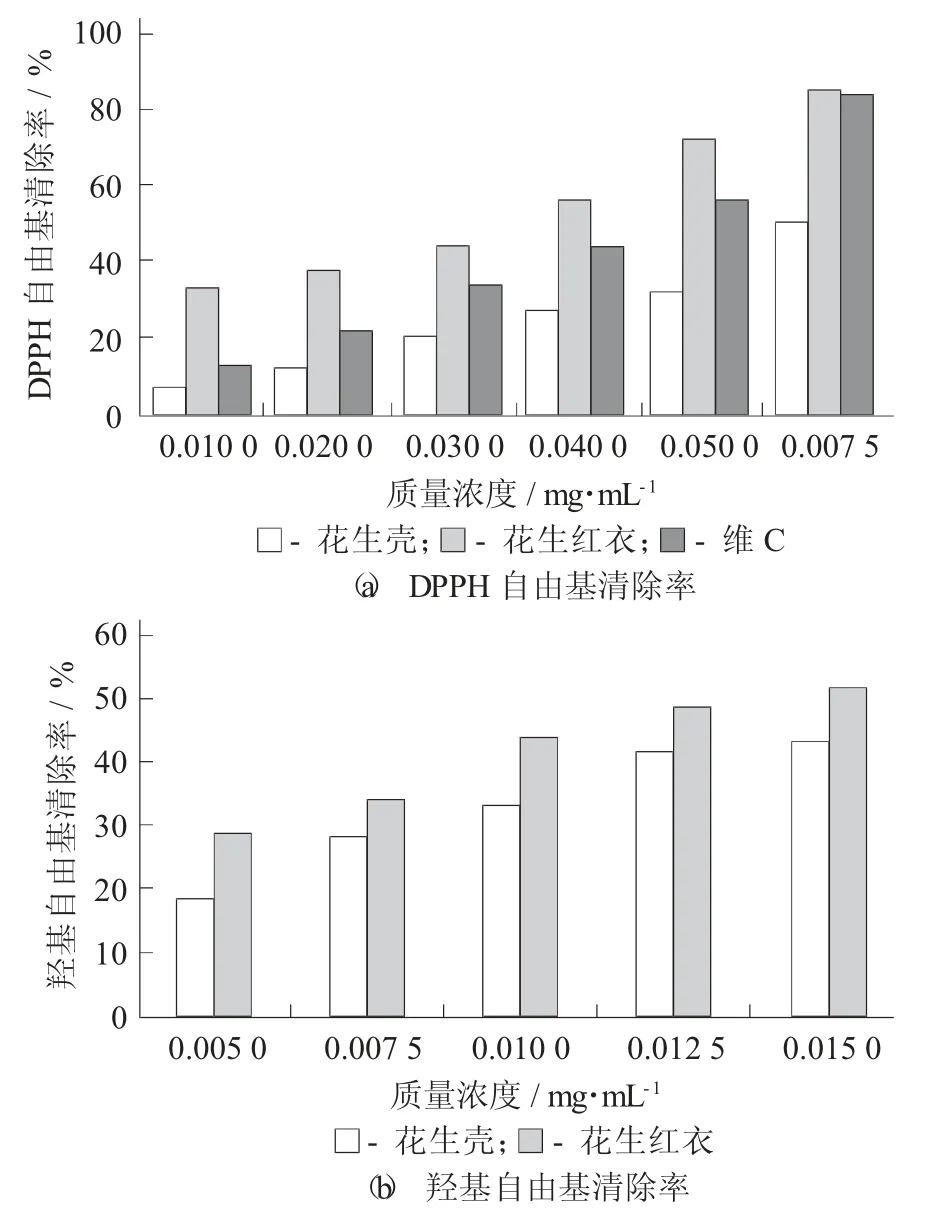
圖7 花生紅衣、花生殼多酚抗氧化活性比較
由圖7(a)可知,當(dāng)質(zhì)量濃度為0.005 mg/mL時(shí),花生紅衣多酚、抗壞血酸、花生殼多酚DPPH自由基清除率分別為72.28%,56.40%,32.27%,花生紅衣多酚對(duì)自由基的清除能力顯著高于花生殼多酚,同時(shí)優(yōu)于抗壞血酸,具有顯著差異(p<0.05);當(dāng)質(zhì)量濃度為0.007 5 mg/mL 時(shí),花生紅衣和抗壞血酸清除率分別為85.59%和84.16%,差異不顯著(p<0.05)。在質(zhì)量濃度為0.000 5~0.007 5 mg/mL 時(shí),抗壞血酸對(duì)DPPH·的清除率與質(zhì)量濃度呈現(xiàn)線性相關(guān)性,回歸方程為Y=10 885X+1.823 3,R2=0.999 3。根據(jù)抗壞血酸標(biāo)準(zhǔn)曲線,花生紅衣多酚的當(dāng)量抗壞血酸為131.56±2.20 mg AA/g,花生殼多酚的當(dāng)量抗壞血酸為6.51±0.71 mg AA/g。因此,花生紅衣清除DPPH 自由基能力顯著高于花生殼(p<0.05),與李娜等人[18]和Meng W 等人[21]已報(bào)道的研究成果一致。
2.4 花生紅衣、花生殼多酚對(duì)羥基自由基清除能力
由圖7(b)可知,花生紅衣、花生殼多酚對(duì)羥基自由基有清除能力均隨著花生紅衣、花生殼多酚質(zhì)量濃度增加而增強(qiáng),當(dāng)多酚質(zhì)量濃度為0.015 mg/mL 時(shí),花生皮、殼多酚的·OH 清除率分別為51.86%和43.26%,花生紅衣多酚的清除羥基自由基能力顯著高于花生殼多酚(p<0.05)。
3 結(jié)論
花生紅衣微波輔助提取多酚物質(zhì)的最佳提取工藝為乙醇體積分?jǐn)?shù)80%,料液比1∶40,微波功率480 W,微波時(shí)間40 s,花生紅衣多酚得率為179.20 mg GA/g;花生殼微波輔助提取多酚物質(zhì)的最佳提取工藝為乙醇體積分?jǐn)?shù)60%,料液比為1∶40,微波功率800 W,微波時(shí)間40 s,花生殼多酚得率為20.63 mg GA/g。
花生紅衣的DPPH 自由基清除能力和羥基自由基清除能力均優(yōu)于花生殼。花生紅衣DPPH 自由基清除能力優(yōu)于抗壞血酸,其當(dāng)量抗壞血酸為131.56±2.20 mg AA/g,花生殼的當(dāng)量抗壞血酸為6.51±0.71 mg AA/g。由此可見(jiàn),花生皮、殼多酚均具有抗氧化性,花生紅衣抗氧化性尤為突出,是一種優(yōu)良的天然抗氧化劑,為開(kāi)發(fā)花生皮殼等農(nóng)業(yè)廢棄物資源提供了依據(jù)。

