汽油PRF 簡化化學反應動力學模型的構建研究
劉凱敏,鄂加強,楊靖,馬寅杰,楊漢乾,羅武生
(1.湖南大學汽車車身先進設計制造國家重點實驗室,湖南長沙 410082;2.中南林業科技大學機電工程學院,湖南長沙 410004)
汽油表征燃料的研究是發動機領域的熱門話題,即選取少數幾種代表性的成分來表征汽油理化特性和燃燒反應特性.當前,越來越多的試驗和數值模擬方法被用來研究汽油燃料的化學反應機理.在進行缸內多維燃燒計算時,由于詳細反應機理會占用大量的計算機內存,且計算時間過長,因此,簡化反應機理是研究發動機缸內燃燒的重要方法.
汽油表征燃料中包含異辛烷和正庚烷兩種主要成分的基礎參考燃料(PRF)常用來表征不同辛烷值的汽油.在PRF 氧化機理的研究中,何邦全等人[1]通過溫度敏感性分析,構建了一個可以合理描述燃料高溫反應過程的PRF 簡化化學反應機理,并模擬研究了不同殘余廢氣率下正庚烷和異辛烷的高溫反應路徑.Ra 和Reitz[2]利用反應速率常數優化的方法對PRF 詳細機理進行簡化,該機理模擬結果與激波管、HCCI 發動機和缸內直噴發動機的試驗數據體現了良好的一致性.Tsurushima[3]構建了一個適用HCCI燃燒的PRF骨架模型,在不同壓力、當量比和辛烷值的條件下,該模型對滯燃期的預測效果良好,并且可以較好地預測HCCI 發動機的缸內壓力和燃燒放熱率.Selim等人[4]詳細分析了PRF84(異辛烷的體積百分數為84%,正庚烷的體積百分數為16%)的燃燒化學反應機理路徑,詳細闡述了造成實驗結果和仿真結果存在差異的原因,并給出了提高反應機理準確性的方法.Rezgui[5]利用數值仿真方法,研究了HCCI發動機在1200 r/min 和進氣壓力為1 bar 的工作條件下,不同氫氣添加比對PRF85燃燒特性的影響.
通過汽油PRF 簡化模型的回顧不難發現,當前國內外學者提出的汽油PRF 簡化動力學機理,很少考慮重要組分演變和層流火焰速度的變化,多數僅通過了滯燃期的驗證.然而,對于實際點燃式發動機,層流火焰速度的大小是缸內氣體流動、燃燒初始條件和可燃混合氣性質綜合效應的體現[6],是燃料化學反應機理可靠性的驗證指標[7].另外,在燃料燃燒各類基礎實驗反應器中,關鍵組分的變化過程與燃油消耗率、燃燒放熱率以及發動機最終排放物息息相關.為了獲得不僅能夠準確描述汽油燃料著火階段,也可以更加準確地反映火焰前鋒面發展、燃料燃燒放熱和排放物生成特性的汽油表征燃料簡化模型,本文將利用反應路徑分析和敏感性分析方法對異辛烷和正庚烷的詳細化學反應動力學模型進行簡化,根據“半解耦”思想,構建包含41種組分和131個反應的PRF 簡化化學反應動力學模型,并通過基礎反應器包括激波管(ST)、一維層流火焰速度(LFS)和射流攪拌器(JSR)的實驗數據進行驗證.
1 汽油PRF簡化動力學模型的構建
1.1 仿真工具及機理的選擇
本文采用的仿真工具為美國Sandia 國家實驗室開發并推出的CHEMKIN PRO 大型氣相化學反應動力學程序.異辛烷的詳細化學反應動力學模型采用最為著名的LLNL 實驗室Curran 等人提出的詳細氧化模型[8],涉及857 種組分和3606 個基元反應.該模型包括所有與低溫化學反應動力學和高溫化學反應動力學有關的化學反應,已經被用在射流攪拌器、流動反應器、激波管和某一摩托車發動機等反應器中研究異辛烷的氧化過程.
在進行異辛烷氧化過程的分析中,由于燃料的氧化燃燒過程受溫度、壓力及當量比的影響很大,因此需要在多種工況下研究燃料的氧化過程.限于文章篇幅,本文選用Dec 等人[9]使用異辛烷作為燃料的單缸HCCI發動機試驗數據進行建模,此發動機的壓縮比為18,發動機排量為0.98 L.選用燃空當量比為0.26,發動機轉速1200 r/min,初始壓力和初始溫度為120 kPa 和395 K 的工況條件為例,討論異辛烷詳細機理模型的化學反應動力學過程.
1.2 異辛烷詳細化學反應動力學模型的簡化
1.2.1 低溫反應階段
在化學反應剛開始的低溫區域,燃料的消耗由異辛烷(iC8H18)和氧氣直接發生反應開始,并放出部分熱量.圖1 給出了異辛烷與氧氣的化學反應速率.由圖可知,異辛烷氧化平均反應速率最大的反應為R3167 和R3169,分別生成同分異構體aC8H17和cC8H17.燃料與氧氣的直接反應屬于低溫反應階段的一種脫氫反應.
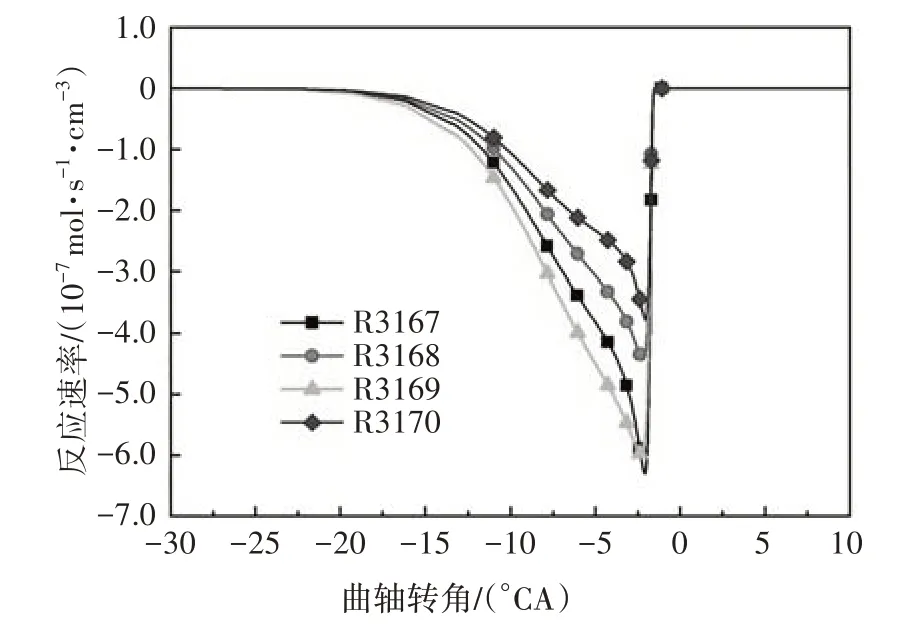
圖1 異辛烷氧化反應速率Fig.1 The oxidation reaction rate of iso-octane
參與脫氫反應的自由基主要包括H、OH、O、CH3、HO2、H2O2、CH3O、C2H5、C2H3等.其中,在低溫反應階段,HO2在所有脫氫自由基中摩爾分數最大(見圖2),HO2與異辛烷反應生成辛烷基以及在高溫反應中起重要作用的H2O2.圖3給出了異辛烷與HO2的反應速率,有較大反應速率的兩個脫氫反應依次為R3159、R3161.隨著反應的進行,自由基OH 也大量生成且遠遠多于其他脫氫自由基.
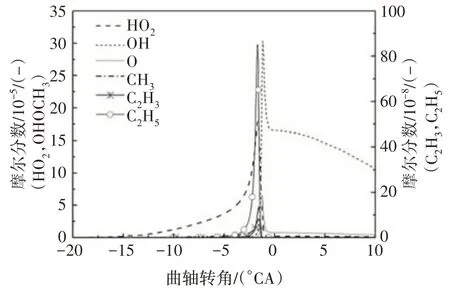
圖2 異辛烷脫氫自由基摩爾分數Fig.2 The dehydrogenation free radicals of iso-octane
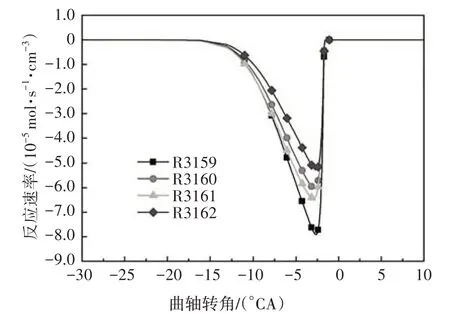
圖3 異辛烷與HO2脫氫反應速率Fig.3 The dehydrogenation rate of iso-octane with HO2
圖4 給出了異辛烷與OH 自由基脫氫反應的溫度敏感性分析.本文中燃料(異辛烷或正庚烷)氧化反應的分析在HCCI發動機模型中進行,反應的敏感性系數為負,代表該反應的發生有利于燃料的氧化分解,反應顯示較高的負敏感性系數,則意味著加大該反應速率能大大提高系統的反應活性;反之反應的敏感性系數為正,代表該反應對燃料的氧化分解起抑制作用.由圖4可知,R3151在四個異辛烷與OH脫氫反應中敏感性系數最大,并生成aC8H17,這說明aC8H17是最重要的脫氫產物,這與圖5 中異辛烷與OH的反應路徑分析結果一致.為了盡可能的減少基元反應數目,本文選用aC8H17作為唯一的脫氫產物,對應的脫氫反應為:
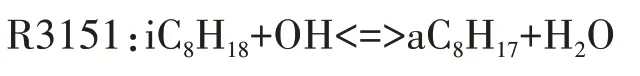
圖4 異辛烷與OH脫氫反應的溫度敏感性分析Fig.4 The temperature sensitivity analysis of dehydrogenation reaction of iso-octane with OH
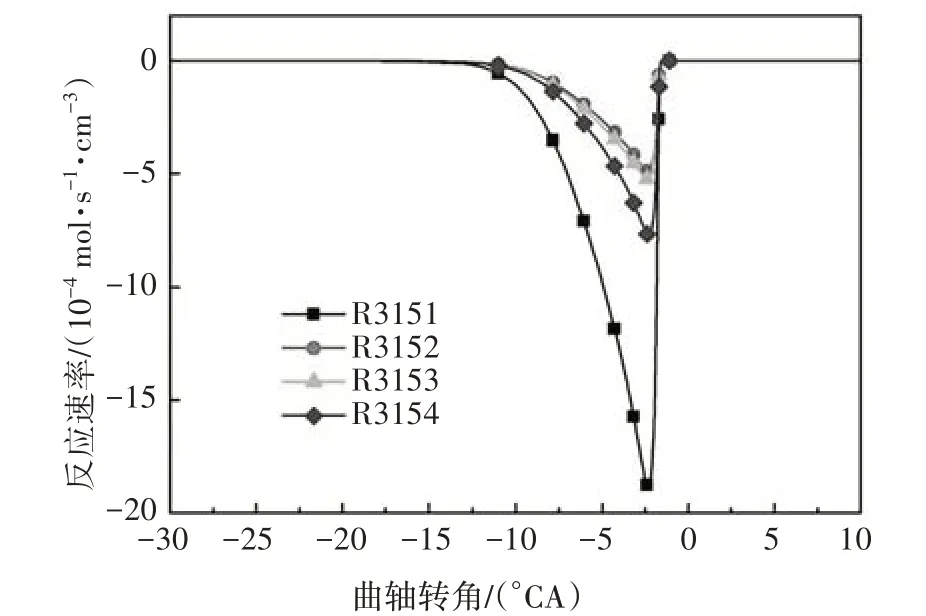
圖5 異辛烷與OH脫氫反應速率Fig.5 The dehydrogenation rate of iso-octane with OH
選定aC8H17作為唯一的脫氫產物后,其對應的第一次加氧反應為R3216,生成aC8H17O2.隨后第一次加氧產物生成4 種C8H16OOH 同分異構化產物,圖6 給出了aC8H17O2同分異構化反應的溫度敏感性分析.其中,R3266 和R3267 對aC8H17O2的同分異構化影響最大,分別生成aC8H16OOH-a、aC8H16OOH-b,有助于燃料的低溫氧化.然而,aC8H17O2生成aC8H16OOH-c、aC8H16OOH-d 的同分異構化反應敏感性系數很小,且R3268 對燃料氧化起抑制作用.因此,選擇敏感性系數最大的R3266 作為aC8H17O2的同分異構化反應.

圖6 第一次加氧產物C8H17O2發生同分異構化的溫度敏感性分析Fig.6 The temperature sensitivity analysis of the isomerization reaction of the first oxygenated product C8H17O2
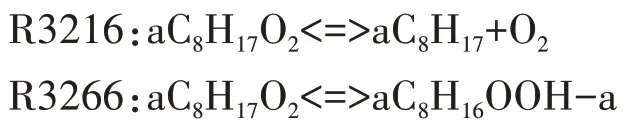
中間產物aC8H16OOH-a 確定后,對應的第二次加氧反應為R3298.第二次加氧產物經歷兩次分解反應,釋放出OH 自由基,這是低溫反應階段OH 自由基的主要來源.第二次加氧反應及其對應的兩次分解反應分別為:
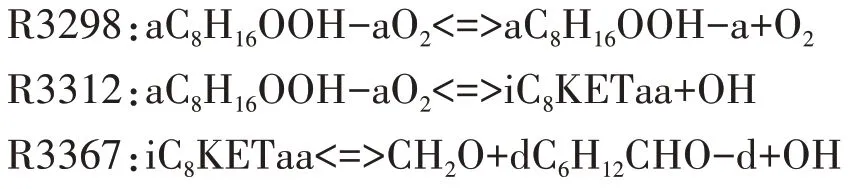
1.2.2 負溫度系數區
隨著溫度的升高,C8H16OOH 各同分異構體進行第二次加氧反應逐漸減弱,系統的整體反應速率下降,化學反應鏈轉向C8H16OOH 的分解反應.通過分析C8H16OOH 各同分異構體的分解反應路徑,理論上C8H16OOH分解生成烯烴和HO2的反應路徑對系統的整體反應速率抑制作用最大,但是異辛烷氧化詳細反應機理中,沒有給出C8H16OOH 的同分異構體aC8H16OOH-a 分解生成烯烴和HO2的反應.因此,本文選擇aC8H16OOH-a 分解生成小分子烯烴、醛和OH的反應R3378,表現負溫度系數區的主要反應特征.
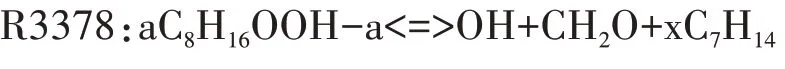
1.2.3 高溫反應階段
在高溫反應階段,第一次加氧反應C8H17O2<=>C8H17+O2的平衡狀態變得越來越重要,平衡狀態從形成第一次加氧產物C8H17O2的方向,向C8H17O2分解為C8H17和O2的方向轉移,高溫反應鏈進一步轉向辛烷基C8H17的分解.對于選定的唯一脫氫產物aC8H17,詳細反應機理中包含R3179、R3180 兩個裂解反應和R3365、R3366 兩個同分異構化反應.由于高溫條件下辛烷基裂解成小分子烷烴基和烯烴基所需的活化能比裂解成大分子烴基少,小分子組分生成量比大分子組分多,因此,選擇R3180 作為辛烷基的分解反應.
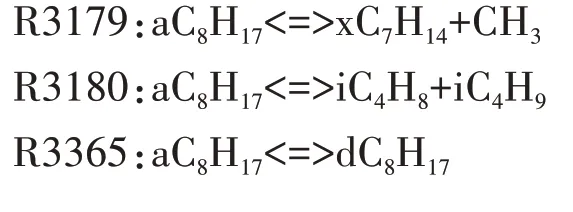
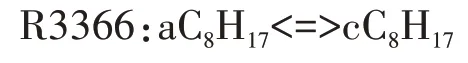
圖7 給出了H2O2主要反應路徑.由圖可見,H2O2的主要生成反應按反應速率由大到小排列依次為R50、R54,其中R50 中H2O2由兩個HO2分子結合生成,HO2自由基主要來源于以下兩方面:其一,在負溫度系數階段,C8H16OOH 各同分異構體發生分解反應,生成大量HO2;其二,在高溫反應階段,R46 對HO2自由基的生成起主導作用,如圖9 所示的HCO自由基主要反應路徑可見,在高溫反應的第一階段,HCO 自由基的主要消耗反應為R46,HCO 被氧化生成大量的HO2和CO,HO2在此階段非常活躍并通過R50、R54 等反應被逐漸消耗生成H2O2.對H2O2的主要消耗反應依次為R51、R537.
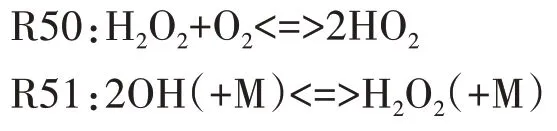
圖7 H2O2主要反應路徑Fig.7 The main reaction path of H2O2
如圖2 所示,對燃料分子氧化最為重要的自由基OH在高溫反應階段大量生成,各組分間化學反應加劇,使燃燒放熱率增大,缸內燃燒溫度也急劇上升至最大值.圖8 給出了OH 自由基主要反應路徑.在高溫反應第一階段,R51 具有最高的羥基生成速率,該反應所需活化能較高,在缸內溫度升高至1060 K時才能發生,為吸熱反應;羥基最重要的消耗反應為R32.在高溫反應的第二階段,生成OH 自由基主要的基元反應依次為R10、R8,此類反應所需的活化能更高,通常需要缸內溫度上升至1200 K時才會進行;此階段OH自由基主要的消耗反應依次為R7、R49.
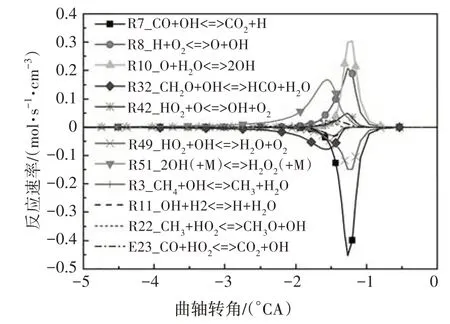
圖8 OH自由基主要反應路徑Fig.8 The main reaction path of OH free radical
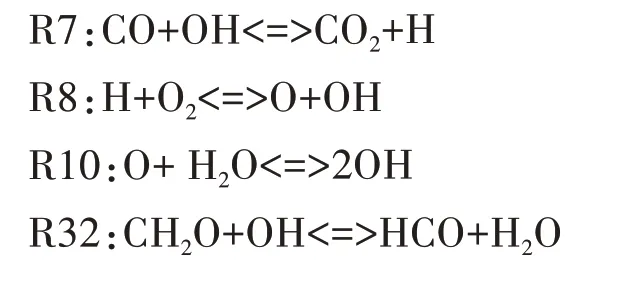
圖9 給出了HCO 自由基的主要反應路徑.由圖可知,HCO 主要通過CH2O 與OH 的反應R32 生成,其主要的消耗反應依次為R46、R12.R46 中HCO 通過進行氧化反應生成CO,R12 中HCO 通過吸熱分解為H 和CO.
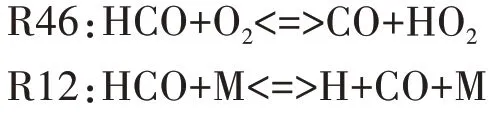
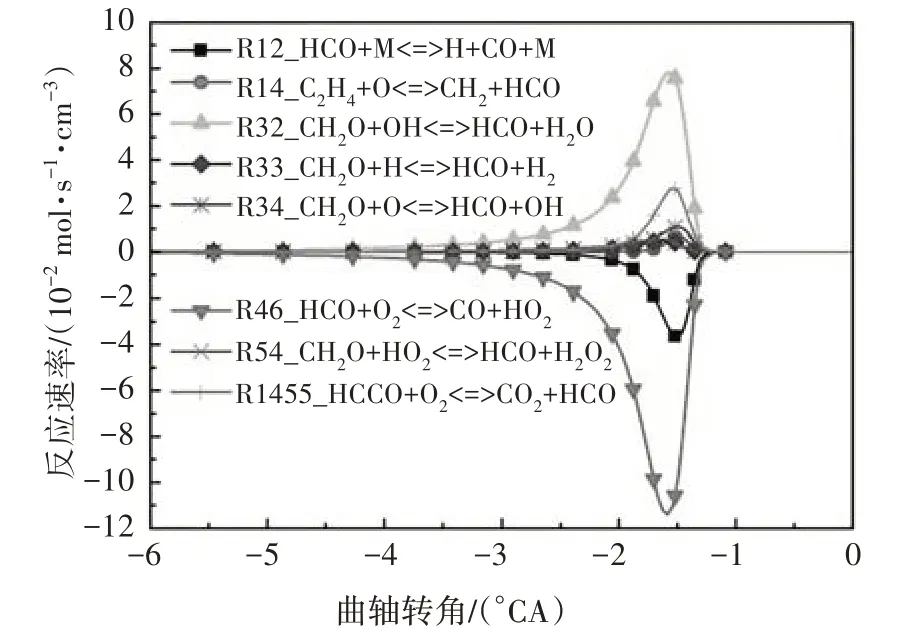
圖9 HCO自由基主要反應路徑Fig.9 The main reaction path of HCO free radical
異辛烷氧化的高溫反應開始后,CH2O 的摩爾分數逐漸達到最大值,在高溫反應第一階段結束時減小至零,隨后CO 的摩爾分數也快速上升達到峰值.隨著燃料被完全氧化,CO 逐漸轉化為CO2,此過程伴隨著大量的光和熱,所以高溫反應第二階段通常被稱作熱焰反應階段.由圖10 所示的CO 主要反應路徑可知,CO 通過反應R7 生成CO2的反應速率最大,因此羥基是降低CO含量的關鍵自由基.
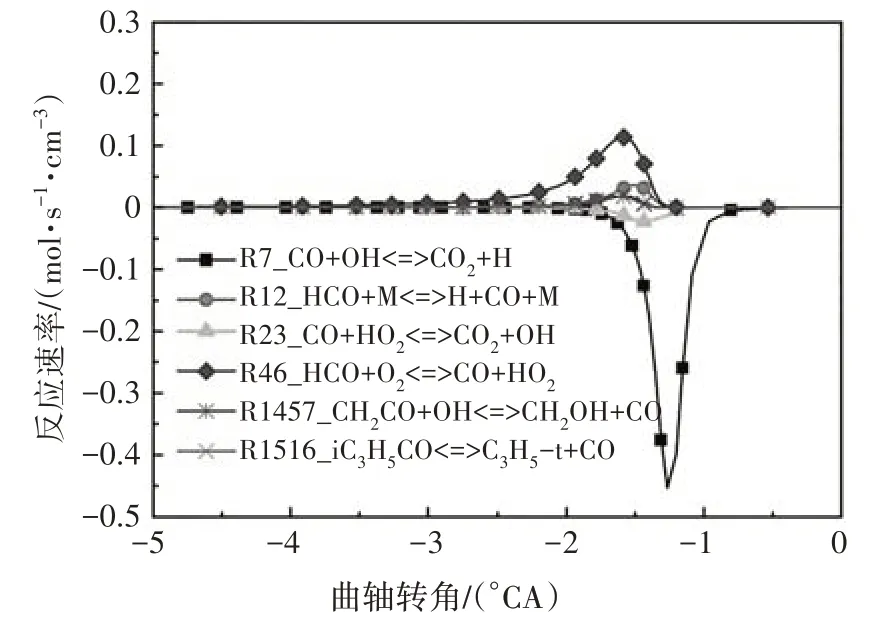
圖10 CO主要反應路徑Fig.10 The main reaction path of CO
通過上述對異辛烷燃料在低溫反應階段、負溫度系數區和高溫反應階段的基本反應鏈以及所涉及的中間產物反應路徑分析,本文繪制了異辛烷簡化機理的主要反應路徑,如圖11 所示.值得注意的是,限于文章篇幅,本文沒有詳細列出其余主要中間產物的反應路徑簡化過程.比如,在低溫反應階段,R3367 中iC8KETaa 分解生成CH2O、dC6H12CHO-d 和OH,其中dC6H12CHO-d 是重要的中間產物,找出dC6H12CHO-d 反應路徑上逐步生成小分子組分的關鍵反應顯得尤為重要.dC6H12CHO-d 主要通過反應R3433 消耗生成iC3H5CHO 和iC3H7,而iC3H5CHO 的主要消耗反應為R1510,生成iC3H5CO 和H2O.在高溫反應階段,選擇R3180:aC8H17<=>iC4H8+iC4H9作為辛烷基的分解反應.對于iC4H9,其主要生成反應為R3180,并通過反應R262 消耗生成C3H6和CH3.對于另一個分解產物iC4H8,其主要消耗路徑為R213,在此反應中iC4H8與OH 自由基發生脫氫反應生成iC4H7.因此,異辛烷簡化機理中主要中間產物的反應路徑可根據圖11,并結合本文選用的反應路徑分析和敏感性分析方法分析得出.
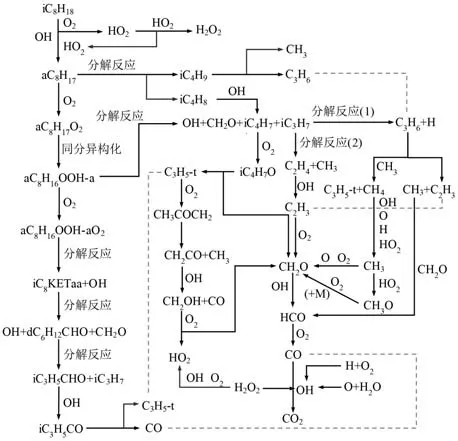
圖11 異辛烷簡化機理的主要反應路徑Fig.11 The main reaction path of iso-octane reduced mechanism
1.3 正庚烷詳細化學反應動力學模型的簡化
對正庚烷的詳細氧化機理研究,最為著名的仍是LLNL 實驗室的Curran 等人提出的正庚烷詳細氧化模型[10],該機理給出了正確的燃燒氧化速率和化學反應路徑,預測結果已經被大量實驗結果驗證.Tsurushima[3]曾指出異辛烷與正庚烷具有相似的燃燒氧化過程,本文在對異辛烷詳細氧化機理進行分析和簡化的基礎上,同樣分析了正庚烷燃燒氧化的主要反應路徑和重要中間產物,并得出了與Tsuru?shima 等人相同的結論.由于研究分析方法與1.2 節相同,為了節省文章篇幅,本文沒有詳細列出正庚烷氧化的研究過程.
1.4 PRF簡化化學反應動力學模型的構建
通過對比多種化學反應動力學簡化機理構建方法發現,Liu 等人[11]提出的“半解耦”思想,能夠對關鍵組分及層流火焰速度的演變過程作出良好的預測,該方法具體描述為:將詳細和普適的H2/CO/C1~Cn小分子機理(n取1、2 或者3)作為整個機理的“內核”,以準確計算燃料在高溫階段的火焰傳播特性及化學反應過程;將燃料低溫階段的化學反應進行簡化后,與“內核”機理進行耦合,以模擬燃料的著火特性.在構建包含多組分燃料的骨架模型時,可以以可靠的“內核”機理作為基礎,通過簡化不同組分燃料的低溫反應機理并調整其化學反應常數,從而對滯燃期、層流火焰速度和關鍵組分的變化等特性參數進行準確預測.
本文構建的PRF 化學反應動力學簡化模型,涉及異辛烷和正庚烷兩種燃料組分.根據“半解耦”思想,本文選用Liu模型[11]中C0~C1的小分子機理作為PRF 燃料的“內核”,選擇“內核”機理后,C0~C1 的小分子機理無需修改,只需要在“內核”機理基礎上,構建并添加PRF 燃料兩種成分的低溫反應和大分子向小分子的過渡反應.選用Patel 等人[12]的C2~C3 的子機理作為過渡機理,這是由于該機理已經被證實具有很好的實用性和可靠性,且機理規模很小,僅包含C2H3、C2H4、C3H4、C3H5、C3H6和C3H7六種組分.結合本文對異辛烷和正庚烷的低溫反應及大分子向小分子的過渡反應的簡化,最終構建了包含41 種組分和131個反應的PRF簡化化學反應動力學模型.
2 汽油PRF簡化動力學模型的驗證
2.1 激波管的驗證
在驗證本文所構建PRF 簡化動力學模型的準確性時,使用在激波管中計算的滯燃期與Fieweger 等人[13]和Ciezki 等人[14]的實驗數據進行對比.限于文章篇幅,本節僅列出某一組分或組分間混合物的對比結果,如無特殊說明,各組分比例是指液體體積分數.在PRF 基礎燃料中,若異辛烷的體積百分數為80%,正庚烷的體積百分數為20%,則該燃料簡寫為PRF80.為了方便表述,本文圖例中使用Exp和Cal分別表示文獻中的實驗值和本文所構建的簡化動力學模型的計算值.
圖12~圖14 分別給出了本文構建的PRF 簡化動力學模型中異辛烷、正庚烷及其兩種組分的混合物在不同邊界條件以及混合濃度下的滯燃期預測值與試驗值的對比.由圖可知,新構建的PRF簡化動力學模型的滯燃期計算值與試驗結果體現了很好的一致性,能夠很好地預測燃料氧化的負溫度系數行為,計算值稍微偏離試驗值的主要原因是由于內核機理中涉及H、H2、CH3和CH4反應的簡化所致[3].
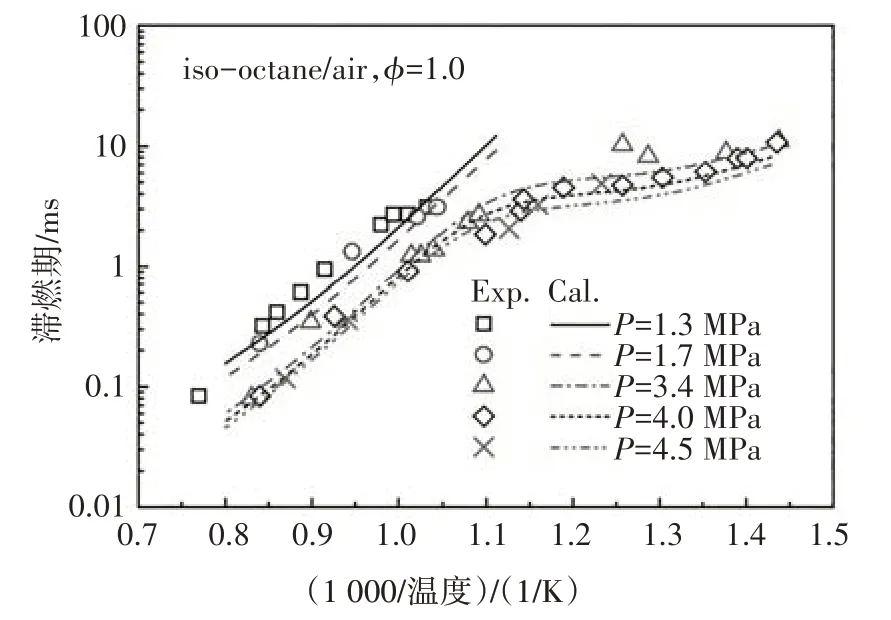
圖12 異辛烷在激波管中滯燃期的計算值與實驗值[13]的對比Fig.12 The ignition delay comparison between calculated value and experimental data of iso-octane in ST
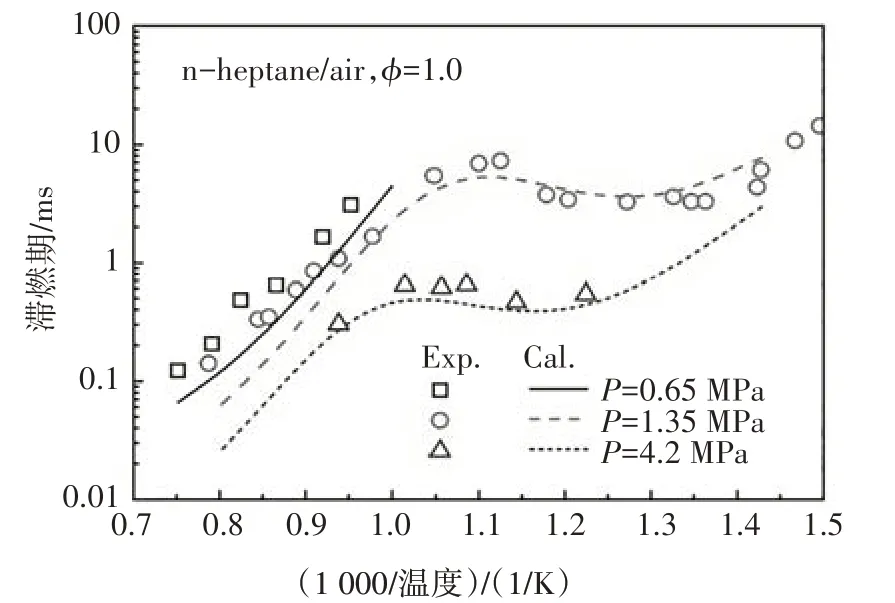
圖13 正庚烷在激波管中滯燃期的計算值與實驗值[14]的對比Fig.13 The ignition delay comparison between calculated value and experimental data of n-heptane in ST
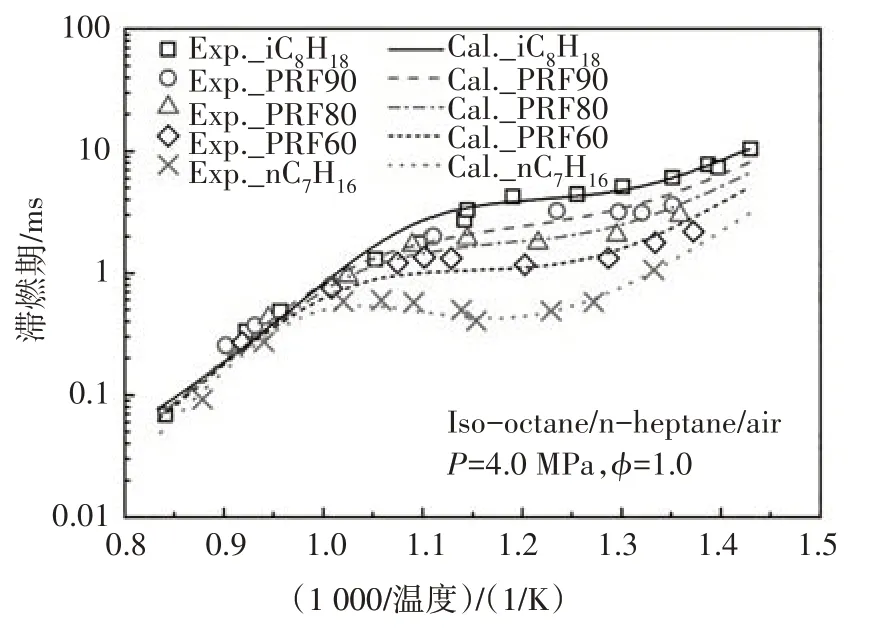
圖14 PRF燃料在激波管中滯燃期的計算值與實驗值[13]的對比Fig.14 The ignition delay comparison between calculated value and experimental data of PRF in ST
2.2 一維層流火焰速度的驗證
圖15 給出了本文構建的PRF 簡化動力學模型中正庚烷或異辛烷燃料在空氣中燃燒的層流火焰速度與試驗數據及其相關模型的對比,實驗在初始溫度298 K、壓力0.1 MPa 條件下開展.可以看出,利用本文構建的PRF簡化動力學機理計算的層流火焰速度與試驗數據吻合良好,盡管圖15b 中異辛烷的層流火焰速度計算值仍然偏高,但相比其它模型計算值已經有了很大改善.
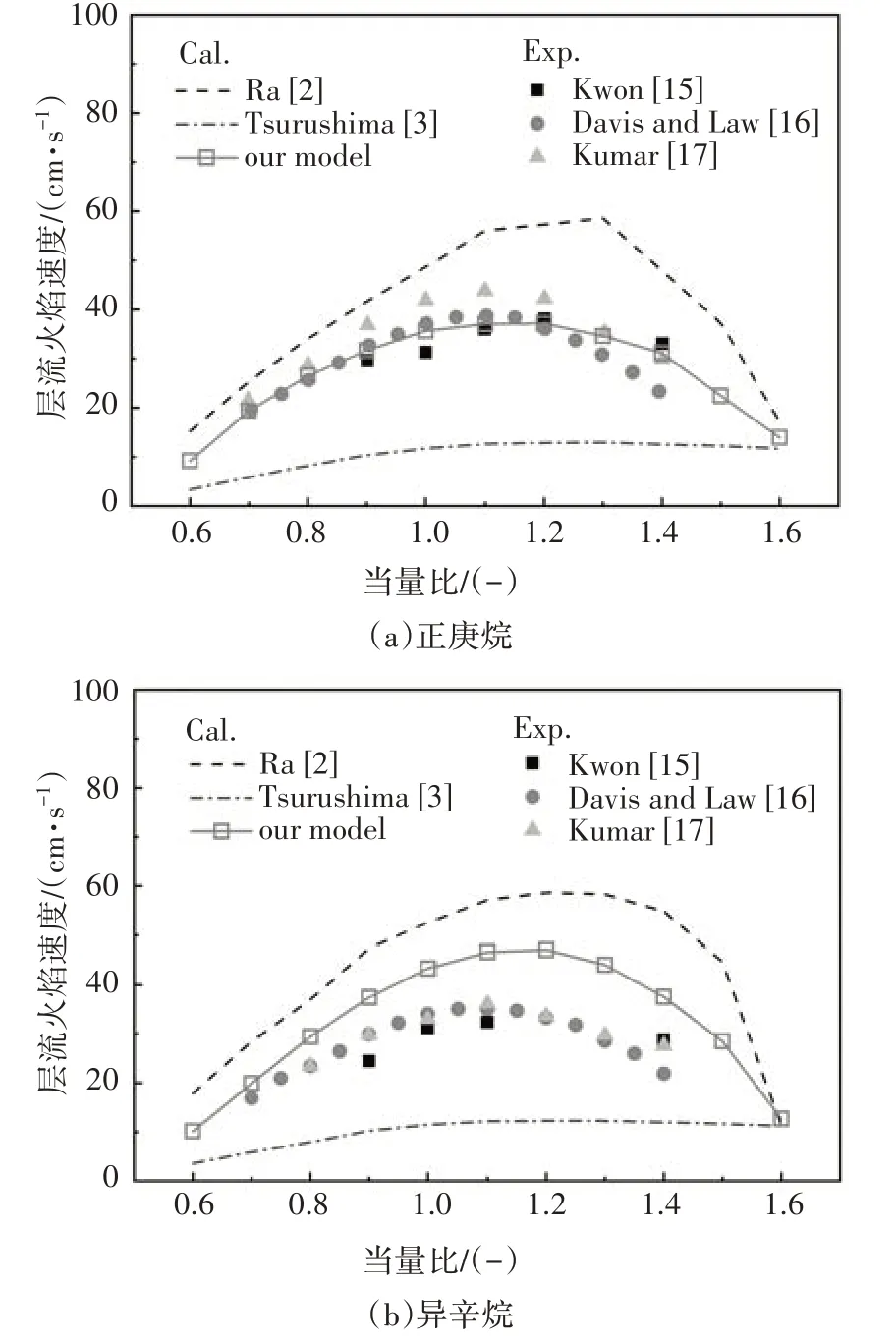
圖15 層流火焰速度計算值與實驗值對比Fig.15 The LFS comparison between simulation results and experimental values
2.3 射流攪拌器的驗證
圖16 給出了本文構建PRF 機理中的正庚烷或異辛烷在射流攪拌器中摩爾質量分數的計算值與Dagaut 等人[18]實驗值對比.試驗在當量比為1.0、溫度范圍550~1150 K、壓力為1.0 MPa 條件下進行,并采用氮氣對燃料稀釋.由圖可知,在機理規模的大大簡化的情況下,雖然CO 計算值與試驗值略有不同,但在不同當量比下,本文構建的PRF 簡化化學反應動力學機理中的正庚烷或異辛烷模型仍能比較準確的擬合試驗結果,并反映組分的變化趨勢.同時,燃料分子摩爾分數在NTC區域的變化趨勢也與試驗值比較接近.除當量比1.0 以外,Dagaut 等人[18]的試驗值也涉及當量比分別為0.5 和1.5、溫度范圍550~1150 K、壓力為1.0 MPa 的實驗條件,利用本文構建的PRF 簡化機理對重要組分摩爾質量分數的預測,與這兩種當量比條件下的實驗值同樣體現了較好的一致性,限于文章篇幅,本文沒有給出相應圖例.
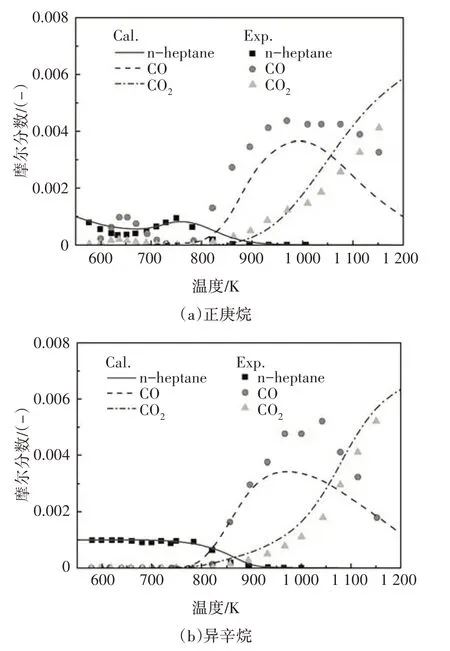
圖16 射流攪拌器中摩爾質量分數計算值與實驗值的對比Fig.16 The species mole fraction comparison between simulation results and experimental values in JSR
3 結論
1)根據“半解耦”思想,本文選用Liu 模型[11]中C0~C1 的小分子機理作為PRF 燃料的“內核”,選用Patel 等人[12]的C2~C3 的子機理作為過渡機理,利用反應路徑分析和敏感性分析方法對異辛烷、正庚烷的大分子反應進行簡化,并組合構建了包含41 種組分和131個反應的PRF簡化化學反應動力學模型.
2)結合本文構建的PRF 簡化化學反應動力學模型,選擇不同液體體積分數組分燃料作為實際汽油的表征,并與實驗結果進行對比,結果表明:本文構建的PRF 簡化化學反應動力學模型很好地通過了激波管、一維層流火焰速度和射流攪拌器的實驗數據驗證,不僅可以準確預測燃料的滯燃期,而且可以比較準確地預測反應中重要中間組分、自由基濃度和層流火焰速度的發展趨勢.

