轉錄因子GRHL3調控GPR108基因表達及其作用機制
倪鳴岳 劉源立 涂珍珍 郭立鈺 臧丹丹 周海勝,*
(1.安徽醫科大學基礎醫學院生物化學與分子生物學教研室,合肥 230032;2. 安徽醫科大學科研實驗中心,合肥 230032)
果蠅頭狀因子(grainyhead-like,GRHL) 基因家族成員序列具有高度保守的特點,所編碼的蛋白質作為細胞核內轉錄因子在胚胎發育過程中發揮關鍵的調控作用[1-5]。果蠅頭狀因子3(GRHL3)作為GRHL家族成員,在表皮的形成、傷口愈合和屏障功能等方面發揮著重要的調節作用。GRHL3通過激活鳥嘌呤核苷酸交換因子,促進肌動蛋白細胞骨架重組,調節細胞附著和運動,有助于傷口愈合過程中角質形成細胞的定向遷移[5]。GRHL3也可以通過結合谷氨酰胺轉氨酶1基因的啟動子,調控谷氨酰胺轉氨酶1表達進而影響交聯蛋白和脂質作用形成表皮角化層[6]。研究[7-8]證實在腫瘤發生過程中,GRHL3與miR-21存在相互拮抗的作用,miR-21抑制了GRHL3的表達,從而抑制了下游的PTEN的生成,并激活PI3K/AKT/mTOR信號通路促進了腫瘤的發生。GRHL3可以作為阻遏物,與靶基因調控區的保守序列5′-AACC(A)GGTT-3′或5′-AACCTGTT-3′特異性結合,從而抑制靶基因表達[9-10]。
G蛋白偶聯受體(G protein-coupled receptor,GPCR)是與三聚體G蛋白偶聯的細胞表面受體,含有7個穿膜區,是迄今發現的最大的受體超家族。 G蛋白偶聯受體108(G protein-coupled receptor 108,GPR108)屬于GPCR超家族成員之一,尚未發現天然配體故屬于孤兒受體。研究[11]證實GPR108主要分布在細胞高爾基器膜及細胞膜,是一種核因子κB(nuclear factor kappa-B,NF-κB)激活劑,可以負向調節Toll樣受體信號通路。研究[12-13]顯示GPR108在腺相關病毒感染的細胞免疫應答中具有重要的作用,因為GPR108可以作為腺相關病毒的受體,通過與胞殼蛋白VP1結合,介導腺相關病毒在靶細胞內轉導作用。但是,有關GPR108基因表達調控及其分子機制目前不清楚。前期筆者分析人GPR108基因結構時,發現其啟動子序列中存在一保守序列5′-AACCGGTG-3′,推測可能是潛在的GRHL3結合基序。本研究旨在證實GRHL3的負調控GPR108表達并探討其調控機制。
1 材料與方法
1.1 細胞系、菌種與載體
人胚胎腎細胞系(293T)、人永生化表皮細胞系(HaCaT)、人皮膚鱗癌細胞系(A-431),人肝癌細胞系(Hep G2)等細胞系均為本實驗室保存;人神經母細胞瘤細胞株(SH-SY5Y)為山東大學藥理教研室惠贈;感受態大腸桿菌TOP10(TSC-C12)購自北京擎科生物科技有限公司;真核細胞表達載體pCMV-2B(L5620),用于檢測啟動子活性的熒光素酶報告基因載體pGL3-basic(E1751)、pGL3-promoter(E1761)、海腎螢光素酶報告基因載體pRL-TK載體(E2241)購自美國Promega公司;克隆載體pMD18-T(6011)購自日本TaKaRa公司;過量表達GRHL3的表達載體pCMV-2B-GRHL3由本實驗室構建。
1.2 主要試劑
DMEM高糖培養基(SH30022.01B)購自美國Hyclone公司;胎牛血清(10099-141)購自美國Gibco公司;質粒提取試劑盒(D6943-02)購自美國Omega公司;雙熒光素酶報告基因檢測試劑盒(E1910)購自美國Promega公司;Ex Taq酶(RR53A)購自日本TaKaRa公司;轉染試劑(IMA202001S)購自北京IMAGEN公司;兔源抗Flag抗體(14793s)、ChIP試劑盒(9002S)購自美國Cell Signaling Technologies公司;反轉錄試劑盒(Q204)購自新貝生物有限公司;突變試劑盒(SMK-101)購自日本TOYOBO公司;SYBR?Green試劑盒(AG11701)購自艾科瑞生物有限公司。
1.3 引物設計與合成
在UCSC網站(http://genome.ucsc.edu/)中,獲得GPR108序列,設計并獲得GPR108啟動子序列,在NCBI網站(https://www.ncbi.nlm.nih.gov/)中,利用Primer-BLAST在線軟件進行引物設計,在正向和反向引物的5′端分別添加NheⅠ和Hind Ⅲ酶切位點;在NCBI網站中獲得GRHL3和GPR108的CDS序列,以此為模板分別設計反轉錄定量聚合酶鏈反應(reverse transcription quantitative polymerase chain reaction, RT-qPCR)檢測GRHL3和GPR108的引物;定點突變GPR108啟動子引物以GPR108啟動子序列為模板,根據突變試劑盒說明書設計刪除突變引物;以GPR108啟動子序列為模板,根據染色質免疫共沉淀(chromatin immunoprecipitation assay, ChIP)試劑盒說明書設計驗證GPR108啟動子的PCR引物和qPCR引物序列。所有引物均由生工生物工程(上海)股份有限公司合成,引物序列見表1。

表1 引物序列Tab.1 Primers sequence
1.4 GPR108啟動子克隆和pGL3-GPR108-promoter表達載體構建
以人HaCat細胞基因組DNA為模板,通過PCR克隆獲得野生型的GPR108啟動子DNA片段,作為人GPR108基因的候選啟動子DNA,片段為992 bp。將PCR產物連接在pMD-18T質粒構建pMD-18T-GPR108-promoter重組載體,NheⅠ和Hind Ⅲ進行雙酶切鑒定和測序鑒定。用NheⅠ和Hind Ⅲ雙酶切后獲得目的DNA與pGL3-basic載體連接,構建含有GPR108啟動子的重組表達載體pGL3-GPR108-promoter。
將含有野生型GPR108基因啟動子的表達載體pGL3-GPR108-promoter和含有突變的GPR108基因啟動子表達載體pGL3-Mut-GPR108-promoter分別轉染293T細胞,并同時轉染過量表達GRHL3的pCMV-2B-GRHL3表達載體或對照載體pCMV-2B,通過檢測熒光素酶活性以驗證GRHL3與GPR108啟動子的結合位點及其對啟動子調控作用。
1.5 雙熒光素酶報告基因檢測
按照轉染試劑說明書,將陽性對照pGL3-promoter、陰性對照pGL3-basic、pGL3-GPR108-promoter、pCMV-2B-GRHL3重組表達載體以及pCMV-2B空載體分別與pRL-TK共同轉染239T細胞;24 h后收集樣品,根據熒光素酶試劑盒說明書進行熒光素酶活性測定。各組5個復孔。
1.6 定點突變構建pGL3-Mut-GPR108-promoter表達載體
以pGL3-GPR108-promoter質粒DNA為模板,利用突變引物進行常規PCR反應。PCR結束后在PCR產物中用2 μL Dpn I,37 ℃作用1 h以消化環形質粒DNA。加T4連接酶將PCR產物進行自身環化。環化DNA轉化感受態細菌TOP10,提取單克隆的質粒DNA進行測序鑒定突變克隆。
1.7 ChIP與RT-qPCR
將帶有Flag標簽的pCMV-2B-GRHL3過表達載體轉染293T細胞,放置于37 ℃并含5%(體積分數) CO2的培養箱中培養24 h,去培養基后,用16%(質量分數)多聚甲醛固定細胞。按照ChIP試劑盒說明書操作,利用Flag抗體捕獲GRHL3結合的DNA。通過PCR驗證捕獲GPR108基因啟動子DNA,同時利用實時熒光定量PCR(ChIP qPCR)進行定量分析,使用Input樣品百分數方法,計算免疫沉淀(immunoprecipitation,IP)效率。
利用Trizol試劑快速提取法提取細胞總RNA,按照反轉錄試劑盒說明書操作合成cDNA。按照SYBR?Green試劑盒說明書添加反應體系進行PCR。ChIP實驗的實時熒光定量PCR(qPCR),運行程序:95 ℃、3 min;95 ℃、15 s,60 ℃、1 min,40個循環。
1.8 生物信息學分析與統計學方法
在CCLE數據庫(https://portals.broadinstitute.org/ccle/about)中獲得了32種組織癌癥的腫瘤細胞系基因表達矩陣,使用R軟件對原始數據集進行數據的可視化,分析GRHL3和GPR108的原始數據集在各種組織腫瘤細胞系中的表達。通過公共數據腫瘤細胞系測序分析,檢測GRHL3和GPR108的表達水平,篩選差異明顯腫瘤細胞系及其疾病以上分析通過R v4.0.3軟件包ggplot2(v3.3.3)構建。
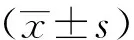
2 結果
2.1 GPR108基因啟動子結構分析
在數據庫中找到人GPR108在染色體上的位置,分析并確定GPR108啟動子位置。通過對啟動子序列分析發現,近端啟動子調控區域的一段序列5′-AACCGGTG-3′,GRHL3可能負調控GPR108基因的表達(圖1)。

圖1 GPR108基因位置及GRHL3調控GPR108示意圖Fig.1 Schematic diagram of GPR108 gene location and GRHL3 regulationGRHL3:grainyhead-like;GPR108:G protein-coupled receptor 108.
2.2 GRHL3與GPR108在腫瘤細胞中的表達譜
首先利用CCLE數據庫,對32種人腫瘤組織來源的1 000多種腫瘤細胞系的GRHL3和GPR108表達水平進行可視化分析。這些組織來源的腫瘤包括:脂肪肉瘤、神經母細胞瘤、腎上腺癌、白血病、骨癌、肝癌、皮膚癌、甲狀腺癌、腦癌、肉瘤、淋巴瘤、腎癌、骨髓瘤、工程化組織、眼癌、肺癌、畸胎瘤、橫紋肌樣瘤、胚胎癌、子宮內膜/子宮癌、卵巢癌、胃癌、宮頸癌、膽囊癌、膽管癌、胰腺癌、膀胱癌、前列腺癌、乳腺癌、結腸癌、食管癌、頭頸癌。結果顯示這些組織來源的腫瘤細胞系中GRHL3表達水平較低,而GPR108具有較高的表達水平(圖2)。

圖2 腫瘤細胞的GRHL3和GPR108表達譜Fig.2 Expression profile of GRHL3 and GPR108 in tumor cells
根據腫瘤細胞系的表達水平,進一步篩選出GRHL3和GPR108基因表達差異明顯的腫瘤細胞系及其對應的疾病,篩選出16種癌癥疾病,這些疾病為:彌漫大B細胞淋巴瘤(diffuse large B-cell lymphoma, DLBC)、多發性骨髓瘤(multiple myeloma, MM)、急性髓系白血病(acute myeloid leukemia, LAML)、皮膚黑色素瘤(skin cutaneous melanoma, SKCM)、肝細胞癌(liver hepatocellular carcinoma, LIHC)、惡性胸膜間皮瘤(mesothelioma, MESO)、多形性膠質母細胞瘤(glioblastoma, GBM)、神經母細胞瘤(neuroblastoma, NB)、腎透明細胞癌(kidney renal clear cell carcinoma, KIRC)、急性淋巴細胞白血病(acute lymphoblastic leukemia, ALL)、 腦低級別膠質瘤(brain lower grade glioma, LGG)、甲狀腺癌(thyroid carcinoma, THCA)、髓母細胞瘤(medulloblastoma, MB)、前列腺癌(prostate adenocarcinoma, PRAD)、尤文肉瘤(ewing’s sarcoma)、慢性淋巴細胞白血病(chronic lymphocytic Leukemia, CLL)。并在腫瘤細胞系測序數據中分析GRHL3和GPR108的基因表達分布見圖2。在數據庫提供的多種腫瘤細胞系中GRHL3與GPR108表達譜顯示二者具有明顯的對立表達方式。
2.3 RT-qPCR驗證
為了進一步驗證生物信息學分析的數據,從中任意選取了A-431、Hep G2以及SH-SY5Y共3種腫瘤細胞系,利用RT-qPCR以檢測GRHL3和GPR108的表達水平。結果顯示,在A-431、Hep G2以及SH-SY5Y等細胞中,GRHL3的表達水平均較低;3種細胞中GPR108具有較高的表達水平(圖3)。

圖3 RT-qPCR檢測腫瘤細胞中GRHL3和GPR108表達Fig.3 RT-qPCR detection of GRHL3 and GPR108 expression in tumor cells
2.4 pGL3-GPR108-promoter表達載體構建和GPR108基因啟動子活性鑒定
為了驗證GRHL3對GPR108的表達可能存在負調控作用,本研究以人HaCaT細胞基因組DNA為模板,通過PCR獲得人GPR108啟動子。候選的人GPR108基因啟動子DNA片段為 992 bp,連接到克隆載體pMD18-T上并將其菌液進行PCR鑒定。PCR結果顯示,提取的單克隆中為陽性重組載體。將單克隆進行擴增、提取質粒DNA并進行NheI和Hind III 雙酶切鑒定,瓊脂糖凝膠電泳顯示條帶位置與目的片段一致的DNA。將此目的DNA亞克隆到pGL3-basic載體并進行雙酶切鑒定,獲得992 bp的目的DNA。將重組載體進行DNA測序,測序結果與原序列進行比對證實目的基因無突變。這些結果證實成功構建了pGL3-GPR108-promoter表達載體。
為驗證克隆的DNA是否具有啟動子活性,將pGL3-GPR108-promoter表達載體轉染293T細胞,進行雙熒光素酶報告基因檢測系統,以檢測GPR108啟動子活性,結果證實,GPR108基因啟動子能夠驅動下游熒光素酶報告基因的表達,提示具有啟動子功能,并且pGL3-basic、pCMV-2B與pCMV-2B-GRHL3均無熒光活性(圖4)。

圖4 pGL3-GPR108-promoter 表達載體構建Fig.4 Construction of pGL3-GPR108-promoter expression vector
2.5 GRHL3與GPR108基因啟動子調控關系及作用位點鑒定
獲得GPR108基因啟動子并找到潛在結合位點。通過同源比對檢測,在GPR108近端啟動子區域中發現了一個高度保守的GRHL結合位點,比對同源物種分別為:人類、東北虎、中華菊頭蝠、花豹、家貓以及獵豹。設計特異引物,利用PCR方法將pGL3-GPR108-promoter中與GRHL3相結合的潛在位點5′-AACCGGTG-3′進行刪除突變,將突變后的表達載體再進行DNA測序驗證。
測序結果顯示GPR108基因啟動子GRHL3潛在位點已被成功刪除,從而獲得突變啟動子的表達載體pGL3-Mut-GPR108-promoter(圖5)。
在過量表達GRHL3的情況下,突變的GPR108基因啟動子表達載體的熒光素酶活性較野生型啟動子明顯增加,GRHL3結合位點突變后,GRHL3與GPR108基因啟動子結合能力減弱,負調控作用減弱;同時發現在沒有GRHL3過量表達情況下,突變的GPR108基因啟動子表達載體的熒光素酶活性比過量表達GRHL3時明顯增高,GPR108基因啟動子可能還存在其他GRHL3的結合位點。在兩組空載體對照組中,野生型GPR108基因啟動子的活性低于突變型GPR108基因啟動子,其原因可能與293T細胞內源的GRHL3抑制作用有關。
根據GPR108基因啟動子的基序5′-AACCGGTG-3′上游和下游設計引物分別進行PCR(擴增產物192 bp)和qPCR(擴增產物99 bp)。PCR擴增后的瓊脂糖凝膠電泳結果顯示,獲得擴增的DNA片段與預期一致;同時qPCR結果顯示,轉錄因子GRHL3可以結合GPR108啟動子,并且可以與后者的特定序列相結合(圖5F)。

圖5 轉錄因子GRHL3調控GPR108啟動子Fig.5 Transcription factor GRHL3 regulates GPR108 promoter
3 討論
GRHL家族成成員其主要功能是作為核內轉錄因子,參與調控多種靶基因的表達[14-22]。例如,GRHL通過多巴脫羧酶(DOPA decarboxylase,Ddc)基因的反式激活來維持角質層的完整性[5,23];Grhl1和Grhl3通過協同調控轉谷氨酰胺酶(transglutaminase,TGMs)維持小鼠表皮通透性屏障[1,24];GRHL2調控口腔鱗狀細胞癌(oral squamous cell carcinoma,OSCC)細胞中人類端粒酶反轉錄酶(htelomerase reverse transcriptase,hTERT)基因的表達,提示在細胞永生過程中端粒酶的激活起作用[21]。在果蠅和小鼠中,Grhl3調節許多類型的終端分化基因,這些基因是表皮屏障形成所需的[25]。GRHL3作為一種促進分化和遷移的轉錄因子,在角化細胞分化過程中,它優先結合到超增強子,而在遷移過程中,它優先結合到啟動子,抑制遷移抑制劑的表達[26]。GRHL3也可直接或間接結合到近端E-cadherin啟動子中的E-boxes,抑制E-cadherin基因表達,從而導致細胞的遷移和侵襲能力顯著增加[27]。這些研究表明,GRHL3可以結合基因的啟動子并進行調控。
GPR108作為G蛋白偶聯受體家族成員,其表達規律及調控機制均不清楚。利用公開數據庫,本研究分析了GRHL3與GPR108在許多不同腫瘤細胞中的表達規律,結果顯示二者的表達譜存在負調控的特點;隨機選取的3種腫瘤細胞系進行RT-qPCR驗證GRHL3與GPR108的表達水平,結果與數據庫表達譜一致。因此,GRHL3可能在腫瘤發生過程中發揮抑制作用,而GPR108在腫瘤發生過程中具有促進作用。
研究[27]發現,Grainyhead轉錄因子及GRHL3在參與調控靶基因表達時,靶基因的啟動子等調控區存在其結合的到特定保守序列。其中常見的保守結合序列為5′-AACCGGTT-3′或5′-AACCTGTT-3′,當GRHL3結合后顯著抑制靶基因的表達。目前有關GPR108的表達調控機制未見報道。通過對GPR108基因啟動子序列分析,發現GPR108基因上游調控區的基因啟動子區域,在第一個外顯子上游的-992 bp位點,存在GRHL3的結合保守序列5′-AACCGGTG-3′,提示GRHL3通過結合該序列對GPR108的表達存在負調控作用。這也是大多數真核細胞轉錄調控的主要方式之一。在本研究中,通過基因克隆技術成功克隆GPR108基因外顯子上游992 bp的DNA,利用熒光素酶分析證實其具有啟動子功能;當與GRHL3過量表達載體共轉染時,GPR108啟動子活性被有效抑制。從而證實GPR108的表達受到GRHL3的負調控。
生物學信息學分析發現GPR108基因中的啟動子區域高度保守序列5′-AACCGGTG-3′,可能是GRHL3潛在結合位點,其位于轉錄起始點上游-171 bp。為進一步驗證其結合GRHL3的調控作用,對該保守序列進行定點刪除突變和熒光素酶活性分析,結果證實GRHL3抑制GPR108表達是與該序列密切相關;ChIP結果也證實GPR108基因的5′-AACCGGTG-3′是GRHL3的特異結合位點;GRHL3抑制GPR108表達的主要機制是GRHL3與GPR108啟動子的5′-AACCGGTG-3′發生了相互作用。同時,本研究結果顯示對該保守序列進行定點突變的啟動子,在GRHL3存在情況下,GPR108基因啟動子活性仍然有一定的抑制作用,提示GPR108基因啟動子區域除存在保守結合序列外,可能存在多個GRHL3結合位點,這將在后續研究中進一步進行驗證。
本研究利用分子生物學方法成功克隆人GPR108基因上游調控區DNA,并證實其具有啟動子功能;該啟動子存在轉錄因子GRHL3特異性結合的保守序列5′-AACCGGTG-3′,GRHL3可以通過結合該保守序列DNA,對GPR108基因表達發揮明顯的抑制作用。這為后續研究GPR108的表達規律、揭示其生理功能及其在炎性反應中作用奠定重要基礎。

