植物花青素代謝途徑相關基因的研究進展
羅天俊
摘 要 植物的花色在其觀賞價值的表觀性狀中占有非常重要的地位,這一特點在被子植物中尤為顯著。植物表觀遺傳研究中,花色也往往被認為是重要內容之一,而花青素在決定花色中扮演著重要角色。近年來,花青素代謝途徑是植物界的研究熱點,主要綜述了參與植物花青素代謝途徑中的相關基因,為開展植物表觀遺傳在生物工程技術中的改良實踐和豐富園林花卉可利用種類提供相應的理論基礎。
關鍵詞 花青素;代謝途徑;花卉;表觀遺傳
中圖分類號:S565.4 文獻標志碼:A DOI:10.19415/j.cnki.1673-890x.2022.16.064
植物的花色主要受外部因素和內在因素的影響,外部因素包括光照、溫度等一系列環境因素,內在因素是遺傳因素,主要指植物細胞內的環境和花瓣的構造等對花色的重要影響。但是,外部因素和內在因素最終都需要作用于花青素(屬黃酮類),進而決定花的顏色,花青素是重要的植物色素之一。
近年來,花青素在生物代謝方面的研究已經取得了充分進展,其中有關花青素的代謝途徑和相關基因的研究報告相對較多。一些學者發現,圓葉牽牛(Ipomoea purpurea Lam.)等觀賞植物的開花過程與花青素有著明確的關系,這種關系存在于花青素合成途徑遺傳因子發育模式與花青素積累之間。花青素的代謝受到多種結構基因、酶、控制基因及外界刺激的調控,如micro RNA、LBD遺傳因子家族、光照、植物激素等。
進入21世紀以來,在一系列先進技術的作用下,生物技術蓬勃發展,越來越多的相關研究成果逐漸闡明了不同的植物花青素代謝途徑的分子控制機制差異。但還有很多經濟價值高的植物,其與代謝途徑有關的基礎機理尚待探索。本文主要總結了與植物花青素代謝途徑有關的遺傳因子,并總結了利用生物工程技術對植物的表觀遺傳進行優化改良等的相關理論
基礎。
1 花青素的結構
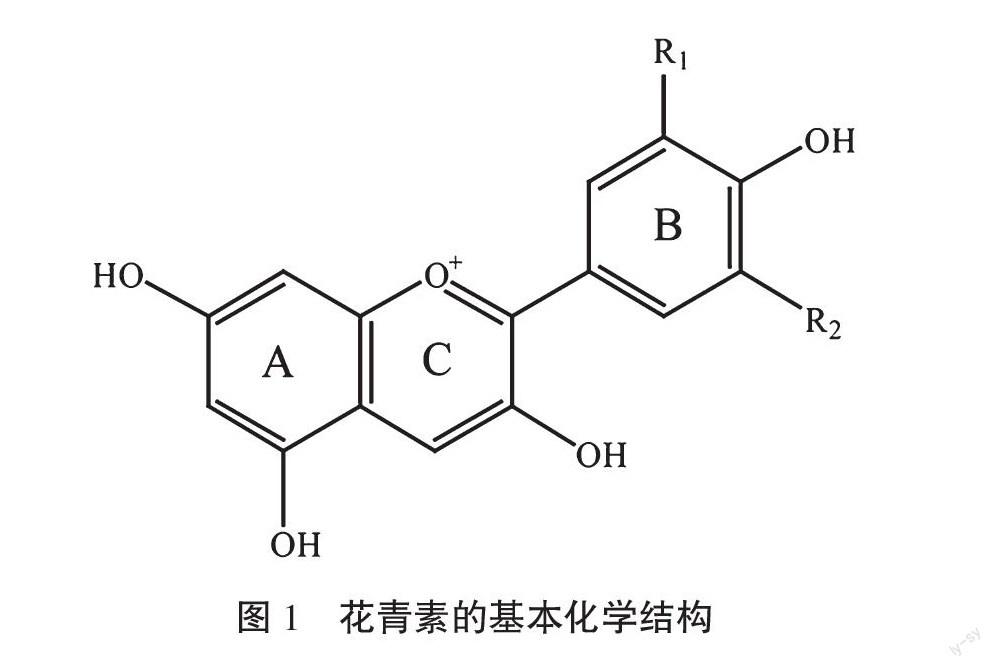
花青素以3,5,7-三羥基-2-苯基苯(并)吡喃羊鹽(三羥基羊鹽、trihydroxyflavylium)為基本碳骨架結構(見圖1),根據在苯環B上不同的取代位置、數量、羥基類型,形成不同的花青素[1]。A、C環的結構相似,但需修飾增加穩定性,其中修飾作用、溶液環境和花青素二維堆積也導致花青素顏色發生改變[2]。花青素大多具有良好的水溶性,使得許多植物含水量高的組織中含有大量花青素,如花和果實。較高的花青素含量在組織中表現出深紅、橙色、藍色、紫色等性狀。
目前已發現的天然花青素有500多種,其中最常見的是芍藥色素(Peonidin,Pn)、錦葵色素(Malvidin,Mv)、飛燕草色素(Delphindin,Dp)、矮牽牛色素(Petunidin,Pt)、矢車菊色素(Cyanidin,Cy)、天竺葵色素(Pelargonidin,Pg)6種。
2 花青素的代謝途徑
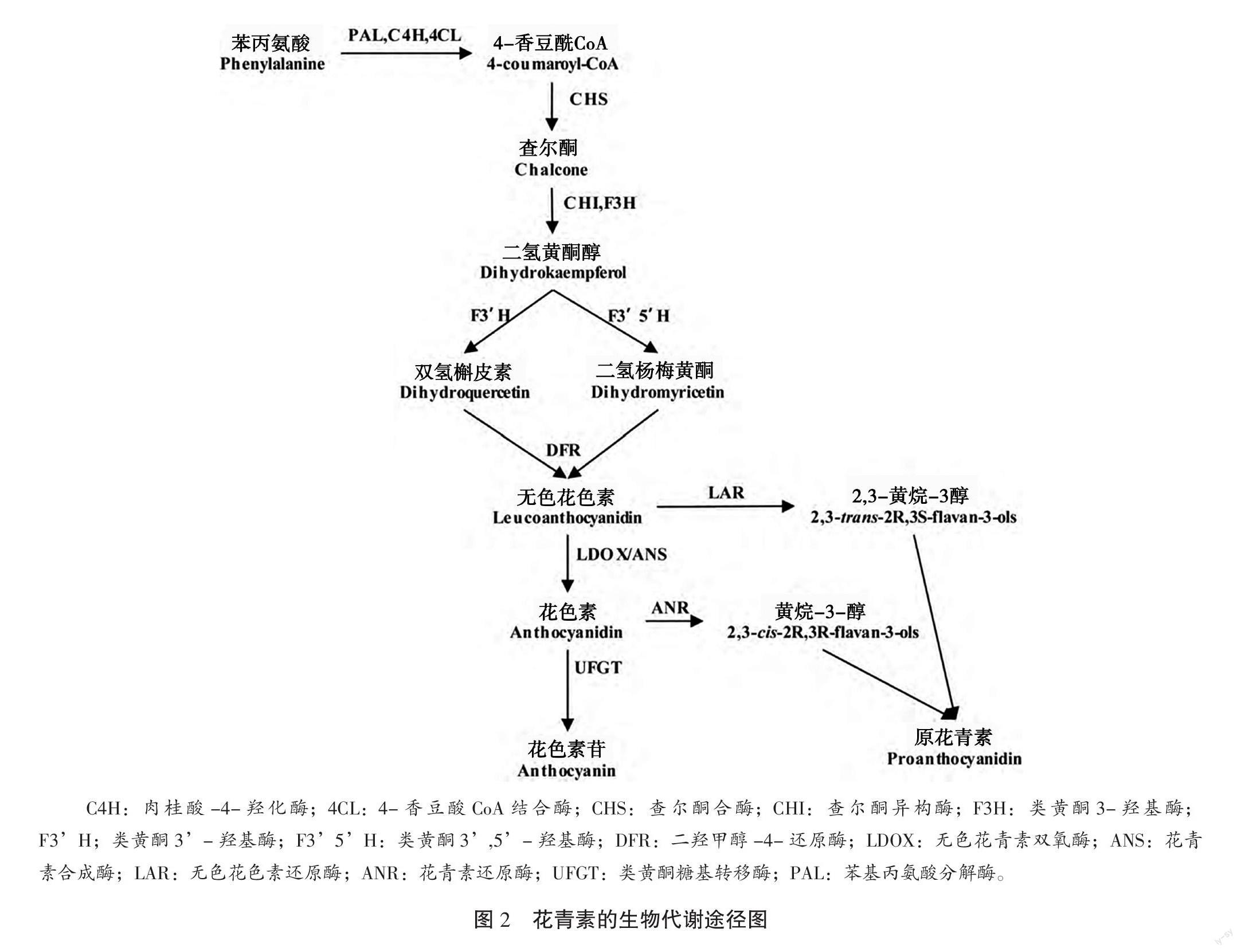
20世紀90年代以來,花青素的代謝途徑研究日臻成熟,其基本代謝途徑如圖2所示。代謝過程至少涉及12種結構遺傳因子(ANS、PAL、AT、C4H、4CL、CHS、DFR、CHI、F3H、F3H、F3H、UD3GT)和3種轉錄因子(bHLH、MYB、WD40)。結構基因主要用于編碼對應類別的酶,轉錄因子主要用于調控結構基因的活動。
2.1 花青素的合成
如圖2所示,花青素的合成主要分3個階段。
1)苯丙氨酸按順序經苯丙氨酸解氨酶(Phenyla-lanineammonialyase,PAL)、肉桂酸-4-羥化酶(Cinnamate 4-Hydroxylase,C4H)和4-香豆酸輔酶A連接酶(4-Coumarate Coenzyme A Ligase,4CL)的催化,轉變為4-香豆酰CoA。PAL廣泛分布在植物中,是植物代謝途徑中重要的調節因子,催化苯基丙氨酸脫氨基,是本階段反應的限速酶[3]。
2)4-香豆酰CoA在查爾酮合酶(Chalcone Synthase,CHS)的催化下生成查爾酮(Chalcone),接著在查爾酮異構酶(Chalcone Isomerase,CHI)和黃酮-3-羥化酶(Flavanone 3-Hydroxylase,F3H)的作用下形成二氫黃酮醇(Dihydrokaempferol,DHK),經類黃酮3-羥化酶(Flavonoid 3-Hydroxylase,F3H)和類黃酮3,5-羥化酶(Flavonoid 3,5-Hydroxylase,F35H)催化后可分別形成雙氫槲皮素(Dihydroquercetin,DHQ)和二氫楊梅黃酮(Dihydromyricetin,DHM)。
3)DHQ和DHM在二氫黃酮醇4-還原酶(Dihydroflavonl 4-Reductase,DFR)的作用下生成無色花色素,分別經無色花青素還原酶(Leucoanthocyanidin Reductase,LAR)和無色花青素雙加氧酶/花青素合成酶(Leucoanthocyanidin Dioxygenase/Anthocyanidin Synthase,LDOX/ANS)的催化分別形成有色花青素。
2.2 花青素的運輸
花青素一般在細胞內合成,在合成相關酶的過程中,通過蛋白質的相互作用,形成可以錨定在內質網膜上的大分子復合體。另外,通過類黃酮糖基轉移酶(UDP-Glycose Flavonoid Glycosyltransferase,UFGT)和尿苷二磷酸葡萄糖醛酸轉移酶(UDP-Glucuronosyhransferase,UGT)的相互作用和修飾作用,轉運到植物液泡中。在當前的研究中,關于花青素的運輸機制有如下4種。1)與液泡膜上的多藥耐藥相關蛋白(MultildrugResistance-Associated Protein, MRP)及毒物外排轉運蛋白(Multidrug And Toxic Compound Extrusion,MATE)有關。液泡上的MATE根據膜內外的H+/Na+濃度差使H+從液泡內排出,從而將花青素輸送到液泡內[4]。如擬南芥功能研究較多的TT12遺傳因子(屬MATE遺傳因子家族),在含原花青素的植物組織中特異性表達,定位在液泡膜上,就是這種轉運方式。但有學者表示,酰基化之后的花青素苷才能夠被MATE基因家族成員轉運[6]。2)依賴谷胱甘肽巰基轉移酶(Glutathione S-Transferase,GST)與液泡膜上的多藥耐藥相關蛋白介導的花青素苷轉運的形式。3)與膽紅素異位酶同族體(Bilitranslocase-homologue,BTL-homologue)相關。目前關于該項研究還較少,但有研究表明,BTL-homologue可以轉運花青素苷和膽紅素(為血紅素降解產物)。4)由囊泡介導的花青素的運輸。例如,在擬南芥中,液泡產生的囊泡可以直接將花青素輸送到相應的空間而不依賴于GST和ATP。
3 花青素代謝途徑相關基因
3.1 結構基因對花青素的影響
1)PAL是植物代謝途徑中的重要限制酶,可以通過催化苯基丙氨酸的脫氨生成反式肉桂酸。PAL在植物中廣泛分布,主要存在于線粒體、葉綠體、過氧化酶體、白血球等細胞器中。PAL由多基因家族編碼,植物的發育情況和環境等因素對PAL基因的表達有很大的影響。CHS是植物合成黃酮化合物過程中最重要的酶,它可以通過催化4-香豆酰CoA和丙二酰CoA縮合而形成查爾酮,為類黃酮類化合物的合成提供了基礎碳框架結構[6]。
2)DFR在植物花瓣的顯色中起著重要的作用,其可以將DHQ、DHM轉化為無色花青素。根據研究,蝴蝶草中加入反義DFR基因,其花色變為藍色,植物體內的花色素含量降低,但花青素和黃酮醇含量卻明顯提高。DFR遺傳因子也經常應用于矮牽牛的花色研究。F3H可催化黃烷酮生成二氫黃酮醇,研究結果顯示,反義抑制草莓(Fragaria×ananassa)中的F3H表達之后,阻斷了花青素的合成代謝,進而對果實中的花青素含量產生影響,進一步表明了F3H是植物花青素代謝途徑中的一個關鍵酶[7]。并且DFR和F3H的過剩表現,增加了花瓣中紅色色素的含量,使花瓣變得更紅。根據相關文獻,DFR、F3H和F35H因為利用共同的底物,所以存在競爭關系,如果DFR和F3H遺傳因子含量過高,則會抑制F35H遺傳因子的表達,植物更趨向于合成天竺葵色素苷;在月季中,DFR基因過量表達,但抑制了F35H和F3H基因的表達,導致月季開粉色花。
3)ANS遺傳因子可以催化無色類黃酮轉化為有色類黃酮,因此在植物呈色中起著重要的作用,如洋蔥(Allium cepa)的ANS遺傳因子變異后,洋蔥的鱗片由紅變黃。在缺少ANS遺傳因子的金鐘連翹(Forsythia×intermedia)中,花青素的積累受到顯著抑制,但是引進DFR和ANS遺傳因子后,植物體內花青素的積蓄顯著增加,胡蘿卜素含量明顯低于天冬酰胺,花瓣顏色變為橙色[8]。根據相關文獻,在植物花色形成過程中,FLS基因和ANS存在底物競爭關系,且在花瓣某些部位,FLS基因會優先表達[9]。因此,可以通過生物技術,將某些基因的表達沉默,進而培育出不同花色的植物品種。
4)通過UFGT類黃酮代謝途徑控制類黃酮合成。該基因在植物中的表達與植物的果實顏色相關,在葡萄、蘋果、荔枝中都有相應研究;在葡萄中,通過雜交技術發現,在白色葡萄株和相應的紅色突變株中都發現了UFGT基因,但在紅色突變株中,UFGT基因發生了突變,因此果實表現為紅色[10];有研究發現,荔枝果皮中UFGT的表達與花青素和類黃酮的含量呈現高度正相關[11]。總之,UFGT基因在植物花青素代謝途徑中起著重要的作用。
3.2 轉錄因子對花青素的影響
植物花青素代謝途徑受結構基因影響,轉錄因子也可以對其產生一定影響,從現有研究來看,轉錄因子主要有3種(WD40、bHLH和R2R3-MYB),這3種蛋白質通過一系列相互作用形成三元復合體,該三元復合體與結構基因的特定位點結合,用于調節結構基因的活性,并進一步調節花青素的代謝。
1)WD40參與包括玉米、擬南芥、紫蘇等眾多植物花青素的代謝途徑。例如,在矮牽牛an11基因突變體中,結構基因DFR的表達量降低,色素積累受到影響,但是DFR的表達活性可以逐漸由組成型基因AN2恢復,說明在花青素合成的控制途徑中AN11基因位于AN2的上游。
2)根據相關文獻,R2R3-MYB轉錄因子可直接調控花青素的代謝,如MYB轉錄因子PAP1的過量表達,使花青素代謝途徑的下游基因的表達量增加,進而增加花青素積累[12-13]。針對矮牽牛的研究表明,RsMYB1遺傳因子的表達水平與花青素代謝所涉及的結構遺傳因子(PAL、CHS、DFF、ANS)的表達水平正相關[14]。MYB家族除了上述因子外還包含了一類具有轉錄抑制或負調控效應的因子,如編碼R3-MYB蛋白AtMYBL2的AtMYBL2基因,缺失該基因的植株,與花青素代謝途徑相關基因的表達水平上升,體內花青素累積量也明顯增加;而含有mybl2突變的植株CHI基因的表達水平較低,但原花青素和黃酮醇含量不變;但MYBL2表達過高的植株中,CHI的表達正常。因此,在花青素代謝途徑中,R2R3-MYB蛋白具有關鍵作用,該基因調控著多個結構基因的表達,進而影響植物體內花青素的積累。
3)bHLH轉錄因子是植物中第二大轉錄因子家族。bHLH的調節在花青素的代謝途徑中起著非常積極的作用。bHLH轉錄因子家族中有抑制花青素積累的成員。例如,在擬南芥中,BHLH32是負調節因子,在BHLH32缺乏的植物中,DFR的表達水平增加,花青素的積累增加。
4 小結
花青素是一種分布廣、種類多、安全性高、無毒性的天然色素,在許多行業中都有著廣泛的應用前景。近年來,關于花青素的代謝途徑相關的基因研究取得了較大的突破,目前已發現與花青素生物合成途徑相關的代謝基因主要有12種,結構基因主要有3種,這些基因在不同物種和組織中有表達差異性,而且目前轉錄因子與生物代謝基因的相互作用對花青素的遺傳表觀研究甚少。探究植物花青素的代謝途徑相關基因及遺傳機制,并利用基因工程開展植物的遺傳改良具有重要意義。
參考文獻:
[1] HONDA T,SAITO N.Recent progress in the chemistry of polyacylated anthocyanins as flower color pigments[J].Heterocycles,2002,56(1):633-692.
[2] 謝燁,孫毅,黃繼榮.擬南芥中花青素的修飾[J].植物生理學報,2013,49(2):101-110.
[3] 賈趙東,馬佩勇,邊小峰,等.植物花青素合成代謝途徑及其分子調控[J].西北植物學報,2014,34(7):1496-1506.
[4] YAMAGUCHI T,FUKADA-TANAKA S,INAGAKI Y,et al.Genes encoding the vacuolar Na+/H+ exchanger and flower coloration[J].Plant Cell Physiol,2001,42(5):451-461.
[5] ZHAO J, DIXON R A. MATE transporters facilitate vacuolar uptake of epicatechin 3-o-glucoside for proanthocyanidin biosynthesis in Medicago truncatula and Arabidopsis[J].The Plant Cell,2009,21(8):
2323-2340.
[6] 侯澤豪,王書平,魏淑東,等.植物花青素生物合成與調控的研究進展[J].廣西植物,2017,37(12):1603-1613.
[7] JIANG F,WANG J Y,JIA H F,et al.RNAi-mediated silencing of the flavanone 3-hydroxylase gene and its effect on flavonoid biosynthesis in strawberry fruit[J].J Plant Growth Regul,2013,32(1):182-190.
[8] ROSATI C,SIMONEAU P,TREUTTER D,et al.Engineering of flower color in forsythia by expression of two independently-transformed dihydroflavonol 4-reductase and anthocyanidin synthase genes of flavonoid pathway[J].Molecular Breeding,2003,12(3):197-208.
[9] YUAN Y W,REBOCHO A B,SAGAWA J M,et al.Competition between anthocyanin and flavonol biosynthesis produces spatial pattern variation of floral pigments between mimulus species[J].Proceedings of the National Academy Sciences USA,2016,113(9):2448-2453.
[10] KOBAYASHI S, ISHIMARU M, DING C K, et al. Comparison of UDP-glucose: flavonoid 3-O-glucosyltransferase (UFGT) gene sequences between white grapes (Vitis vinifera) and their sports with red skin[J].Plant Science,2001,160(3):543-550.
[11] ZHAO D Q,TAO J, HAN C X,et al. Flower color diversity revealed by differential expression of flavonoid biosynthetic genes and flavonoid accumulation in herbaceous peony (Paeonia lactiflora Pall.)[J].Molecular Biology Reports,
2012,39(12):11263-11275.
[12] CHIU L,LI L.Characterization of the regulatory network of BoMYB2 in controlling anthocyanin biosynthesis in purple cauliflower[J].Planta,
2012,236(4):1153-1164.
[13] LIU J Y,OSBOU A,MA P.MYB transcription factors as regulators of phenylpropanoid metabolism in plants[J].Molecular Plant,2015,8(5):689-708.
[14] AI T N,NAING A H,ARUN M,et al.Expression of RsMYB1 in Petunia enhances anthocyanin production in vegetative and floral tissues[J].Sci Hortic,2017,214:58-65.
(責任編輯:劉寧寧)

