玻璃板上氫氧化亞鐵的制備及轉化
石月 李悅迪 王喜貴


摘要: 石蕊溶液在硫酸亞鐵和氫氧化鈉溶液中會呈現出不同的顏色。通過改變硫酸亞鐵溶液和氫氧化鈉溶液的滴加順序,在玻璃板上成功實現氫氧化亞鐵的制備及轉化。實驗能夠短時間內在玻璃板上清晰地呈現“白→灰綠→紅褐”完整的變色現象,不僅有助于學生加深對氫氧化亞鐵還原性的認識,而且有益于激發學生的學習熱情以及培養科學探究與創新意識。
關鍵詞: 氫氧化亞鐵; 制備與轉化; 實驗探究
文章編號: 10056629(2022)06008104
中圖分類號: G633.8
文獻標識碼: B
“鐵及其化合物”是人教版普通高中化學必修第一冊乃至整個高中化學階段中的重要知識內容,是學習元素化合物的基礎,同時也為學生構建“價類”二維認識方式奠定知識基礎。《普通高中化學課程標準(2017年版2020年修訂)》[1]中對于該節教學提出“制備氫氧化亞鐵”的活動建議,旨在讓學生通過氫氧化亞鐵的制備實驗,親歷變色現象,加深對氫氧化亞鐵還原性的認知,加快構建物質分類觀與轉化觀。然而,由于氫氧化亞鐵極易與空氣作用轉變成氫氧化鐵,嚴重影響白色沉淀的觀察,因此其制備實驗成為高中化學課堂中的熱點與難點[2]。很多學者和一線教師對氫氧化亞鐵的制備實驗進行了深入探究,包括改進實驗裝置、甄選實驗試劑、優化操作方法[3~8]等,但依然存在如制備裝置復雜、實驗步驟繁多、忽視沉淀后續轉化而無法觀察到完整的變色現象等問題。此外,上述研究由于條件控制較為復雜,因此教師多以演示實驗為主,學生探究的積極性不高,無法深度參與,不利于培養學生的科學探究與創新意識。
為了簡化實驗裝置和實驗步驟,增強實驗的趣味性,同時發展學生的動手實踐能力,讓他們能夠親自體會神奇的變色現象,進一步理解氫氧化亞鐵的還原性,本文利用玻璃板和一些常規儀器及試劑,采用簡單的溶液滴加的形式在玻璃板上成功實現氫氧化亞鐵的制備及轉化,并且能明顯觀察到沉淀由白到灰綠最后到紅褐色的完整實驗現象。該方法裝置簡單、步驟少、用時短,適用于課堂教學,能夠滿足每個學生親自動手實驗的需要,激發探究興趣,進而培養科學探究與創新意識;同時通過在沒有視覺障礙的玻璃板上直觀地觀察到完整的變色現象,學生不僅能掌握氫氧化亞鐵的還原性原理,而且能深刻認識到物質是處于不斷的變化中,這有助于變化觀念的形成與發展。
1 實驗方案初步探索階段
1.1 實驗用品
托盤天平、燒杯(100mL)、玻璃棒、容量瓶(100mL)、玻璃板、膠頭滴管、滴瓶、研缽、藥匙、鑷子、試管(10mm×100mm);NaOH固體、FeSO4·7H2O晶體、稀硫酸、蒸餾水、Vc片、石蕊溶液
1.2 操作步驟及現象
1.2.1 配制FeSO4和NaOH溶液
根據電勢pH圖可知,Fe2+在酸性條件下更穩定[9],因此選用稀硫酸作溶劑,FeSO4·7H2O晶體為溶質,并將Vc片研磨成粉末狀加入其中,配制成0.1mol/L的FeSO4溶液。用蒸餾水(未煮沸)配制4mol/L的NaOH溶液。
1.2.2 配制變色溶液
在1號試管中滴入約15滴石蕊溶液,然后加入約20滴FeSO4溶液,混勻后溶液變為紅色,編號為溶液1。在2號試管中滴入等量的石蕊溶液,然后加入20滴NaOH溶液,混勻后溶液變為藍色,編號為溶液2。
1.2.3 布置玻璃板背景
將潔凈的玻璃板置于黑色的實驗臺上。為了更明顯地觀察實驗現象,可把白紙襯于玻璃板下,將玻璃板的底部背景一分為二,一半為黑色,一半為白色(在黑色背景中容易觀察到白色沉淀的出現,而在白色背景中容易觀察到紅色、藍色、灰綠色、紅褐色的變化)。
1.2.4 制備Fe(OH)2沉淀
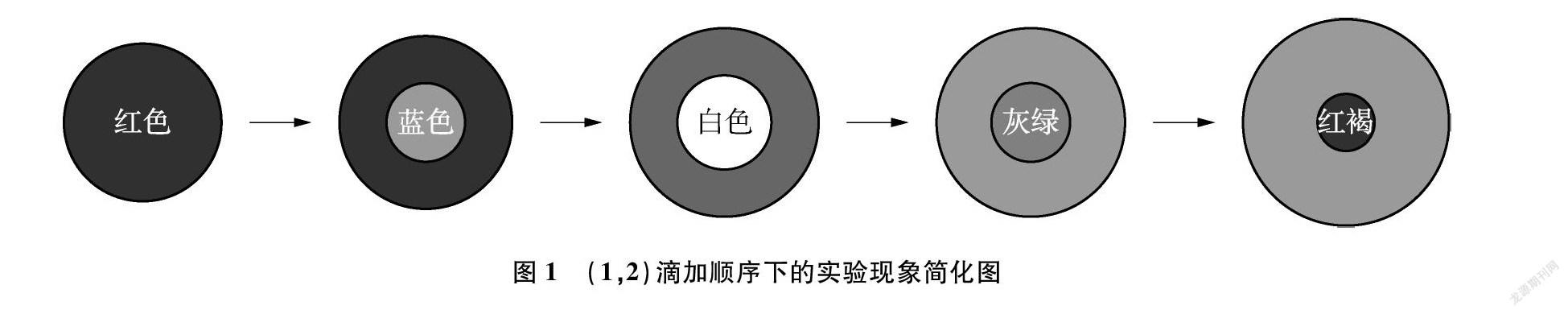
用1號膠頭滴管吸取1號溶液在玻璃板的黑、白背景交界線上緩慢滴加1滴溶液,使其盡量保持圓形液滴的狀態,此時玻璃板上出現的是1滴紅色圓形液滴。再用2號膠頭滴管吸取2號溶液緩慢在圓形液滴中央滴加1滴溶液,立即出現白色絮狀沉淀。但很快觀察到白色沉淀的位置在移動,逐漸從液滴邊緣向內部縮回,顏色也由最初的白色轉變成灰綠色,最終又轉變為一個紅褐色的小點。究其原因發現該液滴邊緣的溶液顯酸性,說明FeSO4溶液中未完全消耗的酸大量聚集在液滴邊緣,將Fe(OH)2沉淀從邊緣向內部溶解。在反應過程中,Fe(OH)2沉淀逐漸被氧化成紅褐色的Fe(OH)3沉淀。為了清晰完整地展現整個實驗過程,勾畫出如圖1所示的簡化圖。
為了探究溶液的滴加順序對于Fe(OH)2的形成是否有影響,改變滴加順序進行探究。
用2號膠頭滴管吸取2號溶液在玻璃板的黑、白背景交界線上緩慢滴加1滴溶液,使其盡量保持圓形液滴的狀態,此時玻璃板上呈現1滴藍色圓形液滴。再用1號膠頭滴管吸取1號溶液緩慢在圓形液滴中央滴加1滴溶液,立即出現白色絮狀沉淀,但很快觀察到白色沉淀由內而外逐漸消失,一段時間后,出現灰綠色圓環,最終呈現出不完整的紅褐色半圓環。玻璃棒蘸取少量環內溶液,用pH試紙進行測定,發現環內溶液顯酸性,進一步證實FeSO4溶液中的酸溶解了Fe(OH)2沉淀,使其呈現圓環形狀。將實驗現象以簡化圖(如圖2)的形式呈現,便于觀察和熟悉整個實驗過程。
2 成功制備、轉化階段
2.1 操作步驟及現象
基于上述探究階段的經驗,用酸配制FeSO4溶液雖然可以在一定程度上抑制溶解氧,但最終還是影響了實驗效果,因此在探究的基礎上作進一步改進。僅將配制FeSO4溶液的溶劑改為蒸餾水,標記為3號溶液;由于NaOH溶液不需要中和FeSO4溶液中多余的酸,因此可以將其濃度降低為1mol/L,標記為4號溶液。其他步驟如同前面的探究實驗。但此階段卻在玻璃板上成功實現了氫氧化亞鐵的制備及轉化。
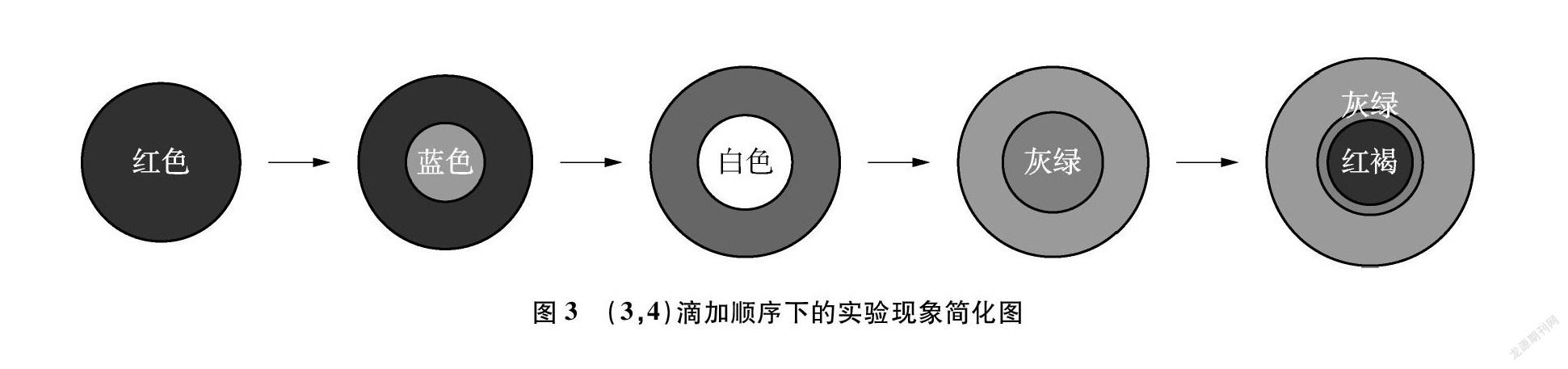
用3號膠頭滴管吸取3號溶液在玻璃板的黑、白背景交界線上緩慢滴加3~4滴溶液,使其盡量保持圓形液滴的狀態,此時玻璃板上呈現出紅色圓形液滴。再用4號膠頭滴管吸取4號溶液緩慢滴加1滴于圓形液滴中央,此時明顯觀察到紅色液滴上呈現出藍色溶液,并且圈層分明。兩溶液混合并快速發生反應,在玻璃板上出現似淡紅色花朵中央綻放白色花蕊的美麗現象。一段時間后,白色花蕊逐漸轉變成灰綠色,最后形成由穩定而堅固的灰綠色環包圍下的紅褐色花蕊。在短時間內,玻璃板上生長出圈層分明的五彩變色“小花”。為了清晰地觀察五彩變色現象,勾畫出如圖3所示的簡化圖。
為滿足學生對于滴加順序是否影響白色沉淀生成的好奇心,教師在此基礎上引導學生改變3、 4號溶液的滴加順序,觀察玻璃板上是否出現相同的實驗現象。
用4號膠頭滴管吸取4號溶液在玻璃板的黑、白背景交界線上緩慢滴加3~4滴溶液,使其盡量保持圓形液滴的狀態,此時玻璃板上呈現出藍色圓形液滴。再用3號膠頭滴管吸取3號溶液緩慢滴加1滴于圓形液滴中央,明顯觀察到藍色液滴上呈現出紅色溶液,并且圈層分明。兩溶液混合并快速發生反應,在玻璃板上出現似淡藍色花朵中央綻放白色花蕊的美麗現象。一段時間后,白色花蕊逐漸轉變成灰綠色,最后完全轉變為紅褐色。為了清晰地觀察五彩變色現象,勾畫出如圖4所示的簡化圖。
2.2 實驗結果
上述兩組實驗表明,改變溶液的滴加順序,在本實驗中并不會影響氫氧化亞鐵白色沉淀的出現,也不影響后續完整變色現象的觀察,因此,在教學過程中不必細究。但就其實驗本身而言,不同滴加順序下的實驗現象略有差異。如圖3中出現“穩定堅固的灰綠色環包圍下的紅褐色花蕊”,而在圖4中僅出現“紅褐色”的現象,并沒有出現前者中的灰綠色環,這是何種原因導致?徐建飛老師在“制備氫氧化亞鐵實驗方案再探究”一文中指出,灰綠色沉淀可能是由于氫氧化亞鐵沉淀吸附溶液中過量的亞鐵離子所致[10]。由圖3所展現的實驗中,硫酸亞鐵量較多且分布在液滴外圍,液滴中央產生的氫氧化亞鐵沉淀吸附了周圍未反應完全的亞鐵離子而形成穩定而堅固的灰綠色環。而由圖4所展現的實驗中,硫酸亞鐵量較少,因此沒有出現如圖3所示的現象。
3 實驗改進總結
(1) 承載豐富的知識內容,建立完整的知識體系。該實驗以回顧舊知為始,將蘊含新知的操作步驟分階段逐步推進,在加強知識銜接的基礎上促進知識體系的完善。首先,利用配制變色溶液這一過程引導學生回顧初中學過的酸堿遇指示劑變色的性質,增強視覺體驗的同時促進知識體系的聯系與銜接。其次,探究階段中由不同滴加順序引起的實驗現象的差異證實了氫氧化亞鐵遇酸溶解的性質,在探究的過程中自主發現該性質,增強了學生的證據推理能力,并在此基礎上優化制備方案。最后,所制氫氧化亞鐵在空氣中由白至灰綠到紅褐色的現象變化,實現了二價鐵到三價鐵的轉化,印證了二價鐵的還原性,促進了學生“價類”二維認知方式的構建。在實驗探究中,實現了對氫氧化亞鐵從性質、制備到轉化的感性認知,并注重前后知識的銜接,有利于學生理性地構建完整的知識體系。
(2) 儀器裝置簡單,操作易行。利用玻璃板取代大部分研究中的試管作為反應發生裝置,其獨特性在于把氫氧化亞鐵的顏色與狀態更加直觀地呈現在學生眼前。由于步驟簡便,只需膠頭滴管在玻璃板上進行滴加便可實現,非常適合開展學生實驗,將理論知識與實踐探究有效結合,培養學生的動手能力,促進科學探究與創新意識核心素養的落實。
(3) 現象直觀,趣味性強。本研究的一個創新點在于把氫氧化亞鐵的制備置于一個開放體系——玻璃板上進行,使學生能夠直觀地觀察到溶液的流動融合、白色沉淀從出現到灰綠以至紅褐的完整變色過程,給予學生以視覺的沖擊與體驗,切身感受化學反應的獨特魅力,增強了實驗的趣味性。
(4) 試劑用量少,高效且環保。本實驗在制備過程中,只需要幾滴溶液就可以明顯地觀察到實驗現象,不僅實驗效果良好,更是體現了高效環保的綠色化學理念。
參考文獻:
[1]中華人民共和國教育部制定. 普通高中化學課程標準(2017年版2020年修訂)[S]. 北京: 人民教育出版社, 2020: 16.
[2]李俊生, 胡志剛. 對氫氧化亞鐵制備的幾個疑難問題的研究[J]. 化學教學, 2011, (11): 67~70.
[3]唐悅. 氫氧化亞鐵制備實驗的探究[J]. 化學教學, 2010, (5): 14~15.
[4]張愛菊, 陶鎖軍, 張小林. 電解制備氫氧化亞鐵除氧方式探究[J]. 化學教學, 2014, (6): 56~57.
[5]張宏艷. 基于X射線衍射分析方法改進氫氧化亞鐵制備實驗[J]. 化學教學, 2021, (5): 77~81.
[6]楊曉東. 氫氧化亞鐵制備實驗的再探究[J]. 化學教學, 2015, (2): 56~58.
[7]張元雙, 許九奎, 馬薇. 氫氧化亞鐵的制備與氧化方法實驗創新[J]. 中學化學教學參考, 2020, (21): 47~48.
[8]聶素云. 穩定氫氧化亞鐵的制備實驗改進[J]. 化學教育, 2011, 32(11): 71.
[9]傅獻彩, 沈文霞, 姚天揚等. 物理化學(第五版)(下冊)[M]. 北京: 高等教育出版社, 2006: 94.
[10]徐建飛, 張平, 杜淑賢. 制備氫氧化亞鐵實驗方案再探究[J]. 化學教學, 2015, (7): 54~57.

