基于高通量測序技術分析青藏高原風干牦牛肉中細菌多樣性
弋凱鴿,吳寒冰,李帥康,王 衛,耿 放,楊 林,池福敏,辜雪冬,
(1.西藏農牧學院食品科學學院,西藏林芝 860000;2.西藏特色農牧資源研發省部共建協同創新中心,西藏林芝 860000;3.成都大學肉類加工四川省重點實驗室,四川成都 610106)
牦牛被譽為“高原之舟”,是我國高原地區所特有的珍稀牛種[1],其肉中富含高蛋白和氨基酸,且脂肪和熱量都較低,因而深受消費者喜愛。風干牦牛肉大多是藏區人民家庭式生產用來過節招待客人或者自己食用的一種傳統生食肉制品。它的制作工藝是將牦牛肉進行分割切條后,充分利用高原地帶冬季低溫干燥低氣壓的特殊自然氣候條件風干而成[2]。風干牦牛肉也有小作坊生產和小型企業的批量生產,受藏族人民傳統的飲食習俗和不規范的制作工藝等方面的影響,其成品可能存在安全衛生及污染等方面的問題[3]。在風干牦牛肉的制作過程中,空氣和土壤中含有大量微生物,其中可能存在一定數量對形成風干牦牛肉品質有積極作用或有潛在益生特性的菌株,也可能存在一些致病菌及條件致病菌[4]。
高通量測序技術可以對一個物種的基因組進行全面分析,且具備處理大規模樣品的優勢[5]。因此,利用高通量測序技術測定不同環境中樣品的微生物,已經成為很多學者使用的一種手段。對比傳統微生物研究方法,如平板分離純化法、定量PCR 等,具有高靈敏度、高效性、準確性、無偏向性等優點,主要應用于微生物學、分子生物學、遺傳學等領域。目前關于風干牦牛肉中微生物研究多側重在加工以及品質形成方面[6?7],而在微生物多樣性方面的研究多側重在對細菌數量的變化[8]。因此,為探究西藏不同地區風干牦牛肉中細菌群落組成對其品質和安全性的影響,本文利用MiSeq 技術對西藏風干牦牛肉中的細菌群落結構以及多樣性進行分析,為后續風干牦牛肉的加工與安全控制提供一定的參考。
1 材料與方法
1.1 材料與儀器
風干牦牛肉 于2021 年4 月采自西藏不同地區的當地農戶家庭,分別是那曲班戈縣、昌都丁青縣、日喀則謝通門縣、拉薩達孜縣、山南扎囊縣。將不同的地區分成5 組,編號為那曲(NQ)、昌都(CD)、日喀則(RKZ)、拉薩(LS)和山南(SN),每個地區分別采集三份來自于不同農戶家庭的樣品;DNeasy Powe Water DNA 提取試劑盒 德國Qiagen公司;AxyPrep DNA Gel Extraction DNA 凝膠回收試劑盒 美國Axygen 公司;DNA Marker DL2000寶生物工程(大連)有限公司;瓊脂糖凝膠電泳試劑美國Invitrogen 有限公司。
P7589 熒光分光光度計 美國Invitrogen 有限公司;BG-gdsAUTO(130)凝膠成像設備 北京百晶生物技術有限公司;DYY-6C 電泳儀 北京六一生物科技有限公司;Flx800 酶標儀 美國伯騰有限公司;2720 PCR 擴增儀 美國ABI 公司。
1.2 實驗方法
1.2.1 樣品前處理 在采集點將樣品放置于無菌樣品采集袋,在采集袋上進行樣品編號,儲存于裝有冰袋的泡沫箱中盡快送回實驗室,4 ℃冰箱中保存備用。
1.2.2 DNA 提取 采用 Mo Bio/QIAGEN 公司的DNeasy PowerWater Kit 進行抽提,之后在260 和280 nm處用熒光分光光度計分別測定抽提DNA 的吸光值,得到DNA 濃度,并使用1%瓊脂糖凝膠電泳檢測DNA 的質量。調整DNA 溶液濃度,于4 ℃下保存DNA 工作液,?20 ℃下保存儲存液。
1.2.3 PCR 擴增 首先針對樣本DNA 特定16S rRNA V3V4 區進行PCR 擴增338F(5'-ACTCCTACGGGG AGGAGCA-3')和806R(5'-GGACTACHVGGGTWT CTAAT-3'),對目標條帶大批量PCR 擴增后進行割膠回收,得到純化的樣本。用酶標儀對各個樣品定量,最后采用標準的Illumina TruSeq DNA 文庫制備實驗流程構建所需的上機文庫,在上海派森諾公司的Illumina Novseq PE250 平臺進行測序。
1.2.4 序列分析 首先調用QIIME2 進行修改,使用demux 插件解復用,用cutadapt 對序列的引物片段進行切除,刪去未匹配引物的序列,然后通過dada2對序列進行質量過濾、去噪、合并、去除嵌合體[9]。使用RDP FrameBot 軟件,基于RDP 網站下載的相應功能基因的seeds 蛋白序列,對核酸序列中的插入和缺失錯誤進行糾正,對樣本中所包含的高質量序列的長度分布進行統計[10]。
1.3 數據處理
使用R 語言stat 包的uclust 函數,默認采用UPGMA 算法對beta 多樣性距離矩陣進行聚類分析,采用QIIME2 的classify-sklearn 算法與SILVA132的Greengenes 數據庫進行物種注釋分析,得到在每個分類水平上的分類學組成信息。通過Qiime 軟件計算Chao1、Simpson、Shannon 等指數,使用R 軟件根據多樣性指數繪制稀釋曲線。基于Qiime 軟件Jaccard 和Bray-Curtis 等兩種距離矩陣,對這些距離矩陣做PCoA 分析,并通過R 軟件進行PCoA 分析[11]。
2 結果與分析
2.1 測序數據統計與稀釋曲線分析
測序獲得不同風干牦牛肉樣品的原始序列數據后,進行篩選,除去不合格的序列,得到的有效序列共386693 條,主要集中分布在404~433 bp 范圍內。稀釋曲線的走勢表明樣品測序深度對多樣性的影響,當曲線走勢趨于平緩,說明該結果充分覆蓋了目前樣本中包含的所有物種[12]。隨機從各樣本的原始數據中抽取一定數量的序列,獲得樣本在一定的條件下所可能包含的物種總數及其中每個物種的相對豐度,得到稀釋曲線(圖1)。結果表明,隨著數據量的增加,曲線逐漸平緩,當前樣本已足夠反應了所包含的多樣性,具有科學性。
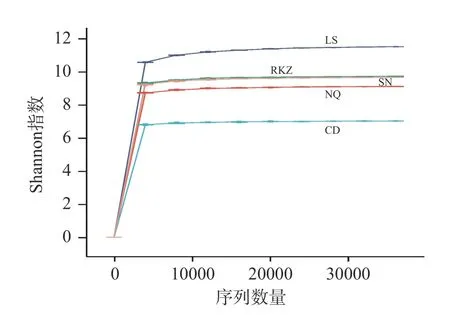
圖1 樣品稀疏曲線圖Fig.1 Sample sparseness curve
2.2 Alpha 多樣性分析
為探究風干牦牛肉樣品中細菌群落的豐富度和多樣性,采用多樣性指標的Observed_species、Chao1、Shannon、Simpson 及Coverage 指數進行評估[13]。Coverage 指所測序列對樣本的覆蓋率,值越高,則表明測出的樣本序列概率越高,可以準確地反映出樣品中微生物多樣性的真實情況。Simpson 與Shannon均被用來估算微生物多樣性,微生物多樣性主要包括豐富度和均勻度。Simpson 側重相對豐度,而Shannon 更側重物種豐富度。當二者指數值越大,說明群落多樣性越高。Chao1 指數用于計算群落豐度,樣品的群落豐度與值的大小呈正比[14]。如表1 所示,5 組樣品的Coverage 指數都達到了0.98 以上,表明測序結果真實可靠。LS 組的風干牦牛肉樣品中Chao1、Shannon 及Simpson 值最高,表明該地區的物種豐度最高,其菌群結構也更復雜。這可能與拉薩地區氣候相對溫和濕潤有利于部分細菌生長有關。CD 組的風干牦牛肉樣品的Chao1、Shannon、Simpson 指數均為最小,這說明了該組樣品中菌群群落豐度及多樣性最低。原因可能是由于昌都地區的人們在制作風干牦牛肉時,采用整條后腿肉直接風干后再切割食用的方式而導致部分細菌分布不均。其余組的豐度指數和多樣性指數也有明顯的差別,那曲、日喀則、山南地區均采用傳統切割分條風干的方式,其中,那曲氣候最為寒冷干燥,而導致部分細菌不易生長。這說明不同的風干環境和農戶制作方式導致細菌群落的多樣性存在差異。
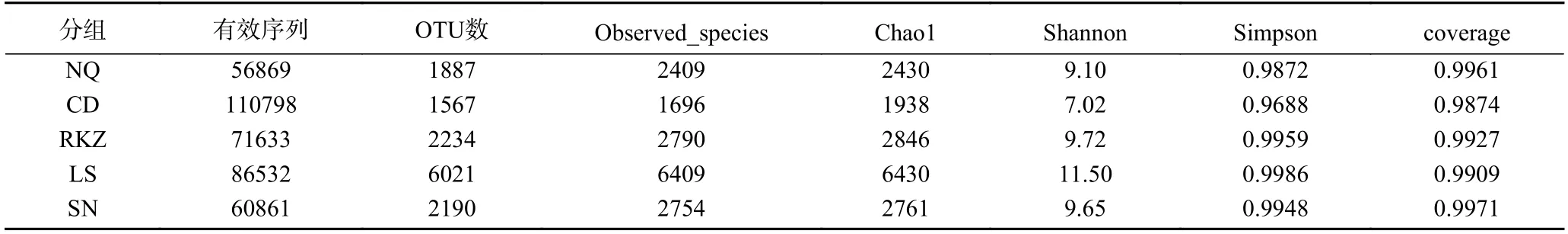
表1 α-多樣性指數Table 1 α-diversity index
2.3 OTU 的花瓣圖分析
基于不同組的樣本中所含的OTU 總數繪制韋恩圖,利用該圖對不同樣本的群落進行分析,可以直觀表達各組樣本共有以及特有的OTU 數[15]。如圖2所示,LS 組樣品OTU 數有6021 個,RKZ 組樣品OTU數有2234 個,SN 組樣品OTU 數有2190 個,NQ 組樣品OTU 數有1887 個,CD 組樣品OTU 數有1567個,而各樣本共有的OTU 數為27 個,表明各樣本之間的菌群結構具有明顯的差異。
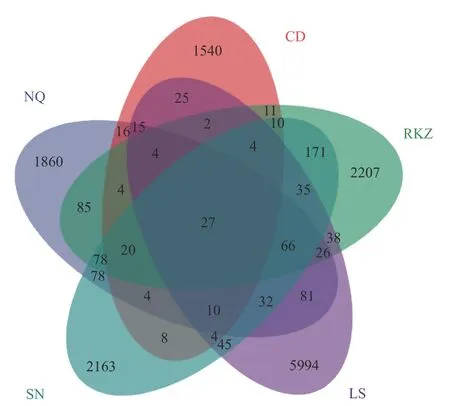
圖2 風干牦牛肉中細菌的OTU 分析圖Fig.2 OTU analysis of bacteria in air dried yak meat
2.4 不同地區風干牦牛肉樣品細菌群落結構分析
2.4.1 基于門水平的細菌群落結構分析 在門水平上,5 組風干牦牛肉樣品的群落組成如圖3 所示。5 組樣品中微生物群落構成基本相同,主要差別在微生物的相對豐度上。微生物群落主要包括放線菌(Actinobacteria)、厚壁菌門(Firmicutes)、變形菌門(Proteobacteria)、擬桿菌門(Bacteroidetes)、綠彎菌門(Chloroflexi)、藍細菌門(Cyanobacteria)、酸桿菌門(Acidobacteria)和芽單胞菌門(Gemmatimonadetes)等。NQ 組的風干牦牛肉樣品細菌組成以厚壁菌門和放線菌門為主,相對豐度分別為38.91%和25.22%,CD 組菌群結構以變形菌門(65.62%)和厚壁菌門(22.01%)為主,RKZ 組以放線菌門(48.82%)和厚壁菌門(21.40%)為主,LS 組以放線菌門(35.86%)和厚壁菌門(29.21%)為主,SN 組以放線菌門(39.80%)和厚壁菌門(24.49%)為主。結果發現,NQ、RKZ、LS、SN 組的優勢菌群是厚壁菌門和放線菌,CD 組的優勢菌群為變形菌門和厚壁菌門。這可能與風干牦牛肉制作時間都處于天氣寒冷干燥時期有關,此環境條件下有利于其生存。其中,厚壁菌門中的細菌可以抵抗脫水和極端環境。芽孢桿菌綱內的物種由于大多可形成抗逆性極強的芽孢,而具有極強的環境適應性[16],因此,在各類生態系統中發揮著重要的生物學作用。放線菌門中大多數細菌是一種呈菌絲狀生長和以孢子繁殖的原核生物,且孢子具有耐干燥的能力[17]。變形菌門中大多數細菌營兼性或者專性厭氧及異養生活[18]。
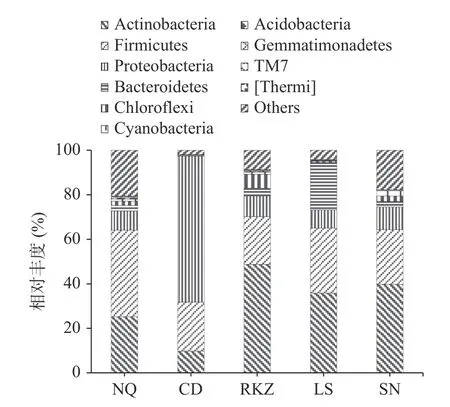
圖3 基于門水平上風干牦牛肉的細菌群落分布圖Fig.3 Distribution map of bacterial community based on air dried yak meat at door level
2.4.2 基于科水平的細菌群落結構分析 不同組樣品中在科水平上的群落分布,如圖4 所示。5 組樣品中細菌群落大體上一致,主要差別在群落的相對豐度上。5 組樣品中微生物群落主要包括微球菌科(Micrococcaceae)、腸桿菌科(Enterobacteriaceae)、假單胞菌科(Pseudomonadaceae)、鏈球菌科(Streptococcaceae)、藍球菌科(Planococcaceae)、間孢囊菌科(Intrasporangiaceae)、棒狀桿菌科(Corynebacteriaceae)、瘤胃球菌科(Ruminococcaceae)、諾卡菌科(Nocardioidaceae)和乳桿菌科(Lactobacillaceae)等。NQ 組的風干牦牛肉樣品菌群組成以乳酸桿菌科(13.56%)為主。乳酸桿菌科主要在厭氧環境下繁殖,廣泛存在于發酵食物中,可提高食品中的風味物質[19]。腸桿菌科(35.62%)和假單胞菌科(27.67%)為CD 組主要群落,為食物中的優勢腐敗菌群,具有分解蛋白質和脂肪的能力[20]。RKZ 組以間孢囊菌科(10.39%)為主,該菌的菌絲體可能含有間囊泡,但不含孢子[21],可能來源于自然環境。LS 組以微球菌科(14.71%)為主,部分菌屬于非致病菌,營呼吸與發酵代謝,可能來源于原料。棒狀桿菌科(8.63%)為SN組主要群落,為腸道菌群中正常存在的微生物,具有一定的耐受能力[22]。
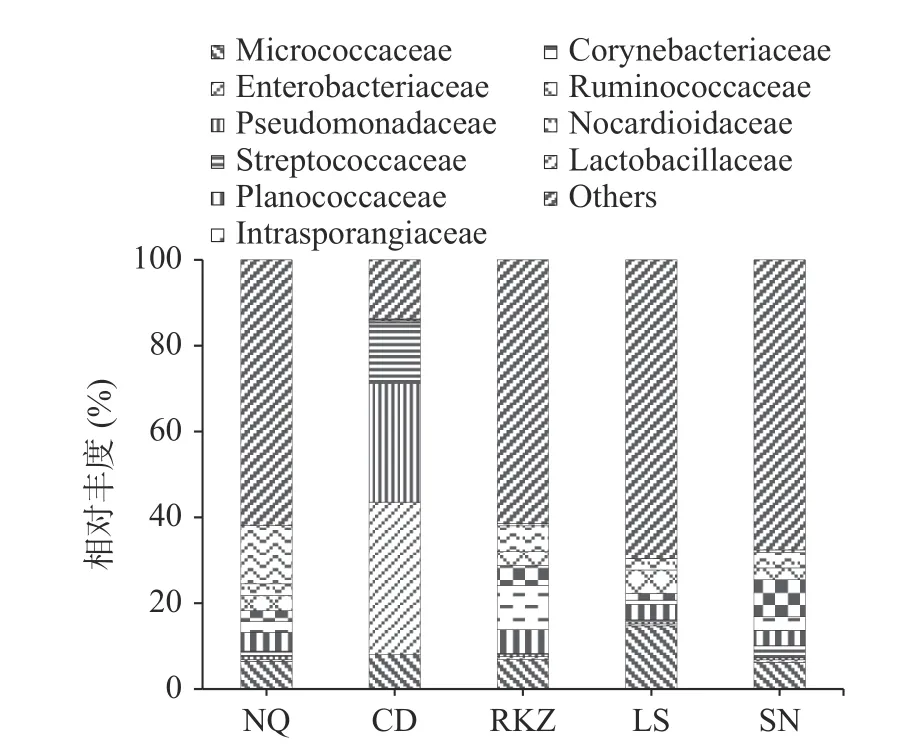
圖4 基于科水平上風干牦牛肉的細菌群落分布圖Fig.4 Bacterial community distribution map of air dried yak meat based on family level
2.4.3 基于屬水平的細菌群落結構分析 基于屬分類水平的5 組風干牦牛肉樣品的細菌群落結構如圖5 所示。5 組樣品中細菌群落除未分類的菌株,在構成和含量上有明顯的差別。細菌群落主要包括假單胞菌屬(Pseudomonas)、節桿菌屬(Arthrobacter)、棒狀桿菌屬(Corynebacterium)、乳酸桿菌屬(Lactobacillus)、鏈球菌屬(Streptococcus)、普雷沃菌屬(Prevotella)、動物桿菌屬(Planomicrobium)、梭菌屬(Clostridium)、小雙孢菌屬(Microbispora)和乳球菌屬(Lactococcus)等。由圖可以看出,NQ 組的優勢菌群為乳酸桿菌屬(12.75%),CD 組為假單胞菌屬(27.27%),RKZ 組為棒狀桿菌屬(4.59%),LS 組為節桿菌屬(10.99%)和普雷沃菌屬(10.20%),SN 組為棒狀桿菌屬(8.63%)。這與田建軍等[23]的研究結果基本一致。其中,乳酸菌作為發酵食物中重要的菌株,可以利用原料肉中的蛋白質和碳水化合物進行異質發酵產酸,賦予風干牦牛肉獨特的風味。假單胞菌、節桿菌屬和棒狀桿菌屬屬于優勢腐敗菌,可以分解食物中的蛋白質和碳水化合物[24?26]。普雷沃菌屬是人體健康腸道菌群中重要的菌群的一種,適量存在對人體健康有益[27]。
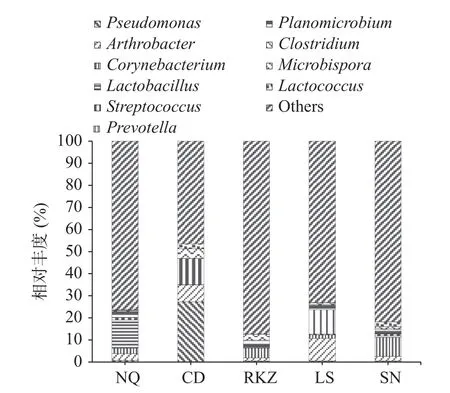
圖5 基于屬水平上風干牦牛肉的細菌群落分布圖Fig.5 Bacterial community distribution map of air dried yak meat based on genus level
2.4.4 物種豐度聚類熱圖 為更直觀展現各地區風干牦牛肉優勢細菌的豐度變化以及相似性,對相對豐度排名在前20 的屬繪制熱圖。由圖6 聚類分析結果可得,那曲與拉薩地區樣品間結構相近,山南與日喀則地區樣品間結構相近,可能是由于這四個地區在地理位置上比較相鄰,農戶家庭的加工方式也大致相同。昌都樣品采集地區的位置距離其他四個地區較遠,且加工方式也有較大差異。各地區優勢細菌的相似性也有較大的差異,昌都與拉薩地區的優勢細菌樹枝距離最近,相似性較高。日喀則與山南地區優勢細菌之間的樹枝距離最近,相似度較高。這兩個地區的優勢菌與那曲地區的相近,相似度較高。
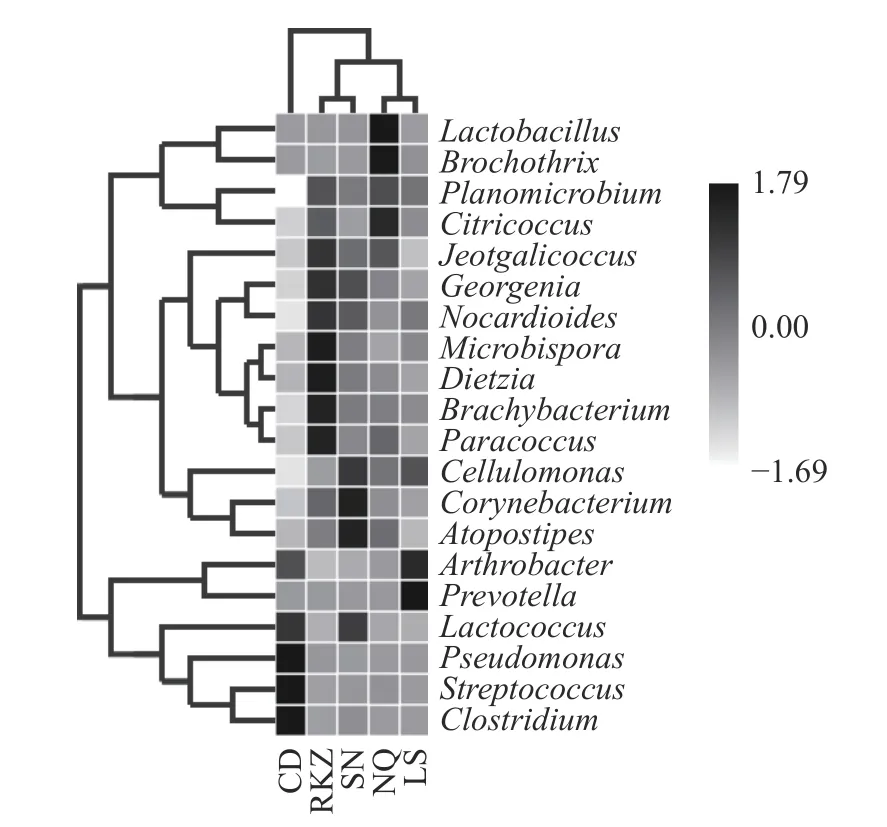
圖6 屬分類水平風干牦牛肉的細菌豐度熱圖Fig.6 Heat map of bacterial abundance of air dried yak meat at genus classification level
3 討論
本文以西藏地區的風干牦牛肉作為研究對象,通過對5 個地區樣品進行細菌多樣性分析,發現各地區間細菌種類以及豐度相差較大,這些細菌主要來源于風干牦牛肉的原料肉以及生產環境中。在門水平分類上,優勢菌群為厚壁菌門、變形菌門以及放線菌門。這與研究發酵肉制品中的結果基本一致[26,28]。相關研究表明,厚壁菌門中清酒乳桿菌在發酵肉制品中產酸,導致pH 降低,抑制雜菌生長,加速亞硝酸鹽分解,致使亞硝胺減少[29]。厚壁菌門也是存在于肉制品中的一種優勢腐敗菌[28],它存在于腸道中通過吸收食物中的熱量而導致肥胖[30]。變形菌門與放線菌門中多為病原菌,例如:變形菌門中的沙門氏菌會引起食物中毒[31]。放線菌門中多為腐生菌,可以使食物腐敗變質[32]。因此,為避免出現食物中毒的情況,采取在原料肉前處理時進行無菌處理,改進加工方法以及食用前進行加熱等方式,盡可能降低有害菌導致的危害。在科分類水平上,各地區風干牦牛肉的菌群種類以及豐度差別較大,可能是與各地區的加工方式以及環境不同有關。其中,乳酸桿菌科為發酵食物中的有益菌株,利用營養物質產生風味物質而形成獨特的風味,同時抑制一些食源性病原菌的生長,保證了食品的品質與風味[33]。假單胞菌科、腸桿菌科和棒狀桿菌科多為優勢腐敗菌,尹德風等[34]對生鮮肉類產品中的腐敗細菌進行研究,認為腐敗微生物可能會出現在屠宰加工環節。因此,控制原料肉的處理極為重要。在屬水平以及豐度熱圖上,發現了各地區的細菌菌落組成與豐度之間的差異與相互關系,從而說明加工環境以及方式對風干牦牛肉的品質有重要的影響。馬靜等[35]發現青海不同海拔牦牛乳的微生物組成和豐度有差異,認為環境對微生物多樣性有重要影響。綜合分析發現,不同地區的風干牦牛肉在門、科和屬水平上存在種類及含量的差異。這可能與每個地區的環境有一定的關系,其次在加工過程中,不同原料肉的前處理方式以及農戶的食用習慣,也有可能導致群落差異的產生。
4 結論
本研究通過對西藏風干牦牛肉進行高通量測序分析,研究發現在門分類上那曲、日喀則、拉薩以及山南組的優勢菌為厚壁菌門和放線菌門,昌都組為變形菌門和厚壁菌門。在科分類上,那曲組優勢菌為乳酸桿菌科,昌都組為腸桿菌科和假單胞菌科,日喀則組為間孢囊菌科,拉薩組為微球菌科,山南組為棒狀桿菌科。在屬分類上,那曲組為乳酸桿菌屬,昌都組為假單胞菌屬,日喀則和山南組均為棒狀桿菌屬,拉薩組為節桿菌屬和普雷沃菌屬,表明不同風干牦牛肉在菌落組成和豐度上有所不同。通過對西藏風干牦牛肉進行測序,了解藏區風干牦牛肉細菌群落情況,發現風干牦牛肉中既存在對品質形成以及產生風味的有益菌,也可能存在優勢腐敗菌以及致病菌,或與藏區農戶對原料肉的前處理以及制作環境有很大關系。因此,提高藏區農戶的食品安全意識,關注致病菌以及腐敗菌污染的隱患,改善風干牦牛肉的加工方式十分重要。

