嗜熱杜邦菌α-淀粉酶的定向進化及高效表達
靳 燕,李延嘯,馬俊文,王玉川,閆巧娟,江正強,3,
(1.中國農業大學工學院,中國輕工業食品生物工程重點實驗室,北京 100083;2.中國農業大學食品科學與營養工程學院,北京 100083;3.南京財經大學食品科學與工程學院/江蘇省現代糧食流通與安全協同創新中心,江蘇南京 210023)
淀粉是地球中儲量最豐富的可再生資源之一[1],是一種天然的葡萄糖聚合物,主要包括兩種類型:直鏈淀粉和支鏈淀粉。α-淀粉酶(EC.3.2.1.1)可以隨機水解淀粉分子內部的α-1,4-糖苷鍵,生成短鏈糊精、麥芽寡糖和少量葡萄糖,因其生產成本低、pH 適用范圍廣、熱穩定性能好[2]等優點而在淀粉糖[3]、釀造[4]和面包烘焙等食品工業中廣泛應用。
分子改造技術能提高已有α-淀粉酶的熱穩定性和比酶活等酶學特性,是提升α-淀粉酶工業應用價值的有效方法之一[5]。目前,許多研究報道了α-淀粉酶的分子改造,常用的方法包括定向進化、定點突變和理性設計等。其中,定向進化無需了解蛋白酶結構功能關系,可快速建立突變體文庫,通過高通量篩選,能有效改良酶的功能[5?6]。如HUANG 等[7]利用定向進化技術對地衣芽孢桿菌來源的α-淀粉酶(BSA)進行分子改造,獲得了一個耐酸性提高的突變體G81R,在pH4.5 下孵育40 min 后仍然保留10%的初始酶活,而相同條件下的野生型淀粉酶已經基本沒有活性。WU 等[8]利用易錯PCR 對解淀粉芽孢桿菌(B.amyloliquefaciens)來源的液化α-淀粉酶(BAA)進行分子改造,有效降低了突變體對Ca2+的依賴性,且突變體的催化效率(kcat/Km)較野生型提高了2.4 倍。劉雪蓮等[9]利用DNA 重排技術構建地衣芽孢桿菌來源的α-淀粉酶突變文庫,篩選得到最適溫度提高10 ℃、最適pH 降低0.5~1 個單位且對Ca2+依賴性降低的突變體V-2。此外,基于基因工程技術進行異源表達是實現α-淀粉酶高產量的重要途徑之一。畢赤酵母表達系統因具有高效表達、胞外分泌等優勢而受到廣大研究者和生產者的關注。如趙寧等[10]將嗜熱真菌樟絨枝霉(Malbranchea cinnamomea)來源的α-淀粉酶在畢赤酵母中高效表達,高密度發酵至168 h 時,胞外酶活力達到13440.6 U/mL。WANG 等[11]將米黑根毛霉來源的α-淀粉酶在畢赤酵母中高效表達,發酵168 h 后,其酶活達29794.2 U/mL。WANG等[12]將嗜熱杜邦菌來源的α-淀粉酶在畢赤酵母中高效表達,發酵168 h 后,其酶活達38314 U/mL。迄今,已有較多α-淀粉酶在畢赤酵母系統中成功表達,但達到工業化生產水平的不多。因此,基于定向進化技術獲得一個穩定性和比酶活力同時提高的α-淀粉酶突變體具有重要意義。
前期研究了嗜熱杜邦菌(Thermomyces dupontii)來源的GH13 家族α-淀粉酶(Td-amy)的酶學性質和異源表達[11]。該酶具有優良的水解特性,在焙烤食品等領域具有良好的應用潛力,但是該酶的熱穩定性和比酶活較低。本研究利用易錯PCR 及定向進化技術對Td-amy 進行分子改造,構建隨機突變文庫,經高通量篩選以期篩選得到耐熱性和比酶活同時提高的突變體,并通過定點突變分析各突變氨基酸對其酶學性質的影響,最后將改造后的α-淀粉酶在畢赤酵母中高效表達,為淀粉酶的大規模工業化生產提供理論依據。
1 材料與方法
1.1 材料與儀器
嗜熱杜邦菌 本實驗室篩選保藏;載有嗜熱杜邦菌來源α-淀粉酶基因的重組質粒pPIC9k-Tdamy 和重組質粒pET28a-Td-amy 本實驗室構建并保存;克隆表達宿主大腸桿菌工程菌株DH5α 和Rosetta(DE3) 北京博邁德基因技術有限公司;表達載體pET-28a(+) Novagen;畢赤酵母GS115北京全式金生物技術有限公司;載體pPIC9K 美國Invitrogen;Fast Pfu DNA 聚合酶(500 U/mL) 北京全式金生物技術有限公司;限制性內切酶BamHI(20000 U/mL)、NdeI(20000 U/mL)、AvrII(20000 U/mL)、SnaBI(20000 U/mL)、SalI(10000 U/mL)和T4 DNA 連接酶(1000 U/mL)美國NEB 公司;瓊脂糖凝膠純化回收試劑盒 北京博邁德基因技術有限公司;高純質粒小量提取試劑盒 北京天根生物科技有限公司;酵母膏和胰蛋白胨Oxoid 公司;DNS 北京索萊寶科技有限公司;溶菌酶(20000 U/mg)、可溶性淀粉、NaCl、檸檬酸、檸檬酸三鈉、磷酸二氫鈉、磷酸氫二鈉、2-嗎啉乙磺酸(MES)、2-環己基氨基乙磺酸(CHES)、3-環己基-1-丙磺酸(CAPS)和咪唑 美國sigma 公司;Geneticin(G418)、異丙基-β-D-硫代半乳糖苷(IPTG)、卡那霉素和氨芐青霉素 美國 Inalco;其它試劑若無特殊說明均是國產分析純。
MD 平板培養基(g/L):10×葡萄糖(20%,w/v)100 mL,10×YNB(13.4%,w/v)100 mL,500×生物素(0.02 g/L)2 mL,瓊脂粉15 g;LB 液體培養基(g/L):酵母提取物5 g,胰蛋白胨10 g,NaCl 10 g;LB 平板培養基(g/L):LB 液體培養基,瓊脂粉15 g;YPD 液體培養基(g/L):酵母提取物10 g,胰蛋白胨20 g,葡萄糖20 g(葡萄糖與其他成分分開滅菌);YPDG418 平板培養基(g/L):YPD 液體培養基,瓊脂粉15 g,1~4 mg/mL G418。
Gene Pulser MXcell 電轉儀、PCR MyCycler 自動擴增儀和 Power Pac BasicTM 型電泳儀 美國BIO-RAD 公司;TGL 12GB 高速臺式離心機 上海安亭科學儀器廠;TU 1800PC 紫外分光光度計 北京普析通用儀器設備有限責任公司;金屬親和層析柱料Ni-NTA agarose 德國 Qiagen 公司;國強5 L 高密度發酵罐 上海國強生化工程設備有限公司;JY92-Ⅱ超聲波細胞粉碎機 寧波新芝生物科技股份有限公司;HZQ-X100 恒溫搖床 江蘇太倉實驗設備廠;酶標儀 賽默飛世爾科技公司;XMTD-6000恒溫水浴鍋 北京長風儀器公司。
1.2 實驗方法
1.2.1α-淀粉酶(Td-amy)隨機突變文庫的建立及高通量篩選
1.2.1.1α-淀粉酶(Td-amy)隨機突變文庫的建立易錯PCR 反應體系如下:0.1 mmol/L Mn2+/0.2 mmol/L Mn2+1 μL,5 mmol/L Mg2+1 μL,0.2 mmol/L dGTP和dATP 各1 μL,1.0 mmol/L dCTP 和dTTP 各1 μL,0.2 μmol/L Td-amy-F 和Td-amy-R 各1 μL(見表1),1.25 U rTaq DNA 聚合酶1 μL,5 ng pPIC9K-Tdamy 重組質粒1 μL,5x pfu buffer 10 μL,剩余用超純水補足至50 μL。易錯PCR 反應條件:95 ℃,3 min;95 ℃,30 s;55 ℃,30 s;72 ℃,90 s;反應循環34 次;72 ℃,10 min。

表1 本文所用引物Table 1 Primers used in this study
易錯PCR 產物經瓊脂糖凝膠電泳驗證正確后進行膠回收,膠回收產物與pET28a 質粒用相同的限制性酶BamHI 和HindIII 在37 ℃下雙酶切處理,并在T4DNA 連接酶的作用下16 ℃過夜連接,連接產物轉大腸桿菌DH5α感受態細胞,將所有單菌落從平板刮取至新鮮LB 培養基中,搖菌提質粒轉化至大腸桿菌Rosetta(DE3)中,收集所有轉化子,即為隨機突變文庫。隨機對10 個轉化子進行測序分析,計算突變體文庫的文庫容量和突變量。
1.2.1.2 突變文庫的初篩 將96 孔板中加入100 μL的含卡那霉素(50 μg/mL)的LB 培養基,之后用牙簽挑取突變體接種至96 孔板,同時接種野生型作為對照,37 ℃培養4 h 作為種子液。將96 孔板中的菌液取20 μL 轉接至新的裝有180 μL 新鮮LB 培養基(含卡那霉素50 μg/mL)的96 孔板中,37 ℃培養3 h后加入IPTG 10 μL 使其終濃度為0.5 mmol/L,16 ℃、180 r/min 誘導16 h。4 ℃、3000 r/min 離心20 min獲得菌體,將菌體于?80 ℃冷凍2 h 后于室溫下復融,加入100 μL 溶菌酶(10 mg/mL),pH8.0、37 ℃處理30 min,再于4 ℃、3000 r/min 離心20 min,獲得上清液即為粗酶液。
在96 孔深孔板中加入90 μL 1%(w/v)可溶性淀粉(50 mmol/L MES 緩沖液,pH6.5),然后加入10 μL 的粗酶液,置于55 ℃反應10 min,加入100 μL的DNS 終止反應。將上述反應液于沸水浴煮10 min,冷卻至室溫后,3000 r/min 離心10 min 后取上清用酶標儀測酶活。選擇酶活高于對照的菌株用于下一步的復篩。
1.2.1.3 突變文庫的復篩 選取初篩為陽性的克隆接種于LB 液體培養基中,37 ℃下培養,取1 mL 菌液在600 nm 處測吸光度值。當其OD600達0.6~0.8,加入10 μL IPTG 使其終濃度為0.5 mmol/L 進行重組酶的誘導表達。分別測定不同菌株粗酶液的酶學性質。以最適溫度和酶活升高的突變體作為正向突變體。
1.2.2 mTd-amy 的純化和酶學性質分析
1.2.2.1 純化 粗酶液使用Ni-IDA 柱(1 cm×5 cm)純化。先用10 個柱體積的緩沖液A(20 mmol/L 磷酸鹽緩沖液PB,500 mmol/L NaCl,20 mmol/L 咪唑,pH8.0)以1.0 mL/min 的流速平衡柱子,粗酶液以0.5 mL/min 流速上樣;用緩沖液A 以1.0 mL/min 流速洗脫至OD280<0.05,除去雜蛋白,然后分別用洗脫緩沖液B(20 mmol/L PB,500 mmol/L NaCl,50 mmol/L 咪唑,pH8.0)和緩沖液C(20 mmol/L PB,500 mmol/L NaCl,100 mmol/L 咪 唑,pH8.0)以1.0 mL/min 洗脫并收集目的蛋白。洗脫后經十二烷基硫酸鈉聚丙烯酰胺凝膠電泳(SDS-PAGE)檢驗其純度。
1.2.2.2 酶活力和蛋白濃度的測定α-淀粉酶酶活力的測定采用DNS 法(3,5-二硝基水楊酸法)[13]:將酶液用MES 緩沖液(50 mmol/L,pH6.5)進行適當稀釋,吸取100 μL 適當稀釋的酶液至900 μL 可溶性淀粉溶液(1.0%,w/v,50 mmol/L MES 緩沖液,pH6.5)中,振蕩均勻后,在55 ℃下反應10 min,加入1 mL DNS 溶液終止反應,于沸水浴中加熱10 min,測定OD540條件下的吸光度值,并使用葡萄糖作為標準。α-淀粉酶酶活力定義為:在以上反應條件下,每分鐘產生1 μmol 葡萄糖所需要的酶量定義為1 U。蛋白質濃度測定參考LOWRY 等[14]的方法。Folin 甲A 液和Folin 甲B 液按50:1 比例混合,每個樣品加1 mL 上述混合液和100 μL 適當稀釋的酶液,輕振蕩后室溫靜置10 min,加入100 μL Folin乙,迅速振蕩后于37 ℃水浴靜置30 min 后于OD650處測定吸光度值。以牛血清蛋白(BSA)為標準品制作標準曲線。
1.2.2.3 野生型Td-amy 及突變體mTd-amy 酶學性質的測定 a.最適pH 及pH 穩定性:在50 ℃(Td-amy)、55 ℃(mTd-amy)50 mmol/L 不同pH 的緩沖溶液中測定純酶的酶活以確定其最適pH。所選擇的緩沖體系分別為:檸檬酸鹽緩沖液(pH3.0~5.0)、MES 緩沖液(pH5.5~6.5)、磷酸鹽緩沖液(pH7.0~8.0)、CHES緩沖液(pH8.5~10.0)、CAPS 緩沖液(pH10.5~11.0)。將酶液用上述不同體系不同 pH 的緩沖液稀釋至OD540為0.2~0.8,于45 ℃水浴中保溫30 min,然后迅速置于冰水浴冷卻30 min,測定殘余酶活力。
b.最適溫度及熱穩定性:最適溫度的測定是將純酶用50 mmol/L、pH6.5 的MES 緩沖溶液適當稀釋,分別在40~80 ℃下測定野生型Td-amy 和突變體mTd-amy 酶活力,確定其最適溫度。將純酶用50 mmol/L、pH6.5 的MES 緩沖溶液適當稀釋,在40~80 ℃下孵育30 min,然后于冰水浴中冷卻30 min后,加熱至55 ℃(Td-amy)和60 ℃(mTd-amy)測定殘余酶活力。
1.2.2.4 底物特異性的測定 分別以1.0%(w/v)可溶性淀粉、紅薯淀粉、小麥淀粉、玉米淀粉和馬鈴薯淀粉為底物,測定野生型Td-amy 和突變體mTdamy 的底物特異性。分別在55 ℃(Td-amy)和60 ℃(mTd-amy)、pH6.5(50 mmol/L MES 緩沖液)的條件下反應10 min。采用DNS 法[13]測定酶活,以可溶性淀粉為底物測得的酶活設定為100%,每分鐘反應生成1 μmol 葡萄糖所需要的酶量定義為1 個酶活力單位。
1.2.3α-淀粉酶(Td-amy)的定點突變及結構模擬分析 將篩選到的陽性突變體α-淀粉酶基因(mTdamy)測序后,與野生型基因(Td-amy)序列進行比對分析,確定陽性克隆的突變位點。根據突變位點信息,以野生型基因為出發點向陽性突變體的方向逐一進行定點突變。
定點突變以重組質粒pET28a-Td-amy 為模板,用定點突變引物(表1),PCR 擴增程序為:95 ℃預變性3 min;95 ℃變性20 s,55 ℃退火20 s;72 ℃延伸3 min,25 個循環;72 ℃總延伸10 min。PCR 擴增產物經DpnI 在37 ℃條件下消化2 h,直接轉化大腸桿菌DH 5α感受態細胞。將轉化后的重組菌涂布于LB 固體培養基(含卡那霉素50 μg/mL),37 ℃培養12 h,對單菌落進行菌落PCR,并測序得到每個突變位點的20 個突變體。收集質粒,轉化大腸桿菌Rosetta(DE3)。
以米曲霉(A.oryzae)來源的Takaα-淀粉酶(PDB:6XSJ,序列同源性為65.54%)結構為模板,經SWISS-MODEL 進行同源結構模擬,得到α-淀粉酶(Td-amy)結構,根據預測的結構信息對突變位點進行分析。利用PyMOL 軟件分析氨基酸殘基間氫鍵相互作用和突變位點對蛋白質二級結構的影響。
1.2.4 mTd-amy 在畢赤酵母中表達及高密度發酵
1.2.4.1 mTd-amy 在畢赤酵母中表達 用限制性內切酶 SnaBI 和AvrII 對淀粉酶突變體基因(mTdamy)和載體 pPIC9K 雙酶切,凝膠回收后連接獲得重組質粒pPIC9K-mTd-amy。重組質粒pPIC9KmTd-amy 用限制性內切酶SalⅠ線性化后電轉化至巴斯德畢赤酵母GS115 中。取 100~200 μL 電轉化產物涂布于MD 平板培養基,30 ℃下培養2~3 d 后用無菌蒸餾水將MD 平板上生長的畢赤酵母轉化子洗脫和重懸。分別涂布于含有不同質量濃度的YPD-G418 平板培養基上30 ℃培養2~5 d。挑取不同質量濃度G418 平板培養基上的單菌落搖瓶發酵3 d,吸取上清液檢測淀粉酶酶活力。
1.2.4.2 突變體mTd-amy 的高密度發酵 選取搖瓶發酵淀粉酶酶活力最高的重組菌株進行高密度發酵。發酵方法及培養基的配制參照畢赤酵母發酵手冊(Version B,053002,Invitrogen)操作。
1.3 數據處理
數據統計和圖片處理采用 Origin 8.0 進行,數據均為3 次平行。
2 結果與討論
2.1 α-淀粉酶突變文庫的構建和篩選
采用Mg2+和Mn2+進行易錯PCR 擴增,與pET28a載體酶切連接構建重組質粒,并轉化至大腸桿菌DH5α,得到隨機突變文庫。隨機對10 個轉化子進行測序分析,結果表明,當Mg2+濃度為5 mmol/L 和Mn2+濃度為0.1 mmol/L 時,隨機突變文庫中堿基突變率約為0.21%,氨基酸突變率約為0.63%,為合適突變率。經過兩輪篩選,最終得到1 個比酶活明顯升高的正向突變體,命名為mTd-amy。該突變體的比酶活為466.3 U/mg,相對于野生型(227.90 U/mg)提高至2.0 倍,測序結果表明,α-淀粉酶突變基因(mTd-amy)中有四個堿基發生改變,分別為C11T、C365T、A581G 和C1403A,導致該突變體中四個氨基酸發生改變,即Ala4Val、Ala122Val、Lys194Arg和Ala468Asp。將野生型α-淀粉酶基因(Td-amy)和突變體基因(mTd-amy)的氨基酸序列與其它GH13 家族α-淀粉酶進行序列比對,發現Ala4Val、Ala122Val、Lys194Arg 為部分保守氨基酸,而Ala468Asp 為非保守氨基酸。
2.2 野生型Td-amy 和突變體mTd-amy 的酶學性質
2.2.1 最適條件的測定 將突變體mTd-amy 純化后,SDS-PAGE 結果分析表明目的蛋白條帶均一,分子量為61.2 kDa(圖1),與其預測分子量和野生型Td-amy 分子量一致。對野生型Td-amy 和突變體mTd-amy 酶學性質測定結果如圖2。mTd-amy 的最適pH 為6.5(圖2A),在pH4.5~10.0 范圍內保持穩定(圖2B),與野生型Td-amy 研究結果一致[12]。mTd-amy 的最適溫度為60 ℃(圖2C),較野生型(大腸桿菌中表達)提高了5 ℃,明顯高于許多不同來源的重組α-淀粉酶,如來源于萊斯氏菌屬(45 ℃)[15]、海洋專性放線菌(50 ℃)[16]、柄籃狀菌(50 ℃)[17]和嗜堿溶淀粉性堿單胞菌(50 ℃)等[18];mTd-amy 在55 ℃以下保持穩定,在55 ℃下保溫30 min 后仍能夠殘留90%左右的酶活力(圖2D),而Td-amy(大腸桿菌中表達)僅在50 ℃以下保持穩定。另外,mTdamy 在65 和70 ℃保溫30 min 后,殘余酶活分別為27.3%和14.2%;而經過相同處理后,Td-amy(在大腸桿菌中表達)的殘余酶活分別僅為16.3%和8.1%。這表明進化后突變體mTd-amy 的最適溫度和熱穩定性均有所提高。

圖1 野生型(Td-amy)和突變體(mTd-amy)純化蛋白電泳圖Fig.1 SDS-PAGE analysis of the proteins during purification process of Td-amy and mTd-amy

圖2 野生型Td-amy 和突變體mTd-amy 的最適pH(A)、pH 穩定性(B)、最適溫度(C)和溫度穩定性(D)Fig.2 Optimal pH (A),pH stabilities (B),optimal temperatures(C) and thermostabilities (D) of Td-amy and mTd-amy
2.2.2 底物特異性 野生型Td-amy 和突變體mTdamy 對不同底物的特異性如表2 所示。結果表明,野生型Td-amy 和突變體mTd-amy 對多種底物均有水解活性,兩者均對玉米淀粉的水解能力最強,與丁夢瑤等[19]對約氏黃桿菌HSL13 中新型α-淀粉酶的底物特異性研究一致,其次是小麥淀粉、紅薯淀粉和馬鈴薯淀粉。突變體mTd-amy 對不同底物的比酶活均明顯提高,其中,底物為馬鈴薯淀粉和可溶性淀粉時,其比酶活都比野生型Td-amy 提高了2 倍以上。

表2 野生型Td-amy 和突變體mTd-amy 的底物特異性Table 2 Substrate specificity of Td-amy and mTd-amy
2.3 定點突變及結構模擬分析
定點突變結果表明(表3),與野生型Td-amy 相比,單突變體Ala122 Val 的比酶活較野生型提高至194.6%,但低于突變體mTd-amy(提高至204.6%),其余三個單突變體Ala4Val、Lys194Arg 和Ala468Asp與野生型Td-amy 相比,比酶活明顯降低。突變體Ala122Val 和Ala468Asp 的最適溫度較野生型提高了5 ℃。所有突變體最適pH 未發生變化。推測第122 位丙氨酸(Ala)突變和第468 位丙氨酸(Ala)突變是影響mTd-amy 酶學性質的關鍵。
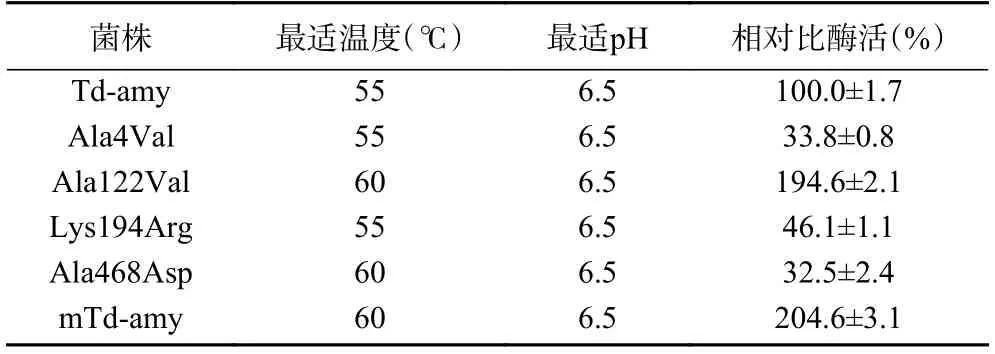
表3 突變體mTd-amy 的定點突變各個突變體的最適溫度、最適pH 及相對酶活Table 3 The optimal temperature,optimal pH and relative enzyme activity of mutants for site-directed mutation of mTd-amy
經SWISS-MODEL 同源結構模擬,得到α-淀粉酶(Td-amy)的結構模型(圖3),與其他GH13 家族α-淀粉酶相似,Td-amy 呈現典型的(β/α)8-TIM 桶結構,C 端區域還包含有一個小的β-片層結構,由8 個β-折疊和1 個小的α-螺旋結構組成。其中,Asp179、Glu232 和Asp299 為關鍵催化氨基酸,位于TIM 桶入口處。根據三維結構可知,該酶第4 位的丙氨酸、第194 賴氨酸和第468 位的丙氨酸均位于酶分子的表面,而第122 位的丙氨酸位于酶分子內部。
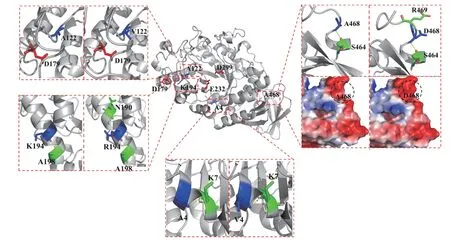
圖3 Td-amy 和 mTd-amy 的結構、改變位點、作用力和表面電荷分布示意圖Fig.3 Schematic diagram of structure,mutant sites,molecular force changes and surface charge distribution of Td-amy and mTd-amy
通常,蛋白質表面電荷的變化會影響蛋白質的折疊以及酶分子的催化特性[20?21]。第4 位電中性的丙氨酸突變為纈氨酸后,具有較大β側鏈的氨基酸纈氨酸不利于α螺旋的穩定[22],這可能是造成其比酶活降低的原因。第194 位賴氨酸突變為精氨酸后,精氨酸有更長的側鏈,增加了空間位阻,影響α螺旋的穩定,導致突變體酶活明顯降低[23]。第468位電中性的丙氨酸突變為負電性的天冬氨酸,導致該區域表面電荷由電中性變為弱負電性,推測可能是表面電荷的變化使其比酶活降低。另外,突變后第468 位的天冬氨酸增加了與第469 位精氨酸的相互作用力,有利于該Loop 區的穩定,可能是導致其最適溫度提高的原因。雖然122 位丙氨酸突變為纈氨酸沒有導致酶分子相互作用和表面電荷的改變,但A122 與三個催化氨基酸均位于催化凹槽入口處的Loop 區域。由于Loop 區是酶結構中最靈活的部分,酶的進化經常涉及它們在環區的殘基變化[24]。Loop 區域氨基酸的變化可能對底物的特異性結合產生了影響。另外,丙氨酸突變為纈氨酸后,穩定了底物結合區的空間結構,有利于底物的結合,既提高了酶活性,也提高了熱穩定性[25]。
雖然單突變體Ala4Val、Lys194Arg 和Ala468-Asp 比酶活都相對于野生型Td-amy 有所降低,但四突變體mTd-amy 的比酶活較野生型Td-amy 提高204.6%,說明單突變體的酶學性質經組合突變后并不一定產生疊加效應。這一結果與陳春等[26]對來源于Arthrobacter ramosus的MTHase 以及史然等[27]對地桿菌來源的α-L-巖藻糖苷酶進行定向進化的研究結果類似。
2.4 mTd-amy 的高密度發酵
突變體mTd-amy 成功在畢赤酵母中高效表達,經168 h 高密度發酵,發酵上清液的α-淀粉酶酶活力和蛋白含量分別達64696 U/mL 和33.6 mg/mL,菌體濕重439 mg/mL(圖4A)。發酵過程中發酵上清液的蛋白電泳如圖4B 所示,誘導開始,發酵上清液出現目的條帶(61.2 kDa);隨著誘導培養時間延長,目的條帶逐漸變粗,發酵上清液中mTd-amy 的蛋白含量逐漸增加。

圖4 畢赤酵母高密度發酵產α-淀粉酶(mTd-amy)歷程圖(A)和SDS-PAGE 分析(B)Fig.4 Time-course of mTd-amy expression in P.pastoris by high-cell density fermentation (A) and SDS-PAGE analysis (B)
突變體mTd-amy 的產酶水平明顯高于許多不同來源α-淀粉酶在畢赤酵母中異源表達的產酶水平,如來源于米曲霉(72 U/mL)[28]、微小根毛霉(8285 U/mL)[29]、地衣芽孢桿菌(11000 U/mL)[30]、米黑根毛霉(29794.2 U/mL)[11]和微小胞根霉(32100 U/mL)[31]。此外,mTd-amy 的蛋白含量也明顯高于許多不同來源重組α-淀粉酶在畢赤酵母中表達的蛋白含量,如米曲霉(0.4 mg/mL)[32]、微小胞根霉(1.5 mg/mL)[31]和地衣芽孢桿菌(12.2 mg/mL)[30]。可見,突變體mTd-amy 的高效表達為該酶的工業化生產奠定了基礎。
3 結論與討論
本研究基于定向進化及高通量篩選方法對嗜熱杜邦菌來源α-淀粉酶(Td-amy)進行分子改造研究,成功篩選到正向突變體mTd-amy,其比酶活較野生型Td-amy 提高至2.0 倍,最適溫度較野生型Tdamy 提高5 ℃,熱穩定性也有明顯提升,進一步將該酶在畢赤酵母中高效表達,酶活水平達64696 U/mL,較野生型Td-amy 提高1.68 倍[12]。ZHU 等[33]基于易錯PCR 技術對來源于解淀粉芽孢桿菌的α-淀粉酶進行隨機突變得到突變體G300H,其比酶活僅提高了9.6%。馬銀鳳等[34]基于酶分子進化原理,得到催化特性明顯提高的突變體E2M6,其最適溫度提高5 ℃,但其比酶活沒有明顯改變。本文利用定向進化技術得到了最適溫度和比酶活力同時改善的正向突變體mTd-amy,為淀粉酶的分子改造提供了理論依據。同時,實現了該酶的高效表達,為淀粉酶的大規模生產提供了實踐基礎。今后,仍需對淀粉酶進行更深入的分子改造,以提高淀粉酶在不同應用中的適應性。

