褪黑素處理對采后李果實Priming 抗病性的誘導作用
雷長毅,汪開拓,譚美琳,王勁松,黎春紅
(重慶三峽學院生物與食品工程學院,重慶 404000)
李(Prunus salicinaLindl.)為薔薇科李屬植物,其成熟果實的果色多樣,口感酸甜多汁且富含諸多有益人體健康的生物活性化合物,如多酚類化合物、類胡蘿卜素和抗壞血酸等,因此深受大眾歡迎[1]。但李果實屬于呼吸躍變型果實,且采摘期又逢高溫季節(6~8 月),采后呼吸和乙烯釋放速率高,果實在貯藏期間迅速軟化,因此易受到病原菌侵染而加速果實腐爛,從而失去商業性,其中,匍枝根霉(Rhizopus stolonifer)是主要的致病菌,極易引起李果實采后品質劣變,造成嚴重的經濟損失[2]。以化學殺菌劑(如噻菌靈、仲丁胺、撲海因等)來控制李果實采后病害的效果極為顯著,但化學殘留及病原菌耐藥性等問題嚴重限制了藥劑保鮮的應用[3]。現階段,眾多綠色環保的化學激發子如水楊酸、茉莉酸及其甲酯衍生物、苯丙噻唑硫代乙酸甲酯(BTH)、β-氨基丁酸(BABA)、油菜素內酯等均被證實可有效誘導果蔬抗病性,降低病害發生率[4]。因此,采用激發子誘導果實采后抗性是替代化學殺菌劑的可能途徑。誘導抗病性包括直接誘導作用和敏化(Priming)反應,Priming 反應是指植物經激發子處理后只有受到病原菌侵染時才展現出更快、更強的抗病性反應,包括抗病基因表達、植保素合成等,是一種低成本、高效的抗病防御機制[5]。
褪黑素(melatonin,MT)是動植物中廣泛存在的一種吲哚胺類激素,可參與眾多信號傳導過程從而調控細胞抗逆性反應以及能量和物質代謝[6]。研究表明,采后MT 處理可顯著抑制采后香蕉[7]和梨果實[8]中乙烯合成,并維持桃[9]、荔枝[10]、石榴[11]等果實活性氧代謝平衡,進而延緩這些果實在貯藏期間的品質劣變速度。此外,外源MT 還可誘導模式作物擬南芥和煙草中水楊酸和乙烯介導的一系列防御基因的表達,激活植株防衛反應[12]。但MT 處理對采后果實抗病性的具體誘導模式仍不明確。本研究以“鳳凰”李果實為試材,通過研究MT 處理對李果實貯藏期間H2O2、抗性相關酶活性及苯丙烷類代謝的影響,分析MT 對李果實抗病性的誘導作用,為MT 處理在李果實實際保鮮中的推廣提供數據支撐。
1 材料與方法
1.1 材料與儀器
八分熟的“鳳凰”李(Prunus salicinacv ‘Fenghuang’) 于2020 年6 月采自四川省遂寧市船山區仁里鎮有機李種植基地,采摘后2 h 內運回實驗室,先將有病蟲害和機械傷的李果實去除,挑選轉色均勻、大小一致的果實攤于實驗臺,經自然風散去田間熱;匍枝根霉(Rhizopus stolonifer)參考Li 等[13]的方法進行分離、純化及鑒定,以傳代培養后的菌絲體為材料,用無菌生理鹽水緩慢沖洗出成熟根霉孢子,并將孢子濃度稀釋為1.0×105個/mL(血球計數板),現配現用;褪黑素(MT)、幾丁質、Follin 試劑、4-香豆酸 美國Sigma 公司;鄰苯二酚、亞油酸鈉、L-苯丙氨酸、N-乙酰葡萄糖胺、亞硫酸鈉、三羥甲基氨基甲烷(Tris)、愈創木酚 重慶拓世眾和生物技術有限公司;3,5-二硝基水楊酸(DNS)、昆布多糖、對二甲氨基甲醛(DMAB) 上海源葉有限公司。
PAL-1 型數顯折光儀 日本愛拓公司;DW-86L328 型超低溫冰箱 浙江捷勝設備有限公司;HWS-P400C 恒溫恒濕培養箱 合肥達斯卡特科技有限公司;UT-1900 型全波長分光光度計 北京普析通用儀器有限責任公司。
1.2 實驗方法
1.2.1 樣品處理 MT 處理濃度參考Bal[14]的實驗結果進行確定。李果實以75%(v/v)乙醇溶液表面擦拭并晾干,隨后用無菌解剖針在果實最大橫截面處對稱穿孔2 個(2 mm×2 mm),隨后隨機劃分為4 份:對照組:用移液槍在李果實穿刺部位注入15 μL 無菌蒸餾水;MT 處理組:將10 μL 濃度為10 mmol/L 的MT溶液注入李果實穿刺部位;R.stolonifer接種組:每個穿刺部位注入15 μL 的1.0×105個/mL 的孢子懸浮液;MT+R.stolonifer處理組:先在李果實穿刺部位注入15 μL 10 mmol/L 的MT 溶液,于20 ℃放置6 h,隨后在各穿刺處接種15 μL 的1.0×105個/mLR.stolonifer孢子懸浮液。以上處理完成后,用PE 塑料盒進行分裝,每盒6 顆果實,每個處理組共15 盒,置于(20±1)℃、80 %~90% RH 條件下貯藏5 d。在此期間每天觀察李果實根霉病的發病情況,同時取樣用無菌手術刀切取健康果肉組織于液氮速凍再置于?80 ℃超低溫冰箱中保存,用于后續指標測定。各處理均重復3 次,整個實驗重復2 次。
1.2.2 發病率和病斑直徑的測定 李果實病斑直徑超過2 mm 時,則可認為是發病果;病果病斑直徑用游標卡尺直接確定。
1.2.3 H2O2含量的測定 稱取1 g 果實凍樣,加入5 mL冷丙酮勻漿,勻漿液超聲提取1 h 后于2 ℃,10000×g離心10 min。收集上清液根據Patterson 等[15]的方法測定H2O2含量,結果以nmol/g FW 表示。
1.2.4 細胞壁水解酶活性的測定 根據Abeles 等[16]的方法測定幾丁質酶和β-1,3-葡聚糖酶活性,以每小時催化生成1 mg N-乙酰葡萄糖胺為1 個幾丁質酶活單位,以每小時形成1 mg 葡萄糖為1 個β-1,3-葡聚糖酶活單位;以上酶活性結果均以U/g FW 表示。
1.2.5 苯丙烷類代謝途徑關鍵酶活性的測定 根據Zucker[17]的方法測定苯丙氨酸解氨酶(PAL)活性,每小時反應液在290 nm 處吸光度增加0.01 為1 個酶活力單位;根據范存斐等[18]的方法測定肉桂酸-4-羥基化酶(C4H)和4-香豆酸輔酶A 連接酶(4-CL)活性,以每小時反應液在340 nm 處吸光度增加0.01為1 個C4H 酶活性單位,以每分鐘反應液在333 nm處吸光度增加0.01 為1 個4-CL 酶活性單位;根據Cao 等[19]的方法測定過氧化物酶(POD)活性,以每分鐘酶促反應體系在470 nm 處吸光度增加0.01 為1 個酶活性單位;以上酶活性結果均以U/g FW 表示。
1.2.6 總酚及木質素含量的測定 根據Flion-Ciocalteu 法[20]測定總酚含量;木質素含量則參照Wang等[21]的方法進行測定。總酚和木質素含量結果均以mg/g FW 表示。
1.2.7 脂氧合酶(LOX)和多酚氧化酶(PPO)活性的測定 根據Lin 等[22]的方法測定LOX 活性,略有修改;用4 ℃預冷的磷酸緩沖液(0.1 mol/L、pH6.8)冰浴提取LOX 粗酶液。取2.75 mL 0.1 mol/L、pH5.5乙酸-乙酸鈉緩沖液、0.05 mL 濃度為0.1 mol/L 的亞油酸鈉溶液,在30 ℃保溫10 min 后加入0.2 mL 粗酶液混勻,以反應液每分鐘在234 nm 處吸光度增加0.01 為1 個LOX 活性單位;根據Cao 等[19]的方法測定PPO 活性,以每分鐘酶促反應體系420 nm 處吸光度增加0.01 為1 個酶活性單位;以上酶活性結果均以U/g FW 表示。
1.3 數據處理
除果實根霉病發病率和病斑直徑重復測定5 次外,其余各指標均重復測定3 次。繪圖采用Excel 2010,差異顯著性檢驗采用SPSS26.0(Duncan 多重比較法),其中顯著水平設定為5%。
2 結果與分析
2.1 MT 處理和R.stolonifer 接種對采后李果實根霉病的影響
對照組和MT 處理組李果實的表觀無明顯變化,未見明顯的發病果實;李果實接種R.stolonifer后發病率不斷上升,同時病斑直徑也急劇增加。貯藏5 d 后,MT+R.stolonifer接種組的果實發病率為55.35%,病斑直徑為14.31 mm,較只接種R.stolonifer的果實分別下降了36.24%和45.65%,說明MT 處理能夠有效控制李果實采后病害的發生(圖1A、B)。
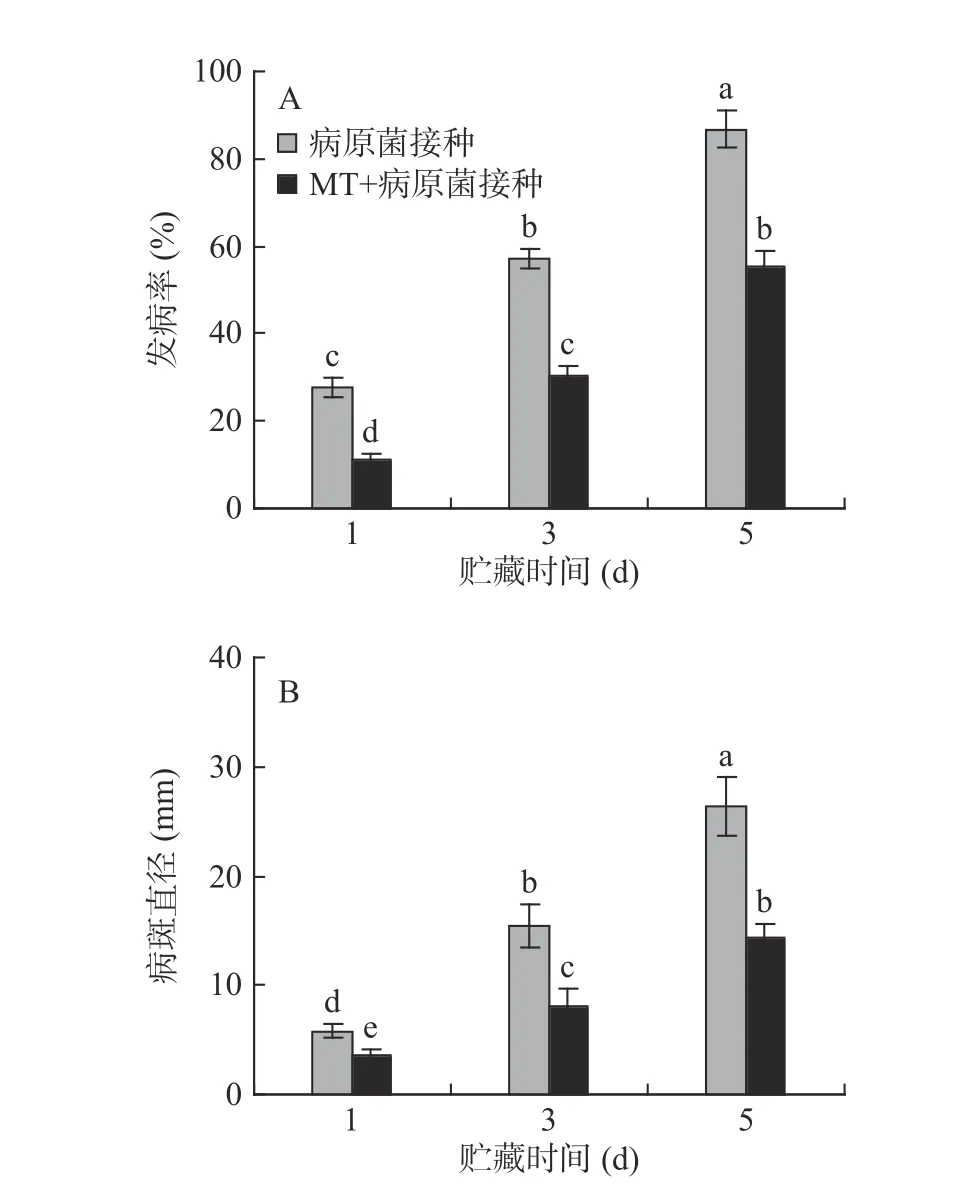
圖1 MT 處理和R.stolonifer 接種對采后李果實發病率(A)和病斑直徑(B)的影響Fig.1 Effects of MT treatment and R.stolonifer inoculation on disease incidence(A)and lesion diameter(B)in postharvest plums
2.2 MT 處理和R.stolonifer 接種對采后李果實H2O2含量的影響
如圖2 所示,對照李果實在20 ℃貯藏期間H2O2含量呈緩慢上升趨勢。單一MT 處理組與對照組之間的H2O2含量無顯著差異(P>0.05),而接種R.stolonifer的李果實H2O2含量大幅上升,并在貯藏第1 d 達峰值,隨后不斷下降,由于果蔬在受到病原菌侵染時會產生應激反應,H2O2迸發是典型的應激反應,所以在接種后會大量生成。與單一接種R.stolonifer的果實相比,MT+R.stolonifer接種則更為顯著(P<0.05)的誘導了李果實中H2O2的生成,其含量峰值較單一接種組上升了31.90%。

圖2 MT 處理和R.stolonifer 接種對采后李果實H2O2 含量的影響Fig.2 Effects of MT treatment and R.stolonifer inoculation on H2O2 content in postharvest plums
2.3 MT 處理和R.stolonifer 接種對采后李果實細胞壁水解酶活性的影響
如圖3 所示,對照李果實中幾丁質酶和β-1,3-葡聚糖酶的活性在整個貯藏期間保持穩定。經單一MT 處理的果實中幾丁質酶和β-1,3-葡聚糖酶活性在貯藏期間逐漸上升,在貯藏3 d 后其活性顯著(P<0.05)高于對照組水平;接種R.stolonifer后,幾丁質酶和β-1,3-葡聚糖酶活性迅速上升,并在第1 d達到峰值水平,隨后呈逐漸下降趨勢,因為幾丁質酶和β-1,3-葡聚糖酶對病原菌有抑制作用,是植物中典型的抗病相關酶,所以當葡萄果實遭受病原菌侵染時,其活性被立即誘導。MT+R.stolonifer接種處理可明顯誘導兩種酶在整個貯藏期間保持較高活性,其活性值在各取樣點均顯著(P<0.05)高于單一接種R.stolonifer果實。
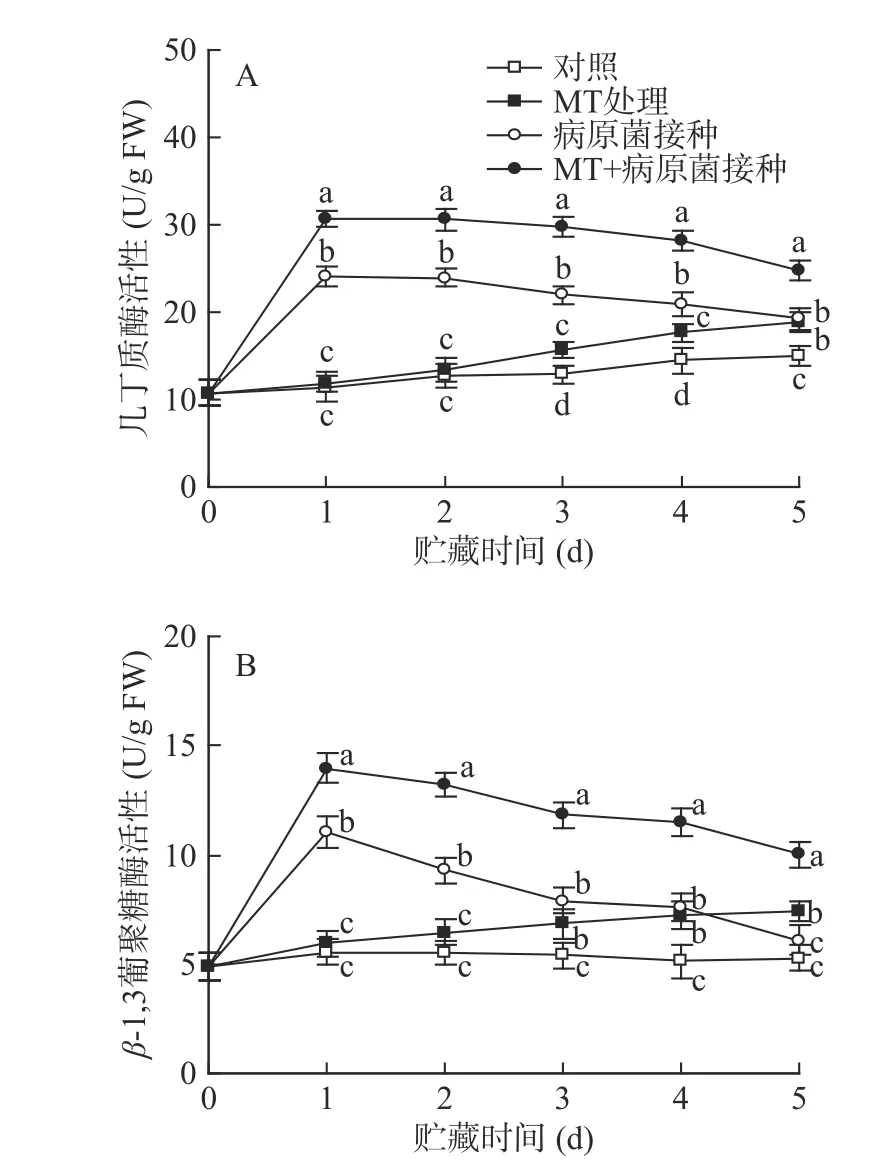
圖3 MT 處理和R.stolonifer 接種對采后李果實幾丁質酶(A)、β-1,3-葡聚糖酶(B)活性的影響Fig.3 Effects of MT treatment and R.stolonifer inoculation on the activities of chitinase (A) and β-1,3-glucanase (B) in postharvest plums
2.4 MT 處理和R.stolonifer 接種對采后李果實苯丙烷類代謝途徑關鍵酶活性的影響
如圖4 所示,在貯藏期間,對照組李果實中PAL 和4-CL 的活性基本維持穩定,C4H 和POD 活性則緩慢上升。MT 處理可有效提高上述苯丙烷類代謝途徑關鍵酶活性。李果實接種R.stolonifer后,PAL、C4H、4-CL 和POD 活性迅速上升;MT+R.stolonifer接種處理可更為顯著誘導李果實中PAL、C4H、4-CL 和POD 活性的上升,使酶活性在整個貯藏期間均顯著(P<0.05)高于單一接種處理水平。

圖4 MT 處理和R.stolonifer 接種對采后李果實PAL(A)、C4H(B)、4-CL(C)和POD(D)活性的影響Fig.4 Effects of MT treatment and R.stolonifer inoculation on the activities of PAL (A),C4H (B),4-CL (C) and POD (D) in postharvest plums
2.5 MT 處理和R.stolonifer 接種對采后李果實總酚及木質素含量的影響
如圖5 所示,對照組李果實在20 ℃貯藏過程中,其總酚和木質素含量在第1 d 達峰值,隨后逐漸降低。MT 處理有效促進了李果實總酚和木質素含量的積累,使兩者含量在貯藏期間顯著(P<0.05)高于對照水平。R.stolonifer接種顯著提高了李果實總酚和木質素的含量,但經MT+R.stolonifer接種處理的果實中總酚及木質素含量在整個貯藏期間均顯著(P<0.05)高于單一接種組水平。
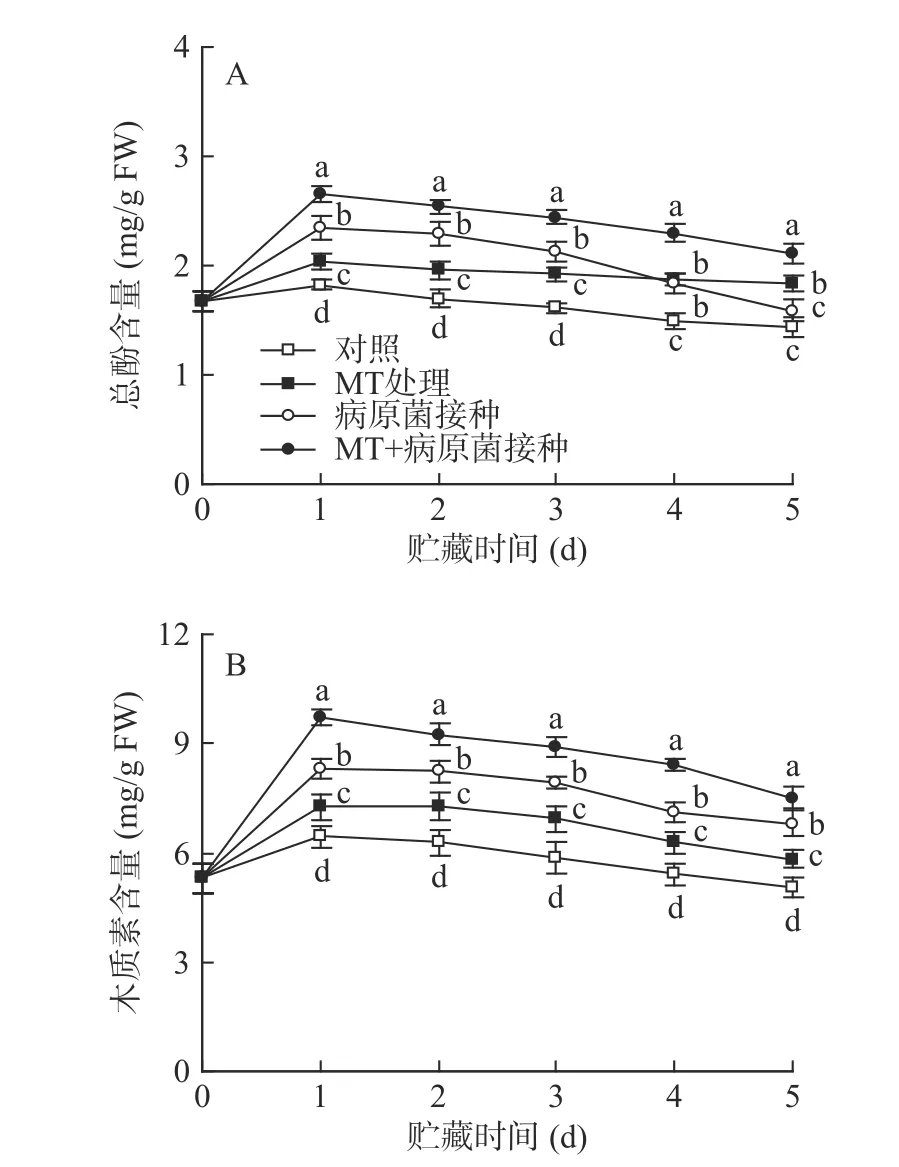
圖5 MT 處理和R.stolonifer 接種對采后李果實總酚(A)和木質素(B)含量的影響Fig.5 Effects of MT treatment and R.stolonifer inoculation on total phenolic (A) and lignin (B) content in postharvest plums
2.6 MT 處理和R.stolonifer 接種對采后李果實LOX和PPO 活性的影響
如圖6 所示,采后貯藏期間,對照組李果實中LOX 活性隨貯藏時間的延長而緩慢上升,同時PPO活性基本維持穩定。單一MT 處理組李果實中LOX活性在貯藏期間緩慢上升,PPO 活性保持穩定。R.stolonifer接種顯著(P<0.05)誘導李果實LOX 和PPO 活性水平的上升;而與單一R.stolonifer接種組相比,MT+R.stolonifer接種處理可更顯著(P<0.05)提升李果實貯藏期間這兩種酶的活性水平,使其保持在較高水平。
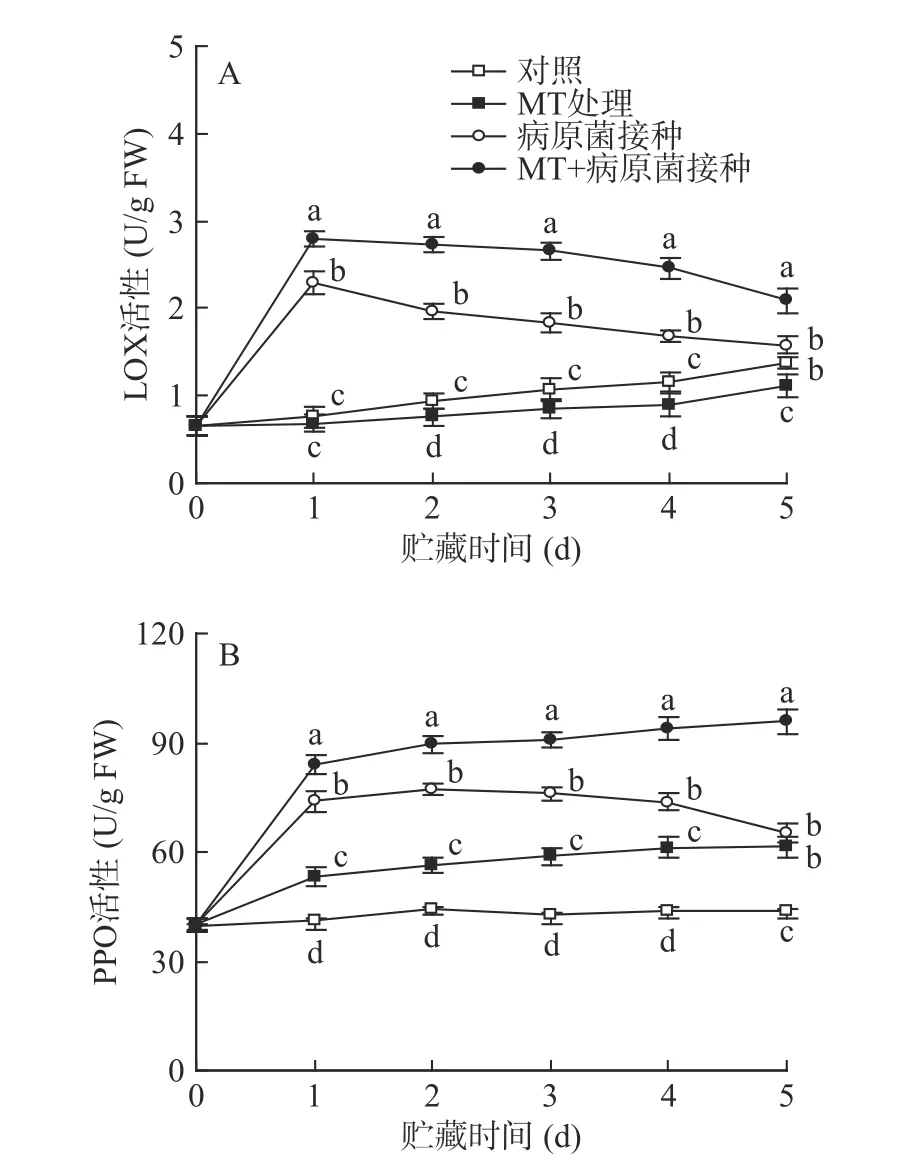
圖6 MT 處理和R.stolonifer 接種對采后李果實LOX(A)和PPO(B)活性的影響Fig.6 Effects of MT treatment and R.stolonifer inoculation on the activities of LOX (A) and PPO (B) in postharvest plums
3 討論
MT 為植物內源吲哚類激素,其通過信號傳導作用參與植物的眾多抗逆反應[23]。外源MT 處理可有效延緩番茄[24]、水蜜桃[9]、櫻桃[25]和草莓[26]等多種果實的采后衰老進程,維持果實綜合品質。在本研究中,10 mmol/L MT 處理可有效誘導李果實中活性氧迸發、提高抗病相關酶活性并促進總酚和木質素的合成,從而抑制采后貯藏期間果實根霉病的發生,維持果實的綜合品質。
根據植物誘導抗性理論,抗病性的表達是一種典型植物應激反應,可調動組織和細胞內的底物和能量從正常的代謝途徑轉入病程相關基因(pathogenesis-relatedgenes,PRs)的表達和抑菌物質的合成,因此可能限制植物的生長和發育;priming 反應是植物免疫系統的共同特征,也是植物誘導抗病性的重要細胞機制,是一種基于代謝平衡和防衛反應的植物抗性模式,可顯著減少植物的適應度損失[27]。研究表明,多種物理、化學和生物等激發子在低濃度狀態下使用時,均可有效誘導果實的priming 反應,從而使果實在受到病原菌嚴重侵染時表達強烈抗性。團隊前期研究也證明,BABA(10~50 mmol/L)、BTH(0.1 mmol/L)和茉莉酸甲酯(10 μmol/L)等激發子均可通過誘導楊梅[21]、草莓[28]和葡萄[29]等果實的priming 反應,來提升果實采后抗性,同時也促進了可溶性糖的積累。此外,H2O2迸發是植物受到病原微生物侵染的典型應激反應,其充當信號分子啟動植物超敏反應,從而提升果實抗性反應[30];幾丁質酶和β-1,3-葡聚糖酶為植物重要的細胞壁水解酶,其可特異性水解真菌細胞壁,阻礙病原菌的進一步侵染[16];植物苯丙烷類代謝途徑是合成酚類和木質素等抗菌物質的主要途徑,PAL、4-CL、C4H 和POD 是該途徑的關鍵酶類[31]。LOX 不僅參與調節植物的生長發育、成熟衰老等過程,在乙烯介導的抗病反應中也起著重要的調控作用[22]。在本研究中,經單一10 mmol/L MT 處理的李果實中苯丙烷類代謝酶以及總酚和木質素含量在整個貯藏期間均高于對照果實,但MT處理對抗病相關酶的誘導作用有限;當經MT 處理的果實再接種R.stolonifer后,果實內H2O2含量、幾丁質酶和β-1,3-葡聚糖活性以及苯丙烷類代謝酶(PAL、4-CL、C4H 和POD)活性、木質素和總酚含量在貯藏第1 d均出現明顯峰值,并在整個貯藏期間均顯著高于單一接種水平。這些結果說明,MT 處理誘導的李果實抗病反應可歸為priming 反應類型,即單一MT 處理可使果實處于防御準備(primed)狀態,隨后病原菌侵染時則迅速激活并放大防衛反應,阻止病原菌的進一步侵染,從而降低腐爛率并縮小病斑直徑。此外,MT+R.stolonifer處理也能顯著誘導LOX活性的上升,暗示MT 誘導的李果實priming 反應可能是由乙烯介導的ISR(induced systemic resistance,誘導系統抗性)類型。與本研究相類似,眾多根瘤菌也可通過乙烯或茉莉酸途徑誘導植物的priming 反應[32]。但同時,MT 也可通過水楊酸(SA)途徑誘導采后草莓果實SAR(systemic acquired resistance,系統獲得性抗性)反應從而提高抗病性[26]。因此,MT 調控不同信號傳導路徑防衛反應的相關分子機理有待進一步闡明。
4 結論
a.10 mmol/ L MT 可有效誘導采后李果實抗病相關酶活性以及總酚和木質素含量的提高,從而提升抗病性,減少采后貯藏期間根霉病的發生。
b.經MT 誘導的李果實在遭受病原菌侵染時可展現出強烈的活性氧迸發、較高的抗病相關酶活性及抗病相關物質含量增加,暗示該防衛反應歸因于一種典型的priming 反應機制。

