適體功能化的金納米棒用于癌癥靶向治療的研究進展
徐 慧 趙 璐 白云峰 馮 鋒
(山西大同大學化學與化工學院,化學生物傳感山西省重點實驗室,大同 037009)
0 引 言
癌癥是人類的第2大疾病,嚴重威脅著人類的生命健康。據美國國家癌癥中心統計,預估在2022年美國將新增609 360個癌癥死亡病例[1]。癌癥的傳統治療方法主要包括手術、放療與化療(chemotherapy,CHT),其中CHT是癌癥治療中最常用的方法,但CHT存在毒性大、療效低、易耐藥等問題,嚴重影響患者的治療效果[2]。隨著生物醫學的發展,癌癥的治療方法主要包括:CHT、光熱療法(photothermal therapy,PTT)、光 動 力 療 法 (photodynamic therapy,PDT)和基因療法(gene therapy,GT),PTT 因具有侵入性小、并發癥少、見效快且對正常組織毒副作用小等優點,引起了科學家們的廣泛關注。PTT 是利用光熱劑(photothermal agent,PTA)將光能高效地轉化為熱能,使癌組織溫度快速升高而誘導其凋亡的一種治療方法。PTA除了用于PTT外,也可用于負載藥物、光敏劑(photosensitizer,PS)、小干擾 RNA(small interfering RNA,siRNA)等,從而實現PTT/CHT、PTT/PDT、PTT/GT、PTT/PDT/CHT 或 PTT/GT/CHT的多模式聯合療法,在癌癥治療中顯示出巨大的潛力[3]。
目前已開發出多種類型的PTA,包括金納米顆粒(gold nanoparticles,GNs)[4]、碳基納米材料[5]、超薄2D納米材料[6-7]、半導體聚合物[8]、導電共軛聚合物[9]、有機小分子[10]等[11-12]。各類PTA用于PTT中的優缺點總結于表1。由于GNs具有局域表面等離子共振(localized surface plasmon resonance,LSPR)的獨特光學性質,根據具體應用情況,通過改變GNs的形狀,可在近紅外區調節LSPR特征吸收峰[13]。眾所周知,700~1 200 nm是PTT的最佳窗口,在此范圍內生理液體和組織對光的吸收率最低[14-15],因此GNs被廣泛用于PTT[16]。GNs具有棒狀、球形、梭形、星形等形狀[17],其中棒狀 GNs(gold nanorods,GNRs)因具有合成簡單、吸收峰可調、表面易修飾和光吸收率高等特點脫穎而出。常見GNRs的長度可調范圍為20~200 nm,寬度可調范圍為5~100 nm,其LSPR峰在近紅外區的位置隨GNRs長徑比(aspect ratio,AR)的不同發生變化[18]。到目前為止,GNRs的合成方法有晶種生長法[19]、電化學法[20]、光化學法[21]和濕化學法[22]等,其中最成熟的方法是晶種生長法[23]。利用晶種生長法合成的GNRs,具有形狀可控、單分散性好、穩定性高等特點。其制備分為3步:(1)以十六烷基三甲基溴化銨(CTAB)作為表面穩定劑,通過NaBH4還原HAuCl4制備種子溶液;(2)將CTAB與HAuCl4混合使其發生配位作用,加入弱還原劑,使Au(Ⅲ)變為Au(Ⅰ),并添加AgNO3制備生長溶液;(3)將種子溶液與生長溶液混合,過夜反應合成GNRs。通過該方法制備的GNRs表面殘留有CTAB,將其應用于細胞實驗時,CTAB會產生細胞毒性,因此需要將其去除。去除CTAB的方法包括離心或在其表面修飾其他材料,常用的修飾材料有聚合物、無機材料、生物分子等[23-24]。
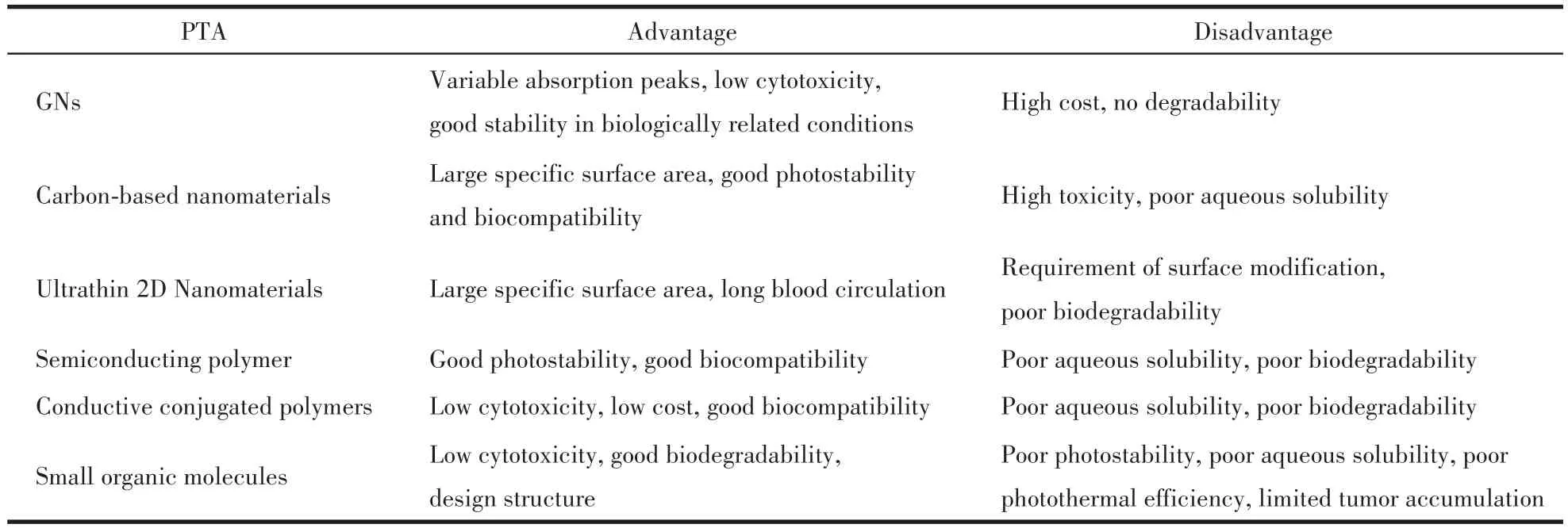
表1 各類PTA應用于PTT中的優缺點Table 1 Advantages and disadvantages of various types of PTA used in PTT
與其他物質相比,聚合物PEG(聚乙二醇)明顯提高了納米材料在血液中的循環周期,治療效果明顯改善[25-26]。Niidome課題組[27]利用PEG修飾GNRs測試了其對Hela細胞的毒性,體外研究結果顯示細胞存活率明顯提升,體內研究表明,PEG修飾的GNRs在血液中的流動時間延長。
在癌癥治療應用中,GNRs可通過納米材料的高通透性和滯留(enhanced permeability and retention,EPR)效應被動地聚集在癌細胞,實現對癌癥的物理靶向治療。但僅依靠EPR效應,無法特異性地靶向癌細胞,通過在GNRs表面修飾靶向分子,可以提高其對癌細胞的主動靶向能力,改善治療效果。近年來,已有報道使用單克隆抗體[28]、葉酸[29-31]、多肽[32]和透明質酸等[33-34]物質修飾GNRs以提高靶向能力,但這些方法存在制備過程復雜、靶向精度低的缺點。核酸適體(aptamer,Apt)的出現極大地改善了這些問題,為癌癥的靶向治療帶來新的希望。我們將Apt與其他靶向配體之間的優缺點比較總結于表2。

表2 適體與其他配體的優缺點比較Table 2 Comparison of advantages and disadvantages of aptamers and other ligands
1 核酸適體
Apt是一種人工在體外篩選的功能性寡核苷酸序列(短的單鏈DNA或RNA片段),通常擁有20~80個堿基,它可以折疊成二級或三級結構,這使其具有高親和力和特異性。由于具有與抗體相似的親和力和特異性,Apt被稱為“化學抗體”。
與抗體相比,Apt具有獨特的優勢和特點:(1)Apt的大小為6~30 kDa,具有高比表面積與體積比,可折疊成特定的結構以高親和力識別靶標;(2)可識別的位點多,可識別細胞、金屬離子、蛋白、細菌、真菌和病毒等[35-39];(3)具有相對較低的免疫原性;(4)穩定性高且生產成本低;(5)具有可編程性,通過刪除、添加、合并Apt序列進而識別不同目標;(6)具有易修飾和標記的特點,可在其5′或3′端修飾生物小分子(例如生物素、鏈霉親和素等)、化學基團(例如氨基、巰基、羧基等)[34]等,已廣泛應用于生物傳感[40-51]、體內成像[52]、靶向遞送藥物[53]和癌癥治療[54]等領域。
經過修飾后的Apt可通過共價作用與聚合物、小分子和納米材料表面的基團結合,從而實現癌癥藥物靶向遞送。在與GNRs結合的癌癥靶向治療體系中,Apt具有以下作用:(1)精準靶向癌細胞或其表面膜蛋白;(2)通過物理作用裝載化療藥物阿霉素(doxorubicin,DOX)[55];(3)在復合材料表面封裝藥物的功能;(4)用于連接光敏劑或RNA等。本課題組利用Apt的優勢,在生物傳感方面進行研究并取得了一些成果[41-51,56-57],實現了對腺苷[42]、癌胚抗原[44]以及伴刀豆蛋白[49]等分子的高靈敏檢測。利用Apt功能化GNRs(Apt-GNRs),可以將Apt的特異性識別能力和結合能力與GNRs的光熱性結合起來,實現癌癥的精準靶向治療,提高治療效率,減少毒副作用。本文基于Apt對癌細胞高特異性識別的優勢,總結了Apt-GNRs在癌癥靶向治療新策略方面取得的研究進展,同時展望了其未來的發展趨勢。
2 Apt-GNRs用于單一模式治療
2.1 Apt-GNRs用于PTT
PTT是利用光熱轉換效率較高的納米材料,在激光的照射下將光能快速轉化成熱能,使癌細胞內的蛋白質和DNA發生熱變性和凝固,從而促使癌細胞凋亡[58]。GNRs具有可調的縱向LSPR波長,這增強了其對相應波長的光吸收,從而實現高效的熱轉換。在癌癥治療中,Apt-GNRs對靶標具有高選擇性,進行PTT時使用較低的激光功率就可實現對細胞的高致死率,同時減少對周圍健康組織的傷害。
2008年,Tan課題組[59]首次設計了一種銀摻雜的 GNRs(Ag-GNRs)(圖1A),與 GNRs相比,Ag-GNRs具有更高的摩爾吸收效率。將Apt-Sgc8偶聯到Ag-GNRs來靶向CCRF-CEM細胞,在激光的照射下,癌細胞死亡率從23%上升為93%,正常細胞NB-4未發生明顯死亡。為了降低GNRs表面CTAB帶來的毒性,2014年,Haam課題組[60]利用羧基修飾的PEG(COOH-PEG-SH)替換GNRs表面的CTAB,為了提高靶向性,同時將Apt-EGFR與EGFR抗體修飾于GNRs上(圖1C),用于靶向A431和MCF-7細胞。體外研究顯示,在激光的照射下,癌細胞的死亡率顯著增高,體內研究發現腫瘤明顯變小。為了提升Apt對靶細胞的親和力,2016年Cheng課題組[61]篩選出一種新型的Apt-KW16-13靶向MCF-10CA1h細胞(圖1B),與Apt-KMF2-1a相比,Apt-KW16-13對MCF-10CA1h細胞表現出較強的親和力,將其修飾于GNRs進行PTT。體外研究結果顯示,在激光的照射下,癌細胞的死亡率高達96%。2019年,Kim課題組[62]篩選一種新的Apt用于靶向KB細胞(圖1D),將Apt修飾于GNRs表面進行PTT,體外實驗證明在激光的照射下,超過80%的細胞死亡。
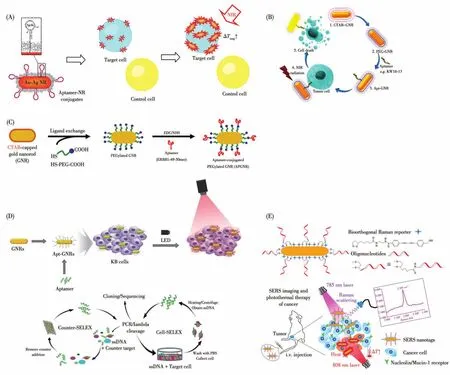
圖1 Apt-GNRs在PTT中應用的示意圖[59-62,64]Fig.1 Schematic diagram of the application of Apt-GNRs in PTT[59-62,64]
PEG具有減少非特異性蛋白吸附、改善血液相容性等優勢,但可能會引起細胞凝血,并產生抗PEG免疫球蛋白抗體。為了改善這一缺陷,Xu課題組[63]將DSPE-PEG-SH和Apt-EGFR修飾于外泌體(exosomes,Exos),通過 Au—S 鍵將其與 GNRs結合,利用Exos提升了GNRs的生物相容性。將Apt-EGFR用于靶向HepG2細胞,體外實驗結果顯示,在激光的照射下,GNRs溫度升高,HepG2細胞存活率顯著降低。
2020年,Tang課題組[64]將 Apt-AS1411/Apt-MUC1修飾的GNRs用于靶向MCF-7細胞(圖1E),體外實驗表明,在激光的照射下,MCF-7細胞幾乎全部死亡,體內實驗中Apt-GNRs對腫瘤的抑制率高達99%,有望在實際臨床中應用。
以上研究結果表明,Apt-GNRs在激光的照射下產生的熱量足以消融癌細胞,PTT可有效抑制腫瘤的生長。
2.2 Apt-GNRs用于PDT
PDT是在指定的波長(一般為440、660 nm)下,PS吸收光能后從基態躍遷到激發態,將能量轉移到周圍的氧分子中,產生細胞毒性活性氧(reactive oxygen species,ROS),例如單線態氧(1O2)和羥基自由基(·OH)等,對癌細胞造成氧化損傷,致使細胞凋亡[65-66]。與其他治療方式相比,PDT可以精確地控制其作用的位置和時間[67-71]。
PDT在臨床應用時,為了避免可見光對注射光敏藥物的患者帶來傷害,患者在一定時間內必須避免與光照接觸,另外,由于光敏藥物的非特異性分布,對正常組織也有毒性作用,限制了PDT在癌癥治療中的應用。為了改善這一問題,Shi課題組[72]首次將Apt-GNRs應用于PDT,選用Apt-MUC1修飾GNRs,并在Apt末端修飾了光敏劑分子Ce6,使Ce6接近GNRs時發生猝滅,在激光的照射下,PDT處于“關閉”狀態。相反,在MCF-7細胞存在時,Apt-MUC1與MCF-7細胞表面的MUC1蛋白結合,使Apt-MUC1構象發生變化,增加了Ce6分子與GNRs之間的距離(圖2),在激光照射下,PDT處于“開啟”狀態,細胞凋亡率提升了53.8%。2021年,Ng課題組[73]利用聚多巴胺(PDA)修飾的GNRs連接hp DNA用于靶向高表達miR-21的MCF-7細胞,在hp DNA上修飾了DSBDP(二苯乙烯基硼二吡咯亞甲基)。在675 nm激光的照射下,DSBDP被“激活”產生1O2(圖2B),使80%的細胞死亡,體內實驗證明該系統可有效抑制腫瘤生長,并對正常組織無明顯毒性作用。
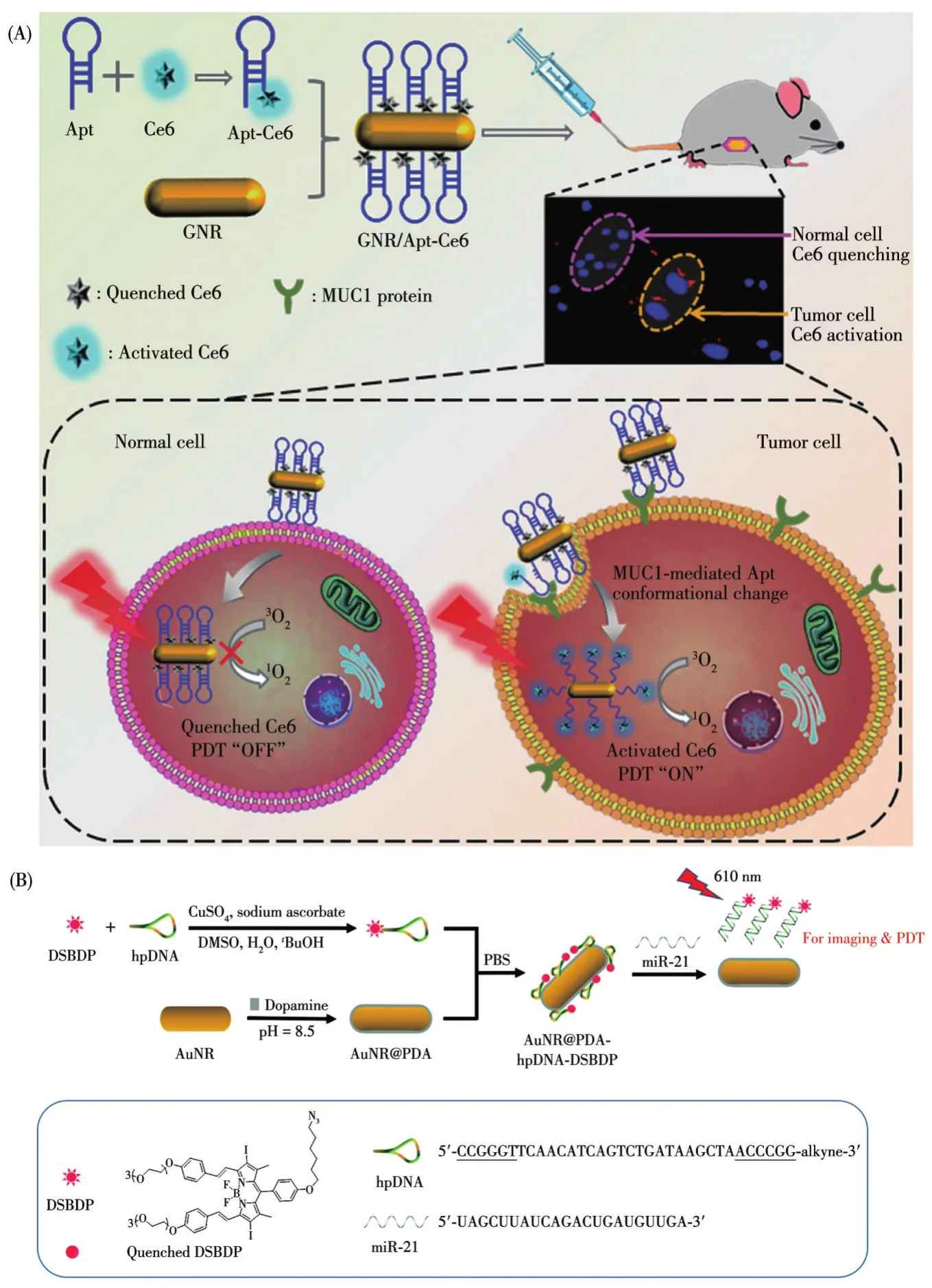
圖2 Apt-GNRs在PDT中應用的示意圖[72-73]Fig.2 Schematic diagram of the application of Apt-GNRs in PTT[72-73]
在Apt上修飾PS,在激光的照射下可實現PDT,而以上研究結果顯示Apt-GNRs可有效使癌細胞凋亡。
2.3 Apt-GNRs用于化療藥物載體
GNRs具有獨特的尺寸、較大的比表面積等特點,藥物可通過物理封裝或化學鍵合(非共價或共價)與GNRs結合,通過Apt的主動靶向作用增強化療藥物在癌細胞中的富集,降低對正常細胞的毒性,實現了藥物的定點釋放。
2016年,Wan課題組[74]設計一種基于GNRs的雙功能適體探針DOX/GNR/DNA(圖3),選擇了Apt-Romas與 Apt-ATP(DNA3)兩種 Apt,GNRs表面的單鏈DNA與DNA3雜交后可提供化療藥物DOX負載位點,以實現載藥。Romas細胞存在時,Apt-Romas與Apt-ATP發揮雙重靶向作用,可高特異性與Romas細胞結合,實現了DOX的靶向遞送,體內外研究均顯示DOX/GNR/DNA系統對癌細胞的增殖有明顯的抑制作用。
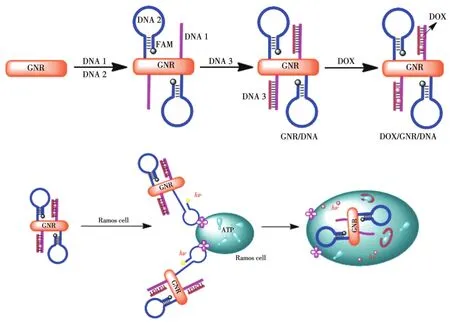
圖3 Apt-GNRs用于癌癥CHT的機理圖[74]Fig.3 Mechanism of Apt-GNRs used in CHT for cancer[74]
3 聯合療法
單一療法在癌癥治療中取得了初步成果,但也存在一些問題,例如:(1)PTT主要依賴PTA的光熱轉換性能,GNRs在體外消滅癌細胞和體內消除惡性腫瘤的效果十分顯著,然而,癌細胞內溫度升高使體內的熱休克蛋白(HSP)表達上調,增強了癌細胞的耐熱性從而降低了PTT的效果;(2)PDT療法主要依靠PS產生ROS,但部分無機PS僅在O2的存在下才能產生單線態氧(1O2),癌組織中乏氧狀態下PDT效果會受到影響;(3)化療藥物(DOX、紫杉醇、5-氟尿嘧啶等)進入身體后的非特異性分布會對人體臟器造成較大的危害,長時間使用化療藥物時,癌細胞會產生耐藥性(multidrug resistance,MDR)。為避免單一治療的缺陷,可以將2種或多種療法聯合使用以提高治療效果[75-76]。
3.1 雙模式聯合療法
3.1.1 PTT與CHT聯合
PTT可以顯著增強CHT效果,兩者聯合療法已被廣泛應用于癌癥治療[77-78]。2011年,Tan課題組[79]在GNRs表面修飾聚丙烯酰胺聚合物(DP-A、DP-B)以形成凝膠用來負載藥物,同時利用Apt-Sgc8靶向CCRF-CEM細胞。在激光的照射下,GNRs溫度升高并加速藥物釋放,細胞的死亡率可達67%左右(圖4A)。為了在提高載藥量的同時實現靶向作用,Qu課題組[80]首次將Apt作為封閉劑,用介孔SiO2包裹GNRs構建介孔二氧化硅納米粒子(mesoporous silica nanoparticles,MSNs),在其表面修飾了 Apt-AS1411用于靶向MCF-7細胞。利用Apt-AS1411與互補DNA序列形成雙鏈結構,在激光照射下,GNRs溫度升高使DNA雙鏈解旋,實現主動靶向MCF-7細胞的目的,MSNs自動解封,實現藥物釋放。體外實驗證明,在PTT和CHT共同作用下癌細胞存活率明顯降低(圖4B)。隨后,Um課題組[81]直接在GNRs表面修飾Apt-A10用于靶向LNCaP細胞,在PTT和CHT的聯合作用下,體內外實驗證明該系統抑制腫瘤有顯著效果。
除了直接靶向癌細胞中的一些蛋白之外,線粒體也可作為癌癥治療中有效的靶點,Qu課題組[82]設計了靶向線粒體的納米載藥系統,該系統同樣使用介孔SiO2包裹GNRs構建MSNs,將Apt-Cytc修飾于MSNs,其可以將藥物靶向遞送到HeLa細胞的線粒體。在980 nm激光的照射下,Apt-Cytc在HeLa的細胞質中釋放,觸發線粒體誘導細胞凋亡并刺激藥物釋放。實驗結果表明,與單獨的CHT和PTT相比,聯合療法產生了更高的細胞毒性(圖4C)。在遇到復雜環境時,MSNs不穩定,SiO2會與GNRs分離,對人體產生毒副作用。為此Tan課題組[83]利用碳層(Carbon)包裹GNRs以增強納米復合材料的穩定性,并修飾Apt-AS1411、裝載DOX構建了GNR@Carbon-DOX納米藥物遞送系統,該系統可通過簡單的疏水作用和π-π堆積在Carbon上裝載DOX,其載藥量高達46%,在紅外激光照射時,該納米系統的溫度由20℃快速上升到75℃,PTT療效顯著,在體外研究中用于靶向MCF-7細胞。實驗結果證明,與單獨CHT和PTT相比,聯合療法對MCF-7細胞生長的抑制作用更顯著(圖4D)。
DNA納米結構因其結構可編程性和良好的生物相容性在藥物載體應用方面備受關注。Ding課題組[84]用Apt-MUC1功能化DNA折紙,在折紙上可裝載DOX與GNRs,用于靶向MCF-7細胞,在激光的照射下,GNRs溫度升高,抑制了P-糖蛋白的表達,增強了癌細胞對DOX的敏感性。實驗結果發現,聯合療法比單一治療更有效地抑制了癌細胞的生長(圖4E)。
2015年,Tan課題組[85]利用DNA自組裝構建了一種大小可控的智能納米復合物,在GNRs短軸端修飾了Apt-Sgc8,用來靶向CCRF-CEM細胞。GNRs長軸端修飾捕獲鏈與金納米球(GNPs)上的DNA鏈雜交,用來裝載DOX(圖4F)。在激光照射下,GNRs溫度升高促使DOX釋放,研究結果顯示,CHT與PTT聯合,CCRF-CEM細胞凋亡率可提升24%。2019年,Hao課題組[86]在MSNs表面修飾PDA用于封裝DOX,同時提升GNRs的光熱效果,Apt-S6通過邁克爾加成反應與PDA連接,用于靶向A549細胞(圖4G),體外實驗表明,在激光照射下,DOX釋放,CHT與PTT共同作用,癌細胞存活率顯著降低。
3.1.2 PTT與PDT聯合
PDT依靠在細胞內直接產生ROS來殺死癌細胞,將PS高效遞送至癌細胞內是實現PDT療效的關鍵。由于溫和的熱療能夠增加細胞膜的通透性以增強癌細胞對納米載體的吸收,可通過溫和的PTT效應增加細胞內PS濃度,從而提高細胞內ROS濃度,進一步增強PDT療效。此外,輕度熱療可加速血液循環,增加血管飽和O2濃度,這也有利于提高PDT-Ⅱ型(O2依賴型)的1O2產量[87]。Tan 課題組[88]將Apt-Sgc8“發夾”結構的末端連接Ce6,依次將PEGSH、Apt-Sgc8修飾在GNRs上,構建了納米復合系統(圖5A)用于靶向CCRF-CEM細胞。由于Ce6貼近GNRs表面,其熒光被猝滅。在CCRF-CEM細胞存在時,Apt-Sgc8構象改變,使Ce6遠離GNRs表面。在激光照射下,GNRs吸收光能轉化為熱能,Ce6產生1O2,實現PDT/PTT聯合作用,CCRF-CEM細胞的死亡率高于70%。2013年,Tan課題組[89]將Apt-Sgc8修飾到GNRs,用于靶向CCRF-CEM細胞。在Apt-Sgc8互補序列(cDNA)末端修飾Ce6(圖5B),Apt-Sgc8識別CCRF-CEM細胞后與cDNA分離,Ce6分子被釋放。在白光和812 nm激光的照射下,Ce6產生1O2,GNRs產生PTT效果。體外研究表明,聯合療法比單一療法更有效,可使細胞存活率降至32%以下。
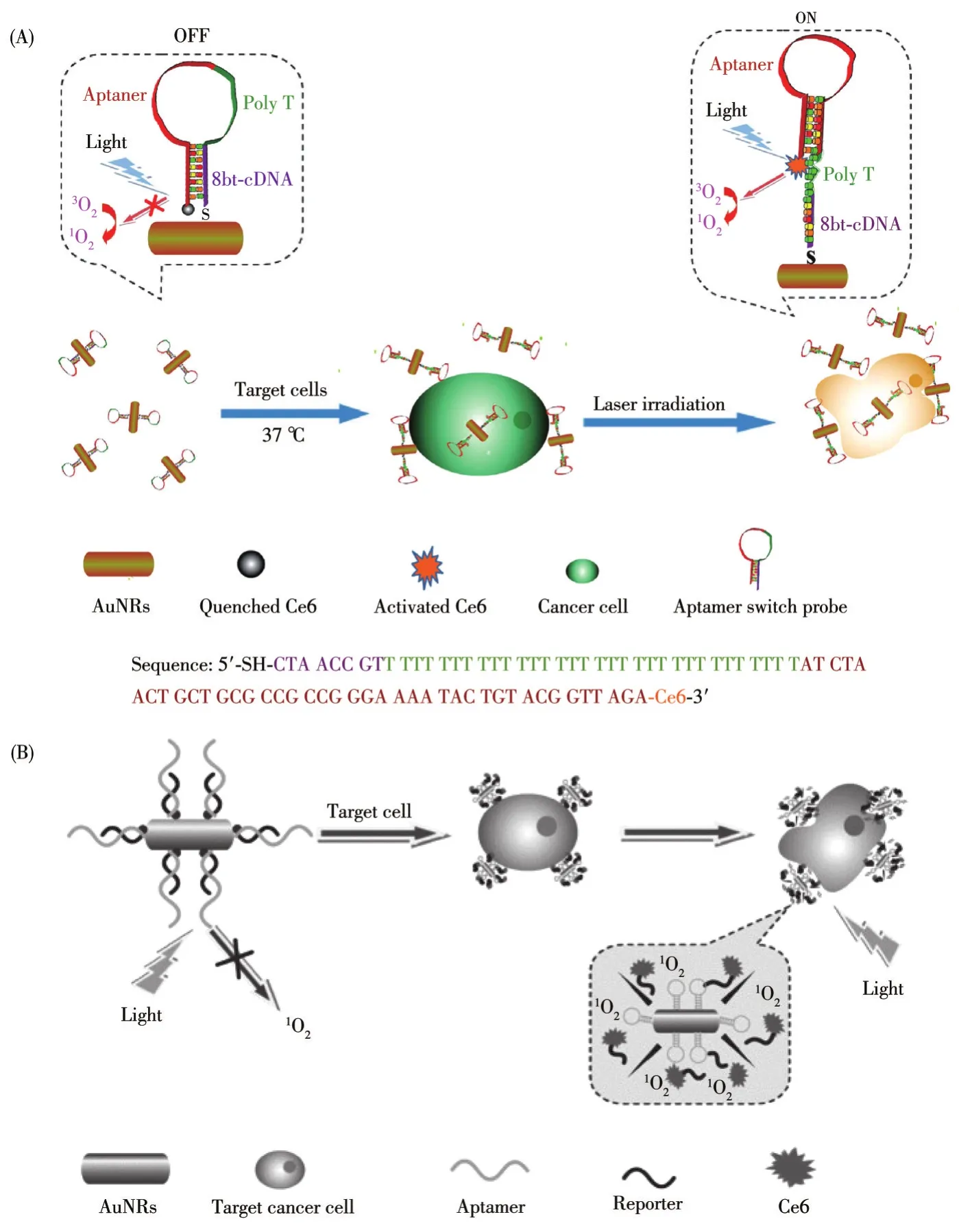
圖5 Apt-GNRs用于PTT/PDT聯合治療的作用機理圖[88-89]Fig.5 Mechanism of combined PTT/PDT based on Apt-GNRs[88-89]
3.1.3 PTT與GT聯合
GT是指將外源正常基因導入靶細胞,以糾正或補償缺陷和異常基因引起的疾病,達到治療目的。為了提高CRISPR-Cas9靶向性,實現sgRNA在靶標處定點釋放,Le課題組[90]利用DNA將sgRNA“保護”起來,將其偶聯至GNRs以構建納米遞送系統。在激光的照射下,GNRs產生熱量,sgRNA“脫保護”與Cas9蛋白結合,啟動特定基因編輯敲除PLK1,誘導A549細胞開始凋亡(圖6A)。體外研究表明,在PTT和GT的共同作用下,細胞的死亡率可達84%。為了提升Apt-GNRs對癌細胞的靶向能力,2021年,Ding課題組[91]利用Apt-MUC1和TAT(多肽)共同靶向MCF-7細胞,實現對癌細胞雙重靶向作用。在sgRNA/Cas9作用下,PKL1表達下調,在激光的照射下,增強了PTT的效果,在聯合療法的模式下,實現了最佳的抑制腫瘤效果(圖6B)。
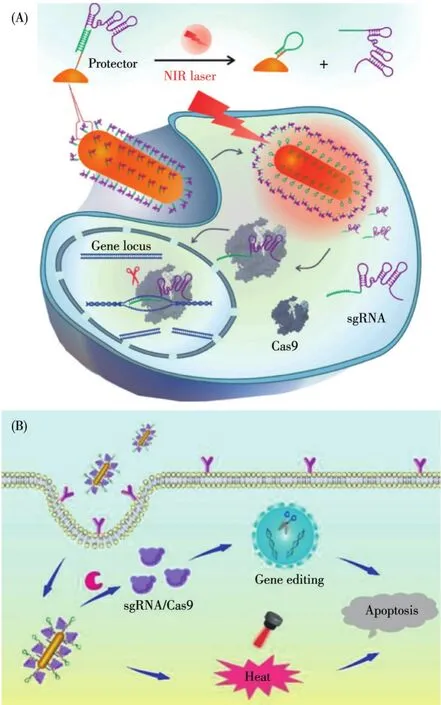
圖6 Apt-GNRs用于PTT/GT聯合治療的作用機理圖[90-91]Fig.6 Mechanism of combined PTT/GT based on Apt-GNRs[90-91]
3.2 多模式聯合療法
兩種治療方式聯合的抗癌效果遠高于單一療法,如果將3種治療方式同時整合于一個納米平臺上,可以進一步提升治療效率,以較低的劑量就可實現最佳的治療效果,進一步減少對正常細胞的毒副作用[92]。
3.2.1 PTT、CHT和PDT聯合
在激光照射時,GNRs產生的熱量可加速釋放化療藥物/PS,提升其對癌細胞的作用強度,從而增強CHT與PDT的治療效果,同時PS產生的ROS可避免內體對GNRs的吞噬,促進藥物遞送。Tan課題組[93]將dsDNA自組裝到GNRs的表面,用來提供DOX的結合位點,光敏劑(TMPyP4)插入Apt-AS1411形成的G-四鏈體結構中構成納米載藥遞送系統,用于靶向HeLa細胞。在808 nm激光照射下,GNRs的溫度迅速升高,DOX從DNA雙鏈中釋放,同時產生1O2。實驗結果顯示,3種療法聯合作用表現出最佳的治療效果,HeLa細胞的死亡率高達80%以上(圖7A)。
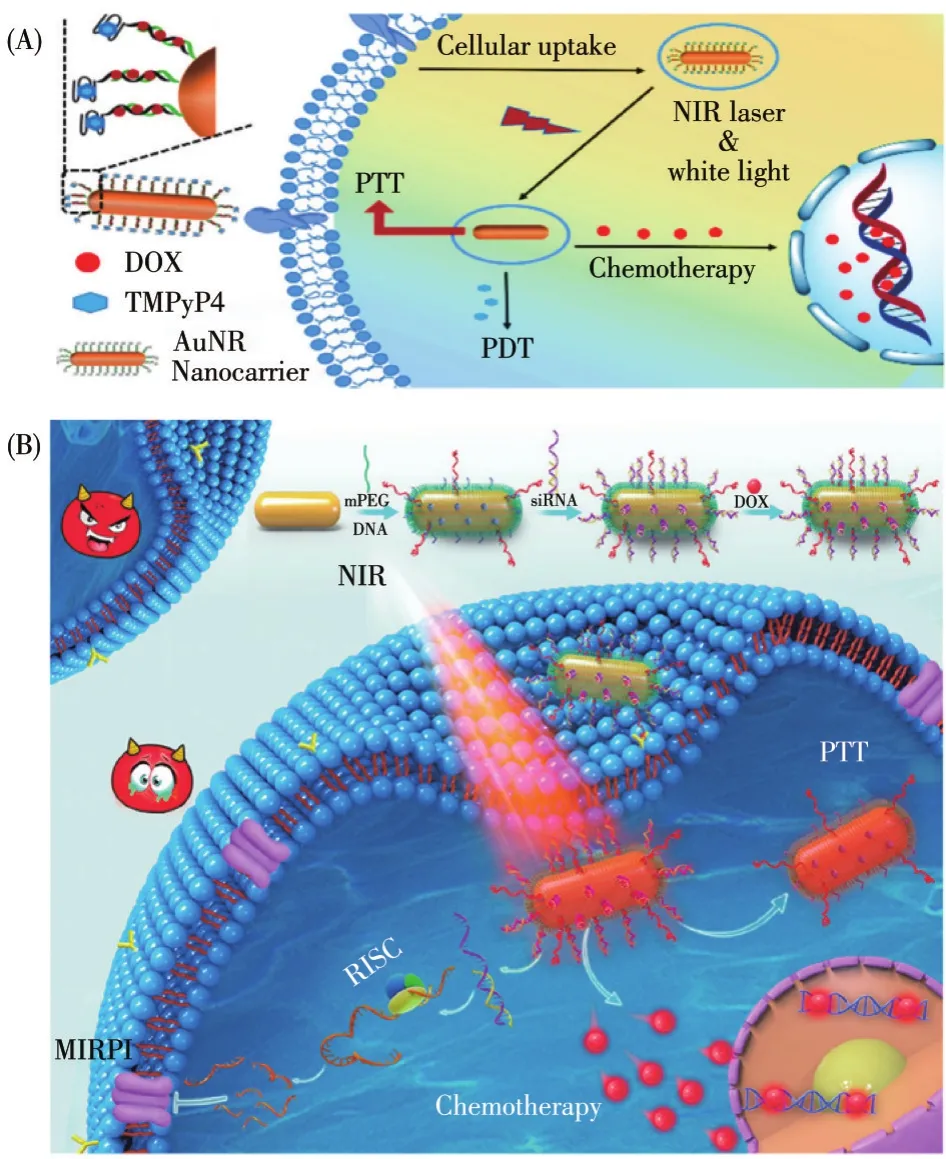
圖7 Apt-GNRs用于癌癥多模式治療的示意圖[93,95]Fig.7 Schematic diagram of multimodal cancer treatment based on Apt-GNRs[93,95]
3.2.2 PTT、CHT和GT聯合
續表3
化療藥物長期使用會產生MDR,GT中特異性的siRNA可作用于耐藥基因,恢復癌細胞對藥物的敏感性,從而有效提高化療的效果[94]。siRNA是一種雙鏈RNA分子,可用于沉默癌癥相關基因的表達。Xu課題組[95]將siRNA與GNRs偶聯,同時使用PEG-SH和Apt-AS1411修飾GNRs,作用于PC-3細胞。在激光的照射下,GNRs周圍溫度升高,使DNA雙鏈解旋釋放DOX和siRNA,DOX進入細胞核,siRNA作用于細胞質。MRP1是一種細胞表面的外排泵,可通過降低細胞內藥物濃度來調節MDR,通過siRNA抑制MRP1的表達,DOX毒性顯著增強,3種治療模式同時發揮作用,PC-3細胞晚期凋亡率高達 84.4%(圖7B)。
以上研究表明,相較于單一模式治療,將PTT、PDT、CHT和GT聯合的多模式治療可提高對腫瘤的抑制作用,利用GNRs本身具有的PTT效果,可以:(1)在其表面或Apt末端修飾PS實現PTT與PDT聯合;(2)利用Apt裝載或連接化療藥物實現PTT與CHT聯合;(3)利用Apt連接外源基因實現PTT與GT聯合,或實現3種療法的聯合。
4 總結與展望
近年來,構建用于癌癥治療的多功能納米材料研究取得了巨大進步,與單一療法相比,多模式療法在集合每種療法優點的同時利用各種療法間的相互補充,成功地彌補單一療法的不足,達到了更佳的治療效果。癌癥醫學研究的主要領域之一是將抗癌藥物靶向遞送于癌細胞,這不僅有助于提高治療效果,而且還降低抗腫瘤藥物的非特異性分布帶來的副作用。Apt作為新型的靶向劑現已成為最熱門的抗癌工具,為癌癥的診斷和治療帶來新的希望。目前已有Apt藥物Macugen上市[96],用于治療濕性年齡相關性黃斑變性,臨床應用治療效果顯著。美國Cytimmue Sciences公司專注于研發金屬納米材料藥物用于臨床癌癥治療,其研發的產品已進入臨床試驗階段,將Apt與GNRs結合作為臨床癌癥治療藥物指日可待。
Apt-GNRs具有良好的生物相容性、較大的負載量、優良的靶向性,在癌癥治療方面展現出良好的應用前景,但仍然面臨許多問題:
(1)表面改性過程中穩定性差。目前已經提出多種GNRs表面改性的方法,但大多受實驗室條件以及試劑純度的影響,存在可重復性差、表面改性時易聚集等缺點,目前已通過在其表面修飾聚合物材料、納米材料等,以改善其穩定性,但效果仍不理想。
(2)載藥量低。Apt-GNRs主要通過Apt與單鏈DNA形成的雙鏈結構或Apt自身的雙鏈結構以裝載藥物,其載藥量較低,目前已通過在其表面修飾比表面積較大的有機/無機材料來提升其載藥量,但與可生物降解的有機大分子相比,大部分無機納米材料在體內中幾乎不能降解,其安全性有待研究。
(3)生物安全性。盡管許多研究探討了Apt-GNRs在體內外使用的安全性,但一些研究也提出了互相矛盾的結果。由于GNRs的物理尺寸大于8 nm時不能通過體內的酶促反應分解成更小的碎片,進入體內后,GNRs會迅速積聚在肝臟、脾臟等健康器官中,無法清除,限制了大多數GNRs應用于臨床,將GNRs的粒徑盡量控制在腎臟利于消除的范圍內(6~8 nm),是目前研究的重點。
Apt-GNRs藥物遞送系統在癌癥治療領域潛力不可限量,未來有望在以下方面取得實質進展:(1)由于許多惡性腫瘤是位于體內而不是體表,NIR-Ⅰ光只能穿透人體幾厘米,降低了GNRs在深部腫瘤PTT的療效,NIR-Ⅱ光比NIR-Ⅰ光對組織的穿透深度更高,開發GNRs在NIR-Ⅱ區的PTT性能,實現對深部的腫瘤進行穿透性治療將是未來的研究方向之一;(2)為了提升GNRs的光轉化率進而提升其PTT性能,利用Ag、Cu與GNRs摻雜可提升其光轉化率,摻雜何種材料能更有效地提升GNRs的光轉化率是未來的研究方向之一;(3)聯合療法只是將各種療法的作用簡單疊加,多種療法聯合如何能起到協同促進作用,達到“1+1>2”的療效將是未來的研究方向之一;(4)盡管采用多種方法提升了GNRs的生物相容性,但人體環境復雜,難以預測,很難確定納米材料進入人體后的溶解性、親水性和聚集性等問題,著重提升其生物相容性和穩定性是將其應用于人體治療中亟待解決的難題之一;(5)應用于體內研究時,Apt功能化可大幅度提升納米材料的靶向遞送效果,但在健康器官中仍有大量的納米材料富集,進一步提升Apt的主動靶向能力是從活體實驗邁向臨床應用的重點研究方向之一。
雖然基于Apt-GNRs納米藥物遞送系統在癌癥治療應用中還面臨著許多困難與挑戰,但這些問題會隨著醫學技術的不斷發展和科學家們對GNRs的深入研究而逐個擊破,Apt-GNRs將在癌癥治療領域展現出廣闊的應用前景。
- 無機化學學報的其它文章
- La-Doped BaSnO3/Multi-walled Carbon Nanotube Modified Separator:Synthesis and Application in Lithium-Sulfur Battery
- Co(Ⅱ)/Ni(Ⅱ) Coordination Polymer of Isomeric Terphenyl-2,2″,4,4″-tetracarboxylic Acids with a Single Water Bridge:Syntheses,Structures,and Magnetic Properties
- Micromotors Based on Ni-Mn Binary Oxide and Its Application for Effective Dye Adsorption
- Direct Synthesis of Dimethyl Carbonate from CO2 and Methanol by Mg-Doped Ceria Monolithic Catalyst
- Hydrogen Storage Capabilities of the Low-Lying Ca2B4Clusters
- 盤狀鏑簇合物的合成及緩慢磁弛豫

