篩選出芽短梗霉生產低聚果糖探究溶氧的影響
李成林,曹偉鋒,秦林莉,劉郅騫,張靜,劉思伽,竹源,梁欣泉*
(1.廣西大學 輕工與食品工程學院,南寧 530004;2.中國科學院過程工程研究所,北京 100089)
短梗霉(Aureobasidiumspp.)是一種分布范圍非常廣泛的真菌。短梗霉的形態比較容易受到環境的影響,并且其生活史復雜的多形態腐生真菌分布在人們的生活中,通常分布在土壤、植物、花草、木材、混凝土等中。出芽短梗霉又稱黑酵母,因為出芽短梗霉生長發育過程中,其細胞形態和部分生理特征非常相似,分離鑒定出芽短梗霉時通常會采用與酵母菌一樣的研究方法。出芽短梗霉菌的菌落最初黏稠,呈現臟白色,然后轉變為綠色,發育到最后菌落呈現黑色[1]。
低聚果糖又稱寡果糖或蔗果低聚糖,是低聚糖中非常重要的一類。它廣泛存在于自然界,是在蔗糖的果糖殘基的C1位上通過β-(2-1)糖苷鍵與1~3個分子的果糖結合而成的低糖,主要是由蔗果三糖(1-kestose,簡稱GF2)、蔗果四糖(nystose,簡稱GF3)和蔗果五糖(1-F-β-fructofranosyl nystose,簡稱GP4)組成的混合物[2-3]。除了不含卡路里,低聚果糖還具有卓越的功能特性,例如調節腸道微生物菌群,改善胃腸道免疫功能,能夠促進脂質的代謝和預防結腸癌的發生[4-5]。低聚果糖天然存在于水果、蔬菜和谷物中,自然界中大約有36000多種植物含有低聚果糖,如大麥、小麥、洋蔥、香蕉和麥芽等[6]。
低聚果糖已經在兩階段或者一步過程中以生物發酵法生產[7]。在兩階段過程中,具有果糖基轉移酶活性的酶首先從真菌中產生,例如出芽短梗霉菌[8]、曲霉屬[9]和青霉菌屬。然后使用蔗糖作為底物,在不同的控制條件下使用酶生產低聚果糖[10-11]。在一步法中,低聚果糖是在生物反應器中使用全細胞作為生物催化劑從真菌中生物合成的[12],無論是固定的還是游離的[13],一步法發酵生產低聚果糖是一種很好的方法,因其省去了從細胞提取物中純化生產低聚果糖酶的步驟[14]。本文將通過發酵過程中的通氣速率、氧分壓和攪拌轉速[15],探索溶氧對發酵生產的影響。
1 材料和方法
1.1 材料
試劑:甘露醇、硝酸銨、磷酸二氫鉀、硫酸鎂、檸檬酸、司班80、硝酸鈉、氯化鉀、七水合硫酸亞鐵、蔗糖、瓊脂、酵母粉;菌種:從土壤與枯葉中篩選的出芽短梗霉、出芽短梗霉IPE-1 No.3337、出芽短梗霉IPE-3 KY618121、出芽短梗霉IPE-5 KY621468,保存于中國科學院過程工程研究所生化工程國家重點實驗室。
1.2 主要儀器與設備
高效液相色譜儀 日本島津公司;蒸汽式滅菌鍋 上海申安醫療器械廠;生化培養箱 上海一恒科學儀器有限公司;全溫搖瓶柜 蘇州培英實驗設備有限公司;超凈工作臺 北京亞泰科隆儀器技術有限公司;發酵罐、高速冷凍離心機 艾本德生命科學公司。
1.3 培養基的配制
1.3.1 富集培養基
甘露醇10%,NH4NO30.1%,KH2PO40.05%,MgSO4·7H2O 0.02%,檸檬酸 0.2%,司班80 0.02%。
1.3.2 篩選培養基
NaNO30.3%,MgSO4·7H2O 0.05%,KCl 0.05%,FeSO4·7H2O 0.001%,蔗糖 3%,K2HPO40.1%,瓊脂1.2%。
1.3.3 保藏培養基
NaNO30.3%,MgSO4·7H2O 0.05%,KCl 0.05%,FeSO4·7H2O 0.001%,蔗糖 3%,K2HPO40.1%,瓊脂1.2%。
1.3.4 搖瓶種子培養基
蔗糖20%,NaNO30.5%,KH2PO40.4%,KCl 0.05%,K2SO40.035%,MgSO4·7H2O 0.05%,FeSO4·7H2O 0.001%,酵母粉1%,消泡劑<0.001%。
1.3.5 發酵培養基
蔗糖 20%,NaNO30.5%,KH2PO40.4%,KCl 0.05%,K2SO40.035%,MgSO4·7H2O 0.05%,FeSO4·7H2O 0.001%,酵母粉1%,消泡劑<0.001%,pH為5.5。
1.4 實驗方法
1.4.1 出芽短梗霉的富集
將土壤和枯葉樣本分別置于富集培養基中進行富集培養,將幾個錐形瓶置于全溫搖瓶柜中進行富集培養,培養條件:30 ℃,100 r/min,培養2~4 d。
1.4.2 出芽短梗霉的初篩
將富集培養基置于超凈工作臺上,使用移液槍吸取100 μL富集培養液置入篩選培養基上,使用涂布棒涂抹,涂抹后再用涂布棒涂抹下一個空白篩選培養基,這樣梯度稀釋3次于篩選培養基上,然后將篩選培養基置于25 ℃恒溫培養箱中倒置培養,培養5 d,選取培養基上類似出芽短梗的單菌落進行分離純化。
1.4.3 出芽短梗霉菌的復篩
將分離純化后的種子置于冰箱中保存,使用時將種子培養基置于25 ℃恒溫培養箱中活化培養0.5 d,然后置于超凈工作臺上進行操作,從斜面種子培養基挑取1環菌體接種于100 mL種子培養基中,搖床設置條件為25 ℃、120 r/min下進行振蕩培養,恒溫培養2 d。
1.4.4 出芽短梗霉菌的搖瓶種子培養
從4 ℃冰箱中取出斜面種子培養基,將斜面種子培養基置于25 ℃恒溫培養箱中培養0.5 d進行活化,用接種環均勻挑選大小接近的種子接種于100 mL種子培養基中,調節pH至5.5,并于121 ℃滅菌20 min,于超凈工作臺冷卻后操作,每次配制6個種子培養基平行,置于25 ℃、120 r/min全溫搖瓶柜中培養2 d。
1.4.5 5 L發酵罐發酵
對復篩低聚果糖含量前三的菌種進行進一步的發酵培養,配制培養基溶液于發酵罐內并于121 ℃高溫滅菌鍋內滅菌20 min,由于糖類和酵母粉高溫下會產生反應,將其分開滅菌。將300 mL搖瓶種子液接種于滅菌后的培養基培養液中,發酵過程中維持pH為5.5,發酵溫度為25 ℃,轉速為400 r/min,初始通氣量為3 L/min,通過發酵罐所連接的發酵控制系統對發酵過程及發酵參數進行監控。接入發酵罐后立即取發酵初始(0 h)的發酵樣品,每12 h取1次發酵樣品,將樣品置于超低溫冰箱中保存,發酵過程為期3 d,發酵罐接種時挑選6個平行搖瓶中3瓶種子培養基,將3瓶培養基接入發酵罐,保證每次接種量都為300 mL,接種量為10%,發酵結束后對超低溫冰柜中的樣品進行處理,測定菌體干重和發酵液中的蔗糖、果糖、葡萄糖、低聚果糖的含量。
1.5 分析方法
1.5.1 液相色譜測定分析糖
色譜柱為Shodex Asahipak NH2P-50 4E聚合物氨基色譜柱,流動相為70%乙腈和30%超純水,柱溫30 ℃,流速1 mL/min,進樣量為20 μL。在上述條件下測量蔗糖、果糖、葡萄糖和低聚果糖色譜柱,由蔗糖、果糖、葡萄糖和低聚果糖標準品計算得出。
1.5.2 干重法測定菌體濃度
發酵液的菌體濃度采用干重法測定,在發酵開始前,提前準備好離心管并編號,放置于90 ℃烘箱中烘制12 h至恒重,取出烘干后的離心管,置入干燥器內放置1 h至冷卻,冷卻后用電子天平稱量離心管的重量。發酵過程中每隔12 h取1次發酵樣品,使用移液槍取3 mL發酵樣品于烘干后的離心管內,在5000 g下離心10 min,倒掉上清液,沉淀物用3 mL的生理鹽水洗滌2次,每次洗滌都在5000 g下離心10 min,倒掉洗滌離心后的上清液,將洗滌完成后的離心管置于90 ℃烘箱中烘至恒重,然后用電子天平稱量。處理時,每個發酵樣品的菌體濃度都采取干重法平行測定,取平均值。
1.5.3 酶活的測定
1.5.3.1 酶活的測定條件
pH 5.5、反應溫度55 ℃、反應時間1 h、反應混合物包含以下組分:800 g/L蔗糖 7.5 mL,0.1 mol/L檸檬酸緩沖液(pH 5.5)2.3 mL,酶樣品0.2 mL。
1.5.3.2 酶活的定義
在1.5.3.1條件下,每1 min產生1 μmol葡萄糖所需的酶活性的量定義為1 U。
1.5.3.3 酶活的處理
分別測定發酵液的細胞外酶活和細胞內酶活,發酵過程中每隔12 h取1次發酵樣品,使用移液槍取3 mL發酵樣品于離心管內,在5000 g下離心10 min,上清液用作細胞外酶活的測定。沉淀物用3 mL生理鹽水洗滌2次,每次洗滌都在5000 g下離心10 min,倒掉洗滌離心后的上清液,最后用生理鹽水重懸至3 mL用作細胞內酶活的測定。
2 結果與分析
2.1 搖瓶發酵結果
出芽短梗霉菌菌落共9株,經檢測產低聚果糖的菌落為7株,復篩結果見表1。
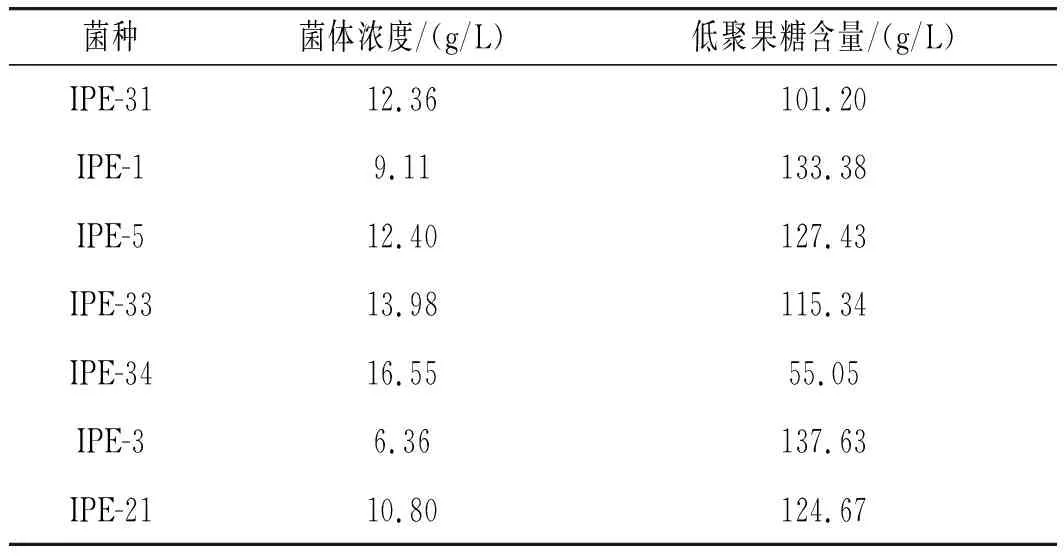
表1 菌株篩選結果Table 1 The selection results of strains
由表1可知,在12 h的搖瓶發酵周期內,菌體濃度最高的為IPE-34,但IPE-34的低聚果糖濃度反而最低,為55.05 g/L。菌體濃度最低的為IPE-3,而IPE-3的低聚果糖產量最高,為137.63 g/L。復篩結果中,低聚果糖含量前三的菌株為IPE-3、IPE-1和IPE-5,對復篩含量前三的菌株進行5 L發酵罐發酵,進一步了解菌株的發酵性能。
2.2 5 L發酵罐發酵結果
對復篩結果中低聚果糖產量最高的3株菌種進行發酵罐發酵實驗,進一步對發酵性能進行比較,所得發酵性能曲線見圖1。

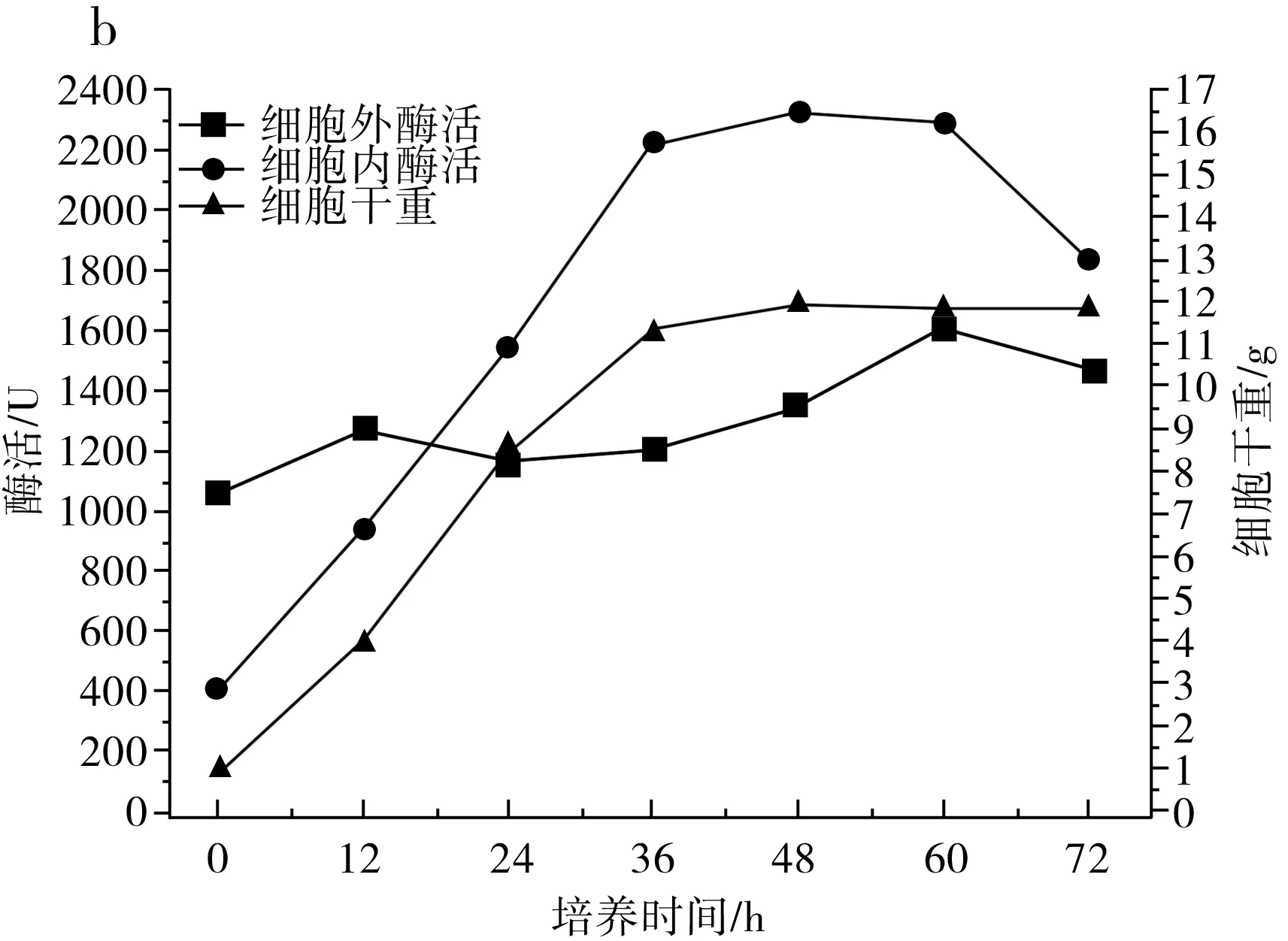
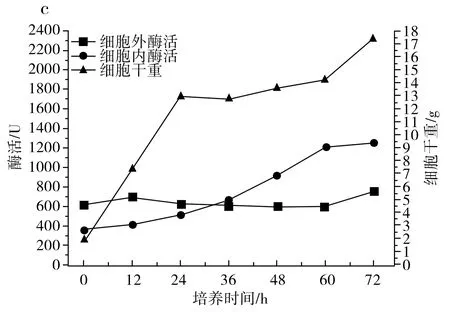
圖1 IPE-1(a)、IPE-3(b)、IPE-5(c)發酵性能及細胞干重Fig.1 Fermentation performance and cell dry weight of IPE-1 (a), IPE-3 (b), IPE-5 (c)
由圖1中a可知,在3 d的發酵周期內,菌體濃度在24~60 h內是一個比較明顯的平穩期,IPE-1的細胞內酶活和細胞外酶活相差不大,比較接近。當3 d發酵周期結束時,IPE-1的菌體濃度為15.98 g/L,細胞外酶活為1771 U,細胞內酶活為1124 U,總酶活為2895 U。
由圖1中b可知,在3 d的發酵周期內,IPE-3的菌體濃度在36 h后基本沒有明顯上漲,保持相對穩定的狀態,細胞內酶活在24 h明顯超過細胞外酶活,并在36~60 h時維持在較高狀態,細胞外酶活一直維持在相對穩定的狀態。當3 d發酵周期結束時,IPE-3的菌體濃度為11.91 g/L,細胞外酶活為1473 U,細胞內酶活為1833 U,總酶活為3306 U。
由圖1中c可知,在3 d的發酵期內,IPE-5的菌體濃度在24 h前快速上漲,在36 h之后緩速上漲,36 h前細胞內酶活比較低,36 h后細胞內酶活超過細胞外酶活,但總體來說,細胞內酶活和細胞外酶活相差不大。當3 d發酵周期結束時,IPE-5的菌體濃度為17.51 g/L,細胞外酶活為758 U,細胞內酶活為1253 U,總酶活為2011 U。
進一步分析發酵數據,對比3株菌株,對發酵過程中糖的利用進行分析,得發酵性能曲線,見圖2。
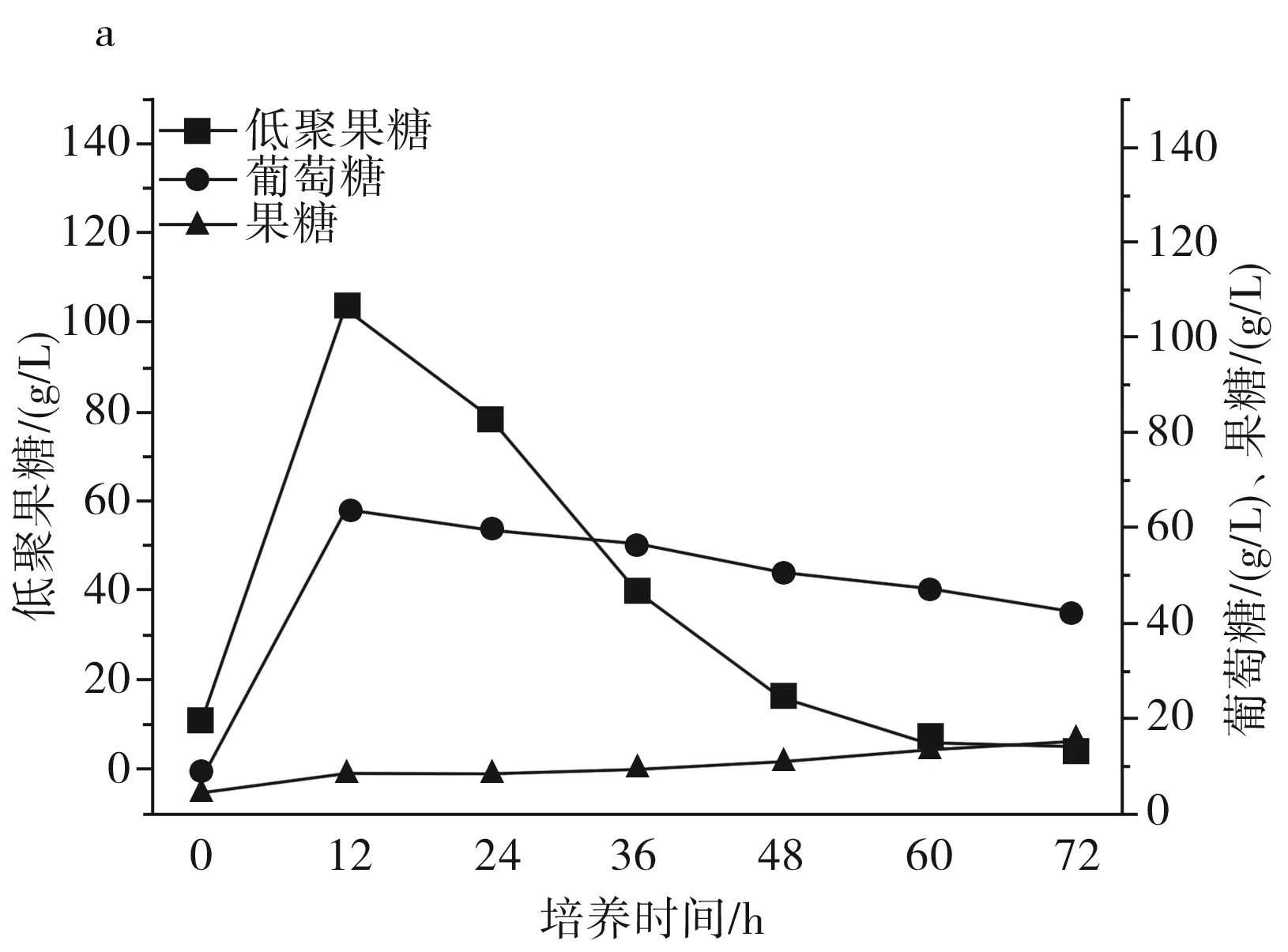
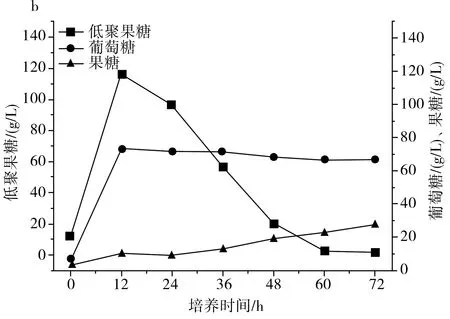

圖2 IPE-1(a)、IPE-3(b)、IPE-5(c)發酵性能Fig.2 Fermentation performance of IPE-1 (a), IPE-3 (b), IPE-5 (c)
由圖2中a可知IPE-1在整個發酵周期內果糖、葡萄糖的利用狀況和低聚果糖產量。在整個發酵周期內,果糖一直維持在一個低水平的狀態,葡萄糖在12 h左右達到峰值,12 h至發酵結束緩慢下降,維持在相對穩定的狀態,低聚果糖在12 h達到峰值,并在12 h至發酵結束持續下降。整個發酵過程中,低聚果糖的峰值為103.57 g/L,葡萄糖的峰值為64.30 g/L,果糖的峰值為14.6 g/L。
由圖2中b可知IPE-3在整個發酵周期內果糖、葡萄糖的利用狀況和低聚果糖產量。在整個發酵周期內,果糖維持在較低水平,并在緩慢提高,72 h時達到峰值,葡萄糖在12 h時達到峰值,并在之后維持在相對穩定的狀態,低聚果糖在12 h時達到峰值,并在之后持續下降到發酵結束。在整個發酵過程中,低聚果糖的峰值為116.62 g/L,葡萄糖的峰值為73.42 g/L,果糖的峰值為27.68 g/L。
由圖2中c可知IPE-5在整個發酵周期內果糖、葡萄糖的利用狀況和低聚果糖產量。在0~48 h,果糖含量在逐步上升,并在48 h達到峰值,葡萄糖在12 h達到峰值,并在之后持續下降,低聚果糖在12 h時達到峰值,然后持續快速下降到發酵結束。在整個發酵過程中,低聚果糖的峰值為110.91 g/L,葡萄糖的峰值為49.28 g/L,果糖的峰值為65.90 g/L。
由圖1可知,IPE-1和IPE-5發酵液中的菌體濃度在發酵過程中均上升較快,IPE-3發酵液中的菌體濃度與IPE-1和IPE-5相比上升較慢,在60~72 h,IPE-1和IPE-3發酵液中的菌體濃度又開始快速上升,發酵結束時IPE-3的菌體濃度最低,但細胞總酶活最高。
由圖2可知,IPE-1、IPE-3和IPE-5發酵液中的低聚果糖主要在最初的12 h內產生,并在12 h之后呈持續下降趨勢,IPE-1、IPE-3和IPE-5蔗糖原料在12 h時還有少量,在24 h前,發酵液中的原料蔗糖已消耗完,推測低聚果糖濃度的降低是因為蔗糖原料不足以及葡萄糖濃度的升高,葡萄糖濃度的升高會對低聚果糖的合成起抑制作用,在12 h之后,由于原料耗盡以及葡萄糖的反饋抑制作用,β-D-呋喃果糖苷酶的水解活性大于果糖基化活性,低聚果糖開始持續分解,充當碳源被菌體利用,以維持菌體自身代謝和菌體生長。綜合得出,IPE-3為生產低聚果糖的最優菌株。
2.3 發酵條件的優化
2.3.1 發酵罐攪拌轉速對IPE-3發酵的影響
在不同的通氣量下分批培養的時間曲線,在2.7 L生物反應器中于pH為5.5,25 ℃下以不同的通氣量培養出芽短梗霉菌IPE-3,在400,600,800,1000 r/min條件下,低聚果糖產量、細胞酶活、菌體濃度和發酵耗氧情況見圖3。
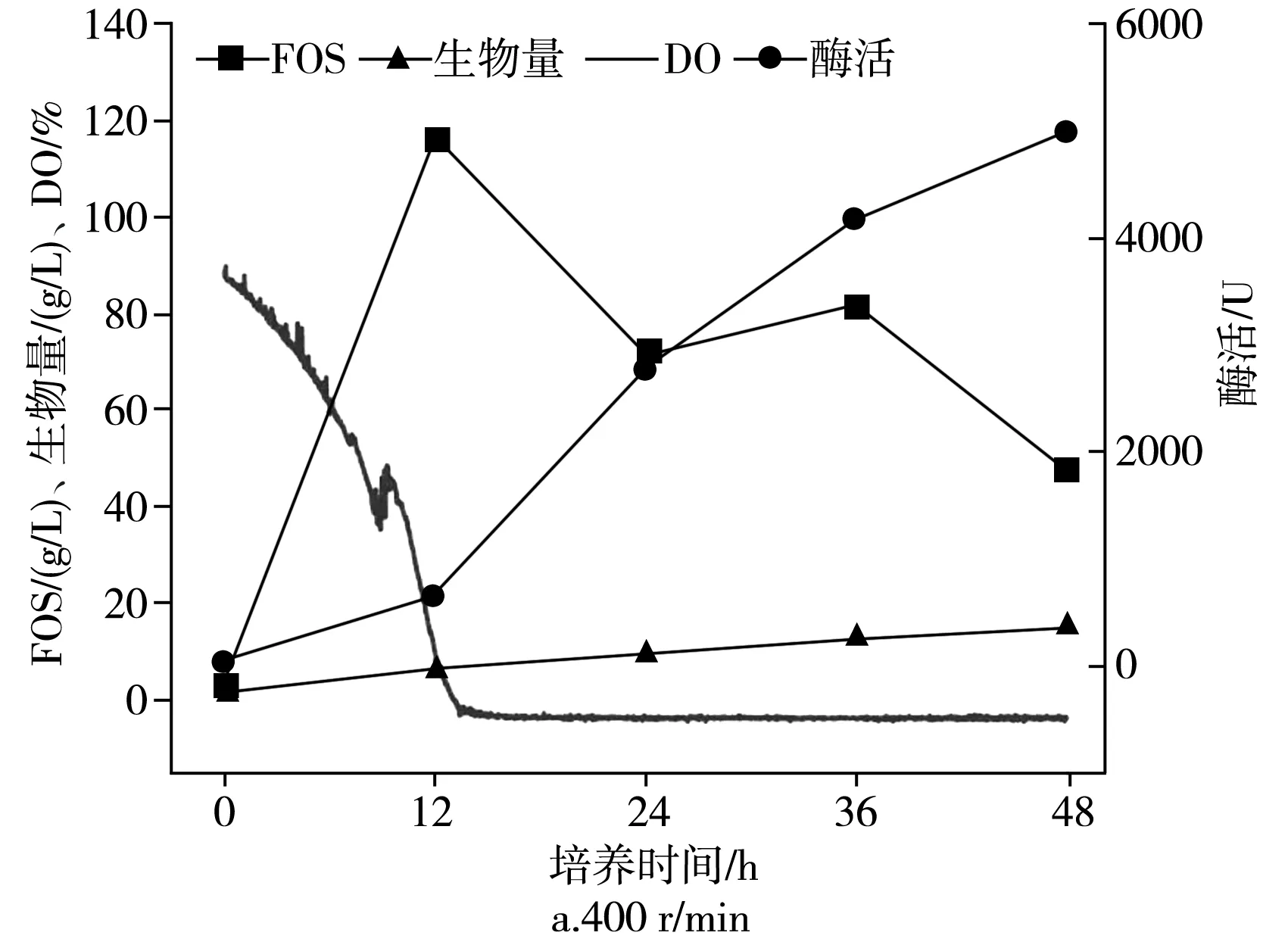


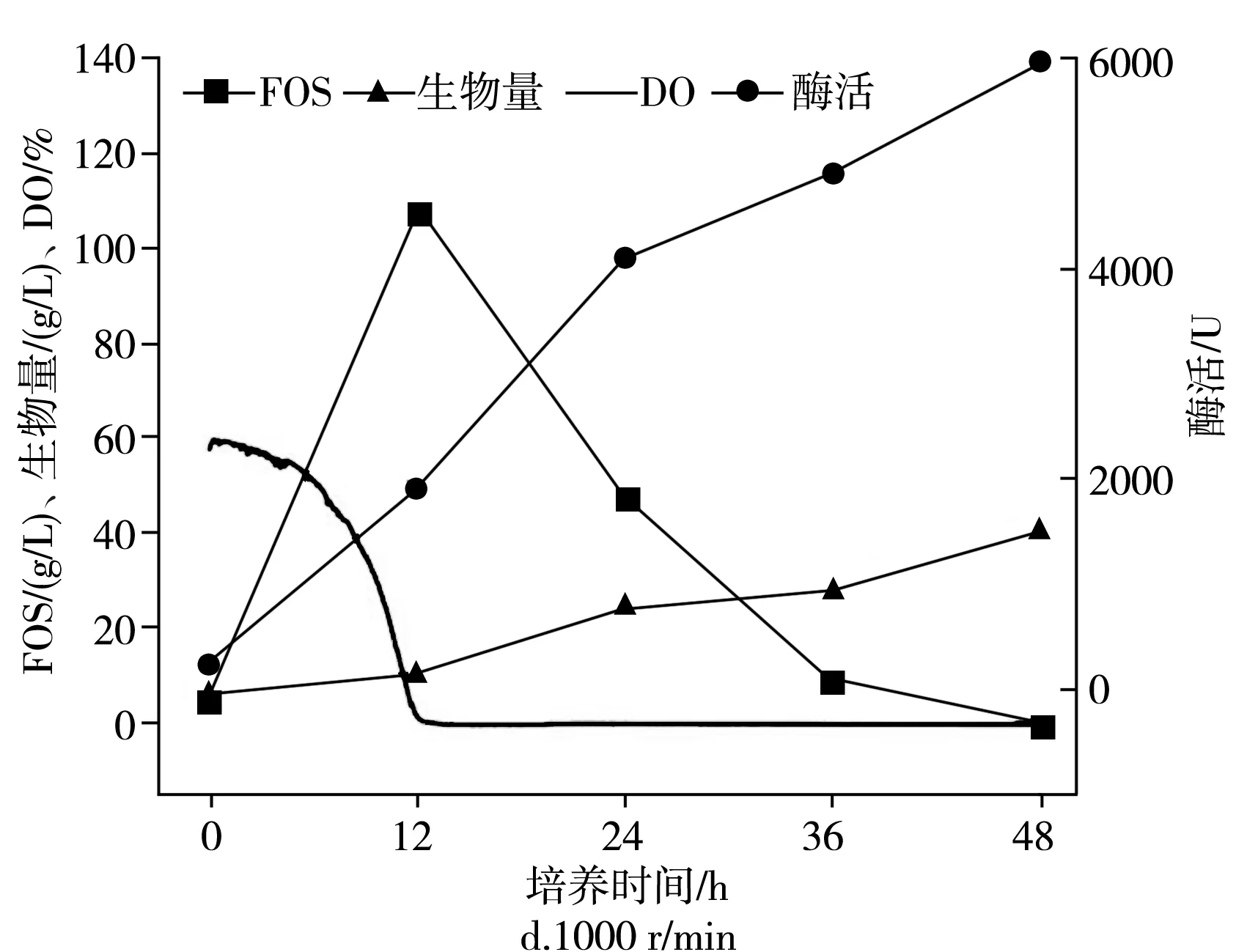
圖3 攪拌轉速對IPE-3發酵的影響Fig.3 Effect of stirring speed on the fermentation of IPE-3
出芽短梗霉在發酵過程中,DO值隨攪拌速度的變化而變化。同時,根據文獻報道,出芽短梗霉可以暴露于高剪切速率下,所以制定了從低轉速到高轉速不同的攪拌速度(400,600,800,1000 r/min)進行分批培養,以研究攪拌速度對低聚果糖生物合成的影響。由圖3可知,低聚果糖在12 h時獲得了最大濃度,在攪拌轉速為400,600,800,1000 r/min下低聚果糖的最大濃度分別為(116.6±5.8),(123.2±6.2),(97.2±4.9),(106.8±5.3) g/L。在600 r/min下獲得最大產率為61.6%±3.0%(g FOS/g蔗糖)。同時發現,發酵結束時,酶的活性在400,600,800,1000 r/min下12 h時分別為(636.5±31.8),(1666.3±84),(1691.6±84.6),(1927.2±96.4) U。
當攪拌轉速高于400 r/min時,酶活性增長迅速,而當攪拌轉速高于600 r/min后,酶活性幾乎沒有增加。對于菌體濃度,在發酵時逐漸增加,在400,600,800,1000 r/min下發酵12 h時分別為(6.3±0.30),(6.2±0.31),(10.2±0.51),(10.4±0.50) g/L。當攪拌速度高于600 r/min時,菌體濃度急劇增加,而在400 r/min和600 r/min或800 r/min和1000 r/min之間沒有太大差異。因此,攪拌轉速對低聚果糖的產生、酶產生和細胞生長顯示出不同的影響。同時,根據以上數據進一步分析可以發現,低聚果糖的產生和酶活性不一致。同樣,盡管細胞的生長和酶的產生隨著培養時間的增加而增加,但當時它們并沒有耦合。此外,在所有使用的攪拌速度下,培養12 h后,DO值均降至0以下,并且培養12 h后低聚果糖開始下降。可以得出以下結論:高溶氧會促進低聚果糖的增加和產生,而低溶氧會促進細胞的生長和酶的產生。另外,攪拌轉速可以增強氧氣的溶解,但是不能產生氧氣。因此,接下來研究通氣量對低聚果糖的影響,因為這是氧氣的來源。
2.3.2 發酵罐通氣量對IPE-3發酵的影響
在不同的通氣量下分批培養的時間曲線,在2.7 L生物反應器中于pH為5.5,25 ℃下以不同的通氣量培養出芽短梗霉IPE-3,在0.9,1.8,2.7 L/min通氣量下,低聚果糖產量、細胞酶活、菌體濃度和發酵耗氧情況見圖4。

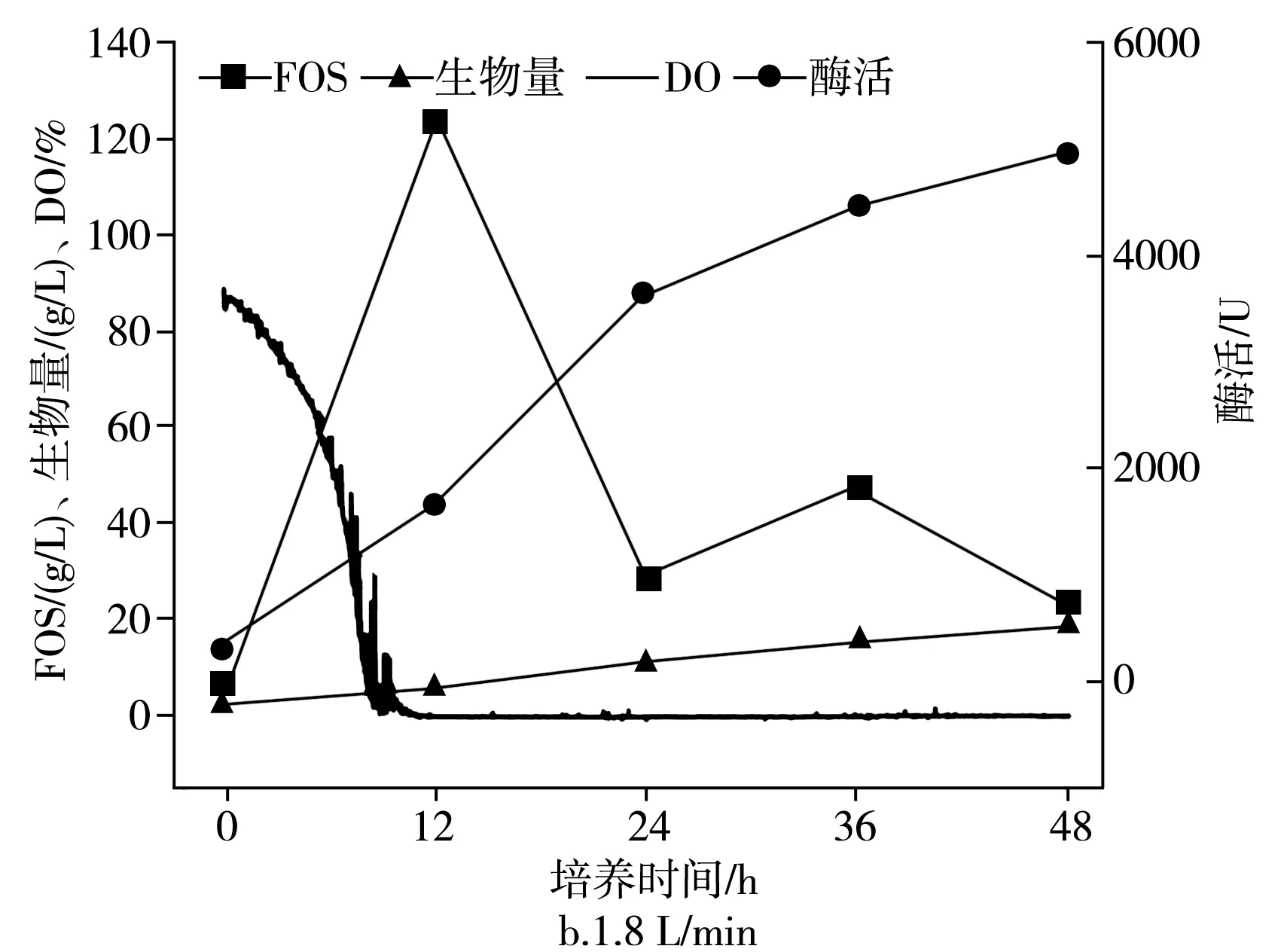

圖4 通氣量對IPE-3發酵的影響Fig.4 Effect of ventilation volume on the fermentation of IPE-3
由圖4可知,低聚果糖在12 h時獲得了最大濃度,FOS的最大濃度在0.9,1.8,2.7 L/min的條件下分別為(118.7±5.9),(123.2±6.2),(81.2±4.1) g/L。低聚果糖含量在0.9 L/min和1.8 L/min之間沒有太大差異,而在2.7 L/min時則比0.9 L/min和1.8 L/min時低得多。對于菌體的酶的產生和細胞的生長,它們的濃度一直在增加,持續到發酵結束。對于酶活性,在0.9,1.8,2.7 L/min下,在12 h時分別為(1449.6±68.3),(1666.3±83.3),(1440.4±72.0) U。
當發酵培養12 h后,酶活性在2.7 L/min下增長緩慢。對于菌體濃度,在0.9,1.8,2.7 L/min下,在12 h時分別為(6.8±0.34),(6.18±0.31),(12.9±0.51) g/L。培養12 h后,在0.9 L/min條件下的細胞比在1.8 L/min條件下的細胞生長快,這導致在發酵時,在0.9 L/min條件下的酶活性比在1.8 L/min條件下的酶活性低。同時,在2.7 L/min條件下,短梗霉菌細胞在整個發酵過程中生長迅速,遠高于在0.9 L/min和1.8 L/min條件下的菌體濃度。因此,推測在2.7 L/min下低聚果糖濃度和酶活性低得多的原因是較高的菌體濃度。對于DO值,在所有通氣量條件下,DO值均下降至0以下,這意味著在發酵培養12 h后,通氣量的增加無法顯著提高DO值,而在第一時間就影響了低聚果糖的產生。推測12 h的原因可能是發酵液中的氧分子無法在水中有效溶解,因此,下一部分將研究發酵過程中罐壓的影響。
2.3.3 發酵罐罐壓對IPE-3發酵的影響


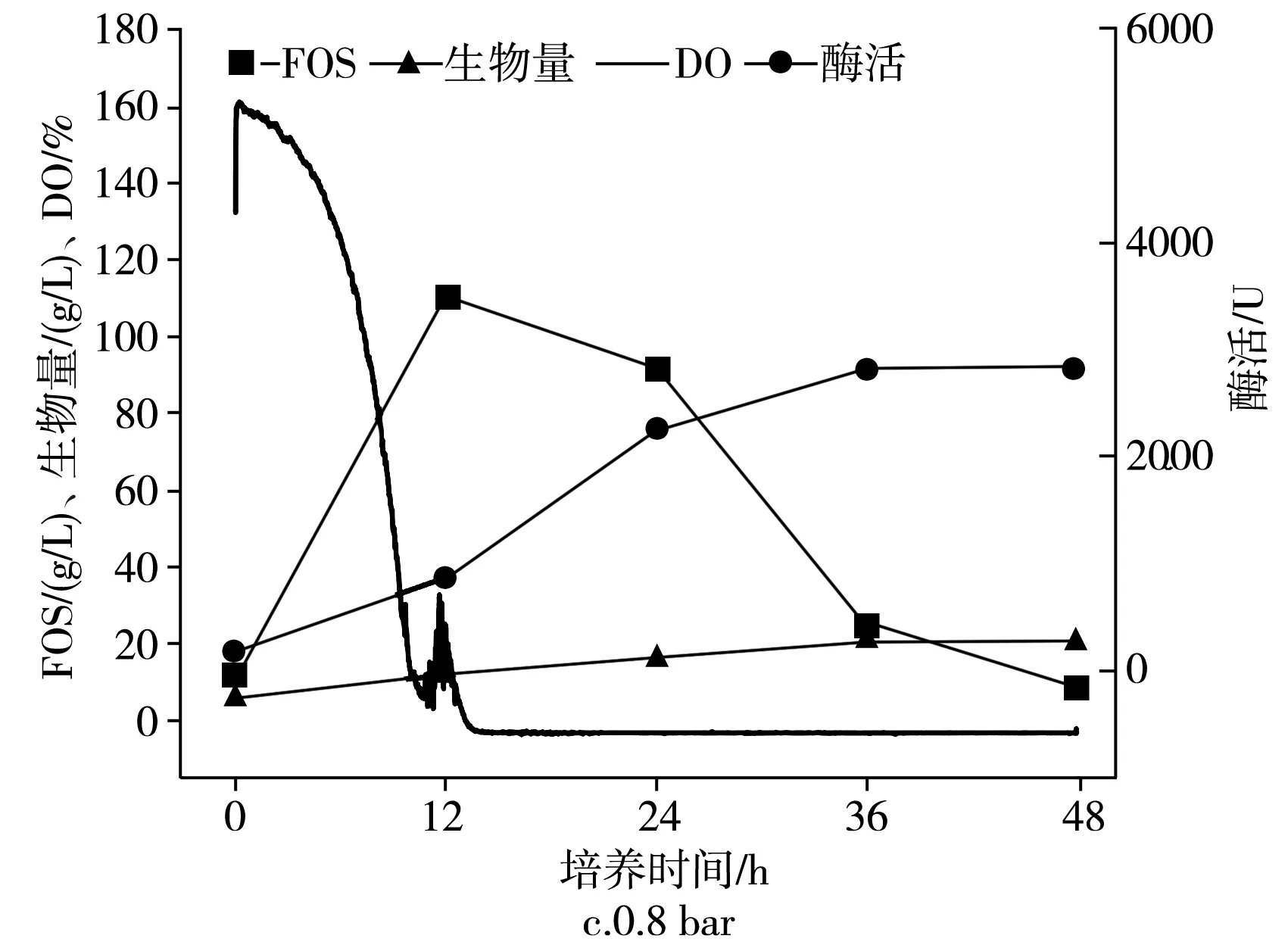
圖5 罐壓對IPE-3發酵的影響Fig.5 Effect of tank pressure on the fermentation of IPE-3
在生物反應器的不同罐壓下分批培養的時間曲線,在2.7 L生物反應器中于pH為5.5、1.8 L/min、25 ℃和不同壓力的發酵罐中培養出芽短梗霉菌IPE-3,IPE-3在0,0.4,0.8 bar罐壓下,低聚果糖產量、細胞酶活、菌體濃度和發酵耗氧情況見圖5。
由圖5可知,隨著發酵罐罐壓的提高,對于低聚果糖的產量而言,在較高的發酵罐罐壓下,低聚果糖的產量反而會下降,在12 h,0,0.4,0.8 bar條件下,低聚果糖的濃度分別為(123.2±6.2),(114.2±5.7),(110.4±5.5) g/L。對于菌體濃度而言,在0.4 bar時顯著增加,0.4 bar和0.8 bar相比,幾乎保持恒定,在0,0.4,0.8 bar下分別為(6.2±0.31),(11.9±0.57),(11.4±0.61) g/L。對于酶活性,在0.4 bar之前在較高的發酵罐罐壓下升高,然后下降,在0,0.4,0.8 bar下分別為(1666.3±84),(1954.2±77.7),(863.5±48.2) U。
由圖5可知,當生物反應器的罐壓提高到0.8 bar時,幾乎達到了所用發酵罐的最大值,初始發酵時發酵反應器的溶氧高達161.2%,與0 bar條件下相比,培養12 h并沒有得到有效改善。這意味著僅通過一個因素(即攪拌轉速、通氣量或發酵罐罐壓)不能提高DO值。此外,酶產生的趨勢也不完全符合細胞生長。例如,菌體濃度在0.8 bar下最高,而酶活性在此壓力下最低。因此,碳源進入細胞生長,低聚果糖的產生和酶產生的代謝途徑被生物反應器的不同壓力所改變,在相同的發酵液成分下,菌體濃度、低聚果糖濃度和酶的濃度在生物反應器的不同壓力下也會發生改變。
3 結論
本研究通過對從土壤中篩選和實驗室已有的出芽短梗霉菌進行發酵實驗,發現IPE-3是一種生產低聚果糖的優秀菌株,在發酵中,IPE-3細胞濃度不高,但是細胞酶活和低聚果糖的產量高,適合作為低聚果糖的生產菌株。對IPE-3進行溶氧控制的研究,通過控制發酵罐的轉速、通氣量和罐壓發現,IPE-3在攪拌轉速600 r/min下低聚果糖產量最高,在通氣量1.8 L/min下低聚果糖產量最高,在加壓條件下低聚果糖的產量會下降。

