亞臨床期關節病型銀屑病的研究進展
古元霞 王怡怡 肖 月 李 薇
四川大學華西醫院皮膚性病科,成都,610041
關節病型銀屑病(PsA)是具有高度異質性的血清陰性脊柱關節病,可不同程度影響外周和中軸關節,受累形式包括關節炎、附著點炎、指趾炎、骶髂關節炎和脊柱炎等,關節外表現可有皮膚、甲受累和葡萄膜炎等。據文獻報告PsA在銀屑病患者中的構成比可高達30%[1],國內報道5.8%[2]。大部分PsA患者皮損先于關節癥狀出現,為早期識別進展為PsA風險增加的銀屑病人群提供了時間窗。任何有異常的影像學上的滑膜-起止點炎癥病變但并不滿足CASPAR分類標準[3]的銀屑病患者被定義為亞臨床期關節病型銀屑病[4]。本文就亞臨床期PsA的定義、臨床表現及特征、國內外診治現狀等研究進展進行綜述。
1 亞臨床期PsA的定義
自20世紀70年代以來,人們已經認識到,每一種PsA的炎性病變,如關節滑膜炎、腱鞘炎、指趾炎、附著點炎、骶髂關節炎和脊椎炎等都可以在患者和醫生沒有識別到的癥狀或體征的情況下發展。這類患者可被視為患有“亞臨床期”或“隱匿性”PsA[5]。
大量影像學研究證實了在銀屑病患者中存在亞臨床肌骨系統改變,并據此提出了“亞臨床期PsA”的概念,在此階段,患者存在異常的影像學改變(如滑膜炎、附著點炎),但并不滿足CASPAR分類標準。2019年Scher等[4]系統地概括了從PsO發展至臨床期PsA間有三個臨床階段:臨床前階段、亞臨床期PsA和PsA前驅期。其中,亞臨床期PsA被定義為有可溶性生物標志物(如血沉、C反應蛋白)和異常的影像學發現(滑膜炎、附著點炎、腱鞘炎及骨侵蝕等),無關節炎的臨床癥狀和體征。影像學異常被定義為核磁共振成像發現的附著點炎、骨髓水腫、滑膜炎、肌腱炎、骨侵蝕和新骨形成;或超聲發現附著點炎、滑膜炎、肌腱炎和骨侵蝕等[6]。但目前尚未有公認的亞臨床期PsA診斷標準。
2 亞臨床期PsA的臨床表現及影像學特征
亞臨床期PsA患者的臨床癥狀和體征與PsO相同,不同之處在于影像學的發現。如果使用亞臨床炎癥的影像學標準,多達一半的PsO患者可被歸類為亞臨床期PsA[7]。外周關節可選擇外周關節肌骨超聲、外周高分辨率定量CT;脊柱及骶髂關節等中軸關節可選擇核磁共振成像MRI掃描。其它檢查手段還包括X光,骨顯影和正電子發射計算機斷層攝影。
超聲對淺表組織具有較高的分辨率,因此被廣泛應用于臨床。多數研究結果表明,在亞臨床期PsA患者中,滑膜炎和附著點炎最為常見[8-13](表1)。西班牙的一項納入162例PsO患者與60名健康人群的病例對照研究結果顯示:銀屑病患者有更多的滑膜炎和附著點炎[14]。華西醫院超聲科的兩項研究納入多名尋常型銀屑病患者和健康對照,發現PsO患者中關節積液/滑膜炎、附著點炎部位及滑膜炎、附著點炎、腱鞘炎的多普勒信號升高的比例較健康人群明顯升高[15]。
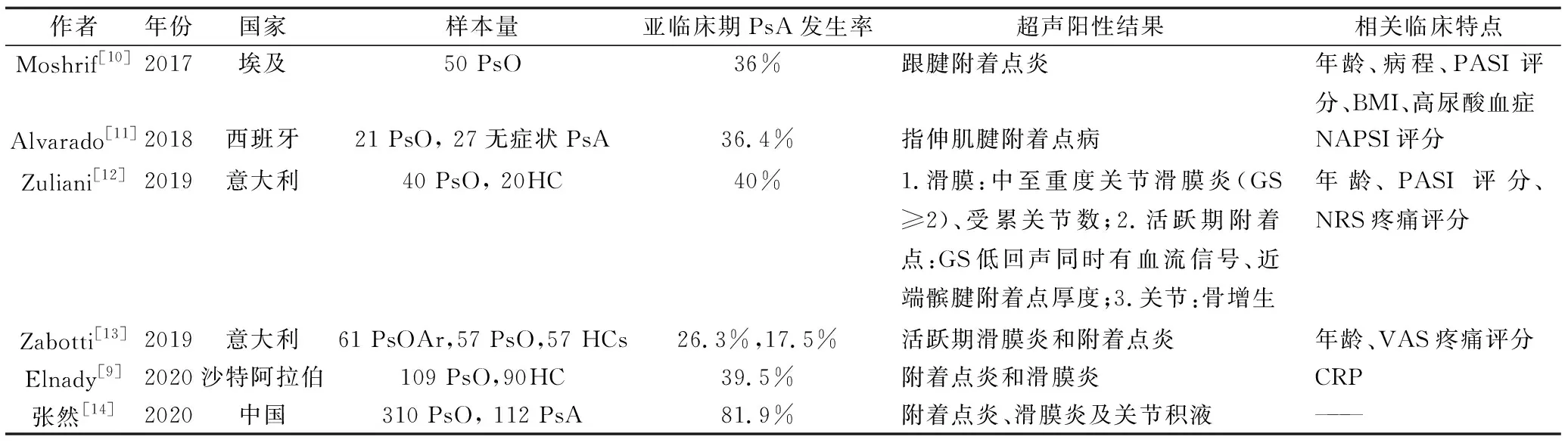
表1 亞臨床期PsA的超聲研究結果
3 國內外診治現狀
附著點炎被認為是PsA最具有特征性的表現,既往研究多關注于使用影像學檢查早期發現亞臨床附著點炎。雷元梅等納入50例尋常型銀屑病患者,對其進行高頻超聲及MRI檢查,發現20%患者有亞臨床關節炎。Elnady等[8]納入109例PsO患者,發現39.5%患者存在亞臨床PsA,對其進行2年的隨訪, PsA發病率為8.6%,且進展為PsA的銀屑病患者比未確診為PsA的患者顯示出更高的基線附著點炎患病率;附著點炎,而不是腱鞘炎,是進展為PsA的風險因素。Bratu等[16]對20例沒有關節炎癥狀的銀屑病患者和22名健康志愿者行中軸關節的磁共振成像檢查,發現骶髂關節炎癥、骨髓水腫、結構改變等結果在兩組間無統計學差異,因此不建議對PsO患者進行潛在亞臨床中軸炎癥的常規篩查。
既往由于PsA患者關節早期癥狀不具有特異性,大部分患者存在診斷延遲,研究表明診斷延遲6個月與治療效果降低相關[17],極大影響了患者的生存質量。而免疫調節或抗炎藥物的早期干預可以顯著改善臨床結果,而對影像學改變的影響未知。超聲或MRI檢出的臨床無癥狀的關節、滑膜或附著點異常隨后是否將自發正常化或經早期干預可以有效逆轉,仍是備受關注的熱點。
在ECLIPSA研究中,大部分銀屑病患者在接受烏司奴單抗(73.9%)或腫瘤壞死因子α抑制劑(41.7%)治療24周后附著點炎消失[18]。英國的一項前瞻性研究記錄了使用烏司奴單抗治療23例有超聲變化的PsO患者在第0周、第12周、第24周和第52周的格拉斯哥超聲附著點評分系統的評分變化,發現至少有一種炎癥的個體的百分比在第24周時從基線的24.2%降低到14.0%,在第52周時降低到10.4%;但是慢性結構改變沒有明顯改善[7]。德國的一項前瞻性的單中心研究納入20例PsO患者,使用司庫奇尤單抗治療24周,使用MRI和CT評估肌骨關節,24周時PsA磁共振評分系統總分(P=0.005)和滑膜炎亞評分(P=0.008)有明顯改善,骨侵蝕和骨贅沒有進展,而橈骨遠端的骨量在24周后顯著增加(P=0.020)[19]。日本的一項研究回顧性納入2011-2015年的179例PsO患者,使用烏司奴單抗治療之后的8個月內,有8例發展為PsA,表明使用該藥并不能完全阻止PsA進展[20]。也有部分研究發現使用系統性治療相比外用藥或未治療的銀屑病患者PsA發病率更低,使用生物制劑與使用傳統抗風濕藥物兩組沒有差異,且生物制劑治療組發展為PsA時出現的指趾炎率更低[21]。
超聲的異常改變可能是患者發展為PsA的危險因素,然而迄今仍缺乏大樣本量的隊列研究證據證明,具有這些“沉默的”影像學改變的患者未來是否有更大的可能性發展成為PsA。Wang等[22]納入162例亞臨床期PsA患者,隨訪2年,有25例進展為臨床期PsA,并發現年齡越大、飲酒、超敏CRP高和低于45歲患脂肪肝是亞臨床PsA患者進展為臨床PsA的風險因素,提示肝臟-皮膚軸在PsA發病機制中有一定作用。
4 總結與展望
亞臨床期PsA是PsO進展為PsA的一個特殊階段,因無明顯關節癥狀,皮膚科醫師常易忽視。因此,建議在所有銀屑病患者初次就診時,都應仔細詢問其有無關節癥狀,并盡可能安排影像學檢查,必要時與風濕科、放射科、超聲科等科室進行多科會診。常規可以使用肌骨超聲評估外周關節附著點炎和滑膜炎等亞臨床改變。使用傳統改善病情抗風濕藥物和生物制劑等系統治療能夠有效改善患者的影像學炎癥性改變,但慢性結構損傷的改善效果不顯著,仍有進一步發展為PsA的風險。影像學檢查結果,如滑膜炎、附著點炎、腱鞘炎、骨侵蝕或骨增生等是否代表異常炎癥特征或僅僅是疾病進展過程中免疫介導的生理性反應,仍是需要討論的主題。需要更多的基礎及臨床前瞻性研究去發現其內在的發病機制、風險因素、生物標記物等,將有利于臨床早期診斷、治療及并改善患者預后。

