基于Ti-Si-Fe 合金與B 粉的TiB2 熔鹽法合成制備研究
程登峰 ,張錦化,王景然,柯昌明*
(1.武漢科技大學,省部共建耐火材料與冶金國家重點實驗室,湖北 武漢 430081;2.九江金鷺硬質合金有限公司,江西 九江 332000)
0 引言
高鈦型高爐渣是我國特有的釩鈦磁鐵礦高爐冶煉工藝過程形成的高爐渣,是典型的大宗工業廢渣。由于高鈦型高爐渣中含有20%~26%的TiO2,也是一種重要的鈦資源。幾十年來圍繞高鈦型高爐渣中鈦資源的利用,開展了大量的研究工作,但由于提鈦工藝成本過高、提鈦后的尾渣無法利用造成環境二次污染等問題未能解決,嚴重制約了高鈦型高爐渣的資源化綜合利用。目前已積存的高鈦型高爐渣近億噸,而且還在以每年新增300~400 余萬t 的速度遞增。大量的爐渣積存在地表,占用大量土地,給長江上游金沙江流域的環境保護帶來極大壓力。同時,爐渣中大量鈦資源無法利用,也造成了鈦資源的極大浪費[1-3]。
自2005 年起,武漢科技大學組織科研人員開展科技攻關,與攀鋼集團公司等單位合作,開發了高鈦型高爐渣制備Ti-Si-Fe 合金、提鈦尾渣高附加值利用技術方案,實現了高鈦型高爐渣的整體、無二次污染的規模化消納及高附加值資源化綜合利用[4-10]。制取的鈦硅鐵合金主要由Ti5Si3、TiSi2、TiSi 和Ti-FeSi2組成,鈦硅鐵合金除可作為鋼鐵生產過程中的合金化元素使用外,在高性能陶瓷材料領域也有很好的延伸開發及高附加值利用空間[9,11-12]。
二硼化鈦(TiB2)具有高熔點、高硬度、優異的耐磨性、抗腐蝕性、導電性等[13-15]特性,廣泛用于陶瓷盔甲[16-17]、耐磨涂層[18-19]、電極[20]、切削工具[21-23]以及合金的強化[24-26]等領域。有關TiB2的合成制備方法中,采用鈦粉和B 粉[27-29]或它們的氧化物作為原料較為常見,它們都是高純度但同時也是高價格的原料。目前,未見到從工業含Ti 廢棄物資源再利用的角度來生產TiB2的報道,也未見到以TiSiFe 合金為原料制備含鈦化合物如碳化鈦、氧化鈦、硼化鈦等的報道,但這類研究對資源再利用、環境保護具有迫切、貼合實際的應用價值,因此很重要也很有必要。雖然TiSiFe 合金粉體中含有Si、Fe 等元素,但可以用來制備TiB2–SiC 基陶瓷[30]/金屬陶瓷[31],或進一步提純后作為TiB2基陶瓷的原料。筆者以從高鈦型高爐渣中提取的鈦硅鐵合金和硼粉為原料,開展了TiB2粉體的熔鹽法合成制備,研究了反應溫度、保溫時間、熔鹽含量對反應進程的影響,探討了以Ti-Si-Fe 合金為原料制備TiB2陶瓷粉體的可行性。
1 試驗方法
1.1 原材料及樣品制備
以從高鈦型高爐渣中提取的Ti-Si-Fe 合金粉(74 μm,攀鋼提供塊狀合金后實驗室破碎)和無定形硼粉(94.0%,<5 μm,阿拉丁)為原料,以分析純NaCl、KCl(摩爾比1∶1)混合組成的復合熔鹽作為反應介質。
Ti-Si-Fe 合金粉化學成分見表1,主要含有Ti、Si、Fe 以及少量Al。XRD 物相(圖1)分析表明其主要物相組成為Ti5Si3、TiSi2、TiSi 和TiFeSi2。

表1 Ti-Si-Fe 合金粉的化學成分Table 1 Chemical compositions of Ti-Si-Fe alloy powder%
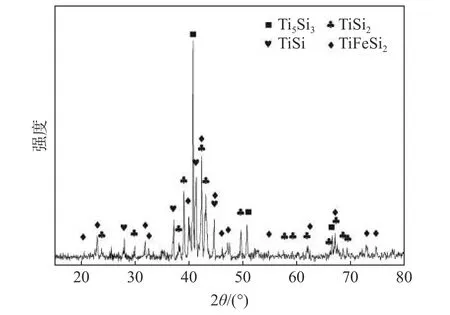
圖1 Ti-Si-Fe 合金的XRD 譜Fig.1 The XRD pattern of Ti-Si-Fe alloy
將Ti-Si-Fe 合金粉和B 粉、一定量的熔鹽在瑪瑙研缽中充分混合均勻。混合物置于石墨坩堝中,在氧化鋁管式爐中于流動的高純氬氣氣氛及設定溫度下進行熱處理。將反應產物用熱的去離子水反復洗滌并真空抽濾至不含Cl-,然后在95 ℃干燥20 h。以保溫時間4 h、熔鹽/反應物的質量比為2.5、B/Ti摩爾比為2.1 這三個參數值為基準,通過改變其中某一個參數來探討反應溫度和這個因素對反應進程的影響,具體試驗參數見表2。

表2 試驗參數Table 2 Experimental parameters
1.2 試樣表征
采用X-射線衍射儀(X’Pert Pro,Philips,荷蘭)對合金及產物粉體進行物相分析,Cu Kα 射線,Ni濾波,λ=0.154 18 nm。采用掃描電子顯微鏡(JSM-6610,JEOL,日本)對粉體形貌進行觀察。
2 結果與討論
2.1 反應溫度的影響
圖2 列出了熔鹽與反應物質量比為2.5,B/Ti摩爾比為2.1,經800~1 100 ℃反應4 h 后產物及Ti-Si-Fe 合金的XRD 圖譜。熱處理溫度為800 ℃時,產物粉體的XRD 圖譜與Ti-Si-Fe 合金粉無明顯差異(B 為非晶態,未出現衍射峰),主要物相為Ti5Si3(PDF29-1362)、TiSi(PDF17-424)、TiSi2(PDF35-785)和少量TiFeSi2(PDF75-2180),表明該溫度下合金與硼粉尚未發生反應。

圖2 Ti-Si-Fe 合金與B 在不同溫度下反應4 h 后產物的XRD 譜Fig.2 XRD patterns of samples prepared by Ti-Si-Fe alloy reacting with B at different firing temperature for 4 h
溫度升至850 ℃時,可在2θ=27.5°、34.2°處看到微弱的TiB2(PDF7-275)的特征衍射峰,表明在該溫度下,有少量TiB2生成。同時Ti5Si3衍射峰強度明顯減弱而其他合金相幾乎沒有變化,這說明800~850 ℃溫度區間主要是Ti5Si3相與B 反應。當溫度升至950 ℃時,產物中TiB2含量顯著上升,合金相Ti5Si3消失,TiSi、TiSi2和TiFeSi2的特征峰強度都有所降低,與此同時衍射圖譜中出現了Si(PDF75-590)、FeSi2(PDF35-822)的特征衍射峰,表明合金中的含鈦物相與B 發生反應生成TiB2后,釋放出了Si 及FeSi2。溫度繼續升高至1 000 ℃以上時,合金相TiSi、TiFeSi2和TiSi2分別在1 000、1 050 ℃和1 100 ℃依次消失,至1 100 ℃時合金相反應完全,反應產物的物相組成為TiB2、Si 和FeSi2。
結果表明:Ti-Si-Fe 合金中各物相與B 的反應順序依次為:Ti5Si3、TiSi、TiFeSi2、TiSi2。Ti-Si-Fe合金中各相與B 粉反應的自由能如下[32]:

因查不到TiFeSi2的熱力學數據,式(4)的ΔG無法計算。由計算出來的結果可知,合金相與B 反應由易到難依次為:Ti5Si3、TiSi、TiSi2,與試驗結果吻合。
2.2 保溫時間的影響
圖3 列出了熔鹽與反應物質量比為2.5,B/Ti摩爾比為2.1,反應溫度為950 ℃時不同保溫時間后產物的XRD 譜。隨保溫時間從1.0 h 增加到4.0 h,產物中TiB2衍射峰強度增加,同時合金相Ti5Si3、TiSi 和TiSi2的衍射峰強度顯著降低,這說明TiB2生成量明顯增多,合金相的反應量增多。反應時間達到5.5 h,Ti5Si3相特征衍射峰消失,在衍射圖譜中仍可以觀察到TiSi、TiFeSi2、TiSi2的特征衍射峰。
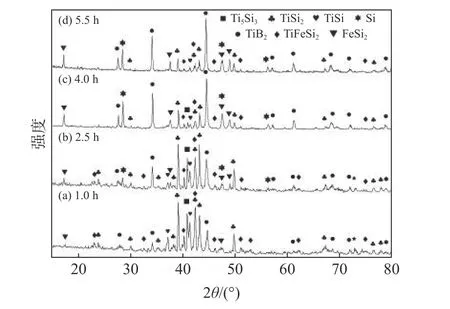
圖3 950 ℃保溫不同時間下產物的XRD 譜Fig.3 XRD patterns of samples prepared at 950 ℃ for different dwell time
圖4 列出了熔鹽與反應物質量比為2.5、B/Ti摩爾比為2.1,1 100 ℃時保溫不同時間后產物的XRD 圖譜。在1 100 ℃反應1 h 時,衍射圖譜中觀察到合金相TiFeSi2的特征衍射峰。延長保溫時間至2.5 h,衍射圖譜中TiFeSi2的特征峰明顯降低,保溫4 h 時TiFeSi2的特征峰基本消失,說明在此條件下該物相反應完全。
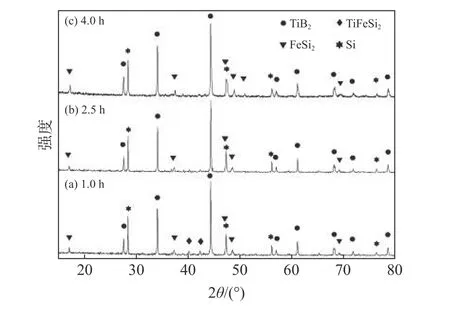
圖4 1 100 ℃保溫不同時間下產物的XRD 譜Fig.4 XRD patterns of samples prepared at 1 100 ℃ for different dwell time
上述試驗結果表明,延長保溫時間可使Ti-Si-Fe 合金與B 反應進行得更徹底。
2.3 熔鹽量的影響
在950 ℃保溫1 h 的條件下(圖5),不添加熔鹽時有大量合金相TiSi2和TiSi 未反應,加入熔鹽后反應產物中TiSi2和TiSi 含量顯著降低,但熔鹽/反應物質量比從1.5 增至3.5 時,熔鹽對反應促進效果不明顯。圖6 為1 100 ℃反應4 h 時,不同熔鹽含量下產物的XRD 衍射譜。從圖6 可知,不添加熔鹽時,反應產物中有較多的TiSi2、TiFeSi2存在,熔鹽添加量為反應物的2.5 倍時,反應幾乎能完全進行。這兩個溫度下的試驗結果都說明熔鹽能促進反應的進行。

圖5 不同熔鹽/反應物質量比下,950 ℃反應1 h 后產物的XRD 譜Fig.5 XRD patterns of samples prepared at 950 ℃ for 1 h with different mass ratios of salt to reactant
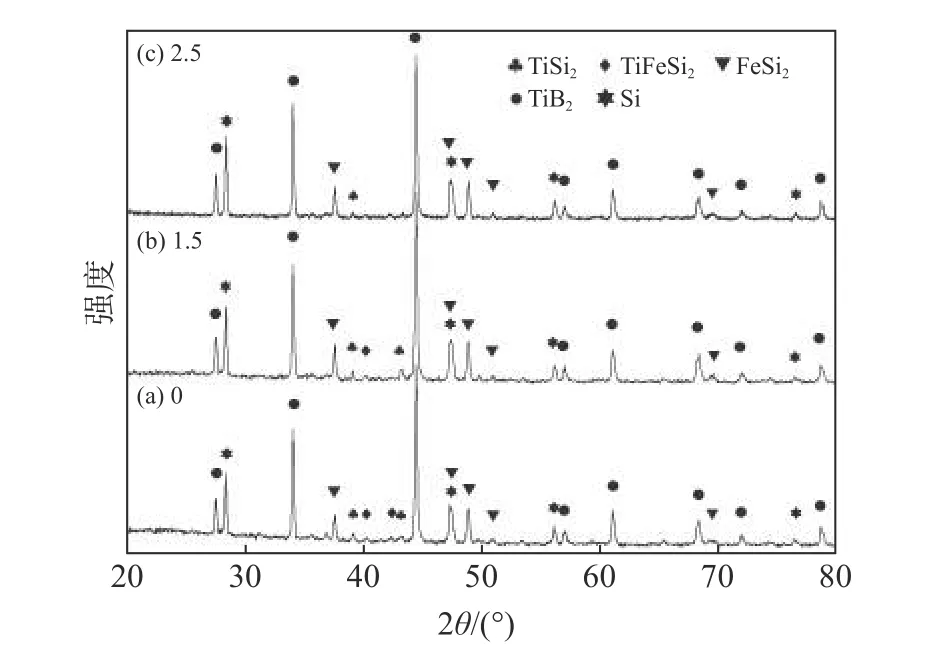
圖6 不同熔鹽/反應物質量比下,1 100 ℃反應4 h 后產物的XRD 譜Fig.6 XRD patterns of samples prepared at 1 100 ℃ for 4 h with different mass ratios of salt to reactant
不加入熔鹽時,反應物分子靠固相擴散發生碰撞并反應。當熔鹽存在時,反應物部分溶于熔鹽中,在熔鹽流體中做布朗運動,其速度為固相擴散時的數個數量級。這增加了單位時間內反應物分子的偶遇機率,因此反應速率增加。
2.4 B/Ti 原子摩爾比的影響
圖7 為1 100 ℃保溫4 h、熔鹽/反應物質量比為2.5 時,不同B 添加量下產物的XRD 衍射譜。從圖7 可知,B 按化學計量B/Ti 原子比為2.0 時,產物中有少量TiSi2未反應。這是因為按化學計量比來配比反應物時,反應物與產物達到化學平衡后就很難繼續反應,過量的反應物可促使反應進一步進行。隨B/Ti 原子比升高,未反應的TiSi2含量逐漸減少,當比值為2.3 時基本完全反應。
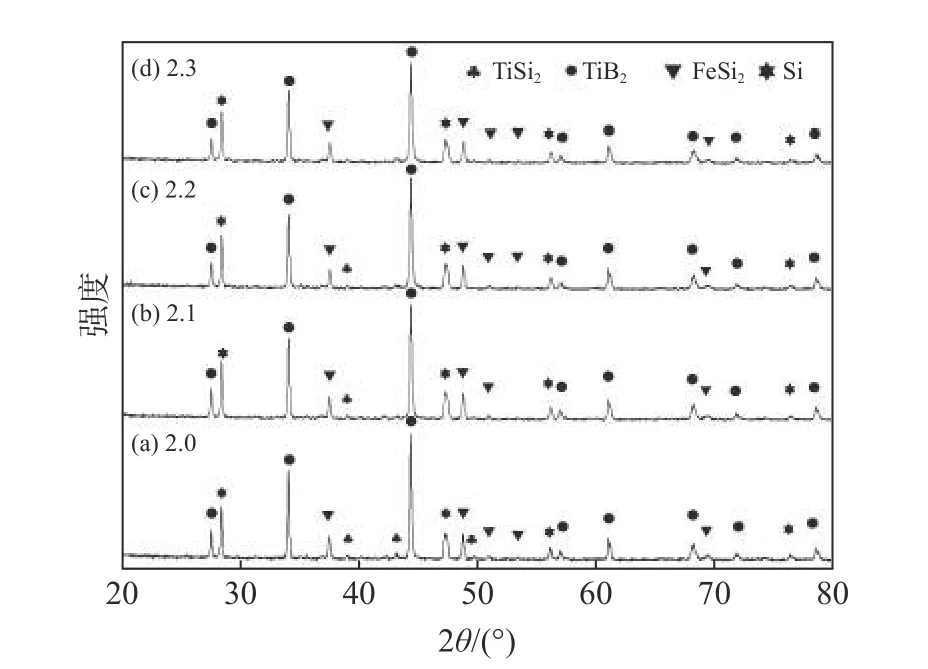
圖7 不同B/Ti 原子比下,1 100 ℃反應4 h 后產物的XRD 譜Fig.7 XRD patterns of samples prepared at 1 100 ℃ for 4 h with different atomic ratios of B to Ti
2.5 反應產物的元素分布
圖8 列出了熔鹽/反應物比例2.5、1 100 ℃反應1 h 后產物中Si、Ti、Fe、Al、B 元素的分布情況。Ti 幾乎存在于所有顆粒之中,B 與Ti 分布接近,對應產物TiB2。Al 分布較為均勻,但以何種物質存在還需進一步研究。含Fe 的顆粒同時含Si,這與產物FeSi2相對應。大多數顆粒含有Si,同時還有Ti和B,說明在這些顆粒中產物TiB2和Si 是伴生在一起的。此外,有些顆粒(圖中右上角區域)有Ti、B 存在,但不含Si,說明這些顆粒就是產物TiB2。

圖8 熔鹽/反應物比例2.5,1 100 ℃反應1 h 產物粉末元素分布Fig.8 Sample element distribution firing at 1 100 ℃ for 1h with 2.5 of mass ration of salt to reactant
2.6 產物形貌
對熔鹽/反應物比例2.5、1 100 ℃反應4 h 后的產物形貌進行觀察,如圖9 所示,產物粉體呈不規則的多棱角顆粒,與Ti-Si-Fe 合金粉的顆粒形態一致。多棱角狀的產物粉體顆粒實質是由極為細小的納米晶粒聚集而成(圖9(c)、(d))。圖8 中不含Si 的產物顆粒,其形貌如圖9(e)所示,由片狀顆粒聚集而成,在其他區域也找到了相同形貌的顆粒(圖9 (f)),說明存在較多這種形貌的顆粒。
從圖9 (c)和9(d)可知,產物顆粒表面呈龜裂狀,有裂縫或微米級孔洞與顆粒內部相連,而Ti-Si-Fe合金顆粒的表面是平滑的完整面(圖9 (a)),這充分說明在反應過程中有物質擴散到熔鹽中,留下了空位。

圖9 Ti-Si-Fe 合金與B 粉1 100 ℃保溫4 h 后反應產物的SEM 顯微形貌Fig.9 The SEM microtopography of sample prepared at 1 100 ℃ for 4 h
2.7 反應機理
由前面的分析可知,在大多數顆粒中產物TiB2和Si 是伴生關系,但也有顆粒只由TiB2組成,這說明TiB2的形成可能存在兩種機制。高溫下,熔鹽呈液態并包裹住Ti-Si-Fe 合金顆粒,促進了合金元素向熔鹽中擴散。由反應式(1)~(4)可知,主要是Ti元素與B 結合形成TiB2,Si 和Fe 只是被動地形成副產物,因此在反應過程中Ti 原子會持續不斷地溶入熔鹽中,在顆粒內部產生孔隙,大部分Si、Fe 不會進入熔鹽中,只會待在原來的位置。Ti-Si-Fe 合金在NaCl-KCl 熔鹽中與B 反應的過程大致為:反應溫度高于熔鹽熔點(657 ℃)時,熔鹽變成液態,合金顆粒表面的Ti5Si3、TiSi2等合金相以及B 逐漸向熔鹽中擴散溶解。B 原子直徑小,在熔鹽中的溶解度相對合金相占據顯著優勢。熔鹽中的[B]在液相促進作用下快速擴散至合金顆粒表面,與合金顆粒表面的[Ti]原子結合形成TiB2。而Si 和Fe 少量溶入熔鹽中并達到溶解平衡后,絕大部分都保持原有狀態。大部分產物TiB2以Si、FeSi2作為形核表面形核并長大,少部分TiB2在熔鹽中形核并長大。隨著反應持續進行,合金中的[Ti]不斷向熔鹽中溶解,形成了裂縫和孔隙,[B]通過這些通道向顆粒內部擴散,與顆粒內部的合金相發生反應。Si、FeSi2作為骨架維持了Ti-Si-Fe 合金粉體顆粒原有的形態特征,TiB2包裹著骨架形成了表面呈龜裂狀或有孔隙的產物顆粒。少量TiB2自然生長形成了由片狀TiB2組成的產物顆粒。反應的過程示意見圖10。

圖10 Ti-Si-Fe 合金與B 粉在熔鹽中反應的過程示意Fig.10 Schematic reaction process of Ti-Si-Fe alloy and B powder in molten salt
3 結論
1) 以Ti-Si-Fe 合金和B 為原料在氬氣保護下、NaCl-KCl 熔鹽中合成了TiB2粉體。850 ℃時開始有TiB2生成,1 100 ℃可反應完全,反應產物為TiB2、Si 和FeSi2。
2)升高反應溫度、延長保溫時間、增加B 添加量、添加熔鹽都能促進反應進行。
3)產物顆粒有兩種,一種顆粒表面呈龜裂狀,有裂縫或微米級孔洞與顆粒內部相連,這種顆粒同時含有TiB2、Si 或FeSi2;另一種顆粒由片狀TiB2組成。
4)合金中的含Ti 物相不斷向熔鹽中溶解,形成了裂縫和孔隙,溶解在熔鹽中的[B]通過這些通道與顆粒內部的合金相進一步反應。而Si、FeSi2停留在原位,從而維持了Ti-Si-Fe 合金粉體顆粒原有的形態特征。
5)合金相與B 反應完全的先后順序依次為:Ti5Si3、TiSi、TiFeSi2和TiSi2。

