黃粉蟲凝乳蛋白酶的分離純化及結(jié)構(gòu)預測
楊祥,喬海軍,楊曉麗,文鵬程,汪月,張衛(wèi)兵,*,張忠明,*
1(甘肅農(nóng)業(yè)大學 食品科學與工程學院,甘肅 蘭州,730070)2(甘肅農(nóng)業(yè)大學 理學院,甘肅 蘭州,730070)3(甘肅省商業(yè)科技研究所有限公司,甘肅 蘭州,730000)
凝乳酶是干酪生產(chǎn)過程中的關(guān)鍵酶,能夠使牛奶凝固并在干酪成熟過程中起著不可替代的作用[1]。凝乳酶的凝乳過程包括2個階段:第一階段是對κ-酪蛋白Phe105-Met106連接的肽鍵進行水解,暴露出內(nèi)部的α-酪蛋白和β-酪蛋白;第二階段是在Ca2+作用下,酪蛋白分子間形成化學鍵,并聚集形成三維網(wǎng)狀凝膠[2]。小牛凝乳酶是最早應用于干酪制作的,然而隨著干酪的市場需求不斷增加,小牛凝乳酶逐漸供不應求,人們不得不尋找其替代品[1,3]。駱駝凝乳酶、羔羊凝乳酶、豬胃蛋白酶等動物源凝乳酶都具有較好的凝乳活力,它們的蛋白水解力較小,制作的干酪苦味小,風味和品質(zhì)也較好。帕爾瑪奶酪、高山奶酪、埃門塔爾奶酪等很多高品質(zhì)的干酪都使用動物源凝乳酶進行制作[4]。動物源凝乳酶替代品中,駱駝凝乳酶與小牛凝乳酶分子結(jié)構(gòu)差異很小,但其凝乳活力要高于小牛凝乳酶,且蛋白水解力只有小牛凝乳酶的30%[5]。羔羊凝乳酶的凝乳活力低于小牛凝乳酶,但具有更高的pH穩(wěn)定性[6];水牛皺胃酶的凝乳活力較低,其穩(wěn)定性和蛋白水解力與小牛凝乳酶差別不大[7];此外,從甲殼類昆蟲Munida中提取出的凝乳酶也可應用于奶酪制作[8]。昆蟲的物種豐富,數(shù)量眾多,是凝乳酶開發(fā)的良好資源,然而,在現(xiàn)有動物源凝乳酶中,昆蟲凝乳酶少有報道。
黃粉蟲(Tenebriomolitor),是鞘翅目擬步行蟲科粉甲屬的昆蟲,常被用作動物飼料。近年來,將昆蟲尤其是黃粉蟲作為動物蛋白納入食品行業(yè)受到歐洲重點關(guān)注[9]。與其他動物一樣,在黃粉蟲的腸道中也存在很多蛋白酶。ELPIDINA等[10]在黃粉蟲幼蟲的后中腸中提取出胰凝乳蛋白酶樣蛋白酶,并測定了其酶學性質(zhì)和N端序列;CRISTOFOLETTI等[11]在黃粉蟲中腸中提取出組織蛋白酶L樣蛋白酶(calpain,CAL),測定了其氨基酸序列并預測了其活性位點和功能;BETON等[12]在中腸中也提取得到CAL,進一步模擬出了酶的3D結(jié)構(gòu)模型;馬勇等[13]研究發(fā)現(xiàn)將黃粉蟲漿加入牛奶后,很快會發(fā)生凝乳現(xiàn)象,但對其凝乳機理未做進一步的研究。本研究從黃粉蟲體中提取和分離純化出凝乳蛋白酶,鑒定出該酶的氨基酸序列,并對其結(jié)構(gòu)特性進行預測,以期為黃粉蟲凝乳蛋白酶在的應用提供理論參考。
1 材料與方法
1.1 材料與試劑
黃粉蟲,山東省德州市平原十號路市場;DEAE-Sepharose FF、Sephadex G75,上海源葉生物科技有限公司;0.45 μm濾膜,上海光譜實驗科技有限公司;蛋白Marker,上海索萊寶生物科技有限公司;玻璃勻漿器,上海澤葉生物科技有限公司;丙烯酰胺、十二烷基硫酸鈉(sodium dodecyl sulfate,SDS),北京酷來搏科技有限公司;甲叉雙丙烯酰胺,上海中泰化學試劑有限公司;考馬斯亮藍G250、考馬斯亮藍R250,天津市光復精細化工研究所;其他常用生化試劑均為分析純。
1.2 儀器與設(shè)備
TD5A-WS高速冷凍離心機,長沙湘儀離心機儀器有限公司;HL-2B恒流泵、BSZ-160自動部分收集器,上海滬西分析儀器廠;SCIENTZ-10 ND真空冷凍干燥機,寧波新芝生物科技有限公司;質(zhì)譜儀Q Exactive HF、液相Easy nLC/ Ultimate 3000、色譜柱C18(1.9 mm,150 μm×120 mm)、色譜預柱C18(3 mm,100 μm×20 mm), 美國Thermo Scientific公司;電泳儀、電泳自動成像儀,美國Bio-Rad公司;PPSQ-33A島津全自動蛋白質(zhì)多肽測序儀,日本SHIMADZU公司。
1.3 實驗方法
1.3.1 黃粉蟲腸道蛋白組分析
將四齡的黃粉蟲置于一塊含0.9% NaCl的冰上切去其頭和尾,從任意一端取出腸道,與pH 6.5的Tris-HCl緩沖液充分混合后,加入玻璃勻漿器中勻漿;將得到的勻漿液4 ℃、10 000×g離心20 min,收集上清液并用0.45 μm濾膜進行微濾,收集濾液[14];將濾液送往北京市百邁客生物科技有限公司進行LC-MS/MS分析,并對得到的碎片肽段序列進行定性和定量分析以及功能注釋,建立黃粉蟲腸道蛋白數(shù)據(jù)庫。
1.3.2 黃粉蟲凝乳蛋白酶提取與分離純化
將黃粉蟲腸道經(jīng)勻漿、離心、微濾后得到濾液,然后對其進行純化。首先,使用弱陰離子交換柱DEAE-Sepharose FF進行離子交換層析[15]:用pH 6.5的0.02 mol/L Tris-HCl作為平衡緩沖液平衡3~5個柱體積,平衡流速為1 mL/min;用0~0.6 mol/L NaCl溶液進行梯度洗脫,洗脫液用平衡緩沖液配制,洗脫流速為0.5 mL/min[16]。收集具有凝乳活力的洗脫液并用3 kDa超濾離心管進行濃縮,將濃縮液作為上樣樣品,使用葡聚糖凝膠Sephadex G75色譜柱(1.6 cm×20 cm)進行凝膠過濾層析:用pH 6.0的0.02 mol/L Tris-HCl作為平衡緩沖液平衡4~5個柱體積,平衡流速為1 mL/min;用平衡緩沖液進行洗脫分離,洗脫流速為0.25 mL/min;收集具有高凝乳活力的洗脫液,得到純化的凝乳酶,冷凍干燥后保存在-80 ℃下。通過SDS-PAGE驗證凝乳酶的純度,采用考馬斯亮藍法測定蛋白含量。
1.3.3 N端15個氨基酸序列測定
采用Edman降解法測定該酶的N端15個氨基酸[10];。將凍干的樣品用pH 6.0的Tris-HCl緩沖液溶解,取20 μL溶液樣品進行12% SDS-PAGE后,將SDS-PAGE膠電轉(zhuǎn)至硝酸纖維素膜上,并用麗春紅染色。剪取相應膜放置到反應器中,組裝好反應器后將其放置于儀器固定位置,通過島津全自動蛋白質(zhì)多肽測序儀(PPSQ-33A)對樣品N端序列進行分析。通過軟件PPSQ-30 Analysis設(shè)置:樣品名稱、樣品號、測試循環(huán)數(shù)、選擇方法文件,設(shè)置完成后開始測試,最終確定該酶N端15個氨基酸。利用該酶的N端15個氨基酸序列與黃粉蟲腸道蛋白數(shù)據(jù)庫比對搜索出同源蛋白。
1.3.4 凝乳酶活力測定
參照ARIMA等[17]的方法,將含有10 mmol/L CaCl2的10%脫脂乳于35 ℃水浴中孵育15 min,再按質(zhì)量比1∶10加入黃粉蟲凝乳蛋白酶,充分混勻后,記錄下容器壁出現(xiàn)絮狀顆粒所需要的時間,即為凝乳時間。凝乳活力的單位為索氏單位,1個索氏單位表示在35 ℃下,40 min內(nèi)凝結(jié)1 mL底物所需要的酶量。凝乳活力計算如公式(1)所示:
(1)
式中:MCA為凝乳活力(milk clotting activity),t為凝乳時間,s。
1.3.5 蛋白水解力測定
參照ZHAO等[18]的方法進行測定并略作修改。樣品的測定方法為:取1 mL樣品在40 ℃水浴2 min,然后加入1 mL 1%酪蛋白溶液反應10 min,再加入2 mL 0.4 mmol/L三氯乙酸溶液終止反應,靜置10 min后過濾溶液并取1 mL濾液在660 nm處測定吸光值。蛋白水解力的單位為U,1 U表示1 mL酶在1 min內(nèi)水解酪蛋白產(chǎn)生1 μg酪氨酸所需要的酶量。樣品的蛋白水解力(proteolytic activity,PA)計算如公式(2)所示:
(2)
式中:A660為樣品在660 nm處的吸光值,4為反應試劑總體積,1/10為反應時間10 min,以1 min計算,K為吸光常數(shù),在標準曲線上,吸光值為1時對應的酪氨酸濃度,n為稀釋倍數(shù)。
1.3.6 黃粉蟲凝乳蛋白酶一級結(jié)構(gòu)分析
在GenBank數(shù)據(jù)庫采用 BLAST 程序查找與其相似的蛋白酶序列,并與黃粉蟲凝乳蛋白酶進行比較分析。
1.3.7 黃粉蟲凝乳蛋白酶理化性質(zhì)預測
參考 SOLEYMANZADEH等[19]的方法計算和預測黃粉蟲凝乳蛋白酶的理化特性。利用肽特性計算器(https://pepcalc.com/)確定酶的分子質(zhì)量、等電點(isoelectric point,PI)和凈電荷;利用ExPASy ProtParam工具(https://web.expasy.org/cgi-bin/protparam /protparam)預測酶的不穩(wěn)定性指數(shù)(不穩(wěn)定性指數(shù)<40預示該肽可能是穩(wěn)定的,不穩(wěn)定性指數(shù)>40則預示蛋白質(zhì)或肽可能不穩(wěn)定)[20];使用肽工具(https://www.peptide2.com)確定酶的疏水性氨基酸比例。
1.3.8 黃粉蟲凝乳蛋白酶二級結(jié)構(gòu)預測
以黃粉蟲凝乳蛋白酶的一級序列為基礎(chǔ),使用PSSFinder工具預測其二級結(jié)構(gòu)(http://linux1.softberry.com/ berry)[21]。
1.3.9 凝乳酶的三級結(jié)構(gòu)預測
以黃粉蟲凝乳蛋白酶的一級結(jié)構(gòu)為基礎(chǔ),運用I-TASSER On-line Server預測其三級結(jié)構(gòu)和B-factor(http://zhanglab.ccmb.med.umich.edu/I-TASSER)。利用COACH服務器和預測到的三級結(jié)構(gòu)預測該酶的活性位點,并以TM-score和Cov作為置信度的評價指標。
2 結(jié)果與分析
2.1 黃粉蟲腸道蛋白數(shù)據(jù)庫的建立
從樣品中共鑒定到1 207種黃粉蟲腸道蛋白質(zhì)及其完整氨基酸序列,其中發(fā)掘出98種新蛋白。建立了黃粉蟲腸道蛋白數(shù)據(jù)庫,將測序數(shù)據(jù)上傳至ProteomeXchange數(shù)據(jù)庫,存儲編號為PXD029111。鑒定到的蛋白涉及的主要代謝通路為碳代謝(ko01200)、氧化磷酸化(ko00190)、糖酵解/糖異生(ko00010)、半乳糖代謝(ko00052)以及多種氨基酸代謝;主要功能包括轉(zhuǎn)移酶活性(GO:0016740)、催化活性(GO:0003824)、單體碳水化合物代謝過程(GO:0044723)、酶調(diào)節(jié)器活性(GO:0030234)等。
2.2 黃粉蟲凝乳蛋白酶提取與分離純化
如圖1-a所示,粗酶液經(jīng)離子交換層析后,共洗脫出6個蛋白峰,其中第1、第2和第3個峰沒有肩峰,表明雜蛋白很少,而后面3個峰都有肩峰,說明存在較多的雜蛋白,蛋白并沒有徹底被分開。在第一個蛋白峰的位置出現(xiàn)了具有高凝乳活力的蛋白,而這個位置是采用0 mmol/L NaCl的洗脫液洗脫的,說明該酶無法被陰離子交換柱吸附。將高凝乳活力的蛋白收集、濃縮,得到了部分純化的凝乳酶,其凝乳活力達到26.81 SU/mg,C/P(clotting activity/proteolytic activity)值為4.83,純化倍數(shù)為6.65。與粗酶液相比,其蛋白水解力明顯下降,凝乳活力有一定提高。
將該提取物進行凝膠過濾層析,結(jié)果如圖1-b所示,經(jīng)凝膠過濾層析后,共洗脫出了2個蛋白峰,第2個峰相較于第1個峰要大很多,且這2個峰都沒有肩峰,說明蛋白純度較高,分離效果較好。在第二個峰的位置附近出現(xiàn)了具有高凝乳活力的蛋白,將其收集并進行了SDS-PAGE以測定其純度(圖1-c),發(fā)現(xiàn)黃粉蟲凝乳蛋白酶已達到電泳純,分子質(zhì)量約為29 kDa。該值在目前所研究的黃粉蟲腸道蛋白分子質(zhì)量范圍之內(nèi),并且偏小一些[22];其分子質(zhì)量與小牛凝乳酶、山羊凝乳酶和豬胃蛋白酶相比較小,與羔羊凝乳酶[5]接近。相比于TERESHCHENKOVA等[23]只使用1種層析柱進行純化,本研究采用2種層析柱和微濾組合的純化方法能達到更好的純化效果。
經(jīng)測定該酶的凝乳活力達到173.8 SU/mg,C/P值為104.70,純化倍數(shù)為43.13,蛋白水解力僅有1.66 U/mL (表1)。其C/P值要高于雞胃蛋白酶、金槍魚凝乳酶和成年的綿羊皺胃酶[24]。C/P值越高則表明在干酪的制作和成熟過程中產(chǎn)生的苦味越少,很多植物源和微生物源凝乳酶[18]做出的干酪質(zhì)地柔軟,苦味重就是由于蛋白水解力太大,C/P值不大導致的。這些都表明該酶在干酪生產(chǎn)上具有一定的潛力。
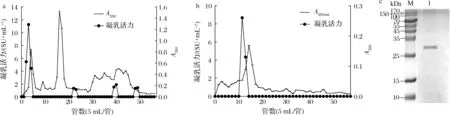
a-DEAE Sepharose Fast Flow;b-Sephadex G75;c- SDS-PAGE(M-標準蛋白;1-純化的黃粉蟲凝乳蛋白酶)圖1 黃粉蟲凝乳蛋白酶的柱層析純化及SDS-PAGEFig.1 Column chromatography purification and SDS-PAGE pattern of milk-clitting protease from T.molitor larvae

表1 黃粉蟲凝乳蛋白酶純化過程Table 1 Purification procedure of milk clotting protease from T.molitor larvae
2.3 黃粉蟲凝乳蛋白酶序列鑒定
經(jīng)測定黃粉蟲凝乳蛋白酶的N端15個氨基酸序列為MKLLVFSLVAISLAQ,與建立的黃粉蟲腸道蛋白數(shù)據(jù)庫比對后發(fā)現(xiàn)其與同源蛋白(g18990)的N端序列完全匹配(表2);該蛋白鑒定方法被許多研究學者運用[10,12],是一種經(jīng)典有效的鑒定手段。該酶的氨基酸序列如圖2所示,其總氨基酸殘基數(shù)為279,與小牛皺胃酶和駱駝凝乳酶的N端序列都只有13.3%的相似度[21]。

表2 黃粉蟲凝乳蛋白酶的序列信息Table 2 Sequence information of milk-clotting protease from T.molitor larvae
另外,該酶序列與NCBI中的幾種蛋白水解酶有50%以上的相似度(表3),其中最高的1種是PREDICTED:brachyurin(XP_969640.1),相似度達到75.27%,這種蛋白水解酶來自同屬鞘翅目的紅面甲蟲(Triboliumcastaneum),但其功能尚未證實。

圖2 黃粉蟲凝乳蛋白酶的氨基酸序列Fig.2 The amino acid sequence of milk-clotting protease from T.molitor larvae

表3 黃粉蟲凝乳蛋白酶與其他相似蛋白水解酶氨基酸序列比對Table 3 Amino acid sequence alignment of milk-clotting protease from T.molitor larvae with other similar proteases
2.4 黃粉蟲凝乳蛋白酶結(jié)構(gòu)研究
2.4.1 黃粉蟲凝乳蛋白酶的理化性質(zhì)
對黃粉蟲凝乳蛋白酶和幾種序列相似的蛋白酶進行了理化性質(zhì)預測,結(jié)果如表4所示。黃粉蟲凝乳蛋白酶的分子質(zhì)量相比表中其余幾種偏小,但是其不穩(wěn)定性指數(shù)<40,這表明該酶性質(zhì)穩(wěn)定。凈電荷是在中性環(huán)境下預測的凝乳酶表面總體靜電荷,均為負,黃粉蟲凝乳蛋白酶與小牛皺胃酶的很接近,但比駱駝凝乳酶小很多,3種酶所帶負電荷殘基數(shù)相差很小,而黃粉蟲凝乳蛋白酶的正電荷殘基少于駱駝凝乳酶。該酶等電點與表中兩種已知凝乳酶相近,幾種酶的等電點都<7,均為酸性蛋白酶;該結(jié)果符合黃粉蟲腸道蛋白的研究范圍,黃粉蟲腸道中存在酸性和堿性的蛋白酶,而且主要的消化蛋白酶為酸性蛋白酶[12,25]。幾種酶的疏水性氨基酸比例都在40%左右,黃粉蟲凝乳蛋白酶偏高,這表明其三級結(jié)構(gòu)可能保持較高穩(wěn)定性[26]。另外,疏水性氨基酸在酶與反應底物相互作用涉及到的一些非共價鍵的結(jié)合上起著不可替代的作用,這也預示著該酶與κ-酪蛋白的復合物的結(jié)構(gòu)可能更為穩(wěn)定。

表4 黃粉蟲凝乳蛋白酶及其他相似蛋白水解酶理化性質(zhì)及部分氨基酸殘基對比分析Table 4 Comparison of physicochemical properties and partial amino acid residues of milk-clotting protease from T.molitor larvae and other similar proteases
2.4.2 黃粉蟲凝乳蛋白酶二級結(jié)構(gòu)
二級結(jié)構(gòu)是指多肽鏈中主鏈原子的局部空間排布構(gòu)象,主要包括α-螺旋、β-折疊和無規(guī)卷曲,其中α-螺旋在二級結(jié)構(gòu)中起主要的穩(wěn)定作用[27]。利用黃粉蟲凝乳蛋白酶的完整氨基酸序列預測出其二級結(jié)構(gòu),結(jié)果顯示其β-折疊的占比要略多于α-螺旋,而小牛皺胃酶和駱駝凝乳酶的β-折疊要明顯多于α-螺旋[21],這表明黃粉蟲凝乳蛋白酶可能具有更穩(wěn)定的二級結(jié)構(gòu)(圖3)。3種酶二級結(jié)構(gòu)的分布位置有很大差別,黃粉蟲凝乳蛋白酶在N端和C端都各有1個α-螺旋,后接幾個β-折疊,而其他兩種酶的N端和C段則是先排列出幾個β-折疊,后接1個α-螺旋。然而,與黃粉蟲腸道中的主要消化蛋白酶系具有一些相似之處[12]:它們在N端都有1個α-螺旋, 其中1種組織蛋白酶L樣蛋白酶 (pCAL2C25S)的C端也具有α-螺旋。
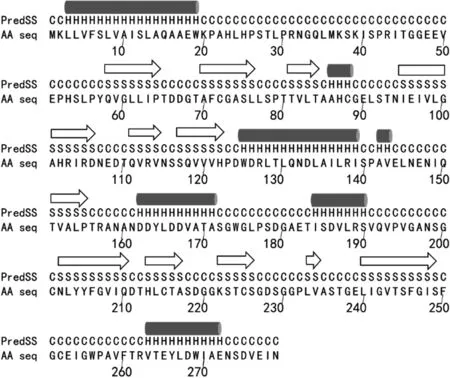
圖3 黃粉蟲凝乳蛋白酶二級結(jié)構(gòu)預測Fig.3 The secondary structure prediction of the milk-clotting protease from T.molitor larvae注:PredSS是預測的二級結(jié)構(gòu);AA seq是氨基酸序列;H或是α-螺旋;S或是β-折疊;C是無規(guī)則卷曲
2.4.3 黃粉蟲凝乳蛋白酶三級結(jié)構(gòu)
黃粉蟲凝乳蛋白酶的三級結(jié)構(gòu)如圖4-a所示,不同的顏色代表不同的結(jié)構(gòu),預測模型的C-score為-1.24,擁有最高的置信度。該結(jié)構(gòu)與小牛皺胃酶和駱駝凝乳酶結(jié)構(gòu)相差甚遠[28],這可能是分子質(zhì)量和物種上的巨大差異造成的,也表明這是1種全新的凝乳蛋白酶。使用COACH服務器預測到了黃粉蟲凝乳蛋白酶可能的4個催化位點,分別是His87、Gly227、Ser229、Gly230(圖4-b)。預測結(jié)果的TM-score為0.821,Cov值0.864,預測結(jié)果也擁有很高的置信度。該酶的外層大多是α-螺旋和一些無規(guī)則卷曲,而酶分子的β-折疊結(jié)構(gòu)占據(jù)了內(nèi)部的大部分位置,并構(gòu)成了1個夾層,夾層的夾角不大,其中卻包裹著該酶的活性位點,使其呈隱藏狀態(tài),并沒有暴露在外層,正因存在這樣的位阻影響,底物難以接近和進入酶的反應中心,導致酶的催化效率偏低,酶活力不如小牛皺胃酶、駱駝凝乳酶等。

a-黃粉蟲凝乳蛋白酶三級結(jié)構(gòu);b-黃粉蟲凝乳蛋白酶活性位點;c-黃粉蟲凝乳蛋白酶的BFP值圖4 黃粉蟲凝乳蛋白酶三級結(jié)構(gòu)、活性位點及BFP值預測Fig.4 The prediction of tertiary structure, active sites and normalized B-factor of milk-clotting protease from T.molitor larvae注:粉紅色代表α-螺旋,黃色代表β-折疊,藍白相間的表示無規(guī)則卷曲,紫色代表活性位點
I-TASSER 還預測了該酶中每個氨基酸的歸一化B因子(normalized B-factor,BFP)值(圖4-c),BFP 值>0的氨基酸殘基是在實驗中不太穩(wěn)定的結(jié)構(gòu)。如圖所示,64.8%的氨基酸殘基的BFP值<0,其中又有64.4%的殘基參與構(gòu)成蛋白的二級結(jié)構(gòu),這表明黃粉蟲凝乳蛋白酶的三級結(jié)構(gòu)穩(wěn)定性較高。
3 結(jié)論
從黃粉蟲腸中提取和分離純化出了黃粉蟲凝乳蛋白酶,通過LC-MS/MS等技術(shù)鑒定出該酶完整的279個氨基酸序列;經(jīng)預測發(fā)現(xiàn),該酶為酸性蛋白酶,理化性質(zhì)穩(wěn)定,二級結(jié)構(gòu)穩(wěn)定;與小牛皺胃酶和駱駝凝乳酶比較發(fā)現(xiàn)三者在N端序列和二級結(jié)構(gòu)等方面有較大差異;通過同源建模預測出該酶的三維結(jié)構(gòu)以及可能的活性位點Ser229等。本研究可為黃粉蟲凝乳蛋白酶的跨膜蛋白分析、與κ-酪蛋白復合物的構(gòu)建等進一步的研究提供科學依據(jù)。

