2020—2021 年我國部分省份禽呼腸孤病毒分子流行病學調查
李 彬,韓曉青,劉 平,劉紅祥,宋姍姍,于 靜,范慶增,張宇龍,譚 鵬,杜元釗,劉 東
(青島易邦生物工程有限公司,動物基因工程疫苗國家重點實驗室,山東青島 266032)
禽呼腸孤病毒(avian reoviruses,ARV)屬于呼腸孤病毒科正呼腸孤病毒屬,基因組為雙股分節段 RNA。根據 SDS-PAGE 電泳遷移率不同,可將ARV 的RNA 分為10 個節段,依次為L(L1、L2、L3)、M(M1、M2、M3) 和S(S1、S2、S3、S4)。S1基因編碼σC、P10、P17 3 種蛋白,其中P10 和P17 是非結構蛋白,σC 是外殼蛋白。σC 蛋白參與細胞吸附,可誘發機體產生特異性中和抗體,是ARV 的主要抗原決定簇,其變異可導致病毒致病性變化,在ARV 感染及致病中發揮重要作用。ARV 可影響各種禽類,包括雞、鴨和鵝,肉雞感染后表現腱鞘炎、心肌炎、免疫抑制和發育遲緩綜合癥等臨床癥狀,對養禽業造成巨大經濟損失[1-3]。
近年來,我國ARV 引起的白羽肉雞發病率明顯升高[4],發病日齡大多在15 日齡以后直至出欄,發病率為5%~20%。發病雞群的上一代種雞群大多免疫過經典ARV 疫苗[5],說明這種常規疫苗并沒有提供足夠的臨床保護。ARV 易變異重組,因此全面了解其分子流行病學特征具有十分重要的意義。為了解我國雞群中ARV 的遺傳變異特點,2020—2021 年從山東、河北、遼寧、江蘇、福建等省份收集疑似ARV 感染樣品,采用RT-PCR 方法篩選陽性樣本,然后對陽性樣本進行σC基因(1 088 bp)測序,并根據測序結果分析ARV 不同基因型的分布規律,以期為我國ARV 感染的防控提供參考。
1 材料和方法
1.1 樣品及來源
2020—2021 年從山東、河北、福建、安徽、遼寧、江蘇等6 個省,采集疑似感染ARV 白羽肉雞的腿或肌腱等組織樣本共253 份。采樣雞群涵蓋網養、地面平養、籠養等多種飼養方式(表1)。疑似ARV 感染發病雞群日齡多為15~25 日齡,個別為10 日齡左右;采食、飲水正常,表現趴臥、不愿走動等癥狀(圖1),隨病程發展病雞撇腿明顯,多為單側腿外撇;前期無死亡,后期因癱瘓被踩踏或繼發細菌性疾病,導致死淘率增加,至出欄時累計淘汰率為3%~20%。解剖可見,跗關節發青,肌腱水腫、炎性滲出、出血(圖2)。

表1 部分樣品來源雞群的流行病學信息
1.2 試劑與耗材
RT-PCR 試劑(一步法試劑盒)和Marker,為Takara 公司產品;50×TAE buffer,為上海生工公司產品;Goldview 核酸染料,為labest 公司產品;瓊脂糖,為康為世紀公司產品;核酸提取純化試劑盒,為杭州博日公司產品。
1.3 儀器與設備
超凈工作臺DL-CJ-INDII,北京東聯哈爾儀器制造有限公司產品;離心機TD24-WS,eppendorf公司產品;核酸提取純化儀NPA-32P,杭州博日科技有限公司產品;電泳儀DYY-6C,北京六一生物科技有限公司產品;凝膠成像儀JS-2000,上海培清科技有限公司產品;移液器,eppendorf 公司產品。
1.4 方法
1.4.1 病料RNA 提取 取腿或肌腱等組織病料約2 g,加入4~5 mL 滅菌PBS 或者生理鹽水,置研磨器(滅菌)中研磨或者用剪刀細心剪碎,置-20 ℃中反復凍融3 次,離心取上清備用。取上述病料樣品上清約300 μL 置1.5 mL 的離心管,取樣加入自動核酸提取板中,按照說明書操作提取RNA。
1.4.2 RT-PCR 檢測 根據NCBI 上發表的ARVσC基因序列設計特異性引物(表2)用于樣品檢測。引物由上海生工生物工程有限公司合成。RTPCR 反應條件(一步法試劑盒):50 ℃逆轉錄30 min,95 ℃預變性3 min;95 ℃變性30 s,55 ℃退火35 s,72 ℃延伸90 s,共32 個循環;72 ℃延伸5 min。RT-PCR 擴增產物經1.0%瓊脂糖凝膠電泳檢測,使用凝膠成像儀觀察和記錄結果。

表2 引物序列和擴增目的片段大小
1.4.3σC基因測序及遺傳進化分析 將RT-PCR產物進行電泳后,對目的條帶進行膠回收,回收產物與pMD18-T 載體連接,連接產物轉化DH5α 感受態細胞,然后將其涂在氨芐板上,37 ℃溫箱內培養過夜;挑取單個白色菌落,接種到含有氨芐的LB 液體培養基,37 ℃搖床培養8 h 以上;對菌液進行RT-PCR 檢測,將陽性菌液送至生工基因公司進行測序。將測序結果拼接,采用MegAlign 軟件將檢測序列與NCBI 中發表的已知序列(表3)進行比對,并采用鄰接法(MEGA6.0 軟件)構建進化樹。

表3 不同基因型ARV 參考序列
2 結果
2.1 RT-PCR 檢測
對253 份疑似ARV 感染樣品進行RT-PCR 檢測,檢出ARV 陽性157 份,平均陽性檢出率為62.1%;6 個省份均有陽性檢出,其中山東的陽性檢出率為64.2%(68/106),福建為58.6%(34/58),江蘇為60.5%(23/38),遼寧為77.3%(17/22),安徽為55.0%(11/20),河北為44.4%(4/9)。具體檢測結果見表4、圖3。
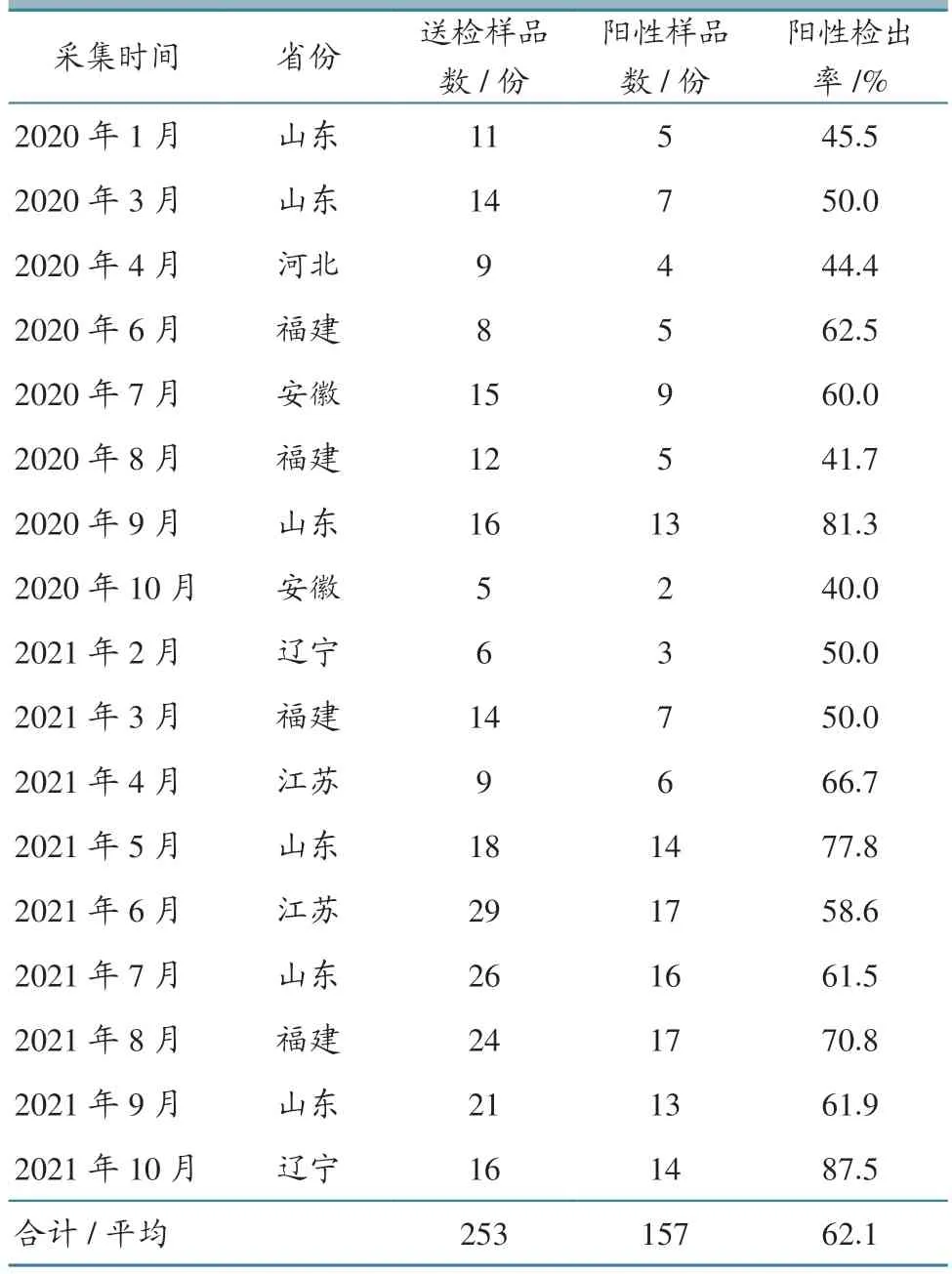
表4 2020—2021 年疑似ARV 感染樣本檢測統計結果
2.2 σC 基因分子進化分析
將157 份ARV 陽性樣本進行σC基因序列測序,然后與GenBank 上發表的ARV 參考毒株構建系統發育樹進行比對。結果顯示:157 份ARV 陽性樣本共分為6 個基因型。61 份(38.8%)屬于基因1 型,其中38 份與標準ARV 疫苗株(S1133)屬于同一亞分支,另外23 份處于單獨分支,與4599 參考株處于另一亞分支;41 份(26.11%)為基因2 型,15 份(9.6%)為基因3 型,9 份(5.73%)為基因4型,30份(19.11%)為基因5型,1份(0.64%)為基因6型。根據σC基因構建的系統發育樹見圖4。
3 討論
ARV 是無囊膜的dsRNA 病毒,其基因組由10 個節段組成。其中S1基因片段的σC基因編碼的細胞附著蛋白,是ARV的主要抗原決定簇。因此,σC基因常被用作ARV 毒株分型的依據[6]。根據σC基因不同,可將其分為6 種基因型[7]。ARV 容易變異重組。近年來,美國、巴西、日本、韓國等國家均有種雞免疫過ARV 商品化疫苗(如1133、1733、2408)但下一代雞群仍然發病的現象。國外學者對ARV 分離毒株σC基因進行分析研究發現,目前廣泛使用的商品化疫苗(如S1133、1733、2408 等)均為基因I 型,而ARV 的臨床分離株多為基因2~6 型,而且不同基因型之間的交叉保護存在較大差異[7-8]。
近年來,我國白羽肉雞群ARV 感染的發病率呈明顯上升趨勢[4],造成發病雞跛行、行走困難、撇腿等,尤其是屠宰時青腿現象異常增加,造成廢棄率升高,給養殖企業帶來了較大困擾。針對該問題,我國學者也做了相關研究[9-10],發現國內存在多種基因型ARV 流行,其與廣泛使用的經典疫苗株S1133 有較大差異。本調查對我國部分省份的157 份ARV 陽性樣品進行σC基因分析,發現6 種基因型在我國均有流行,與國內此前的研究[4,9,11-12]結論一致。本次研究還系統分析了國內部分省份的不同ARV 基因型占比,發現基因1 型、2 型、5 型占比較高。其中,基因1 型分屬于2 個不同的分支,兩分支同源性僅為73.9%~76.7%,說明我國存在基因1 型變異毒株。從以上分析結果來看,我國流行的ARV 基因型較為復雜。從送檢樣品的上游種雞群免疫背景來看,大多免疫過經典ARV 株疫苗(如S1133、2408 等),但保護效果不甚理想,說明當前的疫苗株已不能對國內流行的ARV 提供足夠的保護,需要進一步開展監測,評估病毒流行及變異情況,調整免疫策略,加快新疫苗等疫病防控新技術、新產品研發。

