山羊隱花色素2基因真核表達載體的構建及生物信息學分析
馬白榮 , 張海森,2 , 高登科,2 , 李 超,2 , 靳亞平,2 , 陳華濤,2
(1.西北農林科技大學動物醫學院 , 陜西 楊凌 712100 ; 2.西北農林科技大學動物醫學院農業農村部動物生物技術重點實驗室 , 陜西 楊凌 712100)
為了適應地球晝夜、季節等外界環境條件的周期性更替,地球上的生物隨之進化出了一系列具有周期性變化規律的內源性調控機制,這種內源性的調控機制被稱為生物鐘。狹義上的生物鐘指的是晝夜節律生物鐘(Circadian clock),它能使生物體的行為活動和生理功能表現出以近似24 h為周期的節律性變化[1]。哺乳動物的中樞生物鐘位于下丘腦視交叉上核(Suprachiasmatic nucleus,SCN),能夠同步外界光照明暗的周期性變化,將其轉換為神經內分泌信號,協調同步肝臟、骨骼肌、腎臟、心臟等組織的外周生物鐘(Peripheral clocks),以使機體的內源性節律與外界環境變化相適應[1]。哺乳動物分子生物鐘系統主要由腦肌類芳烴受體核轉位樣蛋白1(Brain and muscle aryl hydrocarbon receptor nuclear translocator-like protein 1, BMAL1)、晝夜運動輸出周期(Circadian locomotor output cycles kaput,CLOCK)蛋白、周期(Period,PER)蛋白、隱花色素(Cryptochrome,CRY)蛋白等生物鐘蛋白形成的轉錄-翻譯正負反饋環路構成,在分子水平與細胞水平呈現以近似24 h為周期的節律性振蕩[2]。
隱花色素2(Cryptochrome 2,CRY2)屬于藍光受體基因家族和光酶解家族成員,是生物鐘正負反饋環路中重要的負調節因子。細胞質中的CRY與另一負調控因子PER經過酪蛋白激酶CK1ε/δ的磷酸化修飾后進入細胞核內,抑制正調控因子BMAL1-CLOCK二聚體對下游鐘控基因的轉錄調控活性[2]。此外,CRY2在調控哺乳動物生殖和代謝穩態方面具有重要意義。研究發現,CRY2通過抑制c-Myc-BMAL1-MMP2/9通路來抑制滋養層遷移和侵襲,在胚胎著床過程中扮演重要角色[3]。小鼠在禁食狀態下,CRY蛋白通過調節環磷腺苷效應元件結合蛋白(cAMP-response element binding protein,CREB)的節律性表達和G蛋白偶聯受體的活性來調節肝臟糖異生的晝夜節律性變化[4]。研究表明,CRY2具有棕色脂肪細胞分化增強劑的作用[5],同時在維持軟骨細胞外基質穩態方面也具有重要意義[6]。
有關哺乳動物生物鐘的研究主要集中于小鼠和大鼠等嚙齒類動物,對牛羊等反芻動物的研究則相對較少。山羊作為支撐我國畜牧業發展的重要經濟動物,深入探究山羊生物鐘調控生殖和代謝等過程的具體機制對提高畜牧生產效益至關重要。然而,山羊生物鐘的分子調控機制目前尚不清楚,有待進一步研究。本試驗旨在克隆山羊CRY2基因編碼序列(Coding sequence,CDS)并構建其真核表達載體,利用生物信息學軟件分析和預測CRY2基因及其編碼蛋白的基本理化特性,為后續探究山羊生物鐘的生物學功能提供前期基礎和關鍵材料。
1 材料與方法
1.1 主要試劑 DMEM培養基,購自美國Hyclone公司;胎牛血清和0.25%胰蛋白酶,均購自美國Gibco公司;無內毒素小提中量試劑盒和DNA純化回收試劑盒,均購自北京天根生化科技有限公司;Total RNA提取試劑盒和QuickCutEcoR I,均購自日本TaKaRa公司;反轉錄試劑盒、高保真PCR用DNA聚合酶和SYBRPremixExTaqTMII試劑盒,均購自日本ToYoBo公司;ClonExpress?II One Step Cloning Kit,購自南京諾唯贊生物科技股份有限公司;瓊脂糖,購自美國HydraGene公司;蛋白提取試劑,購自上海碧云天生物技術有限公司;BCA蛋白濃度檢測試劑盒,購自江蘇凱基生物公司;兔抗CRY2多克隆抗體,購自美國Abcam公司;鼠抗β-actin抗體,購自中國三箭公司;HRP共軛羊抗兔抗體,購自中國中杉金橋公司。
1.2 主要儀器 CO2細胞培養箱和核酸蛋白濃度檢測儀,均購自美國ThermoFisher公司;倒置熒光顯微鏡,購自日本Nikon公司;CFX-96型熒光定量PCR儀、普通PCR儀和電泳儀,均購自美國Bio-Rad公司;凝膠成像系統,購自英國Syngene公司。
1.3 組織樣本、質粒、菌種與細胞 山羊卵巢組織取自楊凌區楊沛屠宰場。pcDNA3.1-Puro-N-3HA質粒,購自美國Promega公司。大腸桿菌DH5α感受態細胞,購自北京天根生化科技有限公司。人體腎臟細胞系HEK293T細胞,由中國科學院細胞庫提供。
1.4 試驗方法
1.4.1 山羊卵巢組織總RNA的提取及cDNA的合成 稱取20 mg山羊卵巢組織置于離心管中,加入TRIzol裂解液,采用酚-氯仿抽提法提取總RNA,測定濃度后按照試劑盒說明書將其反轉錄為cDNA。反應體系(10 μL):模板總RNA 5 μL,5×RT Master Mix 2 μL,去離子水3 μL。反應程序:37 ℃,15 min;50 ℃,5 min;98 ℃,5 min。將獲得的cDNA置于-20 ℃保存備用。
1.4.2 引物的設計與合成 根據NCBI數據庫中山羊CRY2基因(XM_018059193.1)的CDS區信息,使用Primer Premier 5.0軟件進行引物設計,設計完成后添加同源臂(小寫字母),即在CRY2的上下游PCR擴增引物的5′端分別加上與pcDNA3.1-Puro-N-3HA載體的酶切位點互補配對的同源序列(下劃線表示EcoR I酶切位點),Primer F:agcaagctttcta-gagaattcATGGCGGCGGCGGCAGCGGCGA,Primer R:accggatccgatatcgaattcTCAGACGCCCCTGCTCGGCAGT,引物由西安擎科生物科技有限公司合成。
1.4.3 山羊CRY2基因CDS區的克隆 以卵巢組織的cDNA為模板,通過PCR反應擴增帶有同源臂的山羊CRY2基因的CDS區。PCR擴增體系(50 μL):cDNA模板4 μL(50 ng/μL)、上下游引物各1 μL(10 μmol/L),預混液25 μL,添加ddH2O補至50 μL。PCR反應程序:98 ℃預變性5 min;98 ℃變性10 s,55 ℃退火15 s,72 ℃延伸105 s,循環35次;72 ℃總延伸5 min。將PCR產物進行瓊脂糖凝膠電泳,并利用普通瓊脂糖凝膠DNA回收試劑盒對符合預期的條帶進行膠回收。
1.4.4 山羊CRY2基因真核表達載體的構建及鑒定 利用限制性內切酶EcoR I對空載體pcDNA3.1-Puro-N-3HA進行單酶切,經核酸電泳鑒定后,通過膠回收試劑盒回收線性化載體片段。根據同源重組試劑盒說明書,按照一定比例將線性化載體片段與帶有同源臂的目的基因片段混合,37 ℃反應30 min獲得重組質粒。反應體系(20 μL):線性化載體0.88 μL(71.64 ng),目的基因片段1.36 μL(104.22 ng),5×Buffer 4 μL,ExnaseⅡ 2 μL,ddH2O 11.76 μL。將重組質粒轉化大腸桿菌DH5α感受態細胞中,涂板培養后挑取單克隆菌落,在37 ℃條件下搖菌12 h,使用無內毒素質粒小提中量試劑盒提取重組質粒,并對獲得的重組質粒進行酶切鑒定,經公司測序后將得到的陽性質粒命名為pcDNA3.1-3HA-gCRY2。
1.4.5 重組質粒轉染HEK293T細胞 復蘇凍存的HEK293T細胞并進行傳代培養,將細胞以密度1×106個/皿接種到60 mm培養皿中,待細胞密度達60%時,使用Turbofect轉染試劑將pcDNA3.1-3HA-gCRY2和pcDNA3.1-Puro-N-3HA空質粒分別轉染至HEK293T細胞中,轉染48 h后分別收取細胞樣品用于RNA和蛋白提取,檢測山羊CRY2基因在HEK293T細胞中的表達變化。
1.4.6 實時熒光定量PCR檢測山羊CRY2基因在mRNA水平的表達 轉染HEK293T細胞48 h后,分別提取pcDNA3.1-3HA-gCRY2轉染組和pcDNA3.1-Puro-N-3HA轉染組HEK293T細胞的總RNA,反轉錄合成cDNA,按照實時熒光定量PCR(qPCR)試劑盒說明書配制反應體系并完成上機檢測。qPCR反應體系(20 μL):cDNA 4 μL,PremixExTaqII 10 μL,上下游引物各 1 μL,ddH2O補至20 μL。反應程序:95 ℃預變性3 min;95 ℃變性10 s,60 ℃延伸30 s,共40個循環;95 ℃變性15 s,60 ℃延伸15 s,95.5 ℃變性5 s。根據引物設計原則,使用Primer Premier 5.0設計出能同時擴增山羊和人CRY2基因CDS區的qPCR引物,以人的GAPDH作為內參基因,引物序列見表1,采用2-ΔΔCt相對定量法對樣品的Ct值進行定量分析。

表1 引物序列信息Table 1 Primer details
1.4.7 蛋白質免疫印跡(Western blot,WB)檢測山羊CRY2基因在蛋白水平的表達 轉染48 h后,分別提取pcDNA3.1-3HA-gCRY2轉染組和pcDNA3.1-Puro-N-3HA轉染組HEK293T細胞的總蛋白,使用BCA檢測試劑盒測定其蛋白濃度,并將其與上樣緩沖液混勻,煮沸10 min進行蛋白變性以獲得蛋白上樣樣品。WB的操作步驟:配制10%分離膠與5%濃縮膠,置于電泳槽后拔出梳子,從左到右依次加入蛋白Marker和20 μg蛋白樣品進行SDS-PAGE;電泳結束后將蛋白轉移至硝酸纖維素(PVDF)膜,10%脫脂奶粉中封閉2 h,TBST溶液洗滌4次,每次5 min;4 ℃過夜孵育一抗,TBST溶液洗滌4次,每次5 min;室溫下孵育二抗2 h,TBST溶液洗滌4次,每次5 min;將PVDF膜浸泡于配制好的ECL顯色液中,利用G:BOX凝膠成像系統曝光,拍照并記錄結果。
1.4.8 生物信息學分析 利用NCBI數據庫查找并下載山羊(Caprahircus)、小鼠(Musmusculus)、大鼠(Rattusnorvegicus)、人類(Homosapiens)、黑猩猩(Pantroglodytes)、綿羊(Ovisaries)、牛(Bostaurus)、馬(Equuscaballus)、雞(Gallusgallus)和斑馬魚(Daniorerio)CRY2基因的CDS區,利用DNASTAR軟件分析各物種CRY2基因CDS區的序列相似性,并應用MEGA 7軟件構建系統進化樹;利用ExPASy在線軟件分析山羊CRY2蛋白的分子質量、分子式、等電點、氨基酸數目、半衰期和不穩定系數等理化性質;利用ProtScale在線軟件預測山羊CRY2蛋白氨基酸序列的親疏水性;分別使用SingalP 5.0和TMHMM-2.0在線工具預測山羊CRY2蛋白氨基酸序列的信號肽區域和跨膜區域;通過SOPMA和SWISS-MODEL在線軟件分析預測山羊CRY2蛋白的二級結構和三級結構,并使用STRING工具分析相互作用蛋白。生物信息學相關軟件網址及數據庫見表2。
表2 生物信息學分析在線軟件Table 2 Online software for bioinformatics analysis
1.5 統計學分析 試驗結果以平均值±標準誤方式表示。采用GraphPad Prism 6.0軟件對試驗數據進行統計學分析,使用t檢驗進行差異顯著性檢驗。P<0.05表示差異顯著,P<0.01表示差異極顯著。
2 結果
2.1 山羊CRY2基因CDS區的成功克隆 以山羊卵巢的cDNA為模板,通過PCR擴增獲得CRY2基因帶有同源臂的CDS區片段(山羊CRY2基因CDS區為1 791 bp,上下游引物5′端同源臂42 bp),瓊脂糖凝膠電泳結果如圖1所示,可見一清晰明亮的條帶,條帶大小與預期結果相符(1 833 bp)。
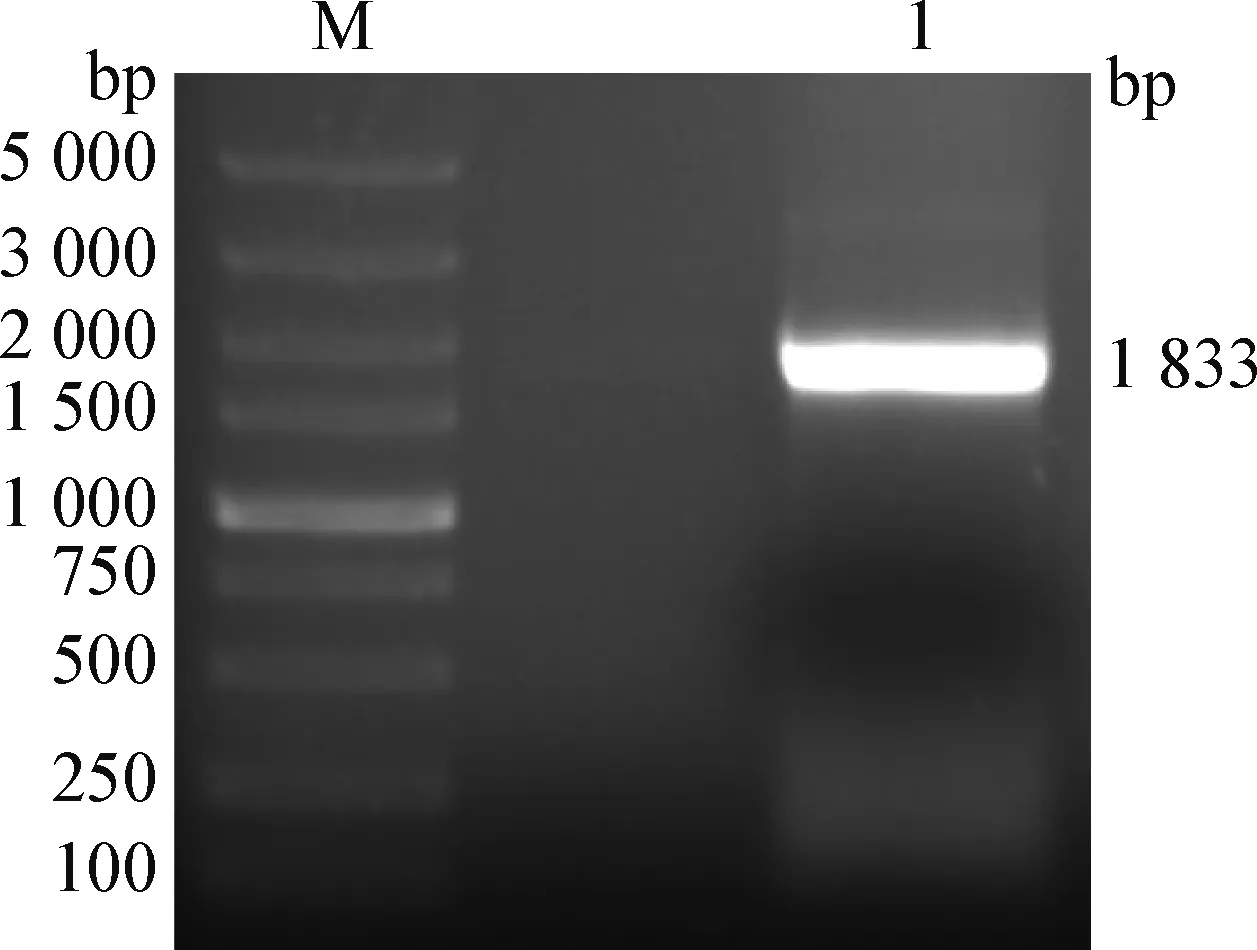
圖1 山羊CRY2基因CDS區的PCR擴增Fig.1 PCR amplification of goat CRY2 gene CDS regionM:DNA分子量標準; 1:PCR擴增產物M:DL5 000 DNA Marker; 1:PCR amplification product
2.2 山羊CRY2基因真核表達載體的成功構建 使用EcoRⅠ酶對pcDNA3.1-Puro-N-3HA空載體和pcDNA3.1-3HA-gCRY2重組質粒進行酶切,并以pcDNA3.1-3HA-gCRY2為模板擴增CRY2基因的CDS區片段,分別將以上獲得的3種產物按順序加樣進行瓊脂糖凝膠電泳。結果如圖2所示,酶切后pcDNA3.1-Puro-N-3HA空載體與pcDNA3.1-3HA-gCRY2重組質粒的第1條帶位置相同(5 211 bp);酶切后pcDNA3.1-3HA-gCRY2的第2條帶與以pcD-NA3.1-3HA-gCRY2為模板擴增獲得的目的基因的條帶大小相同(1 791 bp)。將鑒定正確的重組質粒送至公司測序,測序結果與NCBI數據庫中XM_018059193.1序列信息完全一致。上述結果表明,pcDNA3.1-3HA-gCRY2真核表達載體構建成功。
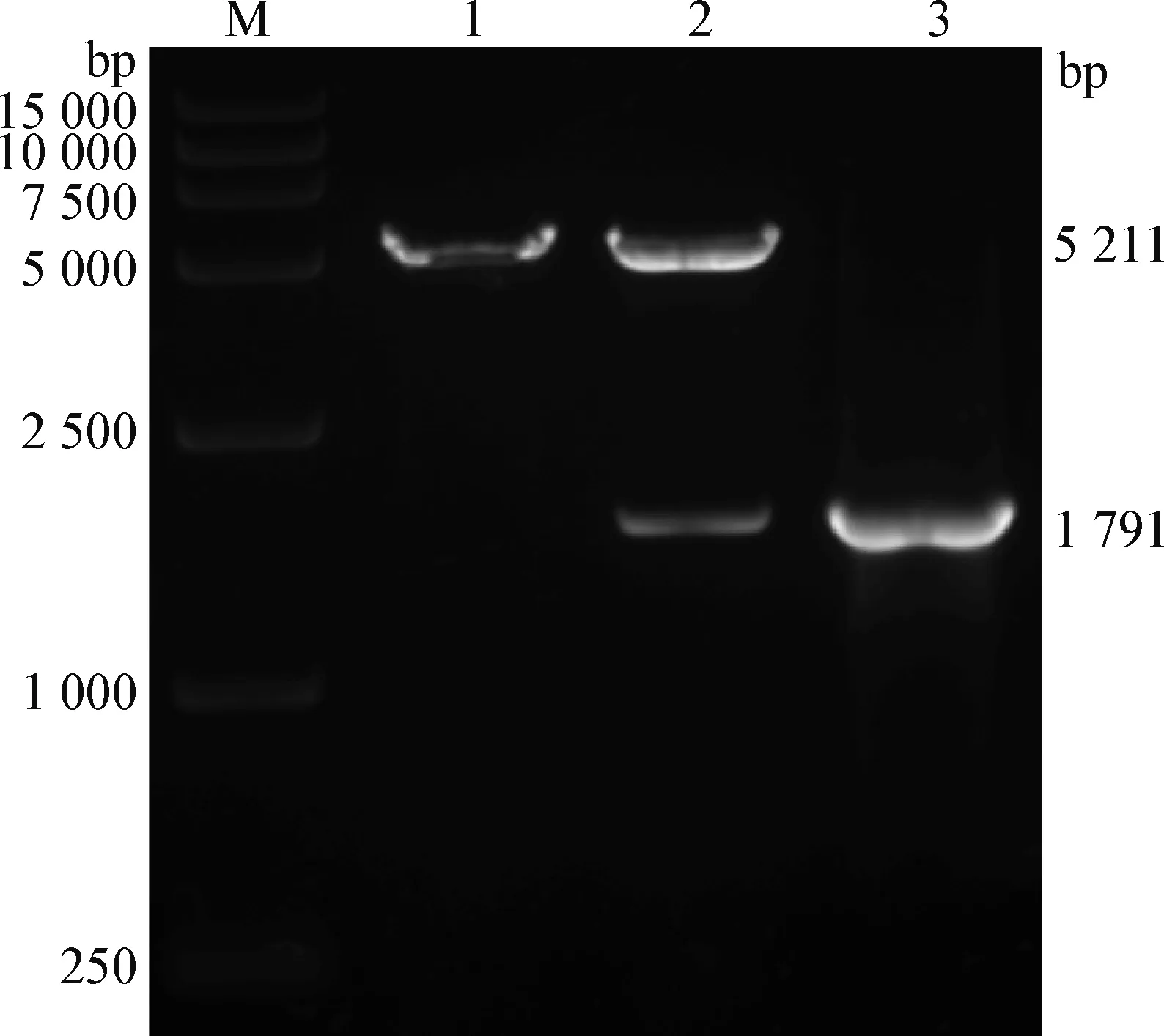
圖2 酶切鑒定結果Fig.2 Results of enzymatic identificationM:DNA分子量標準; 1:pcDNA3.1-Puro-N-3HA酶切產物; 2:pcDNA3.1-3HA-gCRY2酶切產物; 3:PCR產物M:DL15 000 DNA Marker; 1:Restriction enzyme digested product of pcDNA3.1-Puro-N-3HA; 2:Restriction enzyme digested product of pcDNA3.1-3HA-gCRY2; 3:PCR product
2.3 山羊CRY2基因在HEK293T細胞中的過表達 將空載體和重組質粒轉染至HEK293T細胞,分別使用qPCR和WB方法檢測CRY2基因在mRNA和蛋白水平的表達變化。與pcDNA3.1-Puro-N-3HA轉染組相比,pcDNA3.1-3HA-gCRY2轉染組中山羊CRY2基因的mRNA相對表達水平升高約600倍(P<0.001)(圖3A)。同時,WB檢測到CRY2-3HA融合蛋白在pcDNA3.1-3HA-gCRY2轉染組中的表達,而在pcDNA3.1-Puro-N-3HA轉染組中未檢測到條帶(圖3B)。
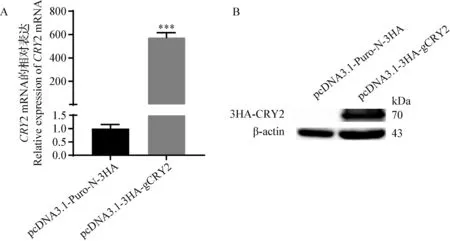
圖3 山羊CRY2基因在mRNA(A)和蛋白(B)水平的表達變化Fig.3 Relative changes of goat CRY2 gene expression at mRNA and protein levels*** :P<0.001
2.4CRY2基因在不同物種間的序列相似性比對及系統進化樹構建 不同物種CRY2基因CDS區的相似性比對結果如圖4A所示,山羊的CDS區與人類、黑猩猩、牛、馬、小鼠和大鼠的相似性分別為90.7%、90.5%、93.4%、92.0%、86.5%和86.5%,與綿羊的相似性高達99.2%,而與雞和斑馬魚的相似性分別為77.1%和68.9%。系統進化樹結果如圖4B所示,山羊CRY2基因與綿羊、牛、馬的遺傳距離最近,與雞和斑馬魚的遺傳距離最遠。
2.5 山羊CRY2蛋白的理化性質 ExPASy在線工具分析結果顯示,山羊CRY2蛋白的理論分子量為66 804.33 Da,分子式為C2 999H4 636N844O847S23,由596個氨基酸組成。各種氨基酸的數量及其出現的頻率如表3所示,其中出現頻率較高的氨基酸依次為Ala(10.2%)、Leu(9.9%)、Arg(8.4%)和Ser(8.4%)。山羊CRY2蛋白氨基酸序列的理論等電點(pI)為8.90,半衰期為30 h,不穩定系數為48.87,屬于不穩定蛋白。使用ProtScale在線軟件分析氨基酸序列的親疏水性,結果如圖5所示,山羊CRY2蛋白氨基酸序列大部分位于親水區域,故推測該蛋白為親水性蛋白,其中位于序列第522位和第525位的氨基酸疏水性最強,分數均為1.900,位于序列第446位的氨基酸親水性最強,分數為-2.311。
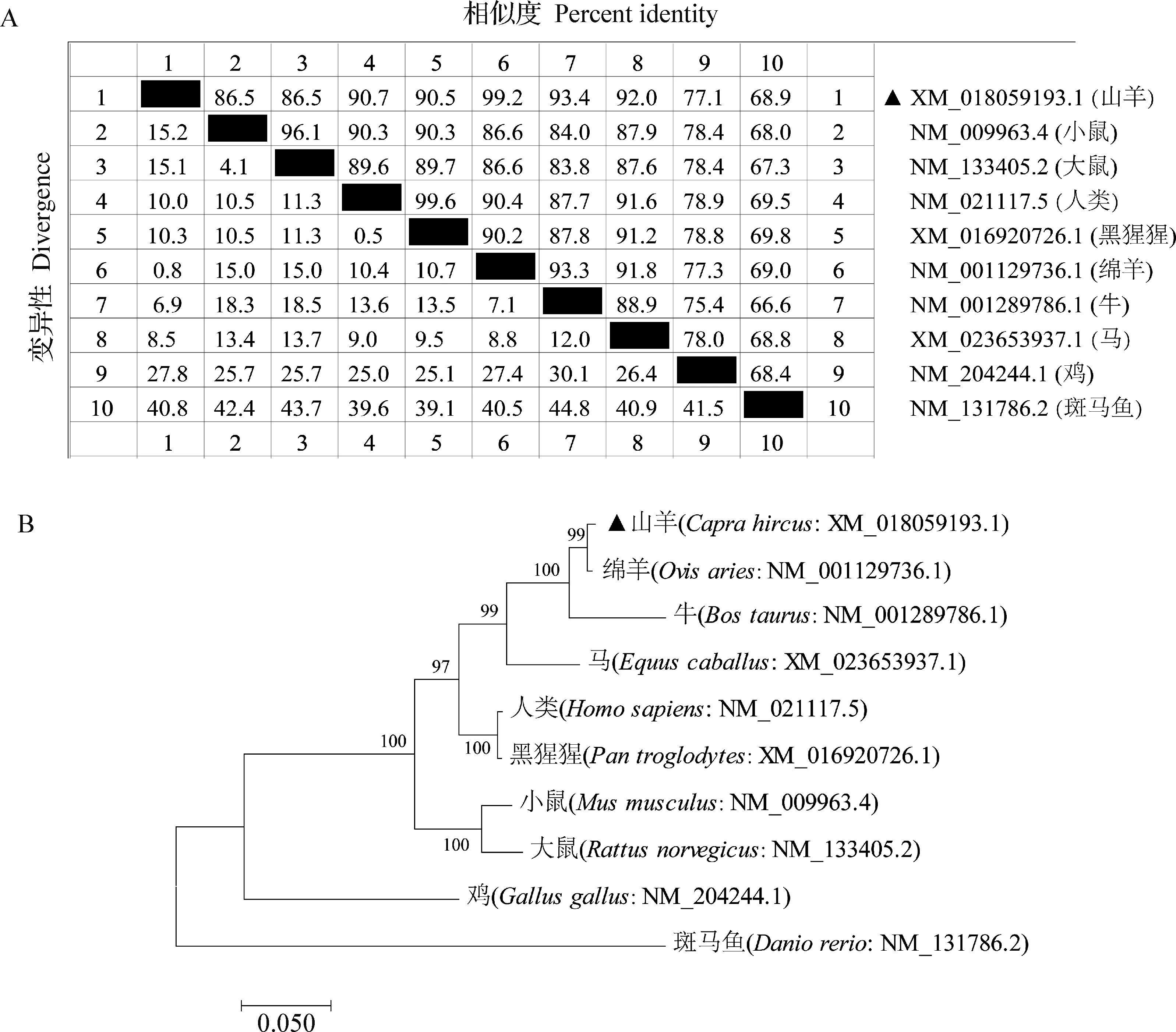
圖4 不同物種間CRY2基因CDS區序列相似性比對(A)和系統進化樹構建(B)Fig.4 Sequence similarity comparison (A) and construction of phylogenetic trees (B) of CRY2 CDS region in different species▲:本試驗獲得的山羊CRY2基因▲:Goats CRY2 gene obtained in this study
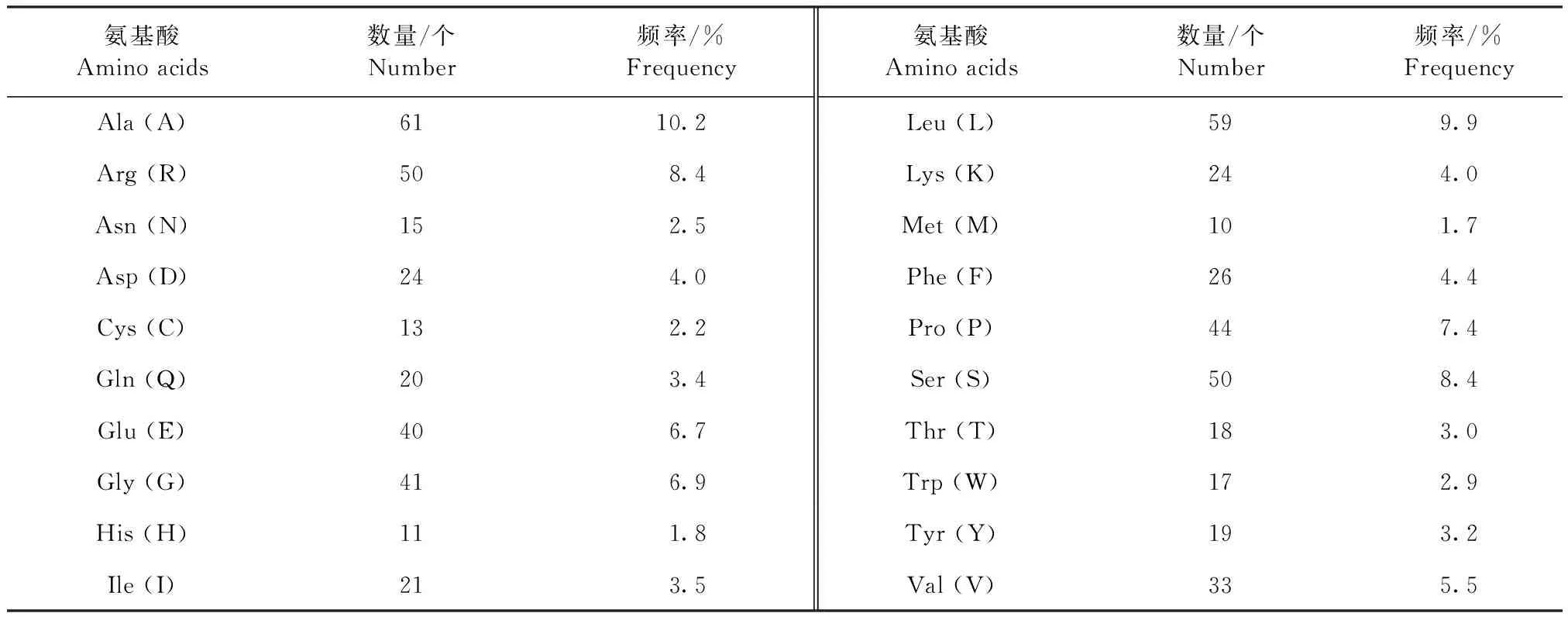
表3 山羊CRY2蛋白的氨基酸組成Table 3 Amino acid composition of goat CRY2 protein
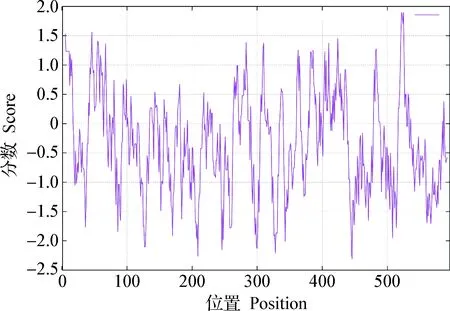
圖5 山羊CRY2蛋白的親疏水性預測Fig.5 Hydrophilicity and hydrophobicity prediction of goat CRY2 protein
2.6 山羊CRY2蛋白的信號肽及跨膜區域預測 利用SingalP 5.0在線軟件預測山羊CRY2蛋白的信號肽區域,結果顯示,該蛋白不存在信號肽。利用TMHMM-2.0在線軟件對山羊CRY2蛋白進行跨膜區域預測,山羊CRY2蛋白不存在跨膜區。
2.7 山羊CRY2蛋白的二/三級結構預測 使用SMOPA在線分析軟件對山羊CRY2蛋白進行二級結構預測,結果如圖6A所示,該蛋白二級結構主要包含α-螺旋、β-轉角、延伸鏈和無規卷曲,占比分別為38.26%、5.20%、9.90%和46.64%,其中無規卷曲占比最多。此外,使用同源建模法(SWISS-MODEL軟件)對山羊CRY2蛋白的三級結構進行預測,選擇模型質量評估得分最高的模型,結果如圖6B所示。
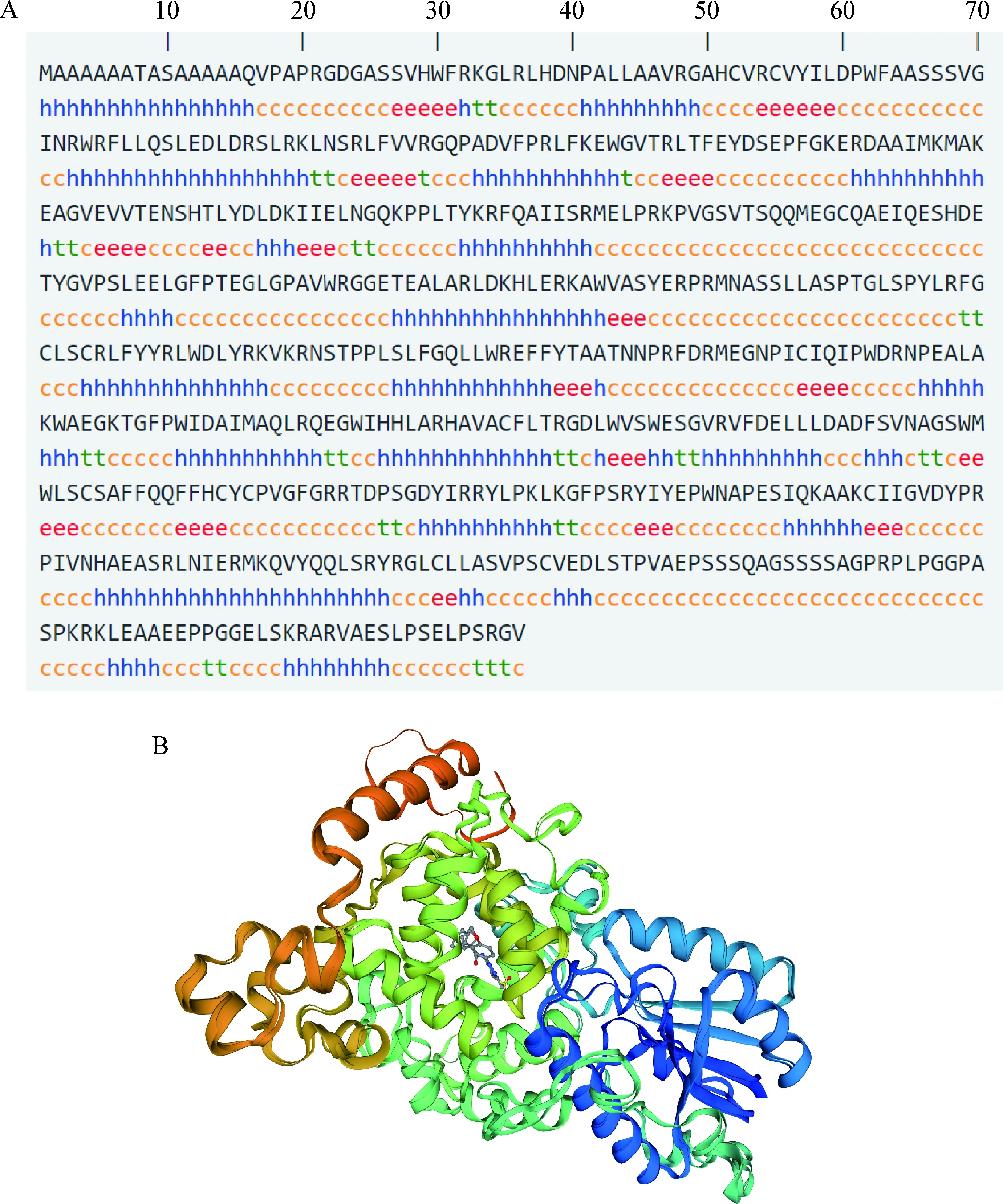
圖6 山羊CRY2蛋白的二級結構(A)和三級結構(B)預測Fig.6 Prediction of secondary structure (A) and tertiary structure (B) of goat CRY2 protein
2.8 山羊CRY2的互作蛋白預測 使用STRING在線數據庫預測山羊CRY2的互作蛋白,預測結果如圖7所示,主要包括ARNTL、PER2、FBXL3、PER1、CLOCK、ENSCHIP00000026821、NR1D1、NPAS2、CSNK1D和BHLHE41。
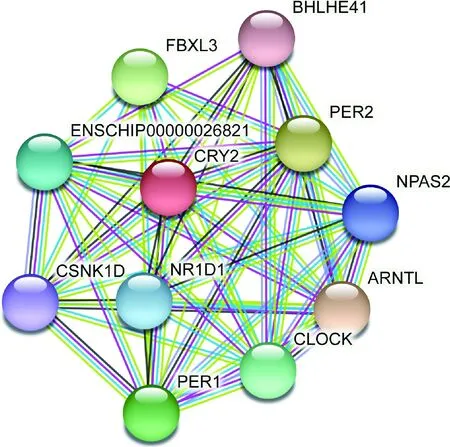
圖7 山羊CRY2蛋白的互作蛋白網絡Fig.7 Interactive protein networks of goat CRY2 proteinARNTL:芳香烴受體核轉位體樣蛋白; PER2:周期蛋白2; FBXL3:F-box和富含亮氨酸的重復蛋白3; PER1:周期蛋白1;CLOCK:晝夜運動輸出周期蛋白; ENSCHIP00000026821:含蛋白激酶域的蛋白質,屬于蛋白激酶超家族;NR1D1:核受體家族1 D組成員1; NPAS2:神經元PAS結構域蛋白2;CSNK1D:酪蛋白激酶1δ,屬于蛋白激酶超家族;BHLHE41:基本螺旋-環螺旋家族成員e41ARNTL:Aryl hydrocarbon receptor nuclear translocator-like protein;PER2:Period circadian regulator 2; FBXL3:F-box and leucine rich repeat protein 3; PER1:Period circadian regulator 1; CLOCK:Circadian locomotor output cycles kaput; ENSCHIP00000026821:Protein kinase domain-containing protein,belong to the protein kinase superfamily; NR1D1:Nuclear receptor subfamily 1 group D member 1; NPAS2:Neuronal PAS domain protein 2; CSNK1D:Casein kinase 1δ,belongs to the protein kinase superfamily; BHLHE41:Basic helix-loop-helix family member e41
3 討論
生物鐘是地球上的生物為適應外界環境條件的周期性變化所產生的一種內源性調控機制,可以接收來自環境中的光照、溫度以及進食等周期性變化信號,以協調機體能量代謝、激素分泌、血壓、睡眠等與環境變化相適應[7-8]。哺乳動物分子生物鐘由BMAL1、CLOCK、CRY1/2、PER1/2/3、RORs、REV-ERBs等核心生物鐘基因共同構成的正反饋回路組成,其中,BMAL1-CLOCK異源二聚體進入細胞核內與PERs和CRYs基因啟動子區域的E-box結合,促進PERs和CRYs基因的轉錄激活與翻譯;當細胞質中的PERs和CRYs蛋白積累到一定程度時,進入細胞核后通過抑制BMAL1-CLOCK異二聚體的轉錄活性進而抑制其自身的轉錄,從而形成一個負反饋回路。此外,核受體RORs和REV-ERBs可以結合到BMAL1啟動子區域的RORE位點,分別激活和抑制BMAL1的轉錄[2]。
前期研究發現,CRY2等核心生物鐘基因在哺乳動物卵巢中呈現節律性表達,在下丘腦—垂體—性腺軸調控激素釋放和靶組織敏感性等進程中發揮重要作用[9-10]。在中樞生物鐘SCN中,精氨酸加壓素(Arginine vasopressin)的表達受BMAL1-CLOCK二聚體調控,而精氨酸加壓素與雌激素協同刺激Kisspeption神經元,進而興奮GnRH神經元,從而通過垂體—門脈系統調控黃體生成素(Luteinizing hormone,LH)和促卵泡激素(Follicular stimulating hormone,FSH)的釋放[11]。在卵巢中,卵泡膜細胞、顆粒細胞和卵母細胞均存在生物鐘基因的表達。在大鼠卵巢中,生物鐘基因的表達受卵泡發育階段影響,發育早期的卵泡未檢測到生物鐘基因的節律性表達,當卵泡發育到竇狀卵泡后和成熟卵泡時,其生物鐘基因表達則會表現出節律性變化[12-13]。在發育到竇狀卵泡期之后的小鼠卵泡中,白天BMAL1和CLOCK的表達水平較高,夜間PER1、PER2、CRY1和CRY2的表達水平較高[14]。此外,在人和小鼠的成熟卵泡顆粒細胞中,StAR、CYP11A1、CYP19A1、HSD3B2等類固醇生成基因的表達都具有晝夜節律性變化[15-17]。上述研究結果表明,CRY2等生物鐘基因在嚙齒動物和人類的生殖內分泌調控、卵泡發育和類固醇激素合成過程中發揮重要作用,但其調控牛羊等反芻動物生理功能的作用機制尚不清楚,有待進一步的深入研究。
前期研究發現,羊卵巢中的BMAL1、CLOCK、CRYs等核心生物鐘基因的表達具有顯著的晝夜節律性變化[18],且持續黑暗誘導的生物鐘紊亂會改變母羊和胎羊的促卵泡激素、黃體生成素、孕酮和雌二醇的分泌[19]。本課題組前期研究發現,山羊CLOCK基因和BMAL1基因在山羊睪丸間質細胞具有節律性表達,并構建了山羊CLOCK基因和BMAL1基因的真核表達載體,隨后通過BMAL1 siRNA干擾和BMAL1過表達等技術證明了生物鐘基因BMAL1通過調節山羊睪丸間質細胞中的類固醇生成相關基因的轉錄來調控睪酮的產生[20-21]。然而,目前關于山羊CRY2的生理功能及其在分子生物鐘的具體作用機制仍不清楚,有待進一步探究。本試驗利用山羊卵巢組織的cDNA,克隆了CRY2基因的CDS區,成功構建了pcDNA3.1-3HA-gCRY2真核表達載體,并在HEK293T細胞中驗證了其表達。HEK293T細胞作為一種質粒輔助細胞,可以使帶有SV40啟動子的pcDNA3.1質粒具有較高的表達效率[22-23]。本試驗將山羊的CRY2基因的CDS區片段克隆至pcDNA3.1載體,并將重組質粒轉染至HEK293T細胞,最終實現CRY2基因的高效表達。生物信息學分析發現,山羊CRY2基因CDS區與人和小鼠相比,具有較高的保守性和同源性,表明山羊CRY2基因可能存在與人和小鼠相似的生理功能。蛋白互作分析預測結果顯示,山羊CRY蛋白主要與ARNTL、PER2、FBXL3、PER1和CLOCK等蛋白存在相互作用。而在小鼠的研究中發現,CRYs蛋白和PERs蛋白主要作為抑制因子抑制ARNTL、CLOCK對一些生物鐘控制基因的轉錄激活作用,FBXL3可以促使CRY2蛋白發生泛素化并使其降解[24]。由此推測,在山羊生物鐘的分子調控網絡中,CRY2蛋白與其他蛋白之間的互作可能與小鼠類似,但具體的作用機制有待進一步的探究。
本試驗成功克隆了山羊CRY2基因的CDS區,采用同源重組方法構建了pcDNA3.1-3HA-gCRY2真核表達載體,并在HEK293T細胞中實現山羊CRY2蛋白的過表達,對山羊CRY2蛋白的基本理化特性進行了初步預測,為進一步探究山羊生物鐘系統的調控機制提供了科學依據。

