黃芩苷銅的優化合成及其對豬源大腸桿菌K88的抗菌作用
吳仲元 , 師亞倩 , 周華林 , 曹晨晨 , 邱銀生
(1.武漢輕工大學動物科學與營養工程學院 , 湖北 武漢 430023 ; 2.襄陽職業技術學院農學院 , 湖北 襄陽 441050)
中藥黃芩能有效防治豬敗血癥,清除豬血液內有毒物質,抑制菌血癥的發生[1]。黃芩苷是黃芩的主要成分,是重要的黃酮類化合物。黃芩苷及其復方制劑已被廣泛應用于養殖業,具有清熱解毒、提高機體免疫力、抗炎抑菌、抗應激和改善生產性能等多種作用[2-3]。黃酮類化合物與金屬離子形成配合物后抗菌活性明顯增強,備受研究人員關注[4]。前期研究發現,黃芩苷金屬配合物對革蘭陽性菌、革蘭陰性菌和真菌的抑制作用比黃芩苷更強[5-6]。
為制備抗菌效果好的黃芩苷銅配合物,本試驗采用正交試驗設計優化黃芩苷銅的合成工藝,并分析其對大腸桿菌(Escherichiacoli,E.coli)K88的不耐熱腸毒素(Heat-labile enterotoxin,LT)的釋放量和超微結構的影響。
1 材料與方法
1.1 主要試驗材料 黃芩苷(92%),購自四川協力制藥有限公司;黃芩苷標準品(93.5%,批號:110715-201619),購自中國藥品生物制品檢定所;豬源大腸桿菌不耐熱腸毒素(LT)試劑盒,購自上海藍基有限公司;五水硫酸銅和碳酸氫鈉,均購自天津市凱通化學試劑有限公司;乙腈、甲醇和磷酸(均為色譜純),均購自天津科密歐化學試劑有限公司;大腸桿菌K88,由動物營養與飼料科學湖北省重點實驗室提供。
1.2 主要儀器 精密分析天平(BS 110S,北京賽多利斯儀器系統有限公司);微型渦旋混合儀(FW 80,上海滬西分析儀器廠有限公司);高效液相色譜儀(Waters,美國 Waters 公司);掌上離心機(D1008E,SCI LOGEX 公司);倒置熒光顯微鏡(Moticam 3000,MOTIC 公司);原子吸收分光光度計(AAS-6000,江蘇天瑞儀器股份有限公司);微量移液器(Eppendorf 公司);掃描電鏡(Hitachi U8010,日本日立儀器有限公司);多功能酶標儀(SpectraMax M2e 型,Molecular Devices 公司)。
1.3 試驗方法
1.3.1 正交試驗設計優化黃芩苷銅的合成工藝條件 根據單因素試驗結果,選取反應時間(A)、反應溫度(B)、碳酸氫鈉/黃芩苷的摩爾比(C)和五水硫酸銅/黃芩苷的摩爾比(D)4個因素,以轉化率為指標,設計L9(34)正交試驗因素水平,見表1。
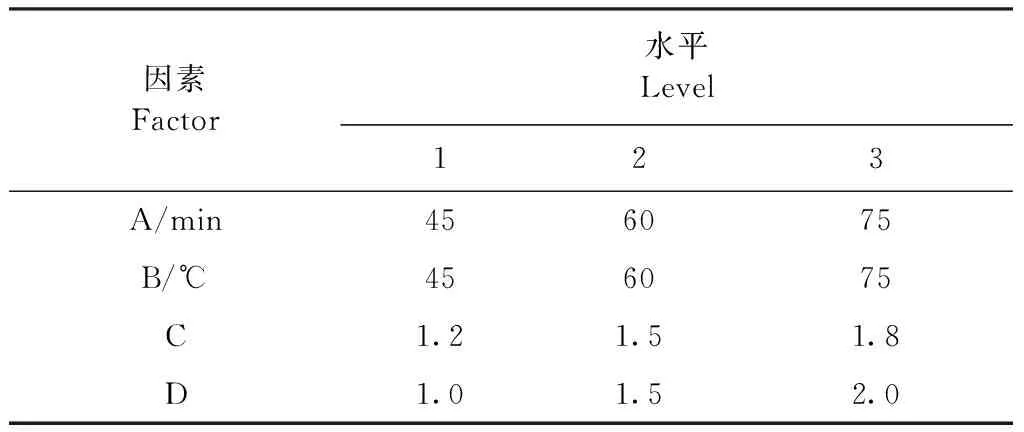
表1 正交試驗因素水平Table 1 Factors and levels for orthogonal test
1.3.2 黃芩苷銅對大腸桿菌 K88腸毒素釋放量的測定 本課題組前期試驗(未發表)測得黃芩苷銅對大腸桿菌 K88的最小抑菌濃度(MIC)為750 μg/mL,K88在生長過程中只分泌不耐熱 LT 腸毒素,不分泌耐熱 STa 腸毒素。本試驗設置5個組:空白對照組以及750、375、187.50 μg/mL和93.75 μg/mL濃度黃芩苷銅處理組,分別對大腸桿菌K88菌液進行處理,恒溫培養箱中孵育6 h 后取出菌液,移至1.5 mL 離心管中,離心15 min(2 500 r/min、4 ℃),取上清液于-20 ℃冰箱保存備用。按照ELISA試劑盒說明書操作方法檢測細菌培養上清液中豬源大腸桿菌 LT的釋放量。
1.3.3 黃芩苷銅處理前后大腸桿菌 K88細胞超微結構變化觀察 基于1.3.2試驗結果,設置空白對照組和375 μg/mL濃度黃芩苷銅處理組,通過掃描電鏡觀察豬源大腸桿菌 K88細胞超微結構的變化。
1.3.4 統計分析 采用SPSS 19.0統計軟件進行正交試驗設計和方差分析。P<0.05表示主效應差異顯著,P>0.05表示主效應差異不顯著。
2 結果
2.1 正交試驗
2.1.1 正交試驗安排及結果 由表2可知,r最小值為1.63,即因素反應溫度(B)對試驗的影響最為不顯著,r值由大到小順序為rC>rA>rD>rB,可知4種因素對黃芩苷銅轉化率的影響大小程度依次為C>A>D>B;最佳合成工藝為A3B2C1D2,即6.2 mmoL 黃芩苷加入水中,加熱,60 ℃時滴加7.44 mmoL碳酸氫鈉水溶液,攪拌加入9.3 mmoL 五水硫酸銅水溶液,反應75 min,加入甲醇攪拌得黃芩苷銅。
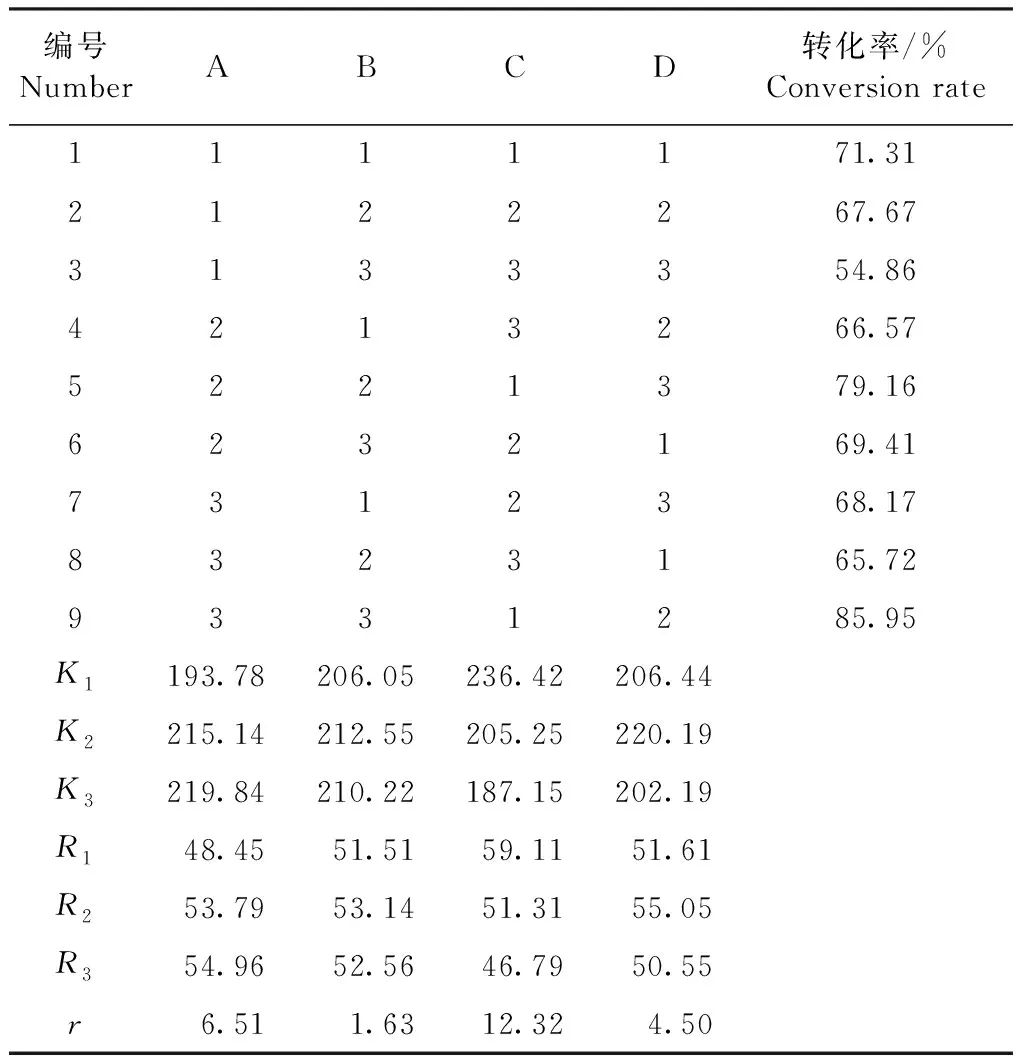
表2 正交試驗安排及結果Table 2 Design and results of orthogonal test
2.1.2 試驗數據驗證 按篩選得到的最佳合成工藝進行3次驗證試驗,得到的轉化率分別為87.61%、89.91%和88.76%。
2.2 黃芩苷銅對豬源大腸桿菌 K88的作用
2.2.1 黃芩苷銅對豬源大腸桿菌LT釋放量的影響 經不同濃度的黃芩苷銅處理6 h后,大腸桿菌 K88培養上清液中LT釋放情況如圖1所示,與空白對照組相比,375 μg/mL 和750 μg/mL 濃度黃芩苷銅處理組分別顯著(P<0.05)和極顯著(P<0.01)抑制K88中LT的釋放,表現為直接的抗毒素作用;而187.50 μg/mL 和93.75 μg/mL濃度黃芩苷銅處理組不能顯著抑制LT的釋放(P>0.05)。
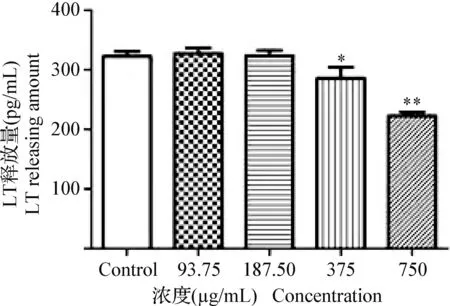
圖1 不同濃度黃芩苷銅對LT釋放量的影響Fig.1 Effect of different concentrations of baicalin-copper on release of LT與空白對照組比較,*:P<0.05;** :P<0.01Compared with the blank control group,*:P<0.05;** :P<0.01
2.2.2 黃芩苷銅對大腸桿菌 K88超微結構的影響 由圖2可知,空白對照組豬源大腸桿菌K88細胞壁完整,胞漿充足,生長狀況良好,而375 μg/mL濃度黃芩苷銅處理組大腸桿菌出現了明顯的細胞質流失,可發現已死亡的細菌。
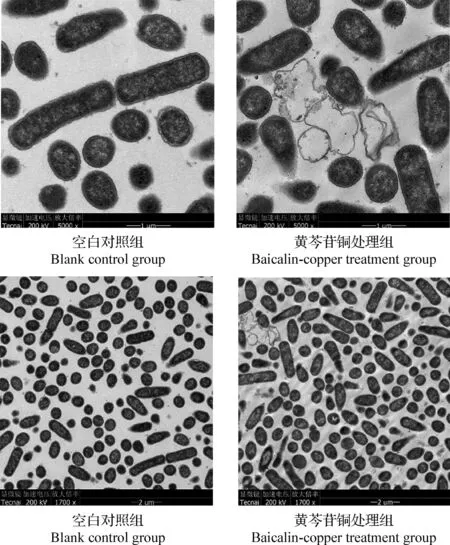
圖2 黃芩苷銅處理前后大腸桿菌 K88超微結構的變化Fig.2 Ultrastructural changes of Escherichia coli K88 before and after baicalin-copper treatment
3 討論
3.1 黃芩苷銅合成工藝參數優化 本試驗采用正交試驗設計進行工藝參數優化,該方法只需安排少量試驗,即可分析出影響試驗規律的主次因素,統計分析可以迅速簡捷分析出合成工藝中的優化條件[7]。在獸用藥品研究中有應用正交試驗設計對中獸藥進行提取優化的報道[8],而進行中獸藥化學正交試驗設計及數據處理的案例極少,具有推廣和普及價值。
本試驗嘗試進行正交試驗設計,優化黃芩苷銅合成工藝參數。試驗選取反應時間(A)、反應溫度(B)、碳酸氫鈉/黃芩苷的摩爾比(C)和五水硫酸銅/黃芩苷的摩爾比(D)4個因素,以轉化率為指標,設計L9(34)正交試驗,優選出的最佳合成工藝為:6.2 mmoL 黃芩苷加入水中,加熱,60 ℃時滴加7.44 mmoL 碳酸氫鈉水溶液,攪拌加入9.3 mmoL 五水硫酸銅水溶液,反應75 min,加入甲醇攪拌得黃芩苷銅。該方法簡單,易于控制,最終產物的含量和收率高。
3.2 黃芩苷銅對豬源大腸桿菌 K88的抗菌作用 仔豬腹瀉是由產腸毒素性大腸桿菌(ETEC)引起的一種高度接觸性、急性和致死性傳染病[9]。ETEC 的主要致病因子是定居因子和腸毒素[10]。致病過程主要是 ETEC 通過特異性定居因子吸附到小腸黏膜上皮細胞,使菌體定植于腸道并大量繁殖,引起仔豬劇烈水樣腹瀉和迅速脫水死亡[11]。為控制大腸桿菌病,養豬場濫用抗生素,導致E.coli對諸多抗生素的耐藥性大大增強,抗生素治療時產生藥物殘留等諸多不利因素,這些都為仔豬腹瀉病治療帶來了困難。因此,養豬業的替抗方法備受人們關注。
從天然藥物中尋找具有抗菌和抗毒素雙重作用的防治仔豬腹瀉藥物是近年來學者研究的熱點。中藥黃芩在臨床上具有良好的抗病原微生物和抗炎活性,主要用于治療肺熱咳嗽、濕熱瀉痢等癥。在獸醫治療中,黃芩對細菌性感染后期毒血癥、敗血癥療效顯著。黃芩苷具有多種生物活性,其中抗菌殺菌、抗炎和免疫調節作用尤為突出[12-13]。有關研究還發現,黃酮類化合物與金屬離子配位后,展現出比母體更強的生物學活性或全新的藥理作用[14]。本試驗發現,黃芩苷銅能抑制豬源大腸桿菌 K88不耐熱腸毒素的釋放,引起細胞質明顯流失,導致細菌死亡。黃芩苷屬黃酮類化合物,其可能通過抑制活性氧(ROS)的產生和炎性小體3(NLRP-3)的表達起到抗炎的作用[15-16]。某些黃酮類配合物抗菌效果與其氧化分裂 DNA 或損傷細菌細胞膜有關,也可能是由于配合物結構、性質發生改變從而使其與 DNA 和蛋白質結合能力更強[4]。
本試驗初步分析了黃芩苷銅的合成工藝和抑菌作用,發現其可抑制豬源大腸桿菌 K88不耐熱腸毒素的釋放,引起細胞質明顯流失,導致細菌死亡。本試驗結果提示,黃芩苷銅有望作為防治仔豬大腸桿菌病的一種新型、有效的中獸藥制劑,可為黃芩苷銅應用于臨床防控仔豬腹瀉病提供參考依據,對促進養殖業的發展具有指導意義。

