miR-145通過靶向ABCE1發揮抗乳腺癌作用
陳雙華,李榮,周玉生(1. 南華大學藥物藥理研究所,湖南 衡陽 421001;2. 湖南中醫藥高等專科學校,湖南 株洲 412000;3. 南華大學附屬第二醫院,湖南 衡陽 421001;4. 南華大學附屬南華醫院,湖南 衡陽 421001)
乳腺癌是女性最常見的惡性腫瘤之一,病死率居女性腫瘤首位[1]。隨著診療手段的不斷發展,乳腺癌患者的病死率逐漸下降,但即便是在疾病早期進行治療,也只能短時間內控制疾病的發展,大多數患者仍會復發、轉移、惡化。因此,深入了解乳腺癌的發病機制和乳腺癌細胞的分子生物學特點,尋找乳腺癌新的治療靶點,對乳腺癌的防治是非常必要的[2]。
ABCE1 屬ATP 結合盒轉運子基因亞家族成員之一,其編碼的ABCE1 蛋白是一種核糖核酸酶L(ribonuclease L,RNase L)抑制因子[3]。RNase L 屬于2-5 腺苷酸(2'-5'oligoadenylate,2-5A)系統,作用于水解磷酸二酯鍵,水解單鏈RNA 分子[4]。以往研究表明RNase L 主要與干擾素抗病毒作用有關,近期研究表明此酶有誘導細胞死亡的功能[5-6]。越來越多的研究發現,RNase不僅具有消化酶的功能,而且還可作為一種有選擇性的細胞毒素,具有抗病毒和抗腫瘤等特殊的生物學功能[7]。研究發現,ABCE1 能特異性抑制2-5A/RNase L 信號通路,又名RNase L 抑制因子,從而增強腫瘤細胞蛋白質合成及細胞增殖,促進腫瘤的進展[3]。Huang 等[2]研究發現,在人小細胞肺癌細胞中轉染ABCE1基因的siRNA 后能限制腫瘤細胞的增殖、侵襲與遷移,并促使其凋亡。使用ABCE1 特異性shRNA 的慢病毒載體感染人肺腺癌細胞后,細胞生長受到顯著的抑制,凋亡率增加[8],上述研究均提示ABCE1基因與惡性腫瘤有著較為密切的關系。
微小RNA(micro RNA,miRNA)是真核細胞中一類參與基因轉錄后調控的非編碼小分子RNA,是一類近年來新發現的非編碼小RNA分子,通常成熟miRNA 通過與mRNA 完全或不完全配對,降解靶mRNA 或阻遏其轉錄后翻譯[9]。研究表明,超過50%的miRNA 基因定位于與腫瘤相關的基因組區域或其脆性位點,認為miRNA 在腫瘤的發生機制中扮演著重要作用。多種miRNA 在乳腺癌中低表達并可作為腫瘤抑制基因,如miR-34、miR-125、miR-200、miR-205、miR-328、miR-30、miR-213和miR-203等[10-12]。Cosentino 等[12]首次對乳腺癌疾病患者的癌組織miRNA 表達譜進行了系統性分析,發現這些miRNA 表達異常可能誘發乳腺癌,并在腫瘤的分類及預后評估方面起著重要的作用,如miR-213及miR-203與乳腺癌的發展相關聯。隨著越來越多miRNA 與乳腺癌相關研究成果的積累,現在更多的關注于miRNA 的靶向調控作為乳腺癌治療的一個新手段。因此本課題研究ABCE1在乳腺癌發生發展中的作用,并尋找調控其基因表達的miRNA,探討干預ABCE1基因表達對乳腺癌腫瘤細胞的影響及作用機制。
1 材料
1.1 細胞與試藥
乳腺癌細胞株(MCF-7,中南大學湘雅藥學院饋贈,來源于中國科學院上海細胞庫)。β-actin 抗體(sc-47778)、GAPDH 抗體(sc-47724)、tubulin抗體(sc-23950)(美國santa cruz 公司);山羊抗兔IgG(ZB-2301)、兔抗山羊IgG(ZF-0314)和DAB試劑盒(ZLI-9017)(北京中杉金橋生物技術有限公司);RNA 提取試劑盒、cDNA 反轉錄試劑盒、RIPA 裂解液(CW2333)和SDS-PAGE 制膠試劑盒(CW0022)(康為世紀);蛋白marker(26616)(Thermo scientific);clone1 試劑盒(CL001)(湖南萊拓福生物科技有限公司)。miR-145 mimic 和miR-145 inhibitor 由吉瑪基因(中國)合成;本實驗中所用到的引物均由生工生物工程(上海)股份有限公司合成。
1.2 儀器
生物倒置顯微鏡(日本Nikon 公司),高速冷凍離心機(德國Eppendorf 公司),酶標儀(美國BioTek 公司),凝膠成像分析系統(美國Alpha Innotech 公司),Q-PCR 儀(美國Bio Rad 公司)。
2 方法
2.1 細胞培養和組織樣本來源
MCF-7 細胞培養于含體積分數為10%胎牛血清、100 U·mL-1青霉素和100 U·mL-1鏈霉素的DMEM 高糖培養基中,培養環境為37 ℃、5%CO2條件。
本研究中所用到的組織樣本來自南華大學附屬第一醫院婦產科,選擇2015年1月至2017年3月收住院行手術治療的乳腺癌患者10 例,術前均無放療、化療及其他治療史,患者中位年齡52 歲(31 ~69 歲),均經病理檢查確診。所有患者均為中國漢族人,無親緣關系,并簽署知情同意書,收集上述患者術后乳腺病變組織和癌旁組織,-86℃保存。本研究已獲得本院倫理委員會的批準同意。納入標準:① 乳腺癌患者經病理診斷確診;② 認知功能正常;③ 知情同意本研究。排除標準:① 有乳腺整形病史患者;② 認知功能障礙患者;③ 伴有嚴重心肝腎功能不全患者;④ 伴有急性傳染病患者。
2.2 Western blot 實驗
提取乳腺癌組織和癌旁組織蛋白:將組織稱重,分別取約100 mg 組織于研磨器內,加入500 μL 細胞裂解液RIPA 研磨。
提取乳腺癌細胞蛋白:將乳腺癌細胞MCF-7分為3 組,分別是對照組(轉染miR-NC,序列為5'-UUCUCCGAACGUGUCACGUTT-3')、miR-145高表達組(轉染miR-145 mimic,序列為5'-GUCCAGUUUUCCCAGGAAUCCCU-3')和miR-145抑制組(轉染miR-145 inhibitor,序列為5'-AGGGAUUCCUGGGAAAACUGGAC-3')。用預冷的PBS 清洗細胞3 次,小心傾去PBS,并加入RIPA裂解液于冰上孵育30 min。使用RIPA 裂解液分別提取組織和細胞中的總蛋白后,采用BAD 試劑盒測定提取液中蛋白濃度,上樣蛋白量為70 μg,蛋白樣本與上樣緩沖液以1∶4 體積混合均勻,置于100℃水中煮10 min,使蛋白充分變性。待蛋白樣本混合物自然冷卻后加至凝膠加樣孔內,電泳直至溴酚蘭到達凝膠底部。
利用轉膜裝置用濕轉法將凝膠上的蛋白質轉移到PVDF 上,轉膜后用麗春紅溶液染膜4 ~8 min,再用去離子水漂洗脫色,觀察PVDF 膜上有無蛋白條帶出現,以明確轉膜效果。將已完成轉膜的PVDF 膜浸泡于1%脫脂奶粉中室溫封閉1 h。然后用TBST 漂洗PVDF 膜3 次,每次5 min,用相應一抗于37℃孵育1 h,然后將PVDF 膜用TBST 漂洗3 次,每次5 min,加入辣根過氧化酶標記的IgG二抗,于37℃孵育45 ~60 min,TBST 洗膜3 次,每次5 min,然后取出PVDF 膜,瀝干殘余液體,置于凝膠成像分析系統觀察照相并進行灰度掃描。用β-actin 作標準,來表示目的蛋白的相對含量。
2.3 總RNA 提取與熒光定量PCR
采用Trizol 分別提取乳腺組織總RNA 提取和MCF-7 細胞總RNA 提取,核酸蛋白分析儀測量樣本的A260和A280值。按逆轉錄試劑盒說明合成cDNA,置于-20℃保存備用。采用10 μL 反應體系進行目的基因表達分析,實驗條件為:50 ℃ 2 min;95 ℃ 5 min;95 ℃ 30 s;60 ℃30 s,40 個循環;Melt Curve 55 ~95℃。實驗結果由熒光定量PCR 分析軟件自動進行統計和計算。實驗中使用引物如下:ABCE1上游引物:5'-GCCCAGTTATGGCAGACAAG-3',下游引物:5'-GTGACAACTCCATAGGCGCT-3';β-actin 上游引物:5'-CTCCATCCTGGCCTCGCTGT-3',下游引物:5'-GCTGTCACCTTCACCGTTCC-3'。根據miRNA-145 成熟體序列5'-GUCCAGUUUUCCCAGGAAUCCCU-3'設計如下引物用于檢測細胞內miRNA-145 的表達水平:上游引物:5'-ACACTCCAGCTGGGGTCCAGTTTTCCCAGGA-3';下游引物:5'-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGAGGGATTC-3'。以U6 作為miR-145 檢測的參照miRNA,U6 上游引物:5'-CTCGCTTCGGCAGCACA-3',下游引物:5'-AACGCTTCACGAATTTGCGT-3'。
2.4 MTT 實驗
將乳腺癌細胞MCF-7 分為3 組,即對照組(轉染miR-NC)、miR-145 高表達組(轉染miR-145 mimic) 和miR-145 抑制組(轉染miR-145 inhibitor)。收集各組MCF-7 細胞,用完全培養基調整細胞懸液濃度為5×104個·mL-1,在96 孔板中每孔加入100 μL 細胞懸液,每個樣本設6 個復孔,邊緣孔用無菌PBS 充填,細胞培養24 h 后,每孔加入20 μL MTT 工作液(5 mg·mL-1),培養3 ~4 h 后,棄去培養液,每孔加入150 μL DMSO,繼續孵育15 min 后,酶標儀檢測490 nm 處各孔的吸光度值(OD)。細胞存活率=(實驗組OD-空白組OD)/(對照組OD-空白組OD)×100%。
2.5 psiCHECK-ABCE1-3'UTR 載體構建與鑒定
根據clone1 試劑盒設計ABCE1 mRNA 3'-UTR 插入片段引物,序列如下:上游引物:5'-AT TCTAGGCGATCGCTCGAGTAGACTGACTCTG AGAATAT-3'(Xhol);下游引物:5'-TTATTGC GGCCAGCGGCCGCAGCCATTATTTGCATATT AA-3'(Notl)。從MCF-7 細胞中提取總mRNA,利用上述引物進行PCR 擴增出ABCE1 從終止密碼子到3500 位的UTR 序列及兩側Xhol 和Notl的酶切序列區。利用clone1 試劑盒將psiCHECK質粒與PCR 產物進行連接,培養感受態細胞,提取菌液,純化質粒,-80℃保存備用。
2.6 miRNA 生物信息學分析
通過Target Scans 靶基因預測軟件對miR-145的潛在靶基因進行預測,為了降低假陽性,選擇至少6 種miRNA 靶標預測工具預測的交集。利用在線軟件RNAhybrid 預測miR-145 與ABCE1 mRNA 靶序列的結合自由能。通過TAM 數據庫查詢miR-145 與疾病的相關性。
2.7 熒光素酶報告基因實驗
采用重組質粒psiCHECK-ABCE1-3'UTR 轉染HEK293T 細胞,轉染前24 h 在500 μL 完全培養基重接種1×105個MCF-7 細胞,待細胞融合度達80%時進行轉染。轉染步驟分別取1 μg psiCHECKABCE1-3'UTR 質粒和psiCHECK 空質粒用50 μL 無血清培養基稀釋。取2 μL 脂質體lipofectamne2000用50 μL 無血清培養基稀釋,輕輕混勻,室溫下靜置5 min。將含有質粒的培養基和含有脂質體的培養基混合在一起,室溫下靜置20 min。將上述混合物按100 μL/孔分別加到24 孔培養板中,輕輕混勻。將24 孔培養板在CO2培養箱中孵育24 h,轉染24 h 后收集細胞采用熒光素酶報告基因檢測試劑盒檢測熒光素酶活性。
2.8 統計學方法
所有數據采用SPSS 16.0 軟件進行分析,t檢驗用于兩個樣本間的比較,方差分析用于多個樣本均數差別的顯著性檢驗。P<0.05 認為差異有統計學意義。
3 結果
3.1 乳腺癌組織中ABCE1 蛋白及mRNA 的表達
為了確定ABCE1 與乳腺癌的相關性,我們檢測乳腺癌組織和癌旁組織中ABCE1 蛋白及mRNA 的表達情況。結果顯示,10 例乳腺癌組織樣本中ABCE1 蛋白含量明顯高于其癌旁組織(P<0.05),但mRNA 的表達水平在乳腺癌組織和癌旁組織間并無明顯差異(見圖1,2)。

圖1 乳腺癌組織和癌旁組織中ABCE1 蛋白的表達情況Fig 1 Expression of ABCE1 protein in the breast cancer and adjacent tissues
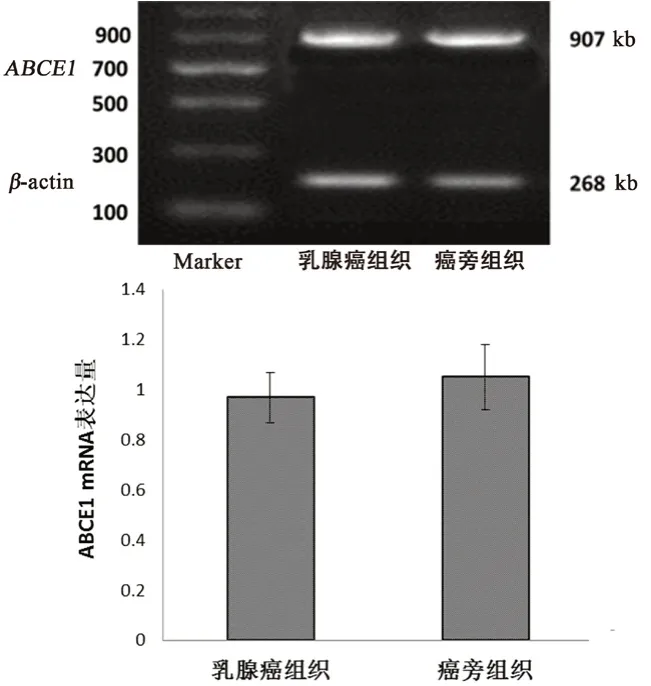
圖2 乳腺癌組織和癌旁組織中ABCE1 mRNA 的表達情況Fig 2 Expression of ABCE1 mRNA in the breast cancer and adjacent tissues
3.2 生物信息學分析miR-145 對ABCE1 mRNA的靶向作用
乳腺癌組織中ABCE1 蛋白含量明顯增加,但其mRNA 水平并未明顯改變,提示在乳腺癌組織中可能存在對ABCE1 的轉錄后調節機制。筆者將ABCE1 mRNA 序列輸入miR Base、miR anda、TargetScan 和PicTar 等miRNA 靶標預測網站,以預測靶向調節ABCE1 的miRNA,得到miR-135、miR-29、miR-145 等多個目標miRNA。同樣,檢索疾病數據庫發現乳腺癌組織中miR-145 表達是明顯降低的,并且TAM 疾病數據庫也顯示miR-145 與乳腺腫瘤和細胞增殖能力密切相關(見圖3)。進一步分析miR-145 對ABCE1 mRNA 的3'-UTR 序列能較好吻合,且兩者結合自由能較低,提示具有較高親和力(見圖4)。因此,上述相關查詢結果提示miR-145 對ABCE1 的調控機制可能參與乳腺癌發生發展。

圖3 TAM 數據庫顯示miR-145 與乳腺腫瘤和細胞增殖具有明確的相關性Fig 3 TAM database shows that miR-145 is clearly associated with breast tumors and cell proliferation

圖4 ABCE1 mRNA 與miR-145 結合的自由能Fig 4 Free energy of ABCE1 mRNA binding with miR-145
3.3 miR-145 與ABCE1 的結合能力
為了驗證ABCE1基因的3'UTR 是否是miR-145 的靶序列,我們將ABCE1基因的3'UTR 片段克隆到熒光素酶報告基因載體psiCHECK 中,構建miR-reporter 載體psiCHECK-ABCE1-3'UTR,將熒光素酶報告載體psiCHECK-ABCE1-3'UTR 分別和miR-145 mimic(miR-145 高表達組)、miR-NC(對照組)共轉染HEK 293T 細胞,48 h 后檢測熒光素酶活性。結果表明,共轉染miR-145 mimic 和psiCHECK-ABCE1-3'UTR 后,熒光素酶活性受到明顯抑制(見圖5)。說明ABCE1是miR-145 的靶基因。
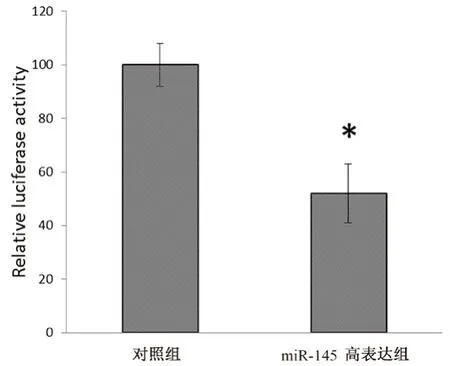
圖5 熒光素酶報告基因實驗檢測miR-145 與ABCE1 的結合能力Fig 5 Binding ability of miR-145 with ABCE1 by luciferase reporter gene assay
3.4 miR-145 對ABCE1 的調節在乳腺癌細胞凋亡中的作用
為明確miR-145 對ABCE1 的靶向調節作用對乳腺癌細胞凋亡的影響,我們檢測了乳腺癌組織和癌旁組織中的miR-145 的表達情況。結果顯示,乳腺癌組織中miR-145 表達水平顯著降低(見圖6)。然后,在乳腺癌細胞MCF-7 中通過外源轉染miR-145 mimic 和miR-145 inhibitor 分別上調或下調細胞內miR-145 水平。結果表明,與miR-145 抑制組相比,miR-145 高表達組能夠顯著抑制ABCE1 蛋白表達(見圖7)。此外,MTT 實驗結果表明轉染miR-145 的MCF-7 細胞存活率顯著低于miR-145 抑制組細胞(見圖8)。

圖6 乳腺癌組織與癌旁組織中miR-145 的表達差異Fig 6 Expression differences of miR-145 in the breast cancer tissues and adjacent tissues
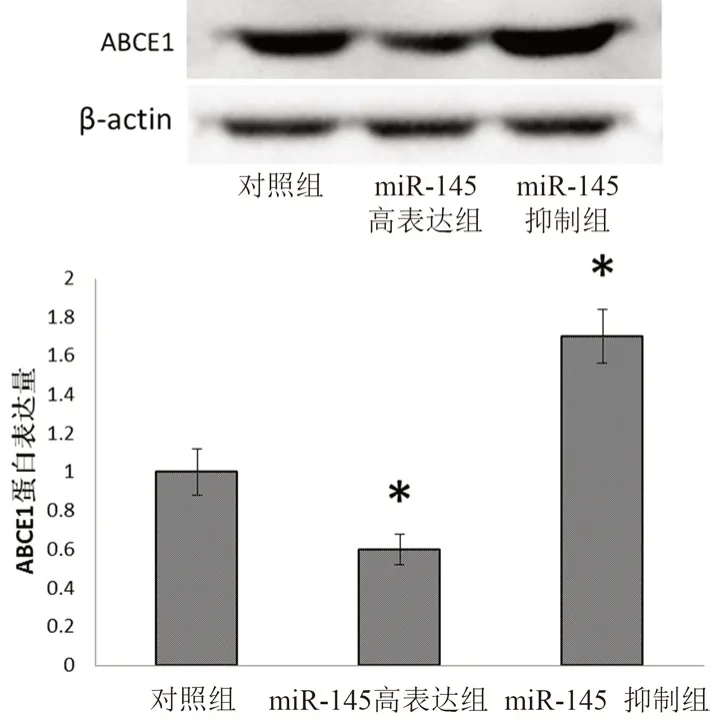
圖7 miR-145 對乳腺癌細胞MCF-7 中ABCE1 蛋白表達的影響(n =3)Fig 7 Effect of miR-145 on the expression of ABCE1 in MCF-7 cells(n =3)
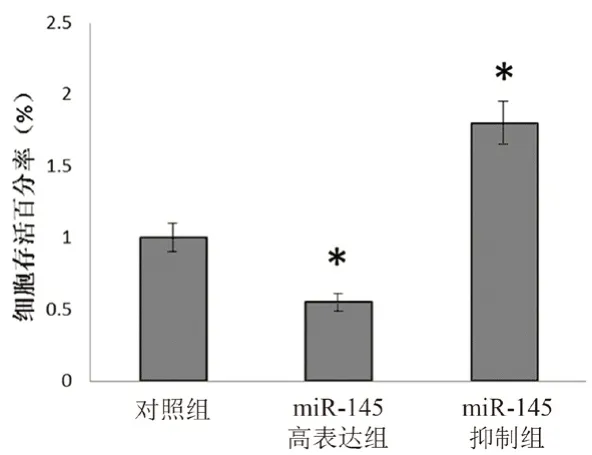
圖8 miR-145 對MCF-7 細胞增殖能力的影響(n =3)Fig 8 Effect of miR-145 on the proliferation of MCF-7 cells(n =3)
4 討論
臨床上乳腺癌的治療主要通過手術、放化療等[13],但不可避免地給患者帶來了極大傷害,且后續治療對身心均有不利影響,因此深入研究乳腺癌的發病機制,從中尋找可供應用的治療靶點將有益于臨床治療。
腫瘤細胞的代謝過程如轉錄、翻譯都異常亢進,RNase L 能通過切割RNA 抑制腫瘤細胞的轉錄,被認為是腫瘤治療的重要分子靶點。ABCE1在多種腫瘤組織中高表達,是腫瘤發生的關鍵基因,其編碼的ABCE1 蛋白是一種RNase L 抑制因子,通過抑制RNase L 發揮促腫瘤細胞增殖的作用。本研究發現,乳腺癌組織中ABCE1 蛋白含量明顯高于癌旁組織,提示其與乳腺癌的發生密切相關。然而,ABCE1 mRNA 的表達水平在兩組間并無明顯差異,說明在乳腺癌組織中存在著對ABCE1 的轉錄后調節機制。我們通過多種miRNA 靶標預測軟件發現ABCE1 的3'-UTR 含有多個miR-145 互補的序列,提示miRNA-145 與ABCE1 之間可能存在調控關系。應用miRNA 靶標預測顯示miR-145 與ABCE1 mRNA 的3'-UTR序列能較好吻合,提示miR-145 與ABCE1 mRNA的結合特異性較高。采用RNAhybrid 和PicTar 在線網站發現miR-145 與ABCE1 mRNA 結合自由能較低,提示兩者具有較高的親和力。這些均說明miR-145 對ABCE1 靶向抑制是一種普遍存在的生理性調節。我們通過在乳腺癌細胞MCF-7 中外源轉染miR-145 mimic 和miR-145 inhibitor 分別上調或下調細胞內miR-145 水平,證實了miR-145 mimic 能抑制MCF-7 細胞中ABCE1 的表達,同時促進細胞凋亡。此外,熒光素酶報告基因實驗也顯示miR-145 與ABCE1 mRNA 具有結合能力,這些結果進一步證實miR-145 對ABCE1 蛋白表達存在靶向調節作用。
綜上所述,本研究篩選出乳腺癌組織內能夠有效靶向ABCE1 mRNA 的miR-145。通過外源性增加miR-145 能夠抑制ABCE1 的表達,進而取消ABCE1 對2-5A/RNase L 信號的阻滯,有利于RNase L 促進乳腺癌細胞的凋亡。因此,miR-145 及其調節的ABCE1基因可能作為新的突破口,為乳腺癌的診治提供新的作用靶點。