齊墩果酸線粒體靶向脂質體的制備及抗胰腺癌研究
譚曉柯,武香香,曾華輝,朱鑫*(. 河南中醫藥大學藥學院,鄭州 450046;. 河南中醫藥大學中醫藥科學院,鄭州 450046)
胰腺癌(pancreatic cancer,PC)是一種難治性惡性腫瘤[1],預后非常差,通常在確診后,只有24%的人存活1年,9%的人存活5年[2]。預后不良的主要原因是缺乏早期癥狀、腫瘤進展迅速以及局部/轉移性疾病的有效藥物療效有限[3]。
齊墩果酸(oleanolic acid,OA)是一種五環三萜類天然產物,廣泛存在于多種中藥材中,如三七、懷牛膝、甘草、石斛夾竹桃和女貞等[4]。研究發現,OA 具有多種有益的藥理學活性,比如抗氧化作用、抗炎作用、降糖作用、抗病毒作用、肝功能保護作用、胃黏膜保護作用、抗微生物作用、抗腫瘤作用等[5]。雖然OA 具有一定的抗腫瘤活性,能夠抑制多種腫瘤細胞的增殖[6],但該藥物的水溶性較差,在水中的溶解度僅為 1μg·mL-1,腸黏膜透過性較差且具有較大的首過效應,致使其生物利用度低且個體間差異較大,這些性質限制了其臨床應用與開發[7]。目前,OA 在市場上銷售的藥物制劑只有片劑和膠囊劑,國內外有關學者進行了OA 新劑型的研究,大多數新型制劑制備工藝較復雜,載藥量低,對設備要求較高,而且存在靶向性較低的問題,使藥物療效不佳以及易產生不良反應[8]。因此,我們需要開發基于脂質體的靶向性制劑來提高OA 的治療效果,并減少毒副作用。
α-生育酚琥珀酸酯(α-TOS)是維生素E最主要的成分α-生育酚(α-TOH)的一種酯化衍生物。維生素E 在儲存和應用過程中易被氧化,因而常將其酯化衍生物作為商業的供應形式,α-TOS 即是其中的一種[9]。近年來研究發現,α-TOS 除作為維生素E 的供應前體外,還具有廣泛的抗腫瘤活性,可通過多種機制發揮抗腫瘤作用,如誘導細胞凋亡、抑制NF-кB 功能、抑制血管生成等。此外,α-TOS 能選擇性殺死腫瘤細胞而對正常組織無不良反應[10]。三苯基磷基團(TPP)中含有3 個苯基,使得整個分子具有很強的脂溶性,同時TPP 中磷原子上的正電荷可以離域到3 個苯環上,在更大空間分散正電荷,降低擴散滲透膜時的自由能,促使TPP 穿越磷脂膜。正常細胞的線粒體膜電位為-(130 ~150)mV,遠高于內質網、核糖體等細胞器的膜電位,因此親脂性陽離子可以很容易地通過脂質雙分子層的疏水屏障并在線粒體中積聚。此外,腫瘤細胞較正常細胞具有更高的線粒體膜電位(大約為200 mV),可將抗腫瘤藥物優先靶向腫瘤細胞的線粒體,誘導腫瘤細胞凋亡[11]。因此,通過親脂性陽離子對抗腫瘤藥物進行修飾,可以實現將藥物遞送至線粒體的目的。
因此,本研究通過TPP 修飾α-TOS 構成具有線粒體靶向能力的三苯基磷基生育酚琥珀酸酯(α-TOS-TPP)偶聯物作為線粒體靶向載體,以期通過靜電作用使藥物更容易富集于腫瘤細胞線粒體。此外脂質體表面修飾聚乙二醇(PEG)可使脂質體清除速率減慢,延長其在血液中的循環時間,提高OA 的生物利用度,進而提高其抗腫瘤活性。
1 材料
1.1 儀器
Agilent 1260高效液相色譜儀(美國Agilent公司);手動擠壓器(型號:HE8433 Genizer 公司);粒徑分析儀(型號:250144,Brookhaven Instruments);高倍顯微鏡(型號:TS100,Nikon);萬分之一電子天平(型號:AL204,梅特勒-托利多儀器上海有限公司);透射電子顯微鏡[型號:JEM-1230(HC)];UV-2201 紫外分光光度計(日本島津公司);全波長酶標儀(Multiskan GO);激光共聚焦顯微鏡(德國,ZEISS);流式細胞儀(美國貝克曼)。
1.2 試藥
α-TOS(阿拉丁,批號:T109349,純度>98%);6-溴正己醇(阿拉丁,批號:B138834,純度>97%); 三苯基膦(阿拉丁, 批號:T104475,純度>99.0%);大豆卵磷脂(阿拉丁,批號:B1504087,純度>98%);膽固醇(北京百靈威科技有限公司,批號:LK40Q28,純度:95%);PEG(SIGMA,批號:BCBQ6878V);二甲基亞砜(Solarbio,批號:710N032,細胞培養級);香豆素6(阿拉丁,批號:12009083,純度>98.0%);Mito-Tracker Red(Beyotime, 批號:062320210302);DAPI 溶液(Solarbio,批號:20190923);Annexin V-FITC/PI apoptosis kid 凋亡試劑盒(聯科生物,批號:A11015);其他試劑均為分析純。
1.3 細胞
胰腺癌BxPC-3 細胞(武漢普諾賽生命科技有限公司)。
2 方法與結果
2.1 α-TOS-TPP 的合成
將α-TOS(5.0000 g,9.4201 mmol)、6-溴正己醇(1938.3 μL,14.1302 mmol)、二環己基碳二亞胺(2.3307 g,11.3041 mmol)、4-二甲基吡啶(0.0575 g,0.4710 mmol)分別用適量二氯甲烷溶解后,在冰浴條件下,將其混合,攪拌10 min 后轉至室溫,再攪拌12 h 后加入6-溴正己醇(646.1 μL,4.7101 mmol),繼續攪拌12 h[12]。通過柱層析分離收集,初始展開劑為石油醚-乙酸乙酯(24∶1),之后適當改變比例增大極性,收集的預測產物在真空管干燥箱60 ℃下減壓干燥5 h,得到無色或淺黃色油狀物化合物A,收率為64.56%。經核磁驗證,如圖1所示。
取化合物A(3.0769 mmol,2.1349 g)、三苯基膦(6.1538 mmol,1.6141 g)、無水K2CO3(0.3000 g)在適量乙腈中混合,90℃ 回流 30 h[12]。過濾除去K2CO3后,濃縮濾液,加入石油醚超聲,過濾除去濾液,不溶物經柱層析,初始展開劑為乙酸乙酯-甲醇(20∶1),之后適當改變比例增大極性,收集的預測產物在真空管干燥箱60℃ 下減壓干燥5 h,得到無色或淺黃色油狀物化合物B,收率為46%,純度為98.53%。經核磁驗證,如圖2所示。
通過1H-NMR 對化合物A 和B 進行了表征。在化合物A 的1H-NMR 譜中,在δ=4.11 ~4.14(2H)和3.37 ~3.41(2H)處出現的三重峰,在δ=1.84 ~1.91(2H),1.78 ~1.86(2H),1.74 ~1.81(2H),1.64 ~1.71(2H)處出現的多重峰證實了6-溴正己醇通過酯鍵與α-TOS 連接。δ=2.92 ~2.95(2H)、2.75 ~2.80(2H)、2.58 ~2.64(2H)處存在三重峰和代表單線態峰,δ=2.09(3H)、2.02(3H)、1.98(3H)證實了α-TOS 部分的存在,如圖1。在化合物B 的1H-NMR 譜中,δ=7.6 ~7.9(15H)證實了苯基的存在,剩余特征質子峰與化合物A 位置相同,如圖2。經驗證化合物B 為α-TOS-TPP。
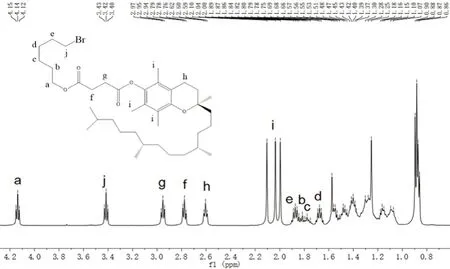
圖1 化合物A 的氫核磁譜圖Fig 1 1H-NMR spectrum of compound A
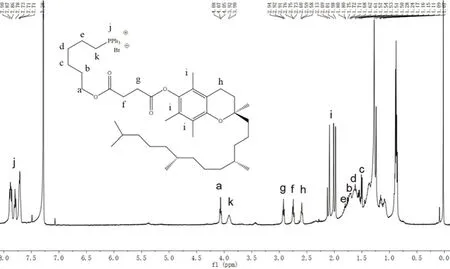
圖2 化合物α-TOS-TPP 的氫核磁譜圖Fig 2 1H-NMR spectrum of compound α-TOS-TPP
2.2 α-TOS-TPP-OA 的制備
精密稱取5.0 mg 卵磷脂,10.0 mgα-TOSTPP,1.0 mg OA,1.0 mg 膽固醇,PEG 1.0 mg(1∶2∶0.2∶0.2∶0.2)分別溶于2.0 mL 的二氯甲烷中,混合上述溶液,20 r·min-1、40 ℃下旋轉蒸發除去二氯甲烷,40 ℃真空干燥2 h 以徹底除去有機溶劑,加入去離子無菌水2.0 mL,60℃下磁力攪拌水化2 h,250 W 水浴超聲5 min,在60℃下依次擠壓通過200 nm、100 nm 聚碳酸酯膜,即得α-TOS-TPP-OA,在4℃下儲存備用[13]。
2.3 形態、粒徑和電位
在室溫下采用粒徑分析儀對制備的脂質體的粒徑與多分散系數(PDI)進行表征,結果平均粒徑為(137.0±0.82)nm,PDI 為(0.23±0.01),PDI 的值較大,可能是因為擠壓膜時聚碳酸酯膜的孔徑大小不一所造成的,如圖3A 所示。使用α-TOS 制備的α-TOS-OA,測得其Zeta 電位為-(31.9±0.97)mV, 將α-TOS 換成α-TOSTPP 后制備的α-TOS-TPP-OA 的Zeta 電位為+(43.09±1.22)mV,Zeta 電位由負電荷轉變為正電荷,見圖3B,說明TPP 可分散在脂質體表面,使其具有線粒體靶向的能力,與預期一致。采用高倍透射電子顯微鏡觀察α-TOS-TPP-OA 的形貌,形態見圖3C ~3E。由電鏡照片可以觀察到,脂質體單分散,呈球形,粒度較均一,其結果與粒徑儀所測到的脂質體粒徑相吻合。

圖3 α-TOS-TPP-OA 的粒徑分布(A)、Zeta 電位及透射電子顯微鏡圖(C ~E)Fig 3 Particle size distribution(A),Zeta potential(B),and transmission electrons(C ~E)of α-TOS-TPP-OA microscope picture
2.4 包封率和載藥量的測定
2.4.1α-TOS-TPP 標準曲線的建立 配制質量濃度為10、30、50、80、120 和150 μg·mL-1的溶液,通過紫外可見光分光光度計在λ=287 nm 檢測溶液的吸光度。以吸光度(y)對質量濃度(x)進行線性擬合,得到回歸方程y=10.082x+0.1995,R2=0.997,表明α-TOS-TPP在10 ~150 μg·mL-1內與吸光度線性關系良好。
2.4.2 OA 標準曲線的建立 采用高效液相色譜法(HPLC)測定OA 的含量。采用ZORBAX SB-C18色譜柱(4.6 mm×250 mm,5 μm);流動相:甲醇-1%醋酸水(90∶10,V/V);柱溫:25℃;流速:1.0 mL·min-1;波長:220 nm;進樣量:20 μL。配制質量濃度為10、50、80、100、150、200和300 μg·mL-1的OA 溶液,進樣測定,以峰面積(y)對質量濃度(x)進行線性擬合,得回歸方程y=5495.8x-34.366,R2=0.9991,表明OA在10 ~300 μg·mL-1內與峰面積線性關系良好。
取1.0 mLα-TOS-TPP-OA 溶液置于超濾離心管內(截留相對分子質量為30 000),以4000 r·min-1離心30 min,分離溶液中游離的OA 及α-TOS-TPP,截留在離心管內的為α-TOS-TPPOA,離心管內加入5 倍體積的甲醇破壞脂質體結構,促使OA 和α-TOS-TPP 從膠束中釋放出來,采用HPLC 測定脂質體中包封的OA 質量,離心管外為游離的OA,采用同樣的方法可測定游離的OA 的質量。α-TOS-TPP 的含量則通過紫外可見光分光光度計在λ=287 nm 檢測;用以下公式計算包封率和載藥量:
包封率=脂質體內包封的藥物質量/(脂質體內包封的藥物質量+未包封的游離藥物質量)×100%
載藥量=包封于脂質體內的藥物質量/(載體的質量+脂質體包封的藥物總質量)×100%經計算得到α-TOS-TPP 的包封率和載藥量分別為(76.21±7.74)%和(39.06±5.51)%,OA的包封率和載藥量分別為(70.96±9.13)%和(3.90±0.75)%。
2.5 脂質體的穩定性
將α-TOS-TPP-OA 分別在4℃純水中和37℃的PBS 環境中分別存放7 d 和3 d,模仿存儲環境和體內環境,檢測其粒徑及PDI 變化。如圖4所示,在4℃的純水下儲存7 d 后粒徑從(137.0±0.82)nm 變為(131.1±0.80)nm,PDI 從(0.227±0.005)變為(0.248±0.009)。在37℃的PBS 儲存3 d 后,粒徑增加到(176.7±3.9)nm,PDI 則變為(0.257±0.013)。由此表明,該脂質體在4℃的純水中有良好的儲存穩定性,且在37℃的PBS 中也有較好的穩定性(見圖4)。
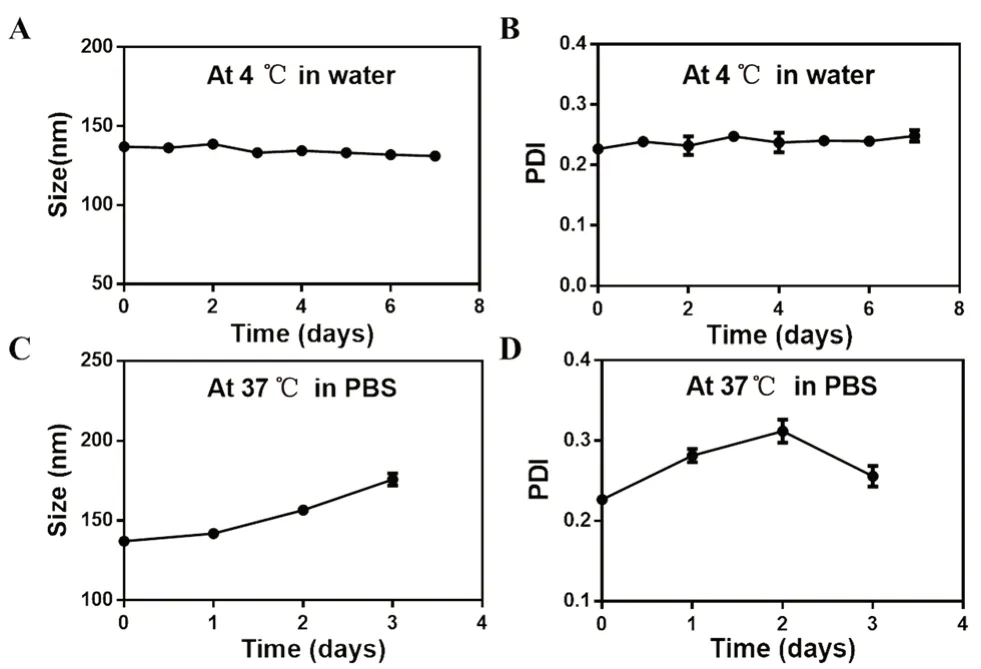
圖4 α-TOS-TPP-OA 的穩定性Fig 4 Stability of α-TOS-TPP-OA
2.6 線粒體靶向
由于OA 自身不發熒光,因此采用脂溶性的帶綠色熒光的香豆素6 作為替代OA 的模型藥物,按“2.1”“2.2”項下方法制備含有香豆素6(C6)的脂質體。將BxPC-3 細胞以1×104個的密度接種于24 孔培養板內,用血清培養基培養24 h,將質量濃度為100 ng·mL-1的載C6(顯綠色熒光)的α-TOS-C6 和載C6 的α-TOS-TPP-C6 加入其中,再與細胞共同孵育1、3 h 后,用37 ℃的PBS 洗滌。用100 nmol·L-1的Mitotracker Red染線粒體(紅色熒光)20 min,10 μg·mL-1的DAPI 溶液染細胞核(藍色熒光)5 min,然后在激光共聚焦顯微鏡下觀察C6 在細胞內的分布情況。
結果如圖5所示,孵育1、3 h 后,含有C6的脂質體進入腫瘤細胞,且隨著孵育時間的延長,綠色熒光逐漸增強,表明隨著孵育時間的延長,腫瘤細胞對脂質體的攝取增加。帶有綠色熒光的脂質體與呈紅色熒光的線粒體重合,會呈現為黃色。隨著孵育時間的增加黃色逐漸變深,說明脂質體逐步聚集在線粒體周圍。脂質體與線粒體的共定位通過皮爾遜系數(PCC)來體現,通過Image J 分析的到共定位散點圖及PCC。通過共定位散點圖表明,隨著孵育時間的增加,α-TOS-TPP-C6 的紅色熒光和綠色熒光共定位關系明顯好于α-TOS-C6。PCC 結果如圖6顯示,α-TOS-TPP-C6 的PCC 明顯高于α-TOS-C6,且存在顯著性差異。由此可知,TPP 陽離子能促進脂質體聚集在腫瘤細胞的線粒體部位。
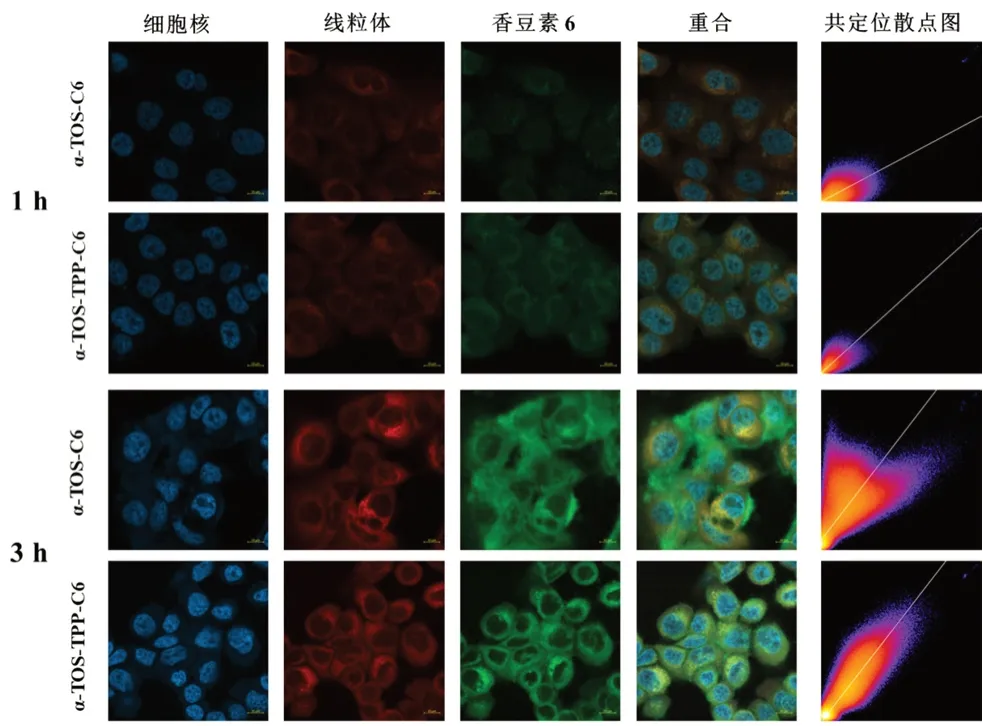
圖5 α-TOS-C6 和α-TOS-TPP-C6 孵育1、3 h 后激光共聚焦顯微鏡圖片及共定位散點圖Fig 5 Confocal laser confocal microscopy images and colocalization scatter plots of α-TOS-C6 and α-TOS-TPP-C6 after incubation for 1 and 3 h
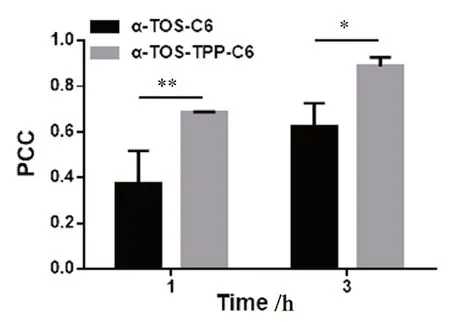
圖6 α-TOS-C6 和α-TOS-TPP-C6 孵育1、3 h 后的PCC 值( ±s,n =3)Fig 6 PCC of α-TOS-C6 and α-TOS-TPP-C6 after 1 and 3 h incubation(x±s,n =3)
2.7 細胞存活率的測定
將胰腺癌細胞株BxPC-3 復蘇傳代,在37℃、5%CO2培養箱中培養24 h,然后分為OA 組、α-TOS-TPP 組、α-TOS-TPP+OA 組和α-TOS-TPPOA 組,給予對應藥物處理,由于不同給藥組在相同濃度時的抑制率相差較大,在計算IC50時容易造成誤差,故給藥濃度有所不同。其中α-TOSTPP+OA 游離藥物組和α-TOS-TPP-OA 組的給藥濃度為1、2、5、10、15、20、25、30 μmol·L-1(以OA 濃度為準),OA 組、α-TOS 組和α-TOSTPP 組給藥濃度為15、20、25、30、35、40、45、50 μmol·L-1,每個濃度設6 個復孔,加藥后孵育48 h 后,取出96 孔板,避光條件下加入MTT溶液20 μL,繼續培養4 h 后取出,加入150 μL 二甲基亞砜,輕微振蕩10 min,在490 nm 波長下檢測下吸光度,計算IC50。
結果如表1所示,通過TPP 對α-TOS 的修飾,α-TOS-TPP 對BxPC-3 的抑制作用較α-TOS 明顯增加。α-TOS-TPP+OA 給藥組合對BxPC-3 的抑制作用高于α-TOS-TPP 和OA 單獨給藥。而α-TOSTPP-OA 對BxPC-3 的毒性高于α-TOS-TPP+OA的給藥組合,其IC50明顯低于其他給藥組。
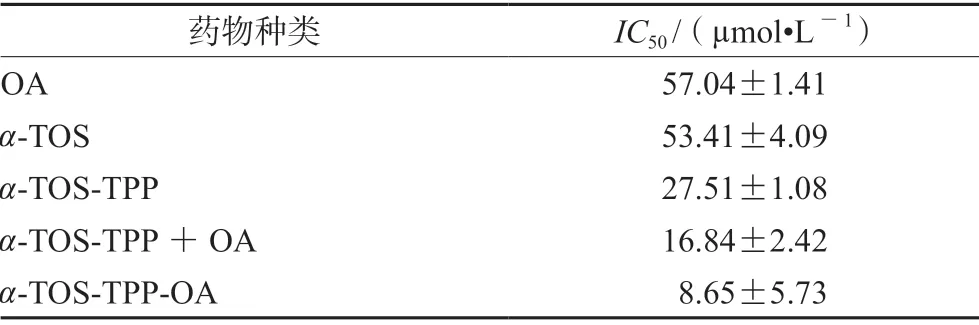
表1 OA、α-TOS-TPP、α-TOS-TPP+OA 游離藥物和α-TOSTPP-OA 在48 h 的IC50Tab 1 IC50 of OA,α-TOS-TPP,α-TOS-TPP+OA free drugs and α-TOS-TPP-OA at 48 h
2.8 流式細胞儀檢測細胞凋亡
為檢測α-TOS-TPP-OA 誘導BxPC-3 細胞凋亡的作用,將BxPC-3 細胞以2×106個每孔加入6孔板中,孵育過夜貼壁。孔內分別加入相應IC50的α-TOS-TPP-OA,其中OA、α-TOS、α-TOS-TPP和α-TOS-TPP+OA 的加入量與α-TOS-TPP-OA中相應含量相等。孵育24 h 后,分別收集孔中的細胞,PBS 洗滌兩次后,加入5 μL Annexin V-FITC和10 μL PI 標記。通過流式細胞儀分析凋亡情況。如圖7所示,α-TOS-TPP-OA 處理的細胞處于早期和晚期凋亡階段的分別占45.34%和37.55%,而α-TOS-TPP+OA 分別誘導46.74%和5.73%的細胞進入早期和晚期凋亡階段。從流式細胞儀分析可以看出,α-TOS-TPP-OA 比α-TOS-TPP+OA 能誘導更多的BxPC-3 細胞凋亡,可能是因為靶向作用讓更多的藥物進入線粒體所致。
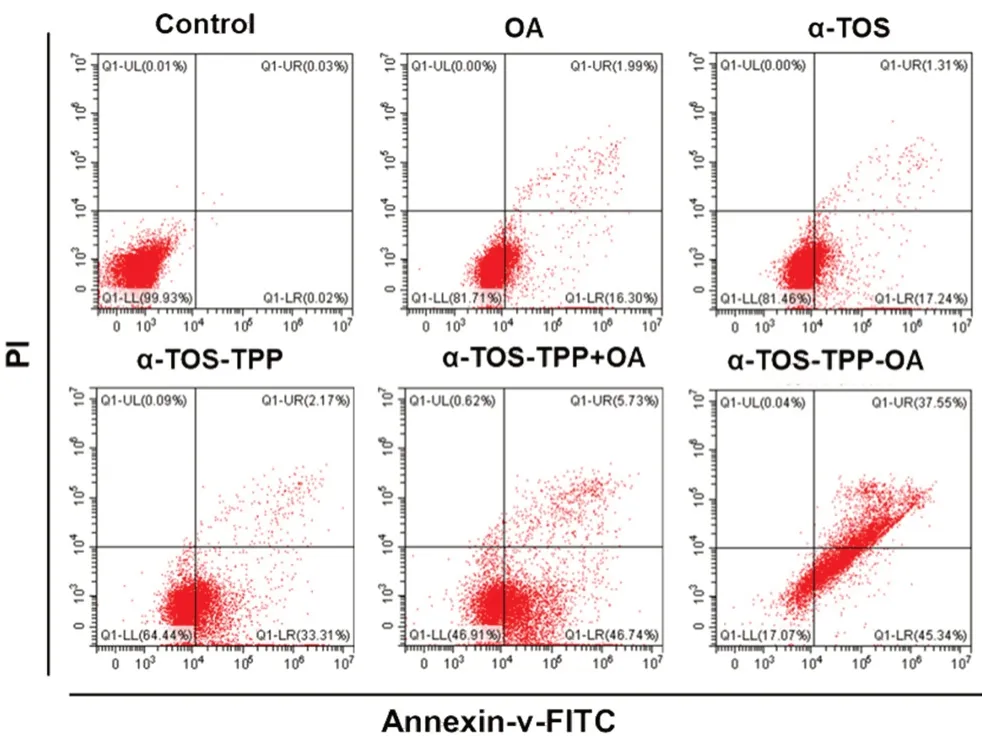
圖7 流式細胞儀分析OA、α-TOS、α-TOS-TPP、α-TOS-TPP +OA 和α-TOS-TPP-OA 誘導BxPC-3 細胞凋亡的作用Fig 7 Apoptosis of BxPC-3 cells induced by OA,α-TOS,α-TOSTPP,α-TOS-TPP+OA and α-TOS-TPP-OA by flow cytometry
3 討論
OA 具有潛在的抗腫瘤活性,可誘導許多腫瘤細胞系凋亡,但OA 的低水溶性和低滲透性限制了其使用[14]。因此,有必要選擇合適的納米給藥系統來增加OA 的溶解度,減少口服首過效應,提高生物利用度。近年來,為了克服低溶解度藥物的缺點,目前已有脂質體[15]、納米脂質體[16]、納米混懸劑[17]、口服微乳[18]、固體分散體[19]等劑型的報道,但存在長期穩定性差、載藥量小、靶向性多、僅依靠通透性保留(EPR)效應的被動靶向等不足。
α-TOS 能與線粒體電子傳遞鏈復合物Ⅱ結合,通過線粒體外膜通透性誘導不同類型腫瘤細胞凋亡,從而損傷線粒體[20]。Mallick 等[13]證明了α-TOS-化療藥物偶聯脂質體可以同時靶向腫瘤細胞中的線粒體和細胞核。本研究通過酯化反應將6-溴正己醇連接到α-TOS 上,該反應生成化合物A,進一步引入線粒體靶向TPP 基團,得到α-TOS-TPP。α-TOS-TPP 具有一定的親脂性,更容易透過細胞膜,而且腫瘤細胞中的線粒體具有更高的膜電位,使得α-TOS-TPP 這種離域型親脂陽離子(DLC)更容易選擇性富集腫瘤細胞線粒體,因此使其一定程度上具有了線粒體靶向的能力[21]。
以α-TOS-TPP 作為線粒體靶向載體,制備了具有線粒體靶向性的OA 脂質體,并且使用PEG對脂質體進行表面包覆,以避開單核吞噬系統,以確保長時間的血液循環。粒徑的大小是通過獨特的滲漏血管系統成功積聚到腫瘤組織中的重要決定因素之一,經證實,粒徑為20 ~300 nm 的膠束的血液循環時間和腫瘤聚集量隨其直徑的增大而增加,最佳粒徑范圍為100 ~160 nm[22]。該脂質體的粒徑為(137.0±0.8)nm,可通過增強EPR 效應和減少網狀內皮系統(RES)的清除提高抗腫瘤效果和降低毒性[23]。此外,α-TOSTPP-OA 的表面電荷為+(43.09±1.22)mV,說明TPP 覆蓋在脂質體的表面,使得該脂質體表面帶有正電荷,這可以使該脂質體通過胞吞進入細胞內后依靠靜電效應向線粒體聚集,通過線粒體靶向性考察,證實了這一點。通過MTT 實驗和流式細胞儀分析發現,α-TOS-TPP-OA 對 BxPC-3細胞的抑制作用明顯增強,這可能與α-TOS-TPPOA 增加了藥物在線粒體的聚集有關。
綜上所述,本研究通過TPP 對α-TOS 的修飾,合成了一種具有線粒體靶向性的載體,制備了搭載OA 的脂質體,并初步評價了其體外抗胰腺癌作用,為OA 治療胰腺癌提供了一種新的思路,但后續還需要更深入地開展細胞水平研究及動物體內實驗對本結論進一步驗證。