烏司他丁在缺血再灌注損傷中的研究進展
趙書馨,張雄,蘇晨林,李霽,于鋒(中國藥科大學基礎醫學與臨床藥學學院,南京 211198)
組織短暫缺血,恢復血液灌注后,組織損傷不僅沒有得到有效的緩解甚至進一步加重的現象,稱為缺血再灌注損傷[1]。缺血再灌注損傷幾乎發生在每個器官中,自從1960年心肌缺血再灌注損傷的定義被提及之后,陸續發現了在腦、腎、肺、腸道等器官中的缺血再灌注損傷[2]。缺血再灌注損傷涉及局部和全身作用的病理生理機制,主要是通過兩個階段發展:在局部缺血期間,主要發生的是缺氧損傷,能量的消耗,由于能量缺乏直接或間接地導致細胞內某些狀態的改變,例如細胞離子穩態紊亂、水解酶激活和細胞膜通透性增加等。隨后在再灌注過程中,主要發生炎癥因子的釋放和細胞凋亡等生理反應[3]。近年來研究發現,缺血再灌注損傷涉及多種生物學過程,主要由自由基產生的增加,細胞內鈣離子(Ca2+)超載和炎癥因子的過度激活等原因造成[4]。
絲氨酸蛋白酶抑制劑是蛋白酶家族的重要成員,主要參與蛋白的合成和降解過程,并且參與炎癥和腫瘤的抑制等。抑肽酶、rhKD/APP、烏司他丁等絲氨酸蛋白酶抑制劑具有保護器官缺血再灌注損傷的能力[5]。尤其是近幾年對于烏司他丁在缺血再灌注損傷中的研究更為深入,已證實其在心臟、腎臟和肺等器官的缺血再灌注損傷中具有良好的保護作用。器官的缺血再灌注損傷有望成為烏司他丁新的臨床適應證。
烏司他丁由143 個氨基酸殘基組成,相對分子量約為67 000,其序列包括兩個Kunitz 型結構域,在血漿中主要以中間α-抑制劑和前α-抑制劑兩種前體形式存在[6]。中間α-抑制劑和前α-抑制劑的主要合成部位是肝臟,在腎臟、胰腺、腸和胃中雖然也會產生,但濃度要低得多[7]。烏司他丁作為廣譜蛋白水解酶,可在體內外抑制多種絲氨酸蛋白酶[8]。臨床治療方面,烏司他丁已被廣泛用于治療急性胰腺炎、敗血性休克、器官衰竭等疾病。烏司他丁通過抑制炎癥反應、抗氧化應激、抗凋亡、調節酶活性、抗血液凝固等來預防和治療疾病[9]。本文針對烏司他丁通過不同的信號通路緩解不同器官的缺血再灌注進行系統性的匯總分析,以期望為臨床用藥提供參考。
1 烏司他丁與缺血再灌注損傷
1.1 烏司他丁與肺缺血再灌注損傷
肺移植等手術和術后環境中常常伴隨著肺缺血再灌注損傷的發生,急性肺損傷、肺部切除和創傷性休克也可以誘發肺缺血再灌注損傷形成[10]。肺缺血再灌注損傷的主要原因之一是氧自由基過剩,而其根本原因是氧化和抗氧化系統的不平衡致使大量活性氧和脂質過氧化物產生的增加。實驗研究表明,與肺缺血再灌注損傷模型組相比,烏司他丁(1.2×104U·kg-1)能夠通過調節丙二醛(MDA)的表達來緩解氧化損傷,進而對肺組織起到保護作用[11]。此外,烏司他丁(1×104U·kg-1)能顯著降低腫瘤壞死因子-α(TNF-α),白介素-6(IL-6)的表達[12],表明其通過抑制炎癥因子的釋放,保護肺組織免受缺血再灌注的損傷。另有研究表明,烏司他丁(1×104U·kg-1)能通過抑制p38 絲裂原活化蛋白激酶(MAPK)緩解肺缺血再灌注損傷,使肺血氣屏障的通透性降低,肺部組織形態和顯微結構明顯好轉,相應的肺部檢測指標也得到了改善[13]。用于肺移植的肺保存液中的成分被認為是在缺血期間使肺損傷最小化的關鍵,合理保存肺器官從而降低肺組織缺血再灌注損傷的發展也是近幾年來探索的熱點[14]。研究表明,往保存液中的添加烏司他丁能夠緩解肺缺血再灌注損傷的發生,實驗對兔子進行原位肺缺血再灌注損傷的造模處理,使用烏司他丁處理的保存液中用于肺保護,肺部組織的髓過氧化物酶(MPO)、MDA 水平明顯降低,且實驗兔血清中TNF-α水平降低,炎癥因子的釋放和中性粒細胞的遷移得到了有效的抑制[15]。以上研究表明,烏司他丁在肺缺血再灌注損傷中能夠通過降低氧化損傷,抑制炎癥反應發揮保護作用。
1.2 烏司他丁與肝臟缺血再灌注損傷
造成肝臟缺血再灌注損傷的原因有很多,如鈣穩態失衡,產生過量的活性氧(ROS)和線粒體功能出現障礙等[16]。烏司他丁對于肝臟缺血再灌注損傷的保護目前已有較多的研究。有研究發現,在乳酸林格保存液中補充烏司他丁(1×103U·mL-1)可有效降低肝酶釋放,其機制是通過增加抗凋亡基因B 淋巴細胞瘤-2 基因(Bcl-2),降低促凋亡基因半胱氨酸蛋白酶-3(Caspase-3)和BAX(Bcl-2 assaciated X protein)的表達來發揮保護作用,烏司他丁可使肝臟免受肝臟缺血再灌注損傷的影響,且呈現劑量依賴性,并能顯著延長肝移植中肝供體的存活時間[17]。自噬的發生通常是由于蛋白質和細胞器的過度降解繼而引發細胞死亡[18]。與常見的缺血再灌注損傷保護機制不同,烏司他丁通過激活張氏肝細胞的自噬功能,進而起到保護作用。實驗通過對張氏肝細胞進行缺氧復氧處理,發現烏司他丁在體外以劑量依賴形式抑制缺氧復氧損傷,同時抑制細胞凋亡和誘導自噬,上調絲氨酸/蘇氨酸蛋白激酶(ULK1)、自噬蛋白1 和微管相關蛋白1 輕鏈3(LC-3)的表達;然而,一旦自噬被抑制,缺氧復氧損傷將會加重。表明烏司他丁誘導的缺氧復氧損傷細胞自噬是保護性代償反應[19]。
烏司他丁除單獨用于肝臟缺血再灌注損傷治療,也常與其他藥物聯用來治療該疾病,有研究表明烏司他丁聯合粉防己堿、維拉帕米等藥物可以對肝臟缺血再灌注損傷起到較好的保護作用,且聯合用藥的作用效果較單用更好[20-21]。以上研究說明,烏司他丁單獨及聯合用藥具有治療肝臟缺血再灌注損傷的作用。
1.3 烏司他丁與腦缺血再灌注損傷
大腦是最容易缺氧的器官,腦組織的缺血再灌注會加劇神經細胞壞死和腦組織水腫。細胞內Ca2+超載、自由基產生、興奮性氨基酸毒性和炎癥反應與腦缺血再灌注損傷密切相關,以上因素都可能引發細胞凋亡和壞死,進而導致疾病的發生[22]。Toll 樣受體4(TLR4)介導的核因子-κB(NF-κB)參與觸發中樞神經系統疾病的炎癥反應[23]。烏司他丁(3×103U/100 g)治療后腦水腫和梗死體積顯著減少,并抑制TLR4 和NF-κB 的表達,說明烏司他丁可以通過抑制TLR4/NF-κB信號通路來發揮穩定有效的神經保護作用[24]。此外,烏司他丁(3×105U·kg-1)可以重新激活Nrf2/血紅素加氧酶1(HO-1)的表達;從分子途徑可發現,Nrf2 抑制劑的治療可阻斷烏司他丁對氧化應激、細胞凋亡和炎癥的抑制作用,更加深入地論證了烏司他丁對于氧化應激的治療作用;另外,高表達的ROS、MDA 也被顯著抑制[25]。然而,烏司他丁對缺血再灌注損傷的改善并不能歸因于單一的分子途徑,其還可以通過抑制凋亡相關信號通路的表達,進而緩解缺血再灌注損傷誘導的細胞凋亡。實驗研究表明,對沙鼠進行缺血誘導后,烏司他丁的治療能抑制海馬神經元細胞的凋亡,從而改善缺血誘導的短期記憶障礙[26]。另外,烏司他丁還可以下調腦組織c-Jun氨基末端激酶(JNK)的表達,抑制細胞凋亡,這與抑制JNK 的傳導路徑有關[27]。
基質金屬蛋白酶-9(MMP-9)作為MMPs 的主要成員之一,其過表達可誘導血腦屏障被破壞,進而導致腦缺血惡化。腦缺血再灌注損傷會激活MMPs 水平,特別表現為MMP-9 水平升高[28]。研究發現烏司他丁(3×103U/100 g)可以顯著地逆轉缺血再灌注損傷誘導的MMP-9 的過度表達,減輕緊密連接蛋白-1 和occludin 的降解,表明烏司他丁可促進缺血性腦組織中血腦屏障完整性的恢復[29]。研究發現,腦缺血再灌注模型組大鼠通過伊文思藍(EB)染色呈現明顯可見的藍色,再灌注6 h 可發現EB 含量顯著升高,并且在24 h 達到峰值;給予烏司他丁后腦組織中EB 染色面積明顯減小,說明烏司他丁顯著降低了大鼠腦缺血再灌注損傷中血腦屏障的通透性[30]。綜上,烏司他丁可以通過抑制細胞凋亡、降低炎癥反應、減輕氧化應激以及改善血腦屏障的通透性來發揮腦缺血再灌注損傷的保護作用。
1.4 烏司他丁與心肌缺血再灌注損傷
心肌缺血再灌注損傷是由再灌注治療導致的急性心肌梗死。與其他類型的缺血再灌注損傷類似,氧自由基的損傷、炎癥因子的活化釋放及細胞凋亡損傷等機制皆會導致心肌缺血再灌注損傷的發生[31]。研究表明,ERK 信號傳導途徑在心肌缺血再灌注引起的損傷中表現出保護性作用,其主要機制包括激活抗凋亡信號傳導途徑和抑制促凋亡信號傳導途徑。烏司他丁(2.5×103U·kg-1)通過降低炎癥因子的表達,激活p-ERK 的表達并抑制心肌細胞凋亡,從而有效地緩解心肌缺血再灌注損傷[32]。同為MAPK 家族的p38/JNK,在烏司他丁治療心肌缺血再灌注損傷中也起著重要的作用。烏司他丁(1×104U·kg-1)可通過下調p38 和JNK 導致凋亡細胞數量減少,進而提高Bcl-2 水平,并且使Bax和caspase-3 水平下降[33]。因此,上述途徑的下調可能有助于抑制心肌缺血再灌注損傷中細胞的凋亡。另有實驗結果證明烏司他丁改善了區域缺血再灌注損傷后的心功能和降低梗死面積大小可能是通過抑制MPO 活性和降低TNF-α的表達有關[34]。自噬在心肌缺血再灌注損傷中也較為重要。烏司他丁的預處理可以使小鼠心肌梗死面積減少,LC3-Ⅱ蛋白表達降低,此外,烏司他丁(1×104U·kg-1)上調了p-Akt、p-mTOR 和p-P70S6K 蛋白表達。進一步研究發現,與模型組相比,在烏司他丁治療前30 min使用mTOR 抑制劑雷帕霉素處理細胞,可使細胞活力增加,乳酸脫氫酶表達降低[35]。由此可以發現烏司他丁通過mTOR 激活調節自噬,對心肌缺血再灌注損傷發揮保護作用。
1.5 烏司他丁與腎臟缺血再灌注損傷
腎臟缺血再灌注損傷通常會引起急性腎損傷、腎衰竭等多種腎臟相關疾病,因此治療腎臟缺血再灌注損傷是減少腎臟疾病的重要舉措。在腎臟缺血再灌注損傷期間,烏司他丁可以顯著降低尿素氮和肌酐水平,且TNF-α、IL-6 mRNA 表達降低等[36]。細胞黏附分子的活化,可以通過激活多種信號傳導途徑來啟動加劇細胞炎癥的發生[37]。研究發現,缺血再灌注損傷大鼠基礎腎臟功能損傷指標皆有所上升,且對體內細胞間黏附分子-1(ICAM-1)表達的檢測能夠發現,隨著對大鼠再灌注時間的延長,ICAM-1 表達也逐漸增加。證明了ICAM-1 在腎缺血再灌注損傷中至關重要,烏司他丁(1.25×104U·kg-1)可顯著抑制缺血再灌注損傷后各個階段ICAM-1 表達的升高,對腎缺血再灌注損傷有一定程度的保護作用[38-39]。實驗監測造模組和給藥組大鼠體內ATP,細胞內pH(pHi)和細胞內鈉(Nai)的動態變化,發現造模組的pHi 值呈現出嚴重的酸中毒,給予烏司他丁(5×104U·kg-1)后能較快地恢復ATP 的供應,且Nai 的恢復比對照組更早[40]。另外,觀察腎小管超微結構發現,烏司他丁給藥后能顯著減輕線粒體膜和嵴的腫脹程度,且跨細胞鈉梯度得以恢復[41],表明烏司他丁可能在缺血期間保護線粒體構象,并促進再灌注后離子泵的功能恢復。研究通過對缺血再灌注期間腎皮質和髓質組織氧分壓的測定來驗證烏司他丁是否對腎臟缺血再灌注有保護作用,結果表明與對照組相比,烏司他丁低劑量組和高劑量組的值完全恢復到缺血前的值,且各組之間的心肺參數沒有差異[42]。說明烏司他丁改善了再灌注后的腎臟氧合而沒有改變心肺參數,從而起到對腎臟的保護作用。因此,烏司他丁能夠對腎臟缺血再灌注損傷起到保護作用,但其確切機制還需要進一步的論證。
2 總結與展望
缺血再灌注損傷作為嚴重的生理疾病,其發病機制較為復雜。烏司他丁能夠通過多種調控途徑治療器官的缺血再灌注損傷,總結如表1所示。
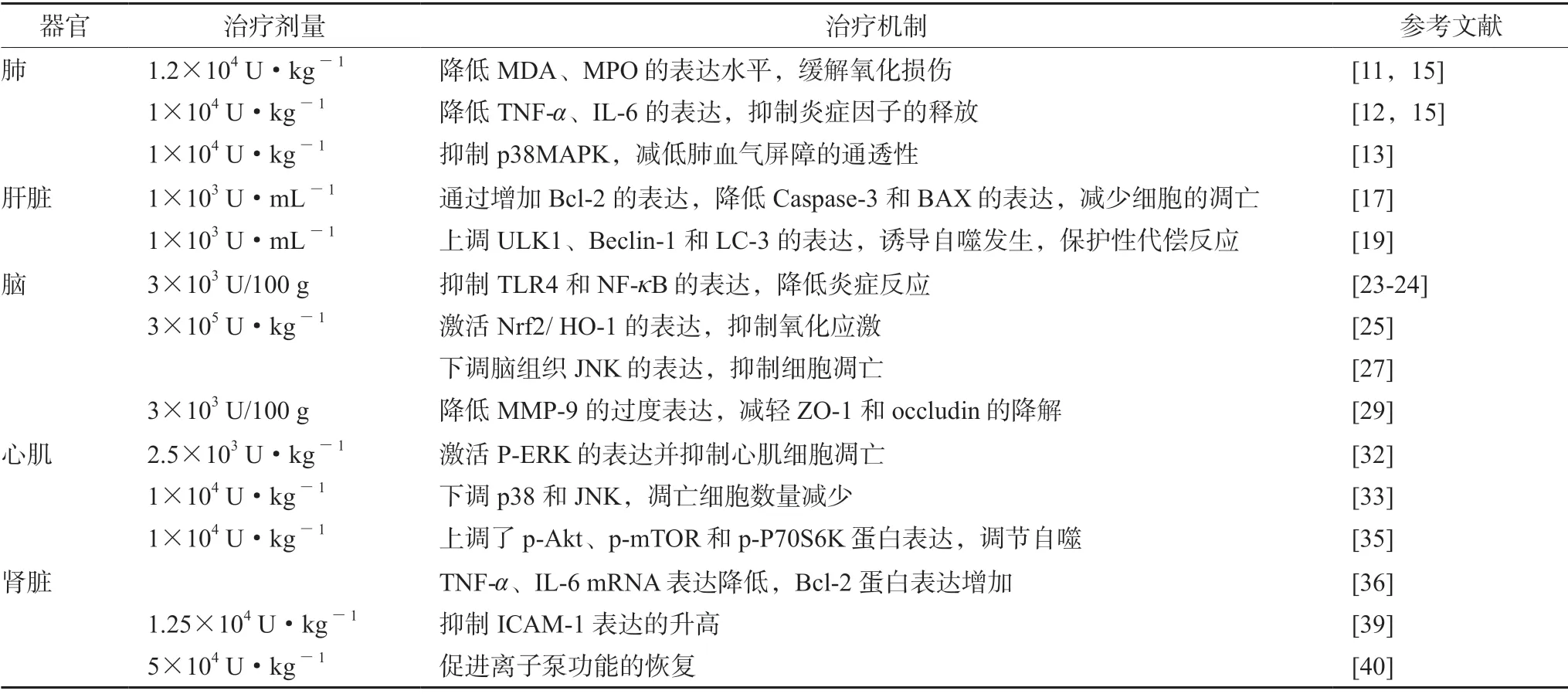
表1 烏司他丁治療器官缺血再灌注損傷的劑量及調控機制匯總Tab 1 Dose and regulation mechanism of ulinastatin for organ ischemia-reperfusion injury
根據目前的研究可知,TNF-α和IL-6 等促炎細胞因子水平升高導致缺血再灌注損傷的產生,MAPK和NF-κB 等分子信號通路介導了缺血再灌注損傷過程中的炎癥和氧化應激,細胞的凋亡和自噬的發生在缺血再灌注損傷中亦較為常見。烏司他丁通過降低TNF-α、IL-6、IL-1β等細胞因子而抑制炎癥反應。在減輕炎癥的信號通路機制方面,烏司他丁通過抑制TLR4、NF-κB、HMGB1 等分子通路發揮保護作用。另外,烏司他丁通過上調Bcl-2、下調caspase 和Bax 抑制缺血再灌注損傷后的細胞凋亡,下調p38 和JNK 信號通路的表達發揮保護作用。本文系統性地匯總了烏司他丁對于缺血再灌注損傷的不同保護機制,如抑制炎癥反應,降低氧化應激,抑制細胞的凋亡等。每一種作用機制都可以通過多個信號通路來介導,形成一個巨大的藥理學機制網絡。在基礎實驗研究中,我們發現不同劑量下烏司他丁對器官缺血再灌注損傷的作用機制不同,這對臨床中不同器官的損傷治療提供了劑量的參考,用藥時應酌情考慮劑量因素的影響。另外,研究也多涉及烏司他丁的聯合用藥對于缺血再灌注損傷的治療,這為缺血再灌注損傷提供了新的治療思路。盡管目前烏司他丁對器官缺血再灌注損傷的研究已經有了一定的進展,但仍存在一些問題需進一步的思考和解決。從目前的研究資料來看,烏司他丁對于腎、肺等器官的研究尚不深入,相關機制研究較少。而且,目前大部分研究仍處于動物實驗階段,臨床研究較為缺乏。另外,已有研究表明絲氨酸蛋白酶抑制劑可以通過抑制中性粒細胞釋放出來的絲氨酸蛋白酶來降低炎癥反應,而烏司他丁作為絲氨酸蛋白酶抑制劑,通過維持酶的平衡來緩解缺血再灌注損傷的報道較為缺乏,這也為以后烏司他丁更為深入的研究提供了思路和方向。因此,烏司他丁對缺血再灌注損傷的治療保護的機制研究還有很長的路要走,需要更多科學嚴謹的實驗來進一步探索和證明。然而,不可否認的是,烏司他丁是一種非常有前景的藥物,有望在器官缺血再灌注損傷的臨床治療方面發揮重大作用。