云南牛血液標本中哺乳動物正呼腸孤病毒(YNSZ/V207/2017)的分離鑒定
李占鴻,肖 雷,李卓然,宋子昂,謝佳芮,楊振興,朱 沛,李華春,廖德芳,楊 恒, 3
哺乳動物正呼腸孤病毒(Mammalian orthoreovirus, MRV)隸屬呼腸病毒科(Reoviridae)棘突呼腸病毒亞科(Spinareovirinae),可感染包括人、豬、牛、羊、貓、犬、猴、水貂、小鼠與蝙蝠在內的多種哺乳動物[1-2]。過去認為MRV僅對嚙齒類動物具有較強的致病性,近年大量的研究顯示MRV在人與其它哺乳動物上均表現出了較強的致病性,可引起腹瀉、腸炎、肺炎或腦炎等癥狀[3-7]。在蝙蝠上多次分離到基因重配MRV變異毒株,提示該病毒可通過蝙蝠在不同動物之間進行傳播[8-10],進而對公共衛生安全構成嚴重的威脅,是一種值得重視的人獸共患病病原。
MRV病毒粒子直徑約85 nm,呈二十面體對稱,基因組大小約23 kb,包含10個節段的雙鏈RNA(double strand RAN, dsRNA),分別為L1至L3基因節段(3.8~3.9 kb)、M1至M3基因節段(2.2~2.3 kb)、S1至S4基因節段(1.1~1.4 kb)[1-2]。MRV病毒粒子具有雙層衣殼結構:外層衣殼由M2、S1與S4節段編碼的μ1、σ1與σ3蛋白構成;內層衣殼由L1至L3基因節段編碼的λ3至λ1蛋白,M1與S2基因節段編碼的μ2蛋白與σ2蛋白等5種蛋白組成。μNS、σ1S與σNS等3種非結構蛋白由M3、S1(重疊基因)與S3節段編碼[1-2]。MRV的S1基因節段高度變異,編碼的α1蛋白可與細胞表面受體結合,具有凝集紅細胞的特性,決定病毒的血清型。通過血清中和實驗與血凝抑制試驗可將MRV分為MRV-1、MRV-2、MRV-3、MRV-4 4種血清型,其代表毒株分別為Lang-T1L(MRV-1)、Jones-T2J(MRV-2)、Dearing-T3D(MRV-3)與Ndelle-T4N(MRV-4)[1,11]。
我國已發現3種血清型MRV(MRV-1、MRV-2、MRV-3)的流行[7,12-13],其中MRV-1型在我國南方與北方均有流行,可引起感染動物出現腹瀉癥狀。2011年河北省饒陽縣的水貂(Mustlavison)中暴發MRV-1型感染導致的病毒性腹瀉,病死率高達100%[7];隨后在黑龍江省出現腹瀉癥狀的仔豬,云南省發生腹瀉死亡的野生樹鼩(Tupaiabelangeri)中均分離出MRV-1型毒株[14-15],表明我國流行的MRV-1型毒株可感染家養與野生動物,具有較強的致病性。在我國南方地區的短鼻果蝠(Cynopterussphinx)、鼠耳蝠(Myotisricketti)與普氏蹄蝠(Hipposiderospratti)中分離出基因重配MRV-1型毒株[16-17],進一步提示MRV-1可通過蝙蝠在野生動物和家畜之間進行擴散。因此,掌握我國MRV-1的遺傳背景、致病性與流行病學特征在動物疫病防控與保障公共衛生安全上具有重要的意義。
2017年本實驗室在云南省師宗縣設立哨兵牛(Sentinel cattle),定期采血進行動物病毒的監測與分離,從采集的動物血液樣本中,相繼分離出藍舌病病毒(Bluetongue virus, BTV)、帕利亞姆病毒(Palyam virus, PALV)、動物流行性出血病病毒(Epizootic haemorrhagic disease virus, EHDV)和MRV-1型病毒。本文對MRV-1型分離株的全基因組測序與序列分析,對當地牛、羊與豬中的MRV-1的流行情況進行了初步調查,為進行我國MRV毒株的遺傳多樣性分析、相應診斷方法的建立及其致病性研究等奠定了基礎。
1 材料與方法
1.1 細胞與主要試劑 幼倉鼠腎細胞(Baby hamster syrian kidney, BHK-21)保存于本實驗。胎牛血清與MEM培養基購自美國Gbico公司;核酸提取試劑、高純度瓊脂糖、反轉錄酶、核糖核酸酶S1、高保真Taq DNA聚合酶、一步法PCR試劑盒和DNA純化試劑盒均購自大連寶生物公司;DNA文庫構建試劑盒TruSeq DNA Sample Prep Kit V2.0購自美國Illumina公司。
1.2 哨兵動物與血液樣本的采集 2017年5月,在云南省師宗縣五龍鄉(經緯度:E103°59′38″,N24°36′41″,海拔 1 000 m)設置10頭1周歲且BTV與EHDV抗體及核酸檢測均為陰性的云南黃牛(Bostaurusdomesticus),作為病毒監測的哨兵動物。哨兵動物不使用任何疫苗與驅蟲藥物,飼養方式為自由放牧。在監控期的5月至10月,由當地職業獸醫每周從哨兵牛上分別采集全血、肝素鈉抗凝血與EDTA抗凝血樣品,保存于4 ℃ 冰盒,送至病毒檢測及分離實驗室:云南省熱帶亞熱帶動物病毒重點實驗室。
1.3 血液樣本中病毒的分離 取500 μL采集至哨兵牛的肝素鈉抗凝血,離心收集紅細胞(Red blood cells, RBCs),以磷酸鹽緩沖液(Phosphate buffer saline, PBS)洗滌RBCs 1次。加入滅菌水裂解RBCs,離心取上清接種生長為單層的BHK-21細胞,盲傳3~5代進行病毒分離。當感染細胞出現規律的細胞病變(Cytopathic effect, CPE)后,離心收集細胞上清-80 ℃凍存,留待進一步的鑒定。
1.4 分離物的RT-PCR鑒定 使用病毒核酸提取試劑盒進行待鑒定樣品的核酸提取,于95 ℃變性3 min,立即冰浴。取4 μL變性核酸為模板,以針對BTV、EHDV、PALV和阿卡斑病毒(Akabane virus, AKAV)的特異性引物[18-20]按一步法RT-PCR試劑盒說明書配制反應液,進行RT-PCR鑒定,反應條件如下:50 ℃逆轉錄30 min;94 ℃預變性 2 min;94 ℃ 變性30 s,55 ℃ 退火30 s,72 ℃ 延伸1 min,共進行30個循環。反應完成后,對擴增產物進行電泳膠回收,并進行測序與序列分析。
1.5 病毒基因組dsRNA的提取與電泳檢測 將待鑒定病毒接種75 cm2細胞瓶中生長為單層的BHK-21細胞,待感染細胞出現完全CPE時收集病變細胞,根據RNA提取試劑說明書提取細胞總RNA;使用S1核糖核酸酶按文獻報道的方法[21]降解宿主細胞RNA。以2%的高純度瓊脂糖凝膠進行電泳檢測,觀察病毒基因組的電泳帶型特征。
1.6 病毒的電鏡觀察 取培養的病毒液,8 000 r/min離心10 min,將離心后的上清轉入超速離心管中,以SW40轉頭,以40 000 r/min的轉速在Beckman超速離心機上離心3 h。將離心后的沉淀以適量TNE Buffer重懸,置于4 ℃過夜。次日將病毒液12 000 r/min離心5 min,取上清滴于銅網上,以2%磷鎢酸溶液(pH6.8)進行負染,在透射電鏡下觀察病毒粒子的形態。
1.7 病毒基因組cDNA的合成與PCR擴增 取純化后病毒基因組dsRNA為模板,采用全長cDNA擴增(Full-length amplification of cDNAs, FLAC)技術[21]進行病毒基因組cDNA的合成。以合成的cDNA為模板,使用高保真DNA Taq酶擴增病毒基因組,擴增程序如下:94 ℃預變性3 min;94 ℃變性30 s,60 ℃復性30 s,68 ℃延伸4 min,35個循環。反應結束后,取5 μL擴增產物進行電泳檢測,分析病毒基因組擴增產物的完整性。
1.8 病毒基因組的高通量測序 使用DNA純化試劑盒純化病毒基因組PCR擴增產物,使用Illumina公司的TruSeq DNA Sample Prep Kit DNA文庫構建試劑盒進行DNA文庫構建,進一步在Illumina Novaseq 6000測序平臺上進行高通量測序(High-throughput sequencing, HTS)。使用Trimmomatic軟件對獲取的數據進行質量控制與濾過處理,使用Edena(v3.131028)[22]與SOAPdenovo(v2.04)軟件[23]對濾過后的reads進行組裝以獲取病毒基因組序列。
1.9 序列分析與系統發育樹的構建 使用NCBI的ORF分析軟件(https://www.ncbi.nlm.nih.gov/orffinder/)分析病毒各基因編碼的蛋白。從GenBank數據庫下載MRV毒株的序列,通過Mafft-win序列[24]比對軟件與本研究中獲取的病毒序列進行比對,使用BioEdit計算核酸與氨基序列相似度(nt/aa),采用MEGA X軟件[25]以鄰近法(Neighbor-joining, NJ)構建系統發育樹,選擇的模型為遺傳距離法(P-distance),自舉檢驗值(Bootstrap)取1 000。
1.10 血清中和試驗 取2016至2017年在云南省師宗縣牛、羊與豬等家畜上采集的血清各40份,56 ℃處理30 min,進行血清中和試驗(Serum neutralization test, SNT)檢測MRV-1抗體,方法簡述如下:在BHK-21細胞上以Karber法[26]測定YNSZ/V207/2017毒株的TCID50,稀釋至100 TCID50備用。將1∶16倍的待檢血清稀釋加入96孔細胞培養板(50 μL/孔),加入100 TICD50的病毒懸液(50 μL/孔),充分混勻后于37 ℃作用2 h。以100 μL/孔的量加入BHK-21細胞懸液,將細胞板置于37 ℃培養7 d,逐日觀察CPE,并計算抗體效價,以抗體效價<1∶16判定為MRV感染陰性,抗體效價≥1∶16判定為MRV感染陽性。
2 結 果
2.1 病毒的分離與鑒定 2017年5月至10月,師宗縣設立的哨兵牛上共采集200份肝素鈉抗凝血,分別接種BHK-21細胞,共獲得8份可在BHK-21細胞上導致CPE的病毒分離物;經RT-PCR與測序鑒定,其中PALV 3株、BTV與EHDV各2株(表1);其中4號哨兵牛8月21日采集的血液樣本接種BHK-21細胞盲傳4代后,可致細胞出現“皺縮、聚集與脫落”的細胞病變(圖1)。提取病變細胞總RNA,進行BTV、EHDV、AKAV與PALV鑒定的結果均為陰性,將待鑒定的病毒命名為YNSZ/V207/2017。
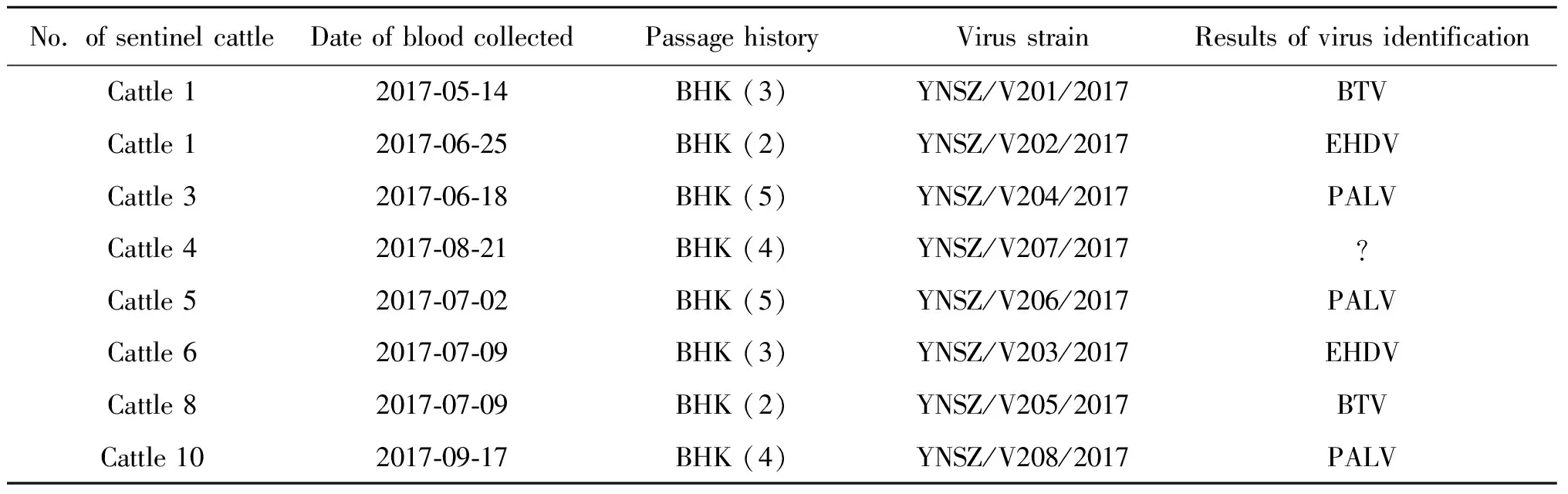
表1 2017年師宗縣哨兵牛血液中分離的病毒
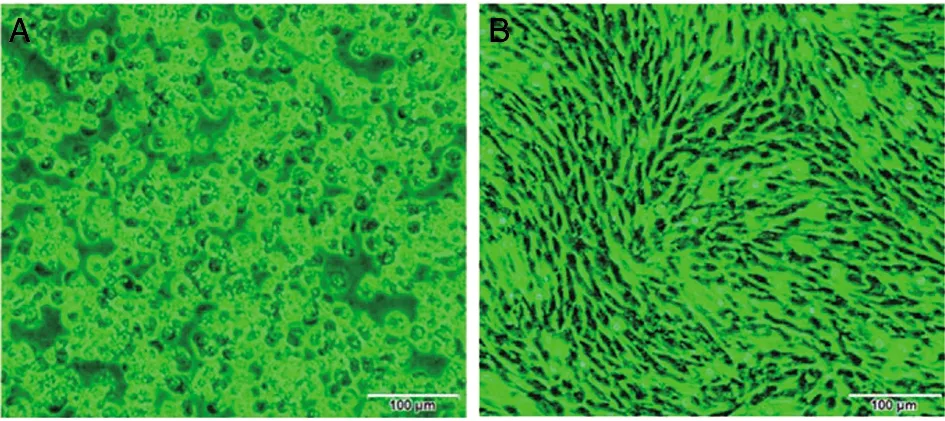
A為YNSZ/V207/2017在BHK-21細胞引起的細胞病變;B為正常BHK-21對照細胞
2.2 YNSZ/V207/2017毒株的基因組電泳與電鏡觀察結果 瓊脂糖凝膠電泳結果顯示,YNSZ/V207/2017病毒基因組為dsRNA,但在瓊脂糖凝膠上的遷移特征與本研究中分離的BTV、PALV及EHDV等存在明顯差異(圖2A)。電鏡下觀察可見YNSZ/V207/2017的病毒粒子直徑約70~80 nm,呈二十面體對稱的球形結構,與文獻[1-2]報道的呼腸孤病毒科病毒粒子的外形特征類似(圖3)。
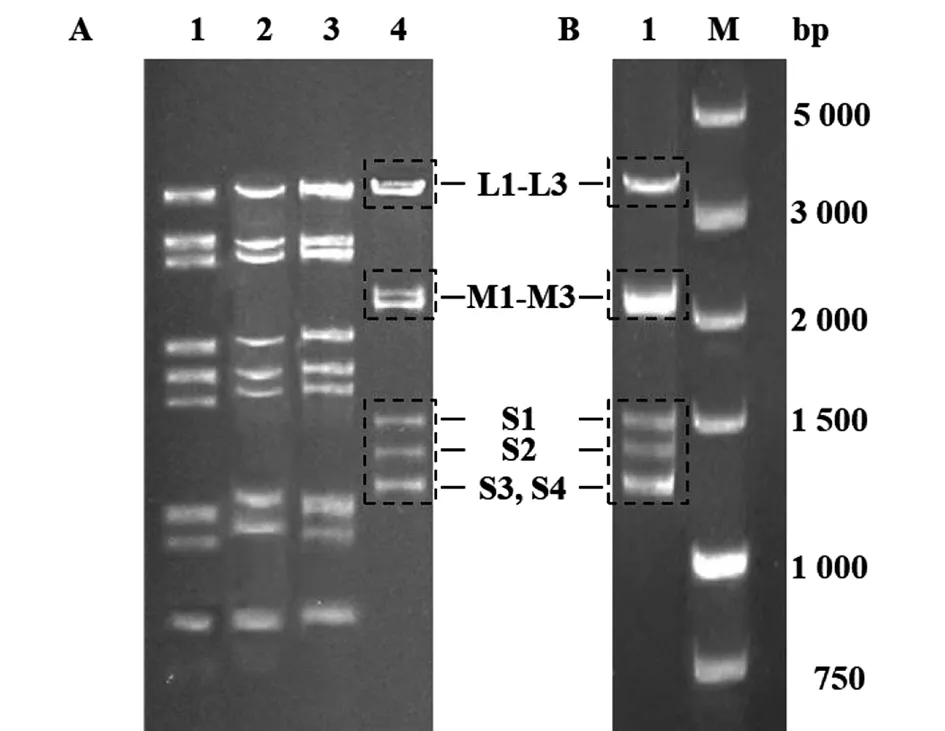
A:泳道1-4分別為BTV、EHDV、PALV與YNSZ/V207/2017毒株基因組dsRNA;B:泳道1為YNSZ/V207/2017毒株全基因組RT-PCR擴增產物,M為 DL 5 000 DNA Marker
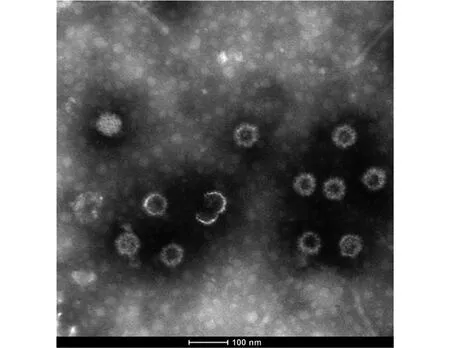
圖3 YNSZ/V207/2017電鏡觀察結果
2.3 YNSZ/V207/2017毒株的基因組RT-PCR擴增與測序 采用FLAC技術[21]進行YNSZ/V207/2017毒株基因組的RT-PCR擴增,電泳結果顯示該毒株的基因組DNA電泳帶型與基因組dsRNA一致(圖2B),表明成功完成了病毒的全基因組擴增。將純化后的擴增產物進行高通量測序。結果顯示,測序共計產生571 343 600條reads。數據過濾處理后得到361 940 200條高質量的reads(Q>30),進一步裝配出10個序列重疊群(contigs),每個堿基位點的測序深度在8 000至20 000之間,表明對YNSZ/V207/2017毒株的基因組進行了深度測序。
2.4 YNSZ/V207/2017毒株為MRV成員 YNSZ/V207/2017的基因組序列分析顯示,病毒基因組全長為23 605 bp,10個基因節段的長度在1 196 bp至3 915 bp之間,G+C含量(mol%)在44.12%至47.89%之間,病毒基因組可編碼11種不同的蛋白,其氨基酸殘基數在120 aa至1 290 aa之間;非編碼區(Non-Coding Regions, NCR)占基因組的3.09%,各基因節段5′ 端NCR的長度在12 bp至32 bp之間,3′端NCR的長度在32 bp至80 bp之間,5′與3′端具有CUA……UCAUC的保守序列(表2)。BLAST 分析顯示YNSZ/V207/2017各基因節段與不同血清型MRV對應基因節段的序列相似度最高,核苷酸(nt)序列相似度在93.6%至98.9%之間,編碼蛋白氨基酸(aa)序列相似度在98.6%至99.4%之間,表明待鑒定病毒為MRV。

表2 YNSZ/V207/2017毒株基因組特征
2.5 YNSZ/V207/2017毒株為MRV-1型 S1基因節段編碼的α1蛋白決定著MRV的血清型[11]。序列比對顯示YNSZ/V207/2017毒株的S1基因節段與MRV-1型毒株的序列相似度最高,核苷酸序列相似度在73.9%至98.5%之間,編碼α1蛋白的氨基酸序列相似度在77.7%至98.9%之間。在MRV S1基因節段構建的系統發生樹上,已知的4種血清型MRV毒株形成4個不同的進化分支,YNSZ/V207/2017毒株與蝙蝠、樹鼩、牛、水貂和人上分離的MRV-1型毒株[7,16-17]處于同一進化分支,在系統發育樹上歸集為一簇(圖4),進一步證實YNSZ/V207/2017毒株為MRV-1型。
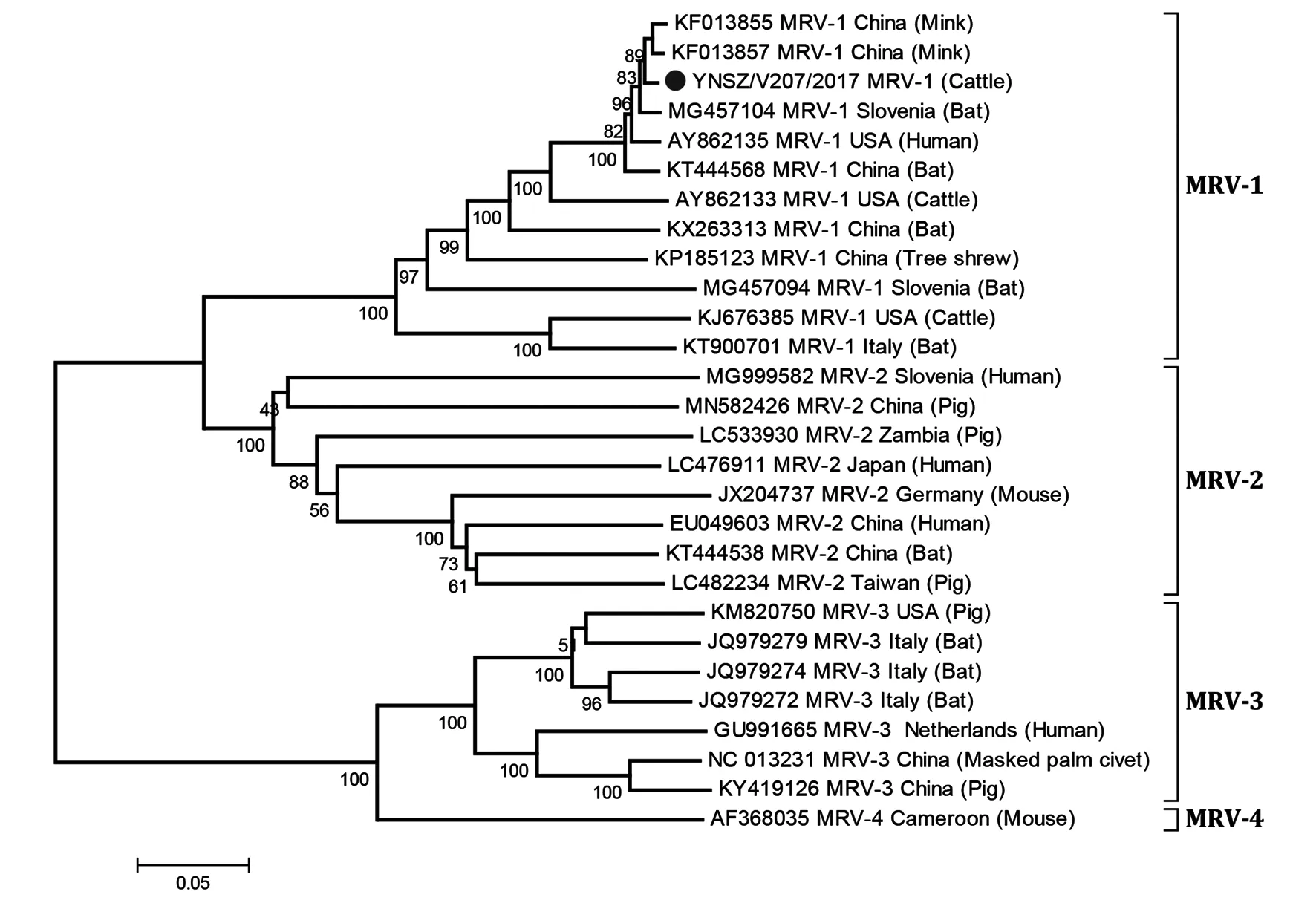
本研究分離的YNSZ/V207/2017毒株以“●”表示,其它MRV毒株以“GenBank號/血清型/分離國家/分離宿主”表示。
2.6 YNSZ/V207/2017毒株可能為基因重配毒株 序列分析顯示,YNSZ/V207/2017毒株的L1至L3、M2、M3與S3基因節段與人糞便樣品中分離的MRV-2型MRV2Tou0毒株序列相似度最高,核苷酸序列相似度在97.0%(L3)至98.9%(S3)之間,編碼蛋白氨基酸序列相似度在98.6%(μNS)至99.4%(λ2)之間;而M1、S1、S2與S4基因節段分別與白尾鹿(Odocoileusvirginianus)、水貂(Mustlavison)、果子貍(Pagumalarvatataivana)和棕蝠(Eptesicusserotinus)上分離的不同血清型MRV毒株對應基因節段序列相似度最高(表3);在構建的系統發生樹上,YNSZ/V207/2017毒株的L1、L3與M1形成相對獨立的進化分支,而L2、M2、M3、M4、S3與S4等基因節段則與分離自人、蝙蝠、豬和果子貍等的不同血清型MRV毒株聚為一簇(圖5),提示YNSZ/V207/2017可能為基因重配毒株。
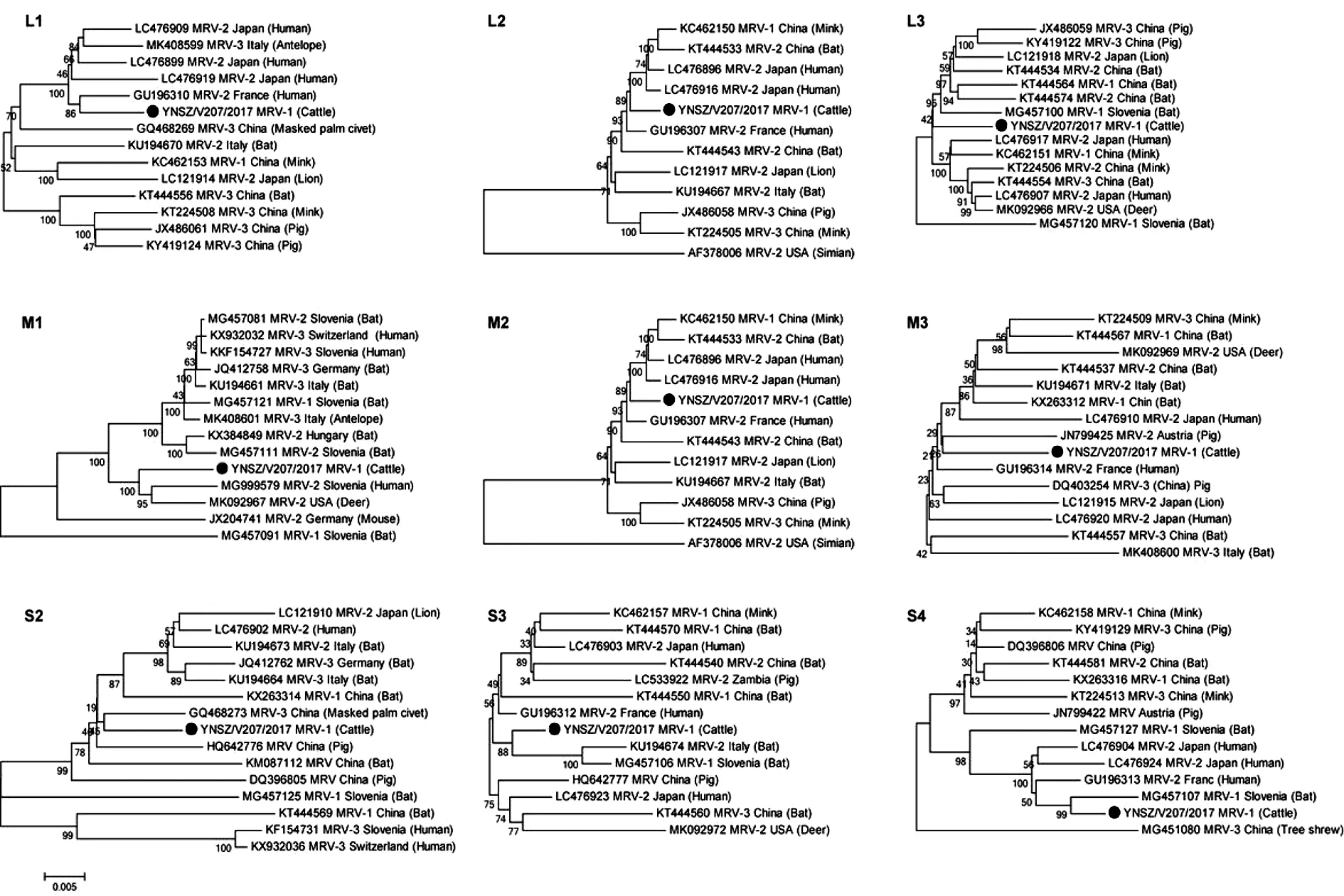
本研究分離的YNSZ/V207/2017毒株以“●”表示,其它MRV毒株以“GenBank號/血清型/分離國家/分離宿主”表示。
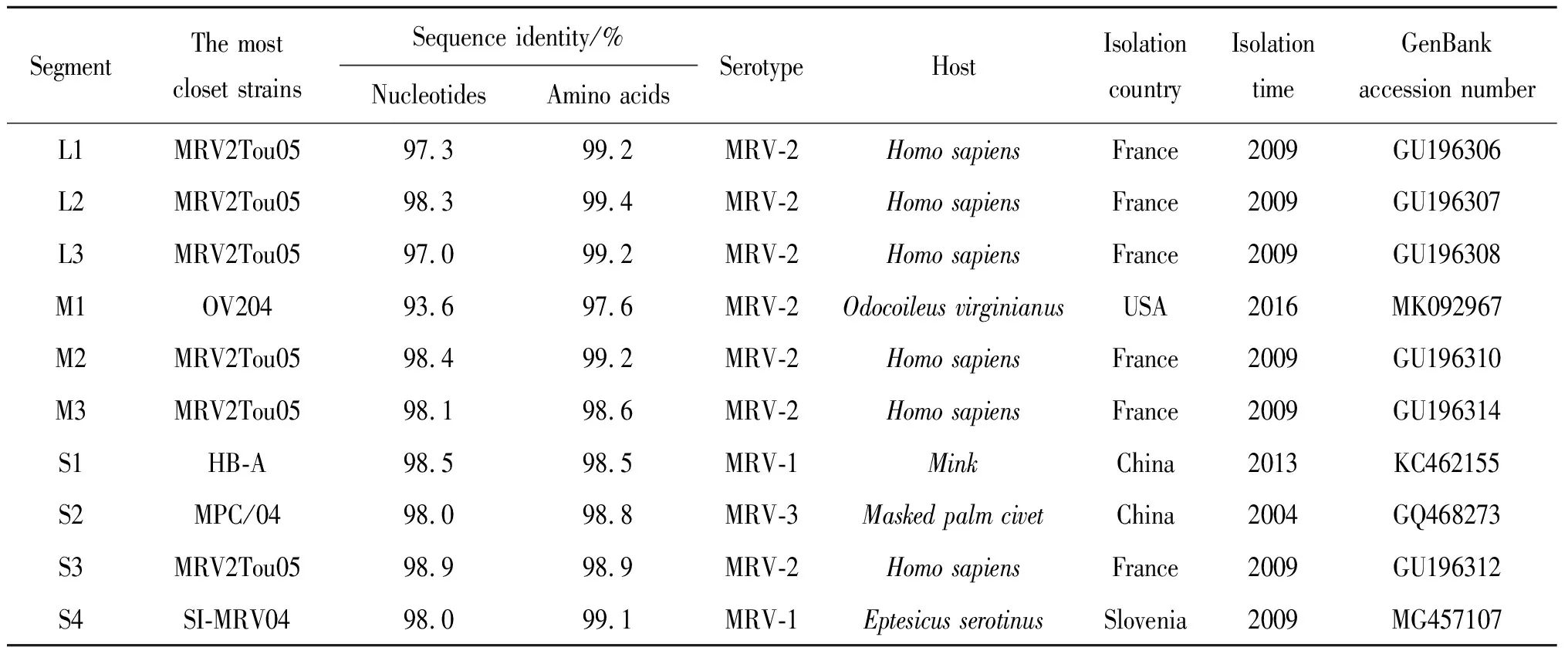
表3 YNSZ/V207/2017毒株各基因片段與GenBank中其它MRV毒株序列的最高相似度
2.7 MRV-1型病毒在當地家畜的流行病學初步調查 為分析MRV-1型病毒在當地家畜的感染情況,通過血清中和試驗,對2016至2017年采集自師宗縣牛、山羊和豬的血清各40份進行MRV-1中和抗體的檢測。實驗結果顯示,牛血清中13份為陽性,陽性率32.5%;山羊血清中檢測出8份陽性樣本,陽性率為20.0%;而豬血清中檢測到17份陽性,陽性率為42.5%,表明師宗縣家畜中普遍存在MRV-1型的感染,豬的感染率高于牛和羊。
3 討 論
近年來,嚴重急性呼吸綜合征冠狀病毒(SARS-CoV)[27]、中東呼吸綜合征冠狀病毒(MERS-CoV)[28]、埃博拉病毒(Ebola virus)[29]與嚴重急性呼吸綜合征冠狀病毒-2(SARS-CoV-2)[30]等來源于蝙蝠與其它野生動物的病毒頻繁出現跨物種傳播,對人類公共衛生安全與社會發展造成了嚴峻挑戰。MRV呈世界范圍流行,多種哺乳動物均為易感宿主,可導致病毒發生跨物種傳播;蝙蝠體內基因重配變異MRV毒株的不斷發現[8-10],病毒引起人、家畜和野生動物發病的報道不斷增多[3-7,14-15],表明MRV的跨物種傳播頻率與致病性正在發生改變。
MRV-1型在我國南方與北方地區均有分布,目前國內已有從水貂、豬、樹鼩、蝙蝠和果子貍中分離出該血清型病毒的報道[7,14-17]。本研究從設立于師宗縣的哨兵牛中陸續分離出BTV、EHDV和PALV等蟲媒病毒,表明多種動物蟲媒病毒流行于云南省。BTV可引起綿羊群中藍舌病的暴發,發病動物病死率高達30%,是世界動物衛生組織規定的法定報告疫病,病毒如果向我國北方綿羊養殖集中的地區擴散,可能會給我國綿羊養殖業帶來較大危害。由于國內未見從牛上分離MRV的報道,因此實驗之初,通過蟲媒病毒特異性的RT-PCR方法對YNSZ/V207/2017毒株的鑒定并不成功。進一步通過透射電鏡觀察病毒粒子,結果發現該分離株具有呼腸孤病毒科病毒粒子特征,同時瓊脂糖凝膠電泳結果顯示該毒株基因組為雙鏈RNA,以上結果均提示分離毒株可能歸屬于呼腸孤病毒科,但準確鑒定分離病毒的種屬關系并掌握其遺傳背景,仍需獲取病毒的全基因組序列。
通過高通量測序(HTS)獲取病毒基因組序列推動了病毒的鑒定、分類學、進化與溯源、診斷試劑、變異與疫苗等領域的研究[31-33]。本實驗室前期建立了通過全長cDNA擴增與HTS獲取呼腸病毒科病毒全基因組序列的技術[21],我們通過該技術獲取了YNSZ/V207/2017毒株的全基因組序列,進而確認了病毒的身份:該毒株與GenBank中收錄的MRV核酸序列相似度在93.6%至98.9%之間,編碼蛋白氨基酸序列相似度在98.6%至99.4%之間,該毒株的S1/σ1與MRV-1型毒株的序列相似度達98.5%/98.9%,在S1基因節段構建的系統發生樹上與MRV-1型毒株聚為一支,表明YNSZ/V207/2017毒株為MRV-1型。
基因重配是基因組分節段RNA病毒進化主要動力之一,因此,對病毒的免疫原性、致病性、傳播與感染特性等均有深刻影響,歷史上幾次大范圍流感病毒的暴發與流行,均與基因重排產生變異毒株有關[34]。MRV基因組分節段,可感染幾乎所有的哺乳動物,為病毒通過基因重配產生多種形式的變異毒株創造了條件;蝙蝠免疫系統的特殊性和生活習性,使其成為產生MRV基因重配變異毒株的“病毒庫”,在MRV傳播和變異中扮演重要角色[8-10,16-17]。本研究分離MRV-1型毒株的L1至L3、M2、M3與S3基因節段與人上分離的MRV-2型毒株親緣關系最近;而M1、S1、S2和S4基因節段則分別與白尾鹿、水貂、果子貍和棕蝠分離的不同血清型MRV毒株序列相似度最高,這與我國腹瀉病豬分離的MRV-1與MRV-2型毒株的基因重配特征類似[12,14],提示MRV可通過基因重配進而適應不同的宿主環境,推動病毒在不同宿主間傳播與擴散。
初步的流行病學調查結果顯示,在云南省師宗縣采集的血清樣本中,牛、羊和豬的MRV-1抗體陽性率分別達到32.5%、20.0%和42.5%,表明該血清型病毒在當地的家畜中廣泛流行。目前有關我國家畜中MRV的流行病學調查研究報道較少,在四川10個豬場采集的78份腹瀉豬糞樣本中MRV-2的陽性率為14%[12],而師宗縣豬血清中MRV-1中和抗體陽性率為42.5%,我們認為除去病毒的差異外,飼養環境的不同也是造成兩地MRV感染率差異較大的原因。四川省生豬的規模化養殖程度較高,而師宗縣生豬養殖以散養為主;MRV對外界環境的抵抗力強,高濕度有利于病毒的存活[35-36],我們推測病毒可通過感染動物的糞便污染水源,而后通過糞口途徑感染造成病毒在當地動物中的流行。由于目前尚無MRV疫苗,因此,通過控制環境衛生仍是控制MRV在動物中擴散的有效措施。
目前,不同血清型MRV毒株在我國的遺傳背景、流行情況、致病性等問題尚不完全清楚。在進一步的工作中,我們計劃建立不同血清型MRV的核酸檢測技術,在云南省開展家畜與野生動物MRV的流行病學調查研究,開展病毒分離及全基因組測序,分析流行株的致病性,為MRV的防控提供科學依據與技術保障。
利益沖突:無
引用本文格式:李占鴻,肖雷,李卓然,等.云南牛血液標本中哺乳動物正呼腸孤病毒(YNSZ/V207/2017)的分離鑒定[J].中國人獸共患病學報,2022,38(1):1-9.DOI:10.3969/j.issn.1002-2694.2021.00.167

