腐霉利和咯菌腈混用對黃瓜灰霉病菌的聯合毒力及藥劑殘留動態
張江兆, 徐重新, 沈 燕,3, 高美靜,盧莉娜, 盧 飛,3, 劉賢金*,
(1. 南京農業大學 植物保護學院,南京 210095;2. 江蘇省食品質量安全重點實驗室——省部共建國家重點實驗室培育基地,南京 210014;3. 農業農村部農產品質量安全控制技術與標準重點實驗室 (南京),南京 210014)
黃瓜灰霉病是由灰葡萄孢Botrytis cinereaPers 引起的一種植物死體營養型病害。灰葡萄孢具有繁殖速度快、產孢量大等特點,由其侵染引起的灰霉病是威脅溫室和大田蔬菜種植業健康發展的重要病害之一[1-3]。目前尚未培育出抗灰霉病的黃瓜品種,因此化學防治仍然是黃瓜灰霉病防控的主要方式[4]。單一農藥的頻繁及過量使用不僅會導致病蟲害抗藥性的產生,同時也易對農作物及生態環境安全產生不良影響。將不同作用機制的農藥進行聯合應用,不僅能夠減輕農藥對單一靶標的刺激,降低抗性風險,同時通過聯合應用所產生的增效作用,也能夠在達到目標防效的基礎上減少農藥施用量,從而降低農藥殘留,在一定程度上提升農產品質量安全[5]。
腐霉利 (procymidone) 屬二甲酰亞胺類殺菌劑,是田間防治灰霉病的常用農藥,其主要通過靶向抑制灰葡萄孢甘油三酯的合成,改變細胞通透性而造成胞內電解質滲漏,最終引起菌體繁殖受阻乃至死亡,從而對患病農作物起到治療和保護作用[6]。咯菌腈 (fludioxonil) 為苯并吡咯類殺菌劑,對灰葡萄孢具有高度專一性,其主要通過抑制灰葡萄孢信號傳導中有絲分裂活化蛋白激酶/組氨酸激酶的磷酸化,從而促進菌體中甘油等物質的合成,達到阻止菌體細胞生長繁殖的目的[7-8]。
Wang 等[9]報道,2020 年在全國多地韭菜樣品抽樣檢測中,腐霉利殘留超標情況屢有發生,分析其原因應是過量施藥導致,這不僅嚴重威脅農產品安全和人體健康,也極易導致病原菌產生抗藥性。有研究表明,浙江省草莓灰霉病菌對腐霉利的抗藥性頻率為71.5%,內蒙古灰霉病菌對腐霉利的抗藥性頻率已達90%以上。灰葡萄孢對咯菌腈敏感性很強,很少出現抗藥性菌株[10]。鑒于腐霉利和咯菌腈作用方式不同,因此通過將兩種農藥聯合應用,很有可能提升藥劑對病原菌的抑制作用,從而減少農藥施用量,一方面能降低農藥殘留,提升農產品質量安全水平,另一方面也有望降低病原菌對咯菌腈的抗藥性風險并延緩其對腐霉利的抗藥性發展。
目前已有研究顯示,腐霉利和咯菌腈在番茄灰霉病防治中無交互抗性現象,將兩者聯合應用有可能獲得較為理想的復配增效藥劑[11],但尚未見有關腐霉利和咯菌腈復配在黃瓜灰霉病防治中應用的研究報道。基于此,本研究擬采用菌絲生長速率法,通過測定腐霉利和咯菌腈單獨使用的毒力及混配組合的聯合毒力,探究了兩種殺菌劑的最佳混配增效比,進而初步明確了其混配增效機理,同時通過優化后的高效液相色譜-串聯質譜(HPLC-MS/MS) 檢測方法,探究了混配劑減量施用后在黃瓜上的殘留規律,以期獲得一種安全、綠色、減量不減效的混配型新制劑。
1 材料與方法
1.1 供試材料
1.1.1 菌株 黃瓜灰霉病菌野生菌株,由本課題組保存,于2019 年從發病黃瓜上通過單孢分離獲得,經菌株特征序列鑒定為灰葡萄孢Botrytis cinereaPers。
1.1.2 藥劑及主要儀器 99% 咯菌腈 (fludioxonil)標準品,上海源葉生物科技有限公司;98% 腐霉利 (procymidone) 標準品,寶如億 (北京) 生物技術有限公司;50%咯菌腈可濕性粉劑 (WP),瑞士先正達作物保護有限公司;50%腐霉利 WP,山東省青島凱源祥化工有限公司。
AB Triple Quad? 4500 (美國AB SCIEX 公司);QL-901 渦旋混合器 (江蘇海門市麒麟醫用儀器廠);R10.v.v 食品切碎攪拌機 (法國Robot Coupe公司) 等。
1.2 試驗方法
1.2.1 供試培養基 馬鈴薯葡萄糖瓊脂培養基(PDA):200 g 馬鈴薯,16 g 瓊脂粉,20 g 葡萄糖,用超純水定容至1 L,于115 ℃ 滅菌20 min,待用。
1.2.2 抑菌活性測定 采用菌絲生長速率法[12]。分別稱取適量腐霉利及咯菌腈標準品至10 mL 容量瓶中,以丙酮溶解,用無菌水定容至10 mL,配成10 g/L 的母液。取適量母液,將腐霉利和咯菌腈分別按照質量比1∶2、1 : 1 和2∶1 的比例配成混合藥液,用無菌水稀釋,加入PDA 培養基中,配制成混合藥液最終質量濃度分別為0.005、0.01、0.02、0.04、0.08、0.16、0.32 和0.64 mg/L的含藥培養基平板;同時配制腐霉利和咯菌腈最終質量濃度均為0.005、0.01、0.02、0.04、0.08、0.16、0.32 和0.64 mg/L 的單劑含藥平板;以無藥PDA 平板作對照。將保存的黃瓜灰霉病菌在25 ℃下活化3 d 后,挑取菌絲,接種至PDA 培養基上繼續活化培養3 d,沿菌落邊緣打取菌碟,分別接種于各含藥及對照PDA 培養基平板中央。每處理設置3 個重復。25 ℃ 避光培養3 d 后,采用十字交叉法測量菌落直徑,通過DPS 分析軟件得出EC50值及毒力回歸曲線。
增效作用分析采用Wadley 法[13]:首先構建單劑的劑量反應曲線,并通過概率對數轉換校正得到線性方程,計算出單劑的EC50值,根據所得單劑的EC50值計算混劑的EC50(th),即預期有效抑制中濃度理論值,mg/L。計算公式見式 (1)。
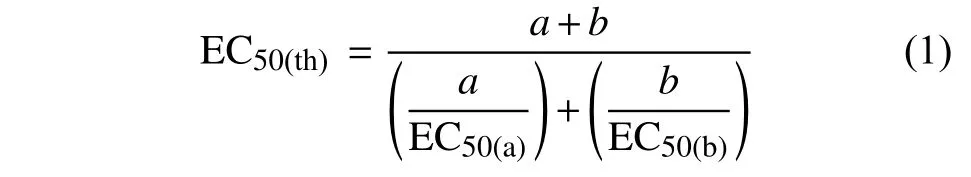
式 (1) 中:a、b分別表示兩種藥劑在混劑中所占的比例;EC50(a)、EC50(b)分別指a、b 兩種單劑對病原菌的有效抑制中濃度,mg/L。
根據式 (2),計算混劑理論EC50值 (EC50(th))與實際EC50值 (EC50(ob),mg/L) 的比值,確定增效比 (SR)。
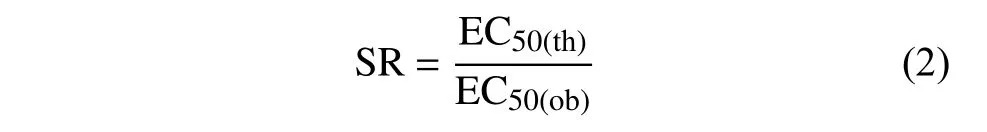
若SR>1.5,認為該混劑表現出增效作用;SR<0.5,認為其表現為拮抗作用;0.5≤SR≤1.5,則認為該混劑表現為相加作用。
1.2.3 田間試驗 2021 年5 月至2021 年11 月于江蘇省南京市溧水區江蘇省農業科學院溧水試驗基地溫室,根據NY/T 788—2004《農藥殘留試驗準則》[14],選取黃瓜處于生長期到成熟期的地塊進行試驗。各小區面積均在30 m2以上,每處理設3 個重復,同時設清水對照組,均施藥1 次。50%腐霉利WP 和50%咯菌腈WP 單劑施藥劑量均為有效成分150 g/hm2,兩者質量比1 : 1 混配劑的施藥劑量為總有效成分150 g/hm2。用水量為600 L/hm2。對黃瓜進行葉面噴施,并于藥后2 h及1、3、5、7、10、14、21 d 取樣,待前處理及分析測定。
1.2.4 儀器條件 檢測方法參考GB 23200.121—2021《食品安全國家標準 植物源性食品中331 種農藥及其代謝物殘留量的測定 液相色譜-質譜聯用法》[15]。
色譜條件:Agilent Zorbax Eclipse PLUS C18色譜柱 (2.1 mm × 50 mm,1.8 μm);柱溫40.0 ℃;進樣量3.0 μL,流速0.3 mL/min;流動相A 為0.1%甲酸水溶液,流動相B 為0.1%甲酸甲醇溶液,梯度洗脫條件見表1。

表1 高效液相色譜梯度洗脫條件Table 1 The gradient elution conditions of HPLC
質譜條件:ESI+多反應監測模式掃描,離子源溫度為550 ℃,氣簾氣壓力為35 MPa,電噴霧電壓5 500 V,霧化氣壓力310 kPa。
腐霉利檢測母離子對:m/z286.0,m/z284.0;子離子對:m/z109.1,m/z156.0 (定量離子);碰撞電壓24 V。咯菌腈檢測母離子對:m/z266.1;子離子對:m/z158.0,m/z229.0 (定量離子);碰撞電壓46 V、17 V。
通過調整、優化液相色譜流動相、梯度洗脫條件、溫度以及各化合物的質譜參數,最終確定了上述最優的HPLC-MS/MS 檢測條件。在此條件下,各化合物均可獨立出峰,且峰形良好,互不干擾。
1.2.5 樣品前處理
提取:田間采集的黃瓜樣品經高速研磨勻漿后,稱取10 g (精確至0.01 g) 置于50 mL 離心管中,加入10 mL 乙腈,于2 500 r/min下渦旋振蕩提取1 min;再依次加入1 g NaCl、4 g 無水MgSO4、1 g 檸檬酸鈉二水合物及0.5 g 檸檬酸二鈉鹽倍半水合物,2 500 r/min 下振蕩1 min;于5 000 r/min 下離心5 min,取2 mL 提取液,待凈化。
凈化:在裝有2 mL 上述黃瓜樣品提取液的離心管中加入50 mg PSA,于2 500 r/min 下渦旋分散固相萃取1 min,5 000 r/min 下離心5 min;取上清液過0.22 μm 有機濾膜,待HPLC-MS/MS檢測。
1.2.6 分析方法確證 采用色譜純乙腈配制腐霉利和咯菌腈質量濃度均為10 mg/L 的1 : 1 混合標準工作溶液,分別在空白黃瓜基質中添加適量混合標準工作溶液,得到兩種農藥添加水平均為0.01、0.02 及0.05 mg/kg 的黃瓜添加樣品,每添加水平重復5 次,測定回收率及相對標準偏差(RSD)。采用凈化后的空白黃瓜基質溶液,將10 mg/L 的1 : 1 混合標準工作溶液逐級稀釋,配制成0.000 1、0.000 2、0.000 5、0.01、0.02、0.05、0.1、0.2 和0.5 mg/L 的基質匹配混合標準溶液,根據所確定的檢測條件及儀器類型,選擇5 個濃度點以上繪制基質匹配標準曲線。
采用標準曲線法定量,各農藥組分含量按公式 (3) 進行計算。
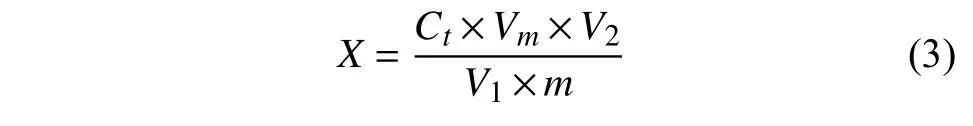
式中:X為供試樣品中被測組分含量,mg/kg;Ct為根據標準工作曲線得到的樣品溶液中被測組分的質量濃度,mg/L;m為所稱取樣品的質量,g;Vm為實測的樣品提取液總體積,mL;V1為移取的提取液體積,mL;V2為定容體積,mL。
2 結果與分析
2.1 腐霉利、咯菌腈及其混配藥劑對菌絲生長的影響
結果 (表2) 顯示:腐霉利和咯菌腈對黃瓜灰霉病菌菌絲生長均具有較強的抑制作用,其中咯菌腈對該菌的抑制活性約是腐霉利的2.5 倍。腐霉利和咯菌腈按質量比1 : 2 和2 : 1 混配施藥后,增效系數 (SR) 分別為1.0 和0.6,對該菌的抑制活性表現為簡單的相加作用;而二者按質量比1 : 1 混配后,抑制作用EC50值分別是咯菌腈和腐霉利單劑的5.3 倍和7.4 倍,SR 高達5.0,表現為極強的聯合增效作用。
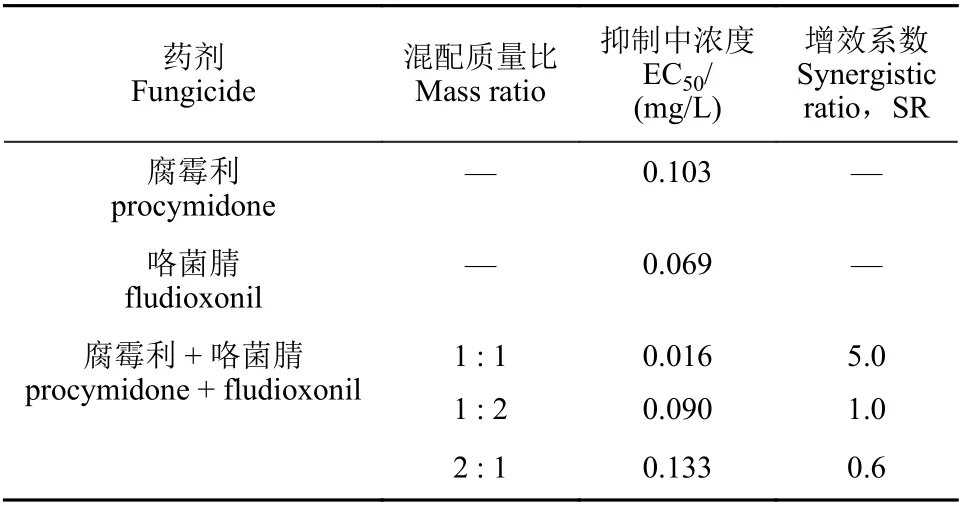
表2 腐霉利和咯菌腈單獨使用及混配組合對灰葡萄孢菌絲生長的毒力測定Table 2 Toxicity of the single agent and mixtures of procymidone and fludioxonil to B. cinerea
2.2 腐霉利、咯菌腈及其混配藥劑對菌絲形態的影響
為進一步了解腐霉利與咯菌腈按質量比1 :1 混配后對黃瓜灰霉病菌的聯合毒力作用,采用掃描電鏡對經混配藥劑處理3 d 后的菌絲形態進行了觀察,結果如圖1 所示。其中,未經藥劑處理的空白對照組 (圖1A) 菌絲大多充盈飽滿,未觀察到菌絲滲透性加強的現象;經腐霉利單劑處理后,菌絲細胞膜滲透性明顯增強,胞內物質大量外泄,大量菌絲呈現出干癟、皺縮的狀態 (圖1B);經咯菌腈單劑處理后,菌絲體表面出現少量凸起,胞內物質外滲并附著在菌絲表面,但菌絲整體結構仍呈較為飽滿的狀態 (圖1C);而經腐霉利與咯菌腈混配劑處理后,菌絲不僅表現出明顯的皺縮現象,同時內容物也出現大量外滲且集中附著于菌絲表面,菌絲表觀形態受損程度明顯比兩種單劑處理組嚴重 (圖1D)。結果進一步印證了腐霉利與咯菌腈按質量比1 : 1 混配對黃瓜灰霉病菌具有顯著的聯合增效作用。

圖1 掃描電鏡觀察兩種單劑及混配藥劑對黃瓜灰霉病菌菌絲表觀形態的影響(4 k ×)Fig. 1 SEM observation of the effects of two single agents and the mixture on the mycelial morphology of B. cinerea (4 k ×)
2.3 檢測方法確證
所采用的HPLC-MS/MS 檢測方法對腐霉利和咯菌腈的標準曲線方程分別為y= 2 137.1x+ 1 731.3,R2= 0.998 8 和y= 23 186.8x+ 29 783.4,R2= 0.999 6,表明該方法下兩種農藥的峰面積和進樣質量濃度間呈良好的線性關系。方法的定量限 (LOQ) 為0.01 mg/L。腐霉利和咯菌腈在空白黃瓜樣品中的添加回收率分別為100%~102%和94%~96%,RSD分別為1.7%~5.3%和2.8%~3.4%,均在農藥殘留檢測規范允許范圍內[14],說明該檢測方法可用于腐霉利和咯菌腈在黃瓜上施用后殘留動態的定量分析。
2.4 殘留消解動態
采用HPLC-MS/MS 檢測方法對溫室葉面噴施兩種單劑及混配藥劑后的黃瓜樣品進行分析,結果顯示:腐霉利單劑在黃瓜中的原始沉積量為1.77 mg/kg,咯菌腈單劑的原始沉積量為1.32 mg/kg;而兩種農藥按質量比1 : 1 混配施用后,腐霉利和咯菌腈在黃瓜中的原始沉積量分別為1.36 mg/kg 和0.70 mg/kg,均比各自單劑明顯降低。針對施藥后21 d 的黃瓜樣品進行農藥最終殘留量分析,結果表明:腐霉利和咯菌腈單劑的最終殘留量分別為0.102 mg/kg 和0.125 mg/kg;而兩種農藥按1 : 1 混配后,腐霉利和咯菌腈的最終殘留量分別為0.042 mg/kg 和0.023 mg/kg,比各自單劑分別降低了59%和82%。消解動態分析表明,兩種農藥在黃瓜中的殘留量與施藥后間隔期呈指數關系(圖2 和圖3),其消解動態符合一級反應動力學方程,混配藥劑中兩種農藥的半衰期均比各自單劑顯著縮短 (表3),表明聯合用藥可有效降低兩種農藥的殘留風險。

圖2 腐霉利單劑及混劑的殘留消解曲線Fig. 2 The digestion curves of procymidone single and mixture agents
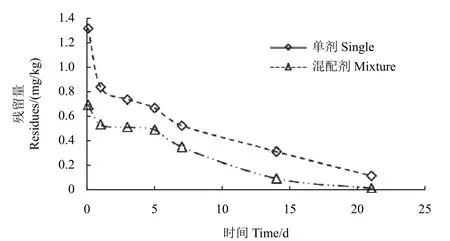
圖3 咯菌腈單劑及混劑的殘留消解曲線Fig. 3 The digestion curves of fludioxonil single and mixture agents

表3 腐霉利和咯菌腈在黃瓜中的消解動態Table 3 Digestion dynamics of procymidone and fludioxonil in cucumber
3 討論與結論
目前尚未見有關腐霉利與咯菌腈復配藥劑在農作物病蟲害防控上應用或研究的文獻報道。本研究首次探究了這兩種農藥混配后對黃瓜灰霉病菌的聯合毒力,并通過室內抑菌活性試驗,確定了兩種農藥按質量比1 : 1 混配后對黃瓜灰霉病菌表現為顯著的增效作用,增效系數 (SR) 達5.0。該增效系數雖低于王翀[16]報道的啶酰菌胺與腐霉利按照1∶2 混配后對草莓灰霉病菌 (同為灰葡萄孢) 的增效系數 (10.34),但明顯高于劉圣明等[17]報道的咯菌腈與氟啶胺按1∶3 混配后對番茄灰霉病菌 (灰葡萄孢) 的增效系數(2.09)[16-17]。由于不同藥劑之間的相互影響不盡相同,關于腐霉利和咯菌腈混配在黃瓜灰霉病防控中的實際應用價值還有待后期進一步綜合研究。根據掃描電鏡觀察結果,腐霉利與咯菌腈按質量比1 : 1 混配后,對黃瓜灰霉病菌菌絲形態所造成的損傷程度均比兩種單劑嚴重,存在疊加放大效應,但其具體的分子機理尚不清楚。據文獻報道的腐霉利和咯菌腈的抑菌作用機理[18-20],我們推測:兩種農藥混用后,腐霉利通過改變病原菌細胞膜通透性而引起菌絲內外滲透壓失衡,瓦解了菌絲的正常形態;與此同時,咯菌腈則持續激活病原菌的高滲透甘油信號通路,以維持其內部膨壓,從而加劇了病原菌菌絲滲透失衡的程度,造成菌絲干癟以及大量內容物滲出,最終表現為協同增效作用。此外,菌絲體表還出現了細胞膜褶皺和糜爛現象,這可能是由于咯菌腈較腐霉利提前作用,導致菌絲充盈膨脹后,胞內物質溢出所致。
本研究將腐霉利和咯菌腈減量混配后施用,其原始沉積量和最終殘留量均得以降低,消解半衰期有所縮短。本研究中的半衰期與文獻報道的腐霉利在露地黃瓜中消解半衰期為2.1~2.8 d,在設施黃瓜中半衰期為3.1~3.8 d[21]相比,其消解速率有所減慢,原因可能是試驗期間 (11 月) 溫度偏低,減緩了腐霉利的代謝速率。目前尚未見有關咯菌腈在溫室黃瓜中殘留消解動態的研究報道,有報道其在溫室菊花中的半衰期為5.5 d[22],在櫻桃中消解速率則相當緩慢,半衰期為33.7~44.7 d[23]。本研究發現,咯菌腈單劑及其與腐霉利按1 : 1 質量比混配后,在田間黃瓜中的消解半衰期分別為6.93 d 和4.33 d,表明其在黃瓜中的消解速率較在櫻桃中快,而與在溫室菊花中的消解速率較為接近。目前關于兩種或兩種以上農藥在作物中代謝規律相互影響的研究較少。有研究表明,腐霉利和多菌靈之間可能存在代謝抑制現象[24];而在Lin 等[25]的研究中,腐霉利和噻蟲嗪復配后,因腐霉利對番茄表面微生物的多樣性存在一定影響,導致兩者半衰期均有不同程度縮短。影響農藥在植物體內相互作用的因素較為復雜,可能取決于施藥劑量、施藥時期、農藥本身化學結構以及農藥在作物中的作用靶標等[26]。關于不同農藥之間具體因何種原因造成部分藥劑代謝速率加快的現象,還需進一步研究闡明。
本研究首次報道了腐霉利與咯菌腈混用對黃瓜灰霉病病原菌灰葡萄孢具有顯著的協同增效作用,且兩種農藥混配后在田間黃瓜中的殘留量以及降解速率明顯優于各自單劑。所得結果不僅可為黃瓜灰霉病防治提供高效的新型混配藥劑,為兩種農藥的聯合減量施用提供依據,同時也有望通過這種減量混合用藥方案,有效降低腐霉利和咯菌腈在黃瓜中的殘留風險,從而提升黃瓜的產品質量安全水平。

