種植蘆竹屬菌草對土壤酶活及土壤微生物群落的影響
林 輝,劉艷玲,羅海凌,王 彤,2,林占熺,蘇德偉,林興生,林冬梅 *
(1.國家菌草工程技術研究中心,福建 福州 350010;2.福建農林大學生命科學學院,福建 福州 350010)
0 引言
【研究意義】蘆竹(Arundo donaxL.)屬被子植物門的禾本科蘆竹屬,是一種多年生的草本植物,其植株高大,產量高,生長3年的蘆竹生物量可達35 kg·m?2。蘆竹綜合利用價值高,可生產食用菌、板材、紙張,作為生物質能源發電、生產沼氣,還可用于生態治理等。蘆竹對土壤酶活及土壤微生物群落的影響的研究,可為蘆竹的推廣種植提供理論基礎,促進蘆竹的開發利用,為實現雙碳目標貢獻力量。【前人研究進展】土壤微生物作為陸地生態系統中的重要角色,參與土壤中有機質分解與轉換、養分的循環與利用和土壤結構與形成等諸多主要生態學過程,能夠促進土壤物質循環、穩定與保持土壤的生產力和健康,且作物的生長與病害、土壤環境及溫室氣體的排放等都與土壤微生物密切相關[1?5],而土壤微生物的多樣性和分布與土壤肥力及其所處的環境亦密切相關[6]。Zimmerman等研究表明,土壤細菌、真菌和放線菌可決定土壤微生物總量的分布以及有機物的分解與轉化[7];此外,土壤微生物還是土壤酶的主要來源,土壤酶幾乎參與土壤中所有的生物化學反應,酶活性表征著土壤中物質代謝的旺盛程度,是土壤肥力的一個重要指標,同時土壤酶影響著土壤微生物數量和群落結構[8?9]。菌草是指所含營養適合食用菌、藥用菌等微生物生長需要,并具有綜合開發利用價值的草本植物[10?13],主要包括禾本科、里白科等共計20多個屬46個種的植物[14?15],蘆竹屬菌草品種是菌草的重要組成部分。20世紀80年代,為了替代林木作為培養基栽培食(藥)用菌,菌草概念應運而生,隨之菌草栽培食藥用菌、菌草生態治理、菌草菌物飼料等應用方面的研究相繼開展[16],實現了在促進食用菌產業可持續發展的同時,經濟、生態與社會三者效益的有機統一[12]。菌草的太陽能轉化率為闊葉樹的4~6倍,根量為一般農作物的3~5倍,維系土壤肥力比農作物高15倍。因此,它對土壤的防沖能力和吸附雨水能力要強于森林和農作物,故被稱作為環境保護和修復的最好植物之一[17]。【本研究切入點】對于蘆竹屬菌草,在其綜合利用方面有較多的研究,但在生態治理方面,有研究表明在荒漠化土壤種植Lz1可顯著提高沙質土壤有機質含量,土壤中活性酶及微生物總量也顯著增多[18],而對其他蘆竹品種以及在黏質土的微生物種群情況,則有待深入研究。【擬解決的關鍵問題】通過對種植蘆竹屬6種不同菌草后的土壤開展研究,解析種植前后土壤酶活和土壤微生物群落結構的變化。采用Illumina-MiSeq高通量測序技術,對種植蘆竹屬6種不同菌草和未種植任何植物的土壤微生物進行測序,發現和挖掘蘆竹屬不同菌草的種植對土壤微生物群落多樣性的影響,以及土壤微生物多樣性與土壤養分、土壤酶活之間的關系,為做好菌草種植、推廣以及菌草生態治理等提供參考和借鑒。
1 材料與方法
1.1 研究區概況
位于福州市閩侯縣福建農林大學旗山校區內,國家菌草工程技術研究中心菌草種質資源圃(N26.05°,E119.18°),該地區屬于亞熱帶海洋性季風氣候,氣溫適宜,溫暖濕潤,四季常青,陽光充足,雨量充沛,霜少無雪,夏長冬短,無霜期達326 d,年平均日照數為 1 700~1 980 h;年平均降水量為 900~2 100 mm;年平均氣溫為 20~25 ℃,年相對濕度約77%。
1.2 試驗方法
采樣點為種植5年后的蘆竹屬(ArundoL.)6個菌草品種,由福建農林大學國家菌草工程技研究中心菌草種質資源圃提供,其中綠洲1號Lz1(H)、綠洲2號Lz2(I)、綠洲3號Lz3(J)、綠洲5號Lz5(K)、綠洲6號Lz6(L)和綠洲9號Lz9(M)分別來自萊索托、山東、福建、厄立特里亞、西藏和陜西,空白對照(CK)為中心菌草種質資源圃周圍未種植任何植物的區域。每種菌草種植區30 m2,種植區內隨機選取3處,根據5點取樣法在每個采樣點取樣,去除表層殘葉和浮土,取根系周圍5 ~30 cm深度的土壤,每處采集的5點土樣混勻為1個樣品,每個試驗區分別采集3個樣品。采集樣品后,去除植物根、動物殘骸及其他雜質,混勻過2 mm篩,一部分保存在10 mL無菌離心管中,用干冰保存送往北京奧維森基因科技有限公司,對采集的土壤樣品進行微生物多樣性檢測;另一部分將采集的土壤放入密封袋中,常溫避光條件下風干、磨細和過篩,進行土壤樣品分析,均隨機采集3個生物學重復。
1.3 土壤養分和酶活性測定
土壤pH值采用pH計測定,土壤有機碳、速效磷、速效氮和全氮等養分采用《土壤農化分析》[19]的方法進行測定;土壤酶活性采用蘇州科銘生物科技有限公司購買的試劑盒測定。
1.4 土壤微生物多樣性測定分析方法
取土壤樣品 0.5 g,根據 E.Z.N.A.Soil DNAKit試劑盒說明書操作流程提取土壤總DNA,然后對提取的土壤總DNA分別進行細菌16SrDNA和真菌ITS擴增。將真菌和細菌的擴增子構建Miseq文庫,Illumina Miseq上機測序,利用Trimmomatic、Pear對原始數據進行質控、過濾、拼接得到有效數據,然后對測序結果進行個性化分析。
1.5 數據處理
采用 SPSS 23.0 和 GraphPad Prism 8.3 軟件進行數據分析,采用SPSS單因素(one-way ANOVA)法進行方差分析和差異顯著性比較,用Pearson法進行相關性分析。采用GraphPad Prism 8.3軟件作圖。圖表中數據均為平均值±標準差。
2 結果與分析
2.1 種植不同菌草對土壤養分及土壤酶活的影響
2.1.1 土壤基礎養分 從表1看出,蘆竹屬不同菌草種植區域的土壤均偏酸性,其中Lz3的土壤pH值最低,為5.43;Lz6土壤pH值6.21,且與對照組、Lz1、Lz2、Lz3和Lz9之間存在顯著差異(P<0.05)。種植菌草的土壤中速效磷(AP)含量均高于對照組未種植菌草的AP含量,其中Lz9和Lz1土壤速效磷含量最高,均大于 8.00 mg·kg?1,差異顯著(P<0.05)。土壤中的速效氮(AN)和全氮(TN)含量基本一致,均是Lz1含量最高,且顯著高于未種植菌草的土壤速效氮和全氮含量(P<0.05)。土壤中有機碳(SOC)含量亦是Lz1最高,Lz9和Lz3次之,與未種植菌草對照組土壤有機碳含量有顯著性差異(P<0.05)。
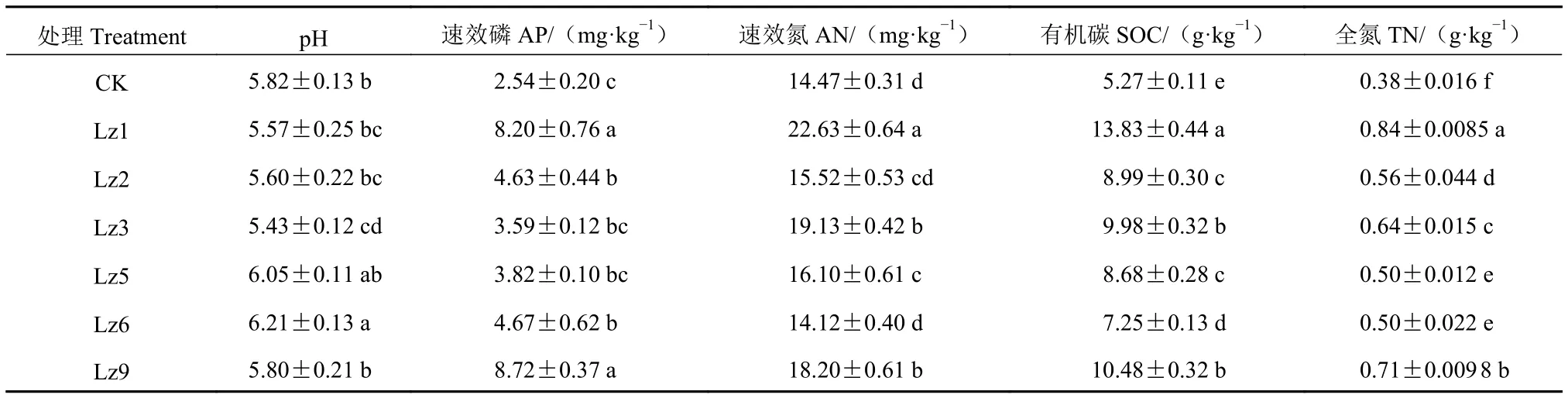
表1 種植蘆竹屬不同菌草對土壤主要養分的影響Table 1 Nutrients in soil as affected by planting of different arundo grasses
2.1.2 土壤酶活 不同土壤樣品的酶活性如圖1所示,種植菌草的土壤脲酶(URE)活性均極顯著高于對照組(P<0.01),其中Lz9脲酶活性最高(859.40 μg·g?1·d?1),Lz1 次 之( 793.40 μg·g?1·d?1)。Lz5土壤中過氧化氫酶(CAT)活性最高(47.19 μmol·g?1·d?1),Lz6 次之(43.26 μmol·g?1·d?1),均極顯著高于未種植菌草的土壤酶活(P<0.01)。Lz5土壤中的蔗糖酶(INV)活性最高(15.91 mg·g?1·d?1),且極顯著高于未種植菌草的土壤蔗糖酶酶活(P<0.01),Lz1的土壤酸性磷酸酶(ACP)活性極顯著高于未種植菌草的ACP活性(P<0.01)。
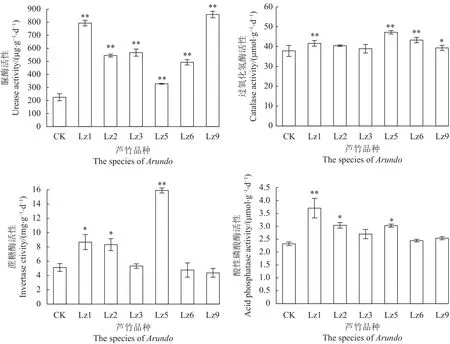
圖1 種植蘆竹屬不同菌草對土壤酶活的影響Fig.1 Enzyme activity in soil as affected by planting of different arundo grasses
2.1.3 土壤特性與土壤酶活相關性分析 由表2 Pearson相關性結果分析可知,土壤過氧化氫酶與土壤pH值有顯著的正相關性(P<0.05)。土壤脲酶、蔗糖酶和酸性磷酸酶與pH值均無顯著相關性。土壤脲酶與速效磷、速效氮、有機碳和全氮均有極顯著的正相關性(P<0.01);相反,過氧化氫酶與速效磷、速效氮、有機碳和全氮均有極顯著的負相關性(P<0.01)。而土壤蔗糖酶與速效磷、速效氮、有機碳和全氮相關性不顯著(P>0.05),土壤酸性磷酸酶與速效氮、全氮均有顯著的正相關性(P<0.05),與有機碳有極顯著正相關性(P<0.01)。
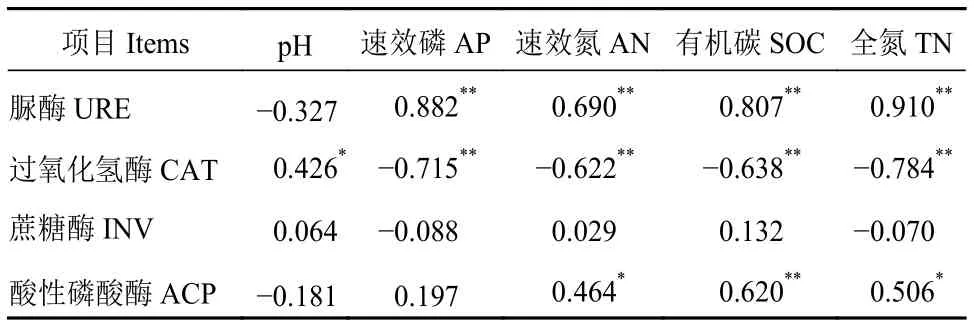
表2 土壤特性與土壤酶活的Pearson相關性Table 2 Pearson correlation between characteristics and enzyme activity of soil
2.2 不同菌草種植對土壤微生物多樣性及群落結構的影響
2.2.1 土壤微生物多樣性 土壤微生物多樣性的評估指數結果分析見表3,其中Chao指數代表群落豐富度,數值越大表明物種豐度越高;Shannon指數代表群落多樣性,數值越大表明其群落多樣性越高。由分析結果可知,種植幾種菌草的土壤細菌Ace、Chao指數均顯著高于對照組未種植菌草(P<0.05),Lz1、Lz2和Lz5細菌Shannon指數顯著高于對照組(P<0.05),而Coverage指數和Simpson指數與對照組差異均不顯著(P>0.05)。Lz1、Lz2和Lz3的土壤真菌Ace、Chao指數顯著高于對照組(P<0.05),種植幾種菌草的土壤真菌Shannon指數均顯著高于對照組(P<0.05),而土壤Simpson指數只有Lz6顯著低于對照組(P<0.05),Coverage指數與對照組差異均不顯著(P>0.05)。分析結果表明7個樣品的細菌文庫覆蓋率均達到96%、真菌文庫覆蓋率達99%,表明大部分微生物種群均能被檢測出,可代表樣本的真實情況。
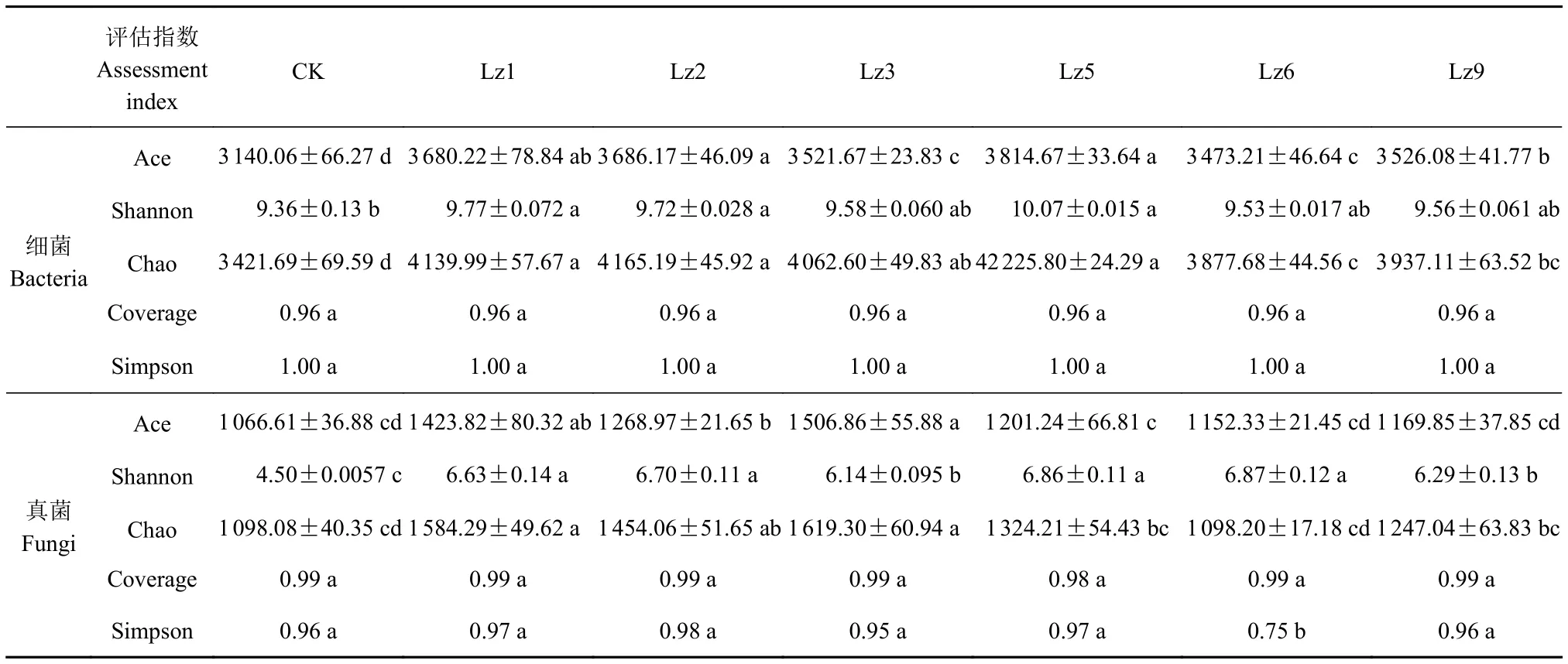
表3 不同土壤樣品微生物豐度和多樣性Table 3 Microbial abundance and diversity of soil samples
2.2.2 土壤微生物群落結構 由圖2可知,種植菌草的土壤樣品中變形菌門(Proteobacteria)的相對豐度均高于對照組,Lz9最高,與對照組相比,提高了47.15%,Lz5和Lz1次之,與對照組相比較分別提高了21.1%、20.7%;酸桿菌門(Acidobacteria)的相對豐度大小順序為:Lz6>Lz5>Lz3>Lz1>Lz9>對照組>Lz2,Lz6比對照組提高了17.3%;綠彎菌門(Chloroflexi)的相對豐度則是對照組最高;放線菌門(Actinobacteria)的相對豐度大小順序為:Lz2>Lz1>Lz3>Lz9>Lz6>對照組>Lz5,其中與對照組相比,Lz2和Lz1分別提高了86.3%、68.6%。
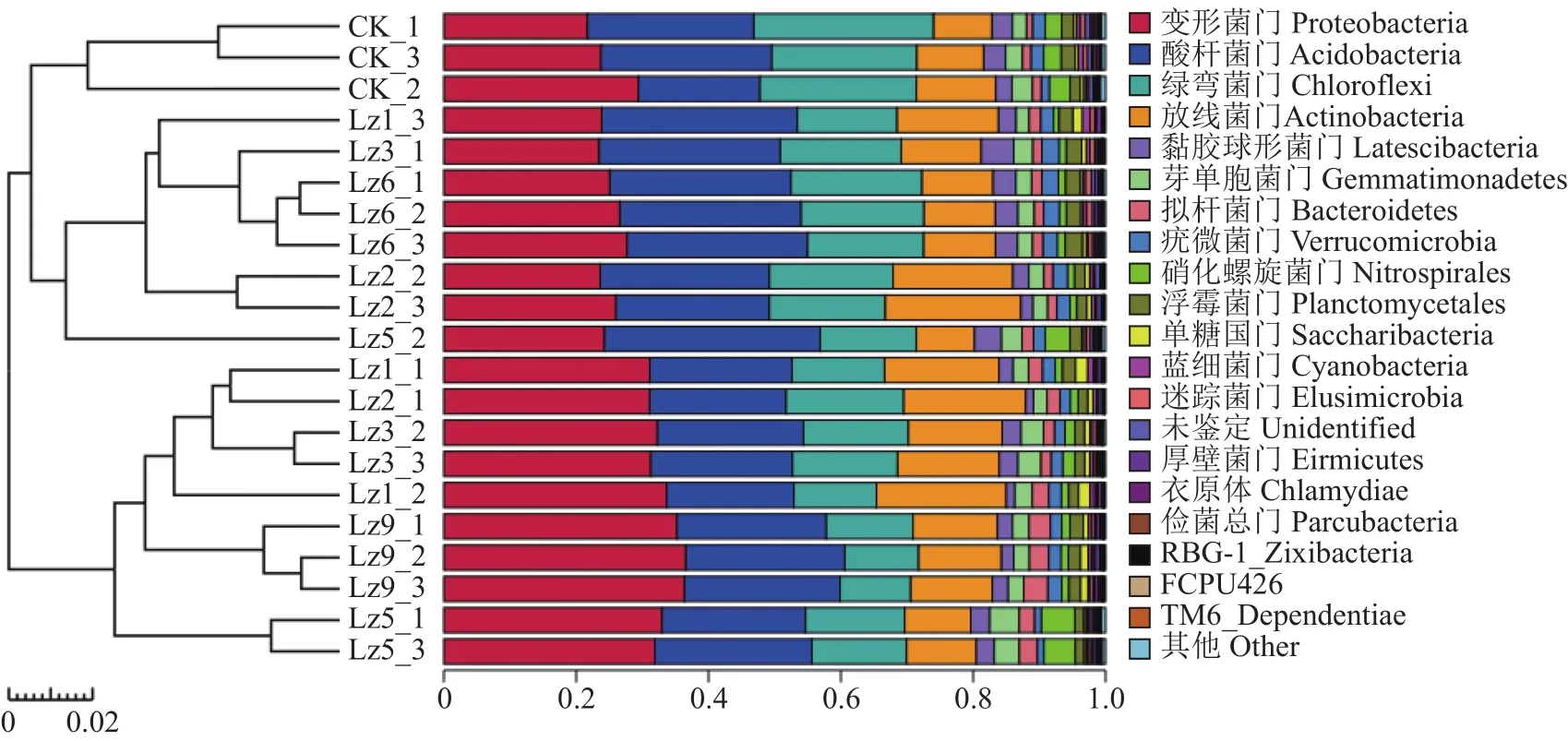
圖2 門水平細菌最大豐度排名前20的物種相對豐度Fig.2 Relative abundance of top 20 bacteria at phylum level
不同土壤樣品門水平真菌最大豐度排名如圖3所示,其中子囊菌門(Ascomycota)相對豐度大小順序為:Lz9>Lz1>>Lz3>Lz5>Lz2>對照組>Lz6,Lz9和Lz1分別比對照組豐度提高了53.2%、32.9%;種植6種菌草的土壤樣品中,擔子菌門(Basidiomycota)相對豐度均高于對照組,其中Lz6的相對豐度最高;Lz1、Lz2和Lz3次之;種植六種菌草的被孢菌門(Mortierellomycota)的相對豐度均低于對照組。
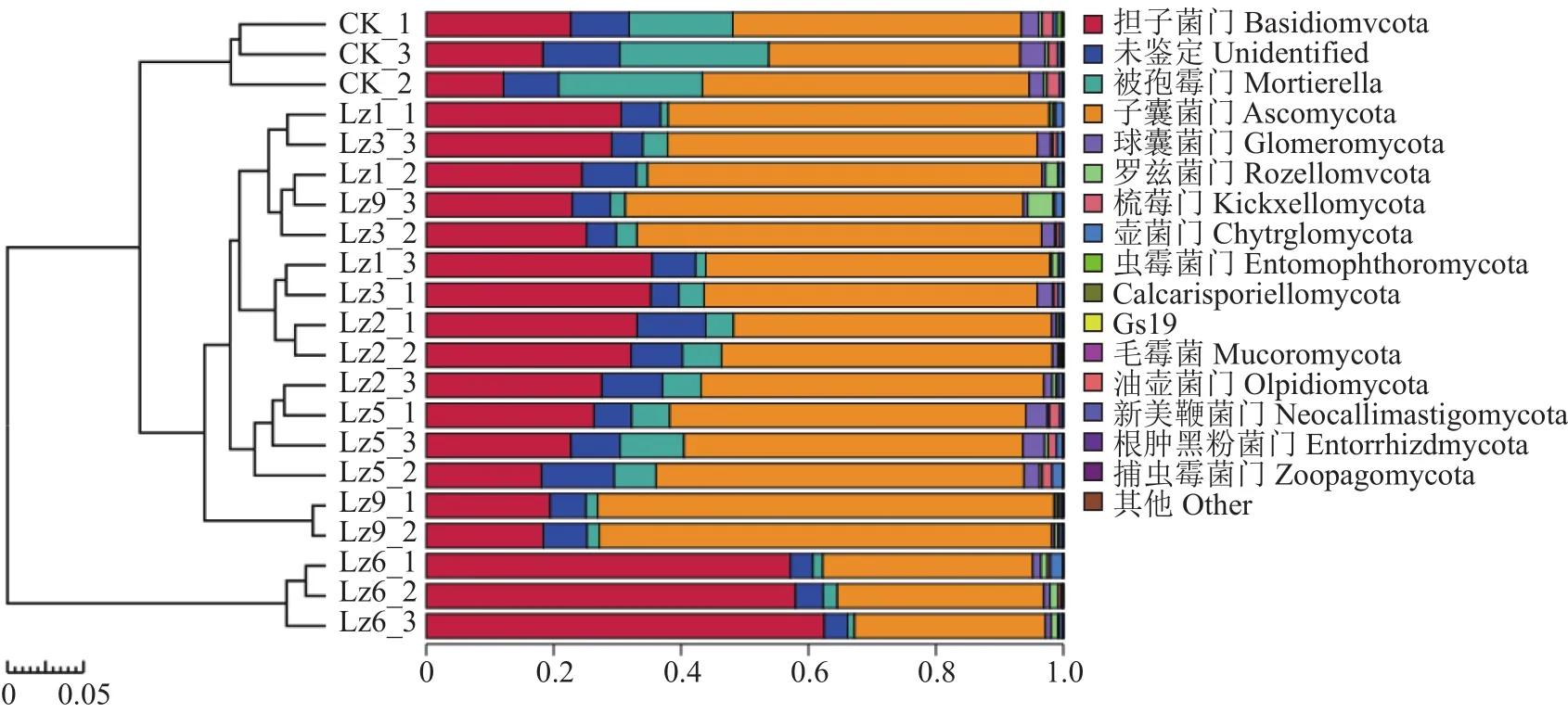
圖3 門水平真菌最大豐度排名前16的物種相對豐度Fig.3 Relative abundance of top 16 fungi at phylum level
2.3 土壤微生物多樣性及群落結構與土壤酶活相關性分析
2.3.1 土壤微生物多樣性指數與土壤酶活相關性分析 土壤微生物多樣性由Ace指數、Shannon指數和Chao指數等來反映,由表4結果可知,蔗糖酶與細菌Ace指數、Shannon指數和Chao指數存在極顯著的正相關關系(P<0.01),酸性磷酸酶與Shannon指數呈顯著正相關關系(P<0.05),與細菌Ace指數、Chao指數存在極顯著的正相關關系;而酸性磷酸酶與真菌的Ace指數存在極顯著的正相關關系(P<0.01),與Shannon指數和Chao指數存在顯著的正相關關系(P<0.05)。
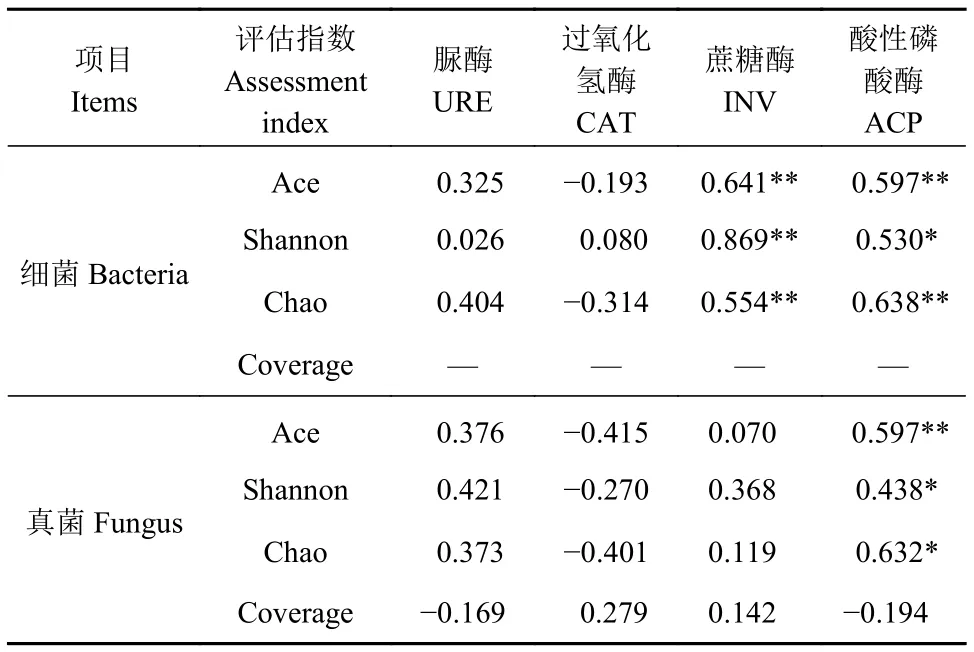
表4 微生物多樣性指數與土壤酶活的相關關系Table 4 Correlation between microbial diversity index and enzyme activity of soil
2.3.2 土壤微生物群落結構與土壤酶活相關性分析 土壤微生物優勢門類與4種土壤酶活之間的相關關系如表5 所示,變形菌門(Proteobacteria)、擬桿菌門(Bacteroidetes)、梭桿菌門(Saccharibacteria)、厚壁菌門(Firmicutes)等4個細菌菌門的相對豐度與URE活性呈極顯著正相關關系(P<0.01),而綠彎菌門(Chloroflexi)和硝化螺旋菌門(Nitrospirae)與URE活性呈現極顯著的負相關關系(P<0.01),芽單胞菌門(Gemmatimonadetes )與URE活性呈現負相關關系(P<0.05);綠彎菌門(Chloroflexi)、硝化螺旋菌門(Nitrospirae)與CAT活性存在極顯著的正相關關系(P<0.01),變形菌門(Proteobacteria)、放線菌門(Actinobacteria)、擬桿菌門(Bacteroidetes)和厚壁菌門(Firmicutes)與CAT活性存在負相關關系(P<0.05);硝化螺旋菌門(Nitrospirae)與INV活性呈極顯著正相關(P<0.01),芽單胞菌門(Gemmatimonadetes )與INV活性呈現正相關(P<0.05),疣微菌門(Verrucomicrobia)與INV活性呈現顯著負相關(P<0.05);放線菌門(Actinobacteria)與ACP活性呈現顯著正相關(P<0.05)。
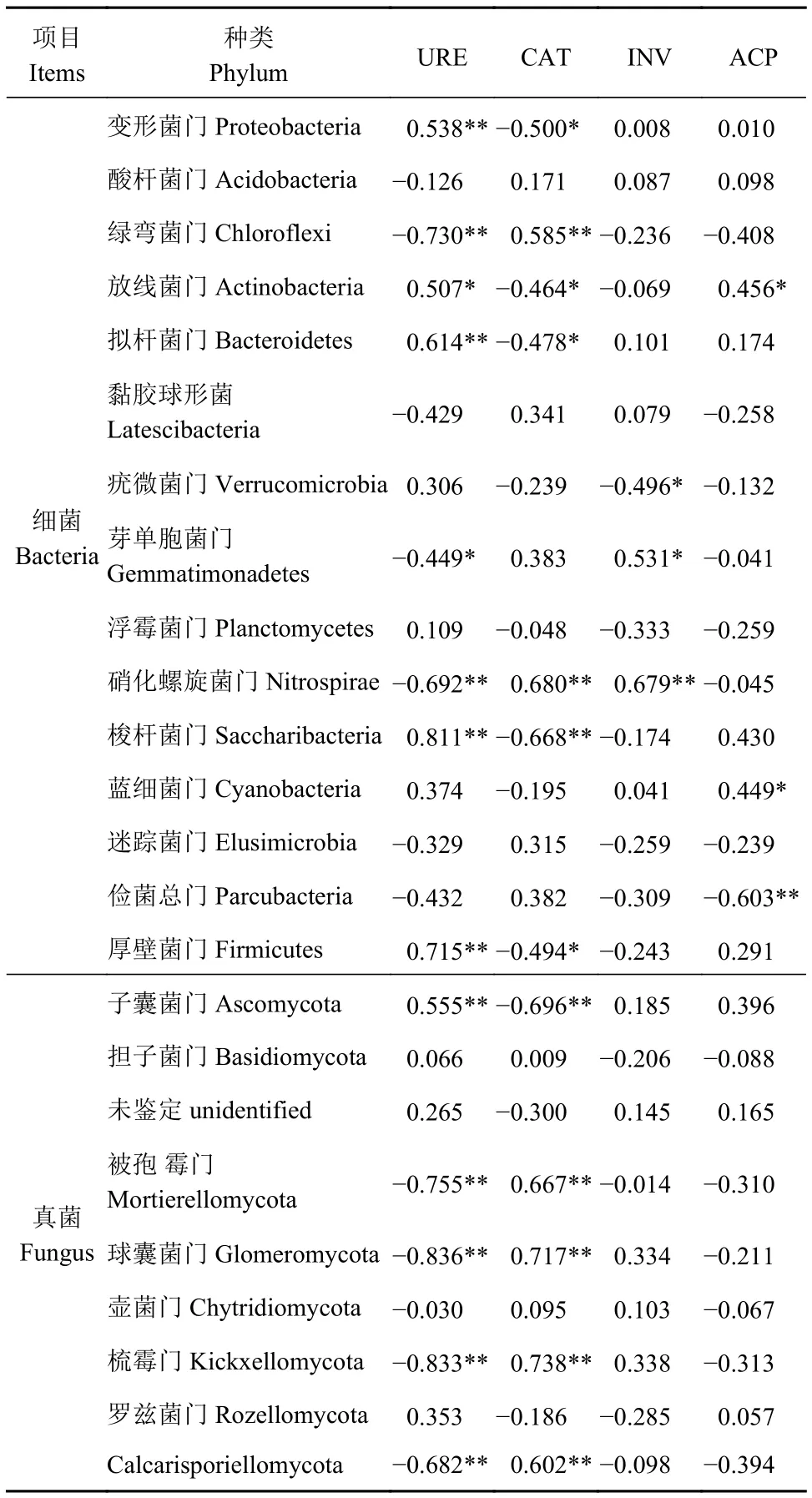
表5 土壤微生物優勢門類與土壤酶活之間的相關關系Table 5 Correlations among dominant microbial phyla,nutrients, and enzyme activity in soil
真菌的優勢菌門中,子囊菌門(Ascomycota)與URE活性呈極顯著正相關關系(P<0.01),被孢霉門(Mortierellomycota)、球囊菌門(Glomeromycota)、Kickxellomycota和Calcarisporiellomycota 與URE活性呈極顯著負相關關系(P<0.01);被孢霉門(Mortierellomycota)、球囊菌門(Glomeromycota)、Kickxellomycota和Calcarisporiellomycota與CAT活性呈極顯著正相關關系(P<0.01),子囊菌門(Ascomycota)與CAT活性呈極顯著負相關關系(P<0.01)。
3 討論與結論
土壤養分是衡量土壤肥力狀況的指標之一,福建農林大學旗山校區國家菌草工程技術研究中心菌草種質資源圃建在用黏土及石塊填方的土地,土壤肥力差。蘆竹屬菌草抗性強,耐貧瘠,種植5年來,在該土地上不僅正常生長,而且長勢旺盛。本研究選用的是種質資源圃種植蘆竹屬菌草5年后的土壤與未種植區域土壤進行比較,結果表明:所測區域土壤均屬于酸性土壤(5.4~6.2),其中Lz6所種植區域土壤pH值最高,Lz3土壤pH值最低;Lz1、Lz9、Lz3的土壤有機碳、AN、TN含量等均顯著高于未種植土壤的各養分含量。由結果可知,種植5年的蘆竹屬菌草,可增加土壤養分的含量,提高土壤肥力,但由于蘆竹屬不同菌草品種的生長特性存在一定差異,因此不同菌草種植區的土壤養分亦存在一定的差異。
土壤酶活性是微生物功能的表現,參與了土壤中許多重要的生物化學過程,與土壤養分有著密切的關系[20],土壤pH值、土壤有機質、AP、AN、TN含量等土壤理化性質都會對土壤酶活產生顯著的影響。土壤酶活性結果顯示,種植蘆竹屬6種菌草的土壤脲酶活性均極顯著高于未種植菌草的對照組,其中Lz1和Lz9的脲酶活性最高,這與Lz1和Lz9土壤有機質含量高的結果一致,且Pearson相關分析亦表明脲酶活性與土壤有機質含量呈顯著正相關(P<0.01)。諸多研究結果亦表明,土壤中有機質含量高,土壤脲酶活性也會相應提高[21?23]。土壤過氧化氫酶活性與土壤呼吸強度和土壤微生物活動相關,是重要的土壤微生態環境指示因子[24?25],能有效防止過氧化氫的毒害,而過氧化氫酶和蔗糖酶活性則是種植Lz5的土壤酶活性最高,均顯著高于對照組,酸性磷酸酶活性則是種植Lz1的土壤最高,顯著高于對照組。影響土壤酶活性的因子較多,在不同的研究中所得結論也不盡相同[26]。本研究相關性結果分析發現,供試4種土壤酶中,脲酶活性與土壤速效磷、速效氮、有機碳和全氮呈極顯著的相關關系(P<0.01),蔗糖酶與幾種土壤養分無顯著的相關性,亦說明土壤酶活性受多因子協同作用影響。
土壤微生物群落多樣性和群落結構,受土壤理化性質、不同土壤條件和環境的差異影響,在不同土壤條件和環境中,土壤微生物群落存在很大差別[27]。基于高通量測序的分析結果表明,蘆竹屬不同菌草土壤微生物的多樣性指數和豐富度指數存在一定差異,種植菌草土壤微生物中細菌和真菌的Ace指數、Shannon指數、Chao指數均高于對照組,亦說明了種植菌草以后土壤微生物的多樣性和豐度總體高于未種植。而不同種植區域微生物優勢菌門大致相似,其中Lz1土壤微生物中變形菌門、酸桿菌門、放線菌門等相對豐度均大于對照組。
土壤中有機碳是土壤微生物群落的能量和微生物細胞組成成分的主要來源,還是土壤微生物新陳代謝的主要產物[28]。由本研究土壤微生物優勢門類與土壤酶活的相關性結果可知,變形菌門(Proteobacteria)、擬桿菌門(Bacteroidetes)、梭桿菌門(Saccharibacteria)、厚壁菌門(Firmicutes)等細菌的相對豐度均與土壤中URE活性呈極顯著正相關(P<0.01)。同樣,研究結果表明優勢菌門與土壤酶活性的相關性存在差異,相關性并不是呈現出一致的趨勢。植物-土壤-微生物之間的關系非常復雜,相互作用、相互影響[29?31],但不同蘆竹種植的土壤微生物多樣性和群落結構存在一定差異,且與土壤養分和土壤酶活的具有一定的相關性。
綜上所述,種植蘆竹屬6種不同菌草后,土壤養分、土壤酶活、土壤微生物多樣性和群落結構存在一定的差異,但與未種植蘆竹屬菌草的空白對照地相比,種植lz1、Lz9土壤中速效磷、速效氮、有機碳和總氮的含量以及土壤脲酶活性顯著升高。土壤微生物豐度和多樣性指數結果亦表明,種植蘆竹后,土壤微生物豐度和多樣性高于對照組。結合之前研究結果,種植蘆竹屬菌草Lz1有望在貧瘠的土壤條件下,起到改良土壤,提高土壤酶活性和土壤微生物多樣性的積極作用,為綠洲1號(Lz1)的推廣奠定理論基礎。

