聚球藻PCC7002 藻藍蛋白提取純化及熱致褪色機理研究
朱林清,曾名湧
(中國海洋大學食品科學與工程學院,青島市海洋食品保鮮技術工程研究中心,山東青島 266003)
聚球藻PCC7002(Synechococcussp.PCC7002,簡稱“聚球藻”)是一類海洋中分布廣泛的單細胞藍細菌,因結構簡單且全基因組序列已被破譯等優勢,被認為是基因工程領域內外源基因表達的理想宿主[1]。除遺傳背景清晰之外,廣鹽性的聚球藻對高溫、強光均有一定的耐受性,被認為是細胞倍增速度最快的常見模式藻種[2]。近年來,藻體內嗜鐵素[3]、多聚磷酸體[4]、類胡蘿卜素[5]、多糖[6]等活性成分的研究使聚球藻逐漸為食品領域內的研究者所關注,使它有望成為工業領域中又一可供高值化開發的微藻資源。
藻藍蛋白(Phycocyanin,PC)是存在于藍藻、紅藻等藻種內、由脫輔基蛋白通過硫醚鍵共價結合藻藍膽素而形成的一類胞內水溶性蛋白,在葉綠素a 光吸收較差的范圍內起著增強光吸收的作用。藻藍蛋白是我國《GB 2760-2014 食品添加劑使用標準》中唯一被批準在食品中使用的天然藍色色素[7],既可添加到果凍、奶酪、飲料、雪糕等食品中賦予食品新奇的藍色色澤,又具有抗氧化、抗炎、抗腫瘤和免疫調節等生理活性[8],能發揮一定的保健功能。然而,當藻藍蛋白配制成酸性食品或進行巴氏殺菌時,其膠體穩定性和顏色穩定性差,限制了藻藍蛋白在食品領域的廣泛使用[9]。據研究[10-11],藻藍蛋白的蛋白結構在50 ℃以上就會變性,進而導致四吡咯發色團的失穩以及藍色色澤的消褪。作為食品加工中必不可少的步驟,熱殺菌對藻藍蛋白呈色穩定性破壞極大且不可避免。因此,藻藍蛋白熱處理過程中的褪色機理研究對于其實際應用具有現實意義,也是藻藍蛋白護色技術研究的重要理論依據。
由于螺旋藻已被產業化養殖且被批準在食品中應用,因此目前關于藻藍蛋白的研究主要與螺旋藻相關,而聚球藻藻藍蛋白的研究則相對匱乏。郭偉等[12]發現聚球藻的藻藍蛋白含量高達15.81%,與螺旋藻中的含量相當,表明聚球藻可作為提取藻藍蛋白的潛在原料。因此,本研究以聚球藻為原料提取純化藻藍蛋白,探究藻藍蛋白在熱處理過程中的褪色機理,以期為提高藻藍蛋白熱穩定性提供理論依據,促進對微藻資源的深度開發。
1 材料與方法
1.1 材料與儀器
聚球藻(Synechococcussp.PCC7002)干粉 實驗室培養、收集及凍干獲取,聚球藻PCC7002 由北京大學生命科學學院趙進東院士惠贈;氯化鈣(分析級)、氯化鈉(分析級)、硝酸鉀(分析級)、硫酸銨(分析級)、溴化鉀(光譜純)國藥集團化學試劑有限公司;殼聚糖(水溶性)食品級,浙江一諾生物科技有限公司;甘氨酸(生物技術級)、十二烷基硫酸鈉(生物技術級)、三羥甲基氨基甲烷(生物技術級)、瓊脂(生物技術級)、40% Acr/bis(29:1)、1 mol/L Tris-HCl(pH8.8)、1 mol/L Tris-HCl(pH6.8)、10% SDS、10%AP(過硫酸銨)、TEMED 北京索萊寶科技有限公司。
GL-2M 高速冷凍離心機 湖南湘儀離心機有限公司;GXZ-280 光照培養箱 寧波江南儀器廠;G154T 全自動高壓滅菌鍋 致微儀器有限公司;AH110B 高壓均質機 ATS 工業系統有限公司;HJ-6CS 磁力攪拌水浴鍋 常州普天儀器制造有限公司;3nh 高品質電腦色差儀 深圳市三恩馳科技有限公司;UV-2550 紫外可見分光光度計 日本島津公司;F-4600 熒光分光光度計 日本日立公司;NicoletiS10傅里葉紅外光譜儀 美國賽默飛公司;Nano-zs 90 激光粒度分析儀 英國馬爾文儀器公司;Protean 凝膠電泳裝置 美國Bio-Rad 公司。
1.2 實驗方法
1.2.1 聚球藻干粉的獲取 參照郭偉等[12]的培養方法,選取平板上生長良好的聚球藻接種于5 L 的Medium A 培養基中通入空氣進行培養,環境溫度設置為32 ℃;以照明日光燈為光源,光照強度達到100 μE/(m2·s)。聚球藻培養至穩定期后收獲(12~13 d),離心所得的藻液(8000 r/min,10 min)收集藻泥。將藻泥重懸于去離子水中再離心,重復操作2~3 次進行脫鹽,最后將藻泥冷凍干燥得到聚球藻干粉。
1.2.2 藻藍蛋白提取條件優化 參考劉立闖等[13]的方法,并作部分修改。通過單因素實驗,以藻藍蛋白純度和得率為指標分別探究提取介質、介質濃度、藻體濃度、均質壓力、均質時間對高壓均質破壁藻細胞溶出藻藍蛋白的影響。
1.2.2.1 提取介質對藻藍蛋白得率和純度的影響固定提取介質濃度為0.01 mol/L,將凍干藻粉分別溶于NaCl、KNO3、CaCl2、PBS 溶液及去離子水中配制0.5 mg/mL 的藻液,60 MPa 下均質5 min 后離心收集上清液(8000 r/min,10 min),用紫外可見分光光度計測定上清液的A620、A650和A280。
1.2.2.2 介質濃度對藻藍蛋白得率和純度的影響固定提取介質為NaCl 溶液,將藻粉分別溶于0.01、0.02、0.04、0.08、0.16 mol/L 的NaCl 溶液中配制0.5 mg/mL 的藻液,60 MPa 下均質5 min 后離心收集上清液(8000 r/min,10 min),用紫外可見分光光度計測定上清液的A620、A650和A280。
1.2.2.3 藻體濃度對藻藍蛋白得率和純度的影響固定提取介質為0.04 mol/L NaCl 溶液,將藻粉溶于NaCl 溶液中配制藻體濃度分別為0.5、1.0、1.5、2.0、2.5 mg/mL 的藻液,60 MPa 下均質5 min 后離心收集上清液(8000 r/min,10 min),用紫外可見分光光度計測定上清液的A620、A650和A280。
1.2.2.4 均質壓力對藻藍蛋白得率和純度的影響 固定提取介質為0.04 mol/L NaCl,藻體濃度為2 mg/mL,將藻液分別于20、40、60、80、100 MPa 下均質5 min后離心收集上清液(8000 r/min,10 min),用紫外可見分光光度計測定上清液的A620、A650和A280。
1.2.2.5 均質時間對藻藍蛋白得率和純度的影響 固定提取介質為0.04 mol/L NaCl,藻體濃度為2 mg/mL,均質壓力為80 MPa,將藻液分別均質5、7、9、11、13、15 min 后離心收集上清液(8000 r/min,10 min),用紫外可見分光光度計測定上清液的A620、A650和A280。
1.2.3 藻藍蛋白粗提液純化 以藻藍蛋白純度和回收率為指標,通過殼聚糖絮凝、硫酸銨鹽析純化所得的藻藍蛋白粗提液。
1.2.3.1 殼聚糖濃度對藻藍蛋白純度和回收率的影響 參考廖曉霞等[14]的方法,并作修改。向藻藍蛋白粗提液中加入殼聚糖,使其濃度分別為0.05、0.1、0.15、0.2、0.25、0.3 mg/mL,混勻并靜置5 min 后離心收集上清液(8000 r/min,10 min),用紫外可見分光光度計測定上清液的A620、A650和A280。
1.2.3.2 硫酸銨飽和度對藻藍蛋白純度和回收率的影響 參考于淑坤等[15]的方法,并作改動。向經終濃度為0.15 mg/mL 的殼聚糖純化得到的上清液緩慢加入硫酸銨,使溶液中硫酸銨飽和度分別為45%、50%、55%、60%、65%、70%,混勻并在4 ℃過夜后離心取沉淀(8000 r/min,10 min),將沉淀復溶于同等體積的PBS 溶液中,用紫外可見分光光度計測定其A620、A650和A280。
1.2.4 藻藍蛋白干粉的獲取 將經0.15 mg/mL 殼聚糖溶液、50%飽和硫酸銨純化后得到的藻藍蛋白溶液裝于截留分子量為8~10 kDa 的透析袋中脫鹽3 d,透析后的溶液冷凍干燥獲得藻藍蛋白干粉。
1.2.5 藻藍蛋白熱致褪色機理研究 將藻藍蛋白干粉溶于PBS 溶液配制濃度為0.5 mg/mL 的藻藍蛋白溶液,將其分別于50、60、70、80、90 ℃水浴中熱處理30 min 后立即冷卻至常溫,測定經熱處理后藻藍蛋白的色澤指標、UV-Vis 光譜、熒光發射光譜、FTIR 光譜、電位粒徑及亞基分子量分布,未經熱處理的藻藍蛋白溶液作為空白對照。
1.2.5.1 色澤指標測定 將2 mL 藻藍蛋白溶液加入24 孔板,孔板下面放空白A4 紙作為空白背景,在同一光源下用色度儀測定溶液的L*、a*、b*值。
1.2.5.2 UV-Vis 光譜測定 將1 mL 藻藍蛋白溶液加入1 cm 石英比色皿,在200~800 nm 處掃描溶液的UV-Vis 光譜,并計算藻藍蛋白溶液的色素保留率和Avis/Auv值,溶液測定前稀釋3 倍。
1.2.5.3 熒光發射光譜測定 將1 mL 藻藍蛋白溶液加入熒光比色皿,PMT 電壓設置為700 V,激發波長和發射波長的狹縫寬度均為5 nm。其中測定藻藍蛋白溶液內源熒光光譜的條件[16]為:Ex=295 nm,Em=310~400 nm;特征熒光發射光譜為:Ex=620 nm,Em=630~680 nm;溶液測定前稀釋3 倍。
1.2.5.4 粒徑和電位測定 樣品測定前不稀釋,溶質和溶劑折射率分別設為1.45 和1.33,在25 ℃的平衡溫度下以自動模式測定藻藍蛋白溶液的電位和粒徑。
1.2.5.5 FTIR 光譜測定 將熱處理后的藻藍蛋白溶液凍干成粉,以質量比1:100 與KBr 混勻壓片進行光譜測定。以溴化鉀為采集背景,格式設置為%透過率,掃描次數為32,溴化鉀使用前于120 ℃下烘干24 h。
1.2.5.6 SDS-PAGE 電泳測定 應用不連續電泳系統進行蛋白電泳,其中濃縮膠與分離膠的質量分數分別為5%和12%。樣品上樣20 μL,上樣濃度1.5 mg/mL,開始電壓恒定為80 V,Marker 分離后(約30 min)將電壓調至120 V,樣品跑到玻璃板接近底部時電泳結束。用鏟子取膠放入平皿,倒入染色液染色2 h,脫色液過夜脫色。
1.2.6 藻藍蛋白分析方法 藻藍蛋白純度級別的計算參照Herrera 等[17]的方法,藻藍蛋白濃度以Soni 等[18]推薦的公式計算,而藻藍蛋白色素保留率參考Jespersen 等[10]的方法計算,如下所示:


式中:P 為藻藍蛋白純度;[PC]為藻藍蛋白濃度,mg/mL;V 為提取液體積,mL;k 為藻藍蛋白提取液的稀釋倍數;m 為藻粉質量,mg;ΔEab為相應溫度下藻藍蛋白溶液的總色差,為未經熱處理的藻藍蛋白溶液的色度值;A620(T)為經過相應溫度處理30 min 后藻藍蛋白溶液的A620,A620(0)為未經熱處理的藻藍蛋白溶液的A620。
1.3 數據處理
本研究中的所有實驗均平行測定3 次,數值結果表示為平均值±標準偏差,所得數據用SPSS 22.0進行統計分析。
2 結果與分析
2.1 藻藍蛋白提取條件優化
2.1.1 提取介質及介質濃度對藻藍蛋白得率和純度的影響 高壓均質是一類通過高速剪切、碰撞及壓力驟減等手段破環細胞壁以釋放胞內分子的工業技術[19]。與反復凍融、超聲破碎等傳統破壁方法相比,高壓均質具有效率高、易控制、便于工業擴大化等優勢。提取介質及其濃度的大小關系到高壓均質破壁效果,甚至與目標溶出物的穩定性相關。如圖1 所示,盡管NaCl 溶液所提取的藻藍蛋白純度比氯化鈣溶液低,但得率卻是所有提取介質中最高的。劉立闖等[13]研究提取介質對于超聲破碎溶出藻膽蛋白的影響時,發現NaCl 溶液在所用溶劑中也具有最高的蛋白溶出率,因此選擇NaCl 溶液作為藻藍蛋白的提取溶劑。
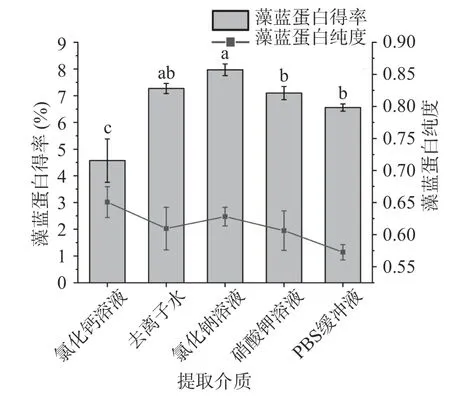
圖1 提取介質對藻藍蛋白得率和純度的影響Fig.1 Effects of extraction medium on the yield and purity of phycocyanin
相對于其他提取介質而言,NaCl 溶液不但利于藻藍蛋白的提取且能提高它在溶液中的穩定性,因此對于藻藍蛋白的提取效率最高。但從圖2 的結果可知,藻藍蛋白得率隨NaCl 濃度先升高后降低,與劉立闖等[13]所得到的趨勢相一致。因此,NaCl 溶液的濃度不易過高,應選擇0.04 mol/L 為宜。
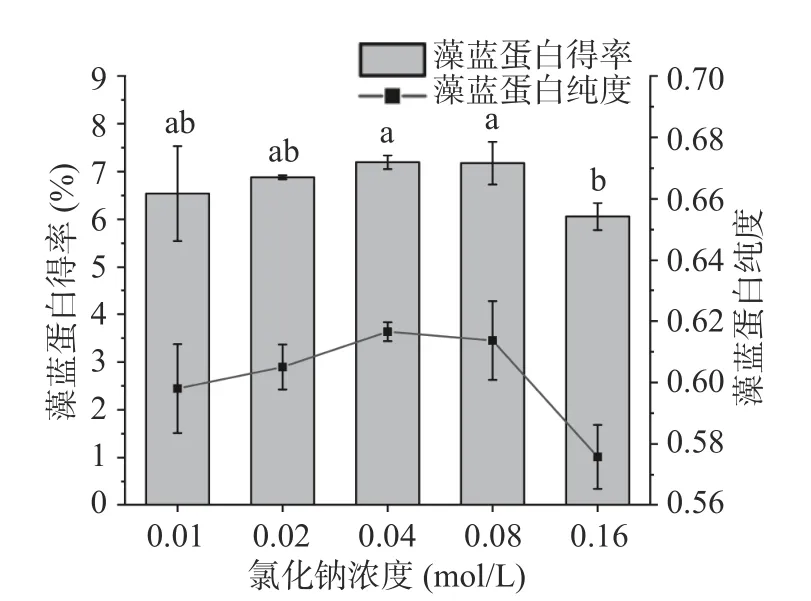
圖2 介質濃度對藻藍蛋白得率和純度的影響Fig.2 Effects of medium concentration on the yield and purity of phycocyanin
2.1.2 藻體濃度對藻藍蛋白得率和純度的影響 如圖3 所示,藻藍蛋白得率隨藻體濃度的增加而緩慢增加,在2.0 mg/mL 時達到穩定。而藻藍蛋白純度隨著藻體濃度的升高則明顯增大,在2.0 mg/mL 時達到最大后呈現下降趨勢,說明說明單位藻細胞可利用溶劑的減少能減少雜蛋白的溶出從而提高藻藍蛋白純度[20],但藻體濃度過大時同樣會因此不利于藻藍蛋白的溶出。因此,綜合考慮藻藍蛋白得率和純度,2.0 mg/mL 為高壓均質最適的藻體濃度。
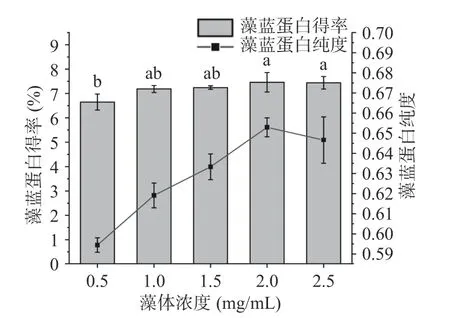
圖3 藻體濃度對藻藍蛋白得率和純度的影響Fig.3 Effects of algal concentration on the yield and purity of phycocyanin
2.1.3 均質壓力對藻藍蛋白得率和純度的影響 均質壓力直接影響著藻細胞破壁效果的好壞,壓力過小會使藻細胞破壁效果差,壓力過大則可能破壞目標蛋白的結構而使得率下降。由圖4 可得,隨著均質壓力的升高,藻藍蛋白的得率和純度逐步增大,到80 MPa后趨于平緩。以上結果與陳裕[21]的研究結果較為一致,但藻藍蛋白得率和純度趨于穩定時的壓力值不同,這可能是由于藻種及所用儀器差異引起的。因此,綜合考慮藻藍蛋白的純度和得率,均質壓力以80 MPa 為宜。
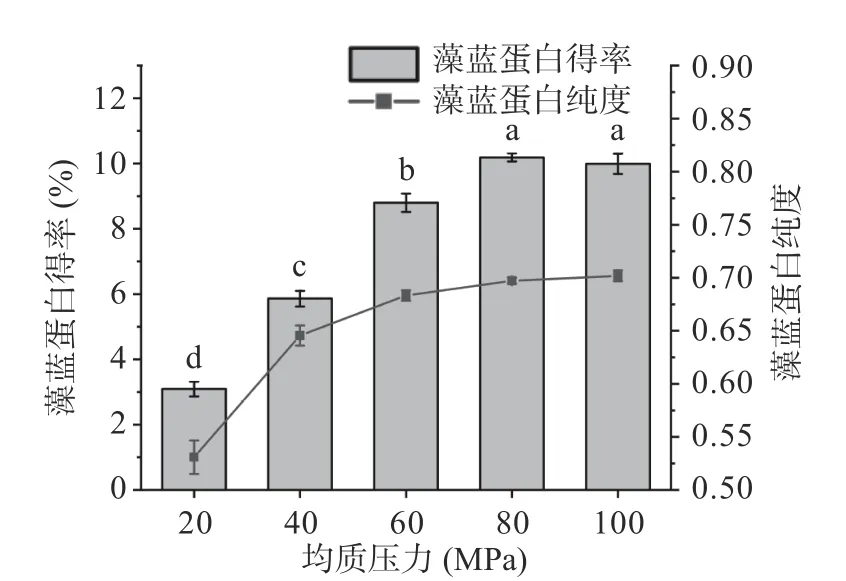
圖4 均質壓力對藻藍蛋白得率和純度的影響Fig.4 Effects of homogeneous pressure on the yield and purity of phycocyanin
2.1.4 均質時間對藻藍蛋白得率和純度的影響 如圖5 所示,隨著高壓均質時間的延長,藻藍蛋白純度和得率逐漸趨于穩定。綜合得率、純度及操作成本考慮,高壓均質的最適時間為7 min,所得的藻藍蛋白純度和得率分別可達到0.6950±0.0043 和10.5081%±0.0936%。
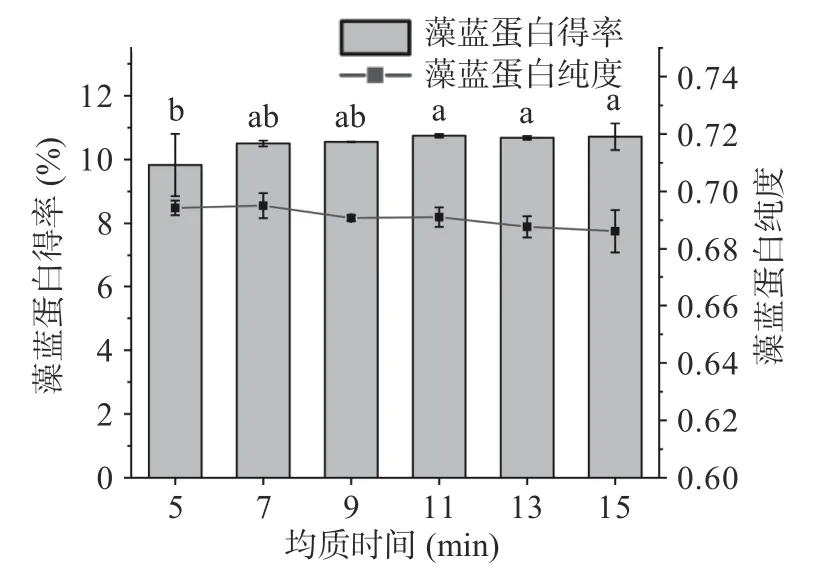
圖5 均質時間對藻藍蛋白得率和純度的影響Fig.5 Effects of homogenization time on the yield and purity of phycocyanin
2.2 藻藍蛋白粗提液純化
2.2.1 殼聚糖濃度對藻藍蛋白純度和回收率的影響 殼聚糖是帶有大量氨基基團的陽離子多糖,可以絮凝帶負電的藻細胞及雜蛋白,從而達到蛋白純化的目的[22]。從圖6 可以看出,藻藍蛋白回收率隨著殼聚糖濃度的升高而逐步下降到24.96%,而藻藍蛋白純度則呈現先升后降的趨勢且0.15 mg/mL 的殼聚糖下達到最高。當殼聚糖濃度大于0.20 mg/mL 時,殼聚糖分子數的增加使靜電吸附增強而選擇吸附性減弱[23],沉淀雜蛋白的同時也會大量沉淀藻藍蛋白,導致藻藍蛋白回收率和純度均下降。因此,兼顧藻藍蛋白純度與得率,選擇0.15 mg/mL 作為殼聚糖絮凝的合適濃度,此時藻藍蛋白純度可提高到1.2616±0.0183,回收率為88.2811%±1.2027%。
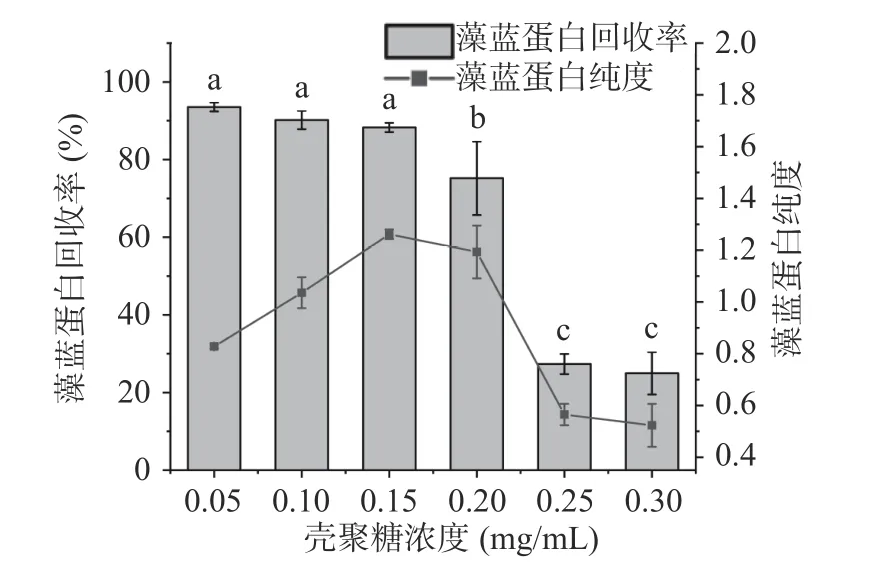
圖6 殼聚糖濃度對藻藍蛋白純度和回收率的影響Fig.6 Effects of chitosan concentration on the purity and recovery of phycocyanin
2.2.2 硫酸銨飽和度對藻藍蛋白純度和回收率的影響 高濃度的中性鹽能破壞蛋白質表面的水化層,從而使目標蛋白失穩從溶液中析出,達到純化的目的。由圖7 可得,當硫酸銨飽和度≥50%時,藻藍蛋白回收率已逐步趨于穩定,而硫酸銨飽和度為50%時藻藍蛋白純度達到最大,因此綜合考慮純度和回收率,選擇50%飽和硫酸銨用于藻藍蛋白純化,所得的藻藍蛋白純度和回收率分別可達到1.9084±0.2621 和80.66%±4.41%。
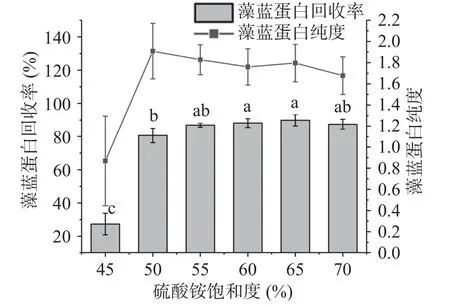
圖7 硫酸銨飽和度對藻藍蛋白純度和回收率的影響Fig.7 Effects of ammonium sulfate saturation on the purity and recovery of phycocyanin
2.3 藻藍蛋白熱致褪色機理研究
2.3.1 色澤指標分析 如圖8 的結果所示,隨著加熱溫度升高,L*值、b*值逐步變大,即溶液顏色逐步由暗變亮、由藍變黃,說明藻藍蛋白的深藍色澤隨溫度的升高而逐步消褪。在處理溫度為50 ℃時,藻藍蛋白溶液的b*值與未經熱處理的無顯著差異(P>0.05),且ΔEab很小。然而,當溫度到達60 ℃時,b*值和ΔEab便開始顯著增大,說明60 ℃可能是藻藍蛋白溶液的藍色大幅消褪的分界點。
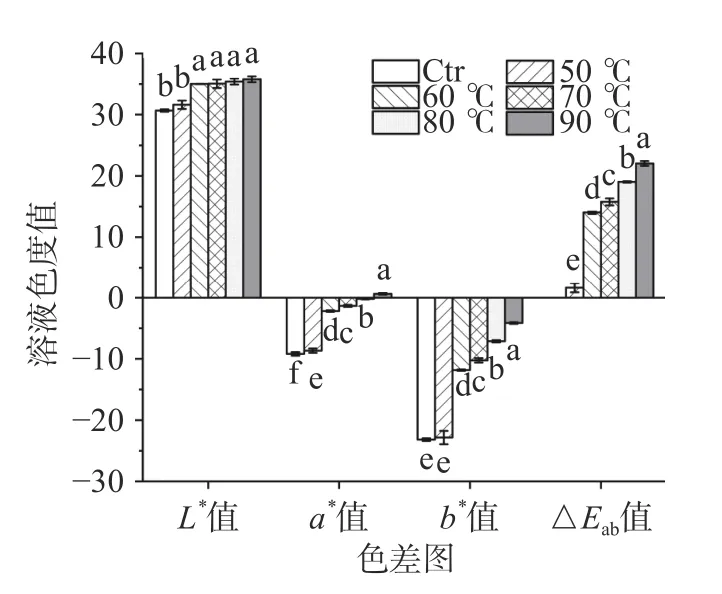
圖8 不同處理溫度對藻藍蛋白溶液L*,a*,b*值的影響Fig.8 Influence of different heating temperature on L*,a*,b *value of phycocyanin solution
2.3.2 UV-Vis 光譜分析 藻藍蛋白的特征吸收峰波長在620 nm 左右,是蛋白質及其所連接的發色團所處狀態的外在光譜性質體現,因此A620的變化可以用于表示色素保留率以及發色團結構的破壞程度[24-25]。如圖9 所示,藻藍蛋白色素保留率由50 ℃時的90.17%下降到60 ℃時的27.21%,導致藻藍蛋白溶液在60 ℃時的b*值和ΔEab顯著(P<0.05)增大。另外,當溫度升至80 ℃時,藻藍蛋白溶液的色素保留率相對于60 ℃時的保留率出現顯著下降(P<0.05),說明80 ℃下藻藍蛋白色澤消褪的程度可能進一步加深。
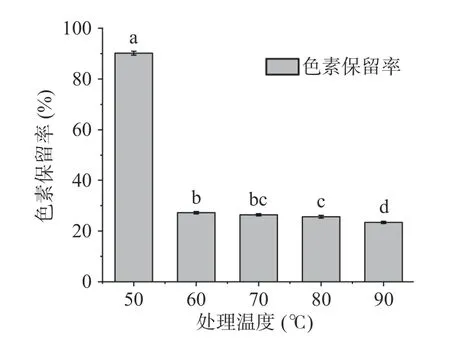
圖9 不同處理溫度對藻藍蛋白色素保留率的影響Fig.9 Influence of different treatment temperatures on the retention rate of phycocyanin pigment
大部分蛋白質含有色氨酸、酪氨酸等芳香族氨基酸,因而在280 nm 處有特征吸收峰。如圖10 所示,隨著處理溫度增加到60 ℃,280 nm 處的蛋白吸收峰消失,說明藻藍蛋白有序三維結構在60 ℃下被破壞,從而將芳香族氨基酸埋藏得更深[26]。與此同時,游離藻藍膽素發色團的360 nm 處特征吸收峰隨280 nm 處吸收峰的消失而出現,這是因蛋白高級結構變性四吡咯發色團重排而引起的[27]。
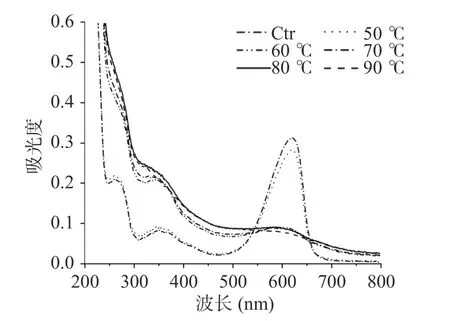
圖10 不同處理溫度對藻藍蛋白紫外可見光光譜的影響Fig.10 Influence of different treatment temperatures on the ultraviolet visible light spectra of phycocyanin
Avis/Auv是可見光區(~600 nm)最大吸收峰值與紫外區(~360 nm)最大吸收峰值之比,可作為四吡咯發色團構象的粗略度量[28]。由圖11 的結果可知,當處理溫度達到60 ℃時,Avis/Auv值由3.09(>>1,天然的線性構象)變為0.86(<1,游離的螺旋構象),說明發色團發生構象轉變,即上述因蛋白結構變性引起的重排。區別于有序的化學變性,熱處理同時影響藻藍蛋白的發色團和蛋白質結構而引起褪色[29]。另外,從80 ℃起發色團的Avis/Auv值趨于穩定(P>0.05)且360 nm 處的吸收峰消失,這可能是80 ℃下形成的蛋白聚集體將四吡咯發色團包埋于其內的結果。
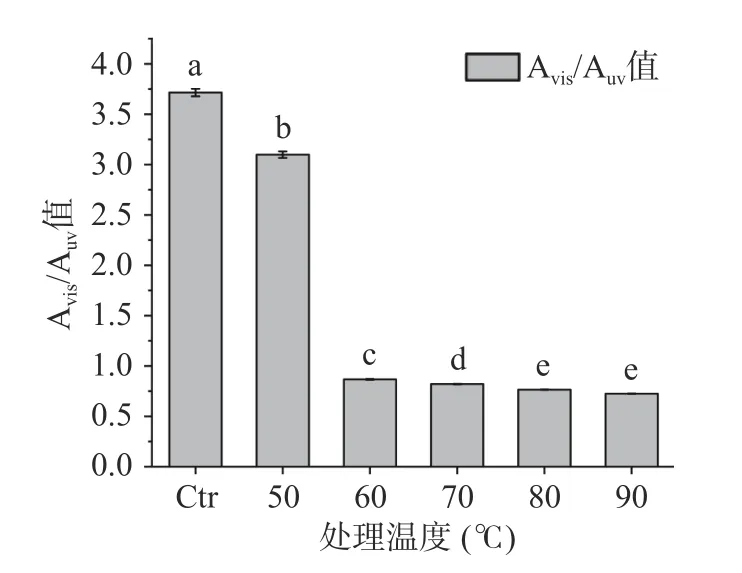
圖11 不同處理溫度對藻藍蛋白溶液Avis/Auv 值的影響Fig.11 Influence of different heating temperature on Avis/Auv value of phycocyanin solution
2.3.3 熒光發射光譜分析 內源熒光的產生是由于藻藍蛋白中色氨酸的熒光發射所引起的,與蛋白質的折疊結構狀態密切相關[30]。內源熒光的藍移或強度減小表明體系環境(含色氨酸)非極性增強,而色氨酸熒光的紅移或強度增大則是氨基酸暴露于極性環境中的結果[31]。如圖12 結果所示,隨著溫度升高,色氨酸的內源熒光強度下降且吸收峰波長藍移,說明色氨酸所處環境非極性增強,藻藍蛋白在60 ℃起由于有序三維結構的破壞而開始發生聚集。
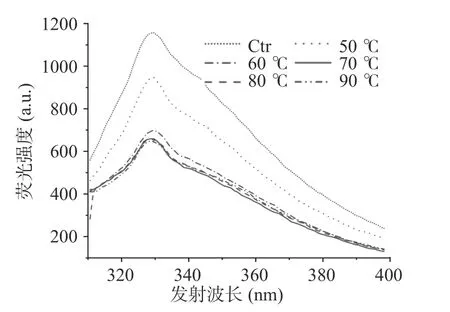
圖12 不同處理溫度對藻藍蛋白內源性熒光發射光譜的影響Fig.12 Influence of different treatment temperatures on the endogenous fluorescence emission spectra of phycocyanin
藻藍蛋白由于四吡咯發色團的存在,在620 nm處被激發后能發射出自身的特征性熒光。由圖13可知,藻藍蛋白特征熒光隨溫度的升高發生明顯的藍移和強度下降,60 ℃下以脫輔基蛋白有序三維結構為重要基礎的藻藍膽素熒光特性大幅減少,這與梁霄等[32]的結果一致。綜合之前的結果,可以得出:在熱處理時間為30 min 的前提下,60 ℃作為藻藍蛋白藍色色澤消褪的關鍵溫度點;在此溫度下,熱處理引起的脫輔基蛋白有序的三維結構破壞導致依托于蛋白骨架的藻藍膽素天然構象及光學性質遭到破壞,從而使溶液中有呈色活性的藻藍蛋白分子大幅減少,藻藍蛋白溶液的藍色色澤因此大幅消褪。
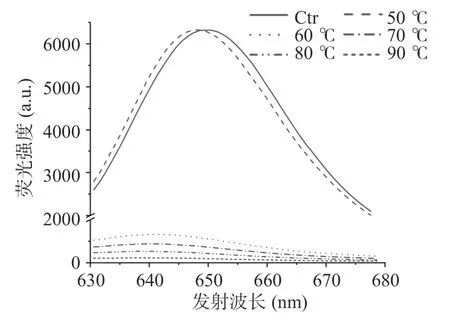
圖13 不同處理溫度對藻藍蛋白特征性熒光發射光譜的影響Fig.13 Influence of different treatment temperatures on the characteristic fluorescence emission spectra of phycocyanin
2.3.4 粒徑和電位分析 如表1 所示,未經熱處理的藻藍蛋白無法測定出其平均粒徑,與先前研究結果相一致[33-34],可能是藻藍蛋白的水溶性大或是自身顏色干擾所引起的。50 ℃下的粒徑同樣無法測出,說明50 ℃下處理30 min 能較好保持藻藍蛋白的天然狀態;60 ℃下藻藍蛋白由于蛋白結構破壞而趨于聚集,可以用于解釋280 nm 左右吸收峰的消失;而80 ℃下藻藍蛋白粒徑顯著增大(P<0.05),藻藍蛋白進一步的聚集可能將游離四吡咯發色團包埋于蛋白質內部,使溶液的藍色再度變淺,與2.3.2 的結果相印證。

表1 不同處理溫度對藻藍蛋白粒徑及電位的影響Table 1 Influence of different treatment temperatures on particle size and potential of phycocyanin
2.3.5 FTIR 光譜分析 如圖14 所示,藻藍蛋白的紅外特征吸收峰分別在3413、1654.47、1541.79、1399.25、1078.35 cm-1處,與文獻[35]中報導的基本一致。未經熱處理的藻藍蛋白紅外光譜上3413.43 cm-1的峰對應O-H 和N-H 基團的伸縮振動及帶有氫鍵結合的仲胺基,該吸收峰在50 ℃下出現藍移并隨著熱處理溫度升高峰形逐步尖銳,與蛋白質分子相關的氫鍵作用加強有關[36]。而出現氫鍵作用加強的原因可能是蛋白質與水之間的氫鍵相互作用被蛋白質之間的氫鍵相互作用代替,表明蛋白質水化能力的降低及蛋白質聚集程度的增大[37]。1654.47 和1541.79 cm-1分別代表著蛋白質的酰胺Ⅰ帶和酰胺Ⅱ帶,對于蛋白質二級結構的變化十分敏感。代表α螺旋的1654.47 cm-1處尖銳峰在60 ℃后逐鍵變寬,表明藻藍蛋白分子中主要二級結構的破壞。
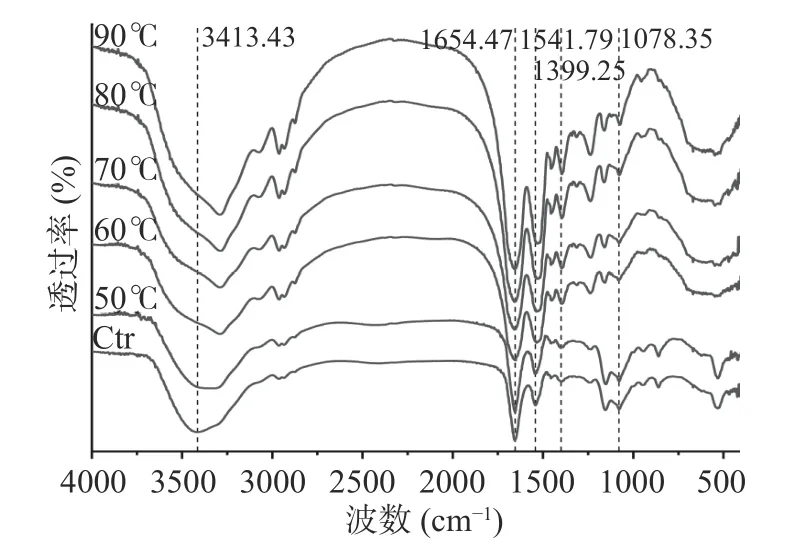
圖14 不同處理溫度對藻藍蛋白紅外光譜的影響Fig.14 Influence of different treatment temperatures on the infrared spectra of phycocyanin
2.3.6 SDS-PAGE 電泳分析 如圖15 所示,純化后的聚球藻7002 的藻藍蛋白由α、β兩種亞基構成,這與之前的研究結果一致[38]。隨著熱處理溫度的升高,α亞基的條帶仍清晰可見,但β亞基的條帶顏色卻逐漸變淡,說明β亞基對于高溫的熱穩定性可能遠不及α亞基。藻藍蛋白單體(αβ)分子上共價結合著3 個四吡咯發色團,其中1 個結合在α亞基的84 位半胱氨酸殘基上,而另外兩個結合在β亞基的84、155 位半胱氨酸殘基上[39],因此β亞基的破壞可能是藻藍蛋白藍色色澤嚴重消褪的主要原因之一。
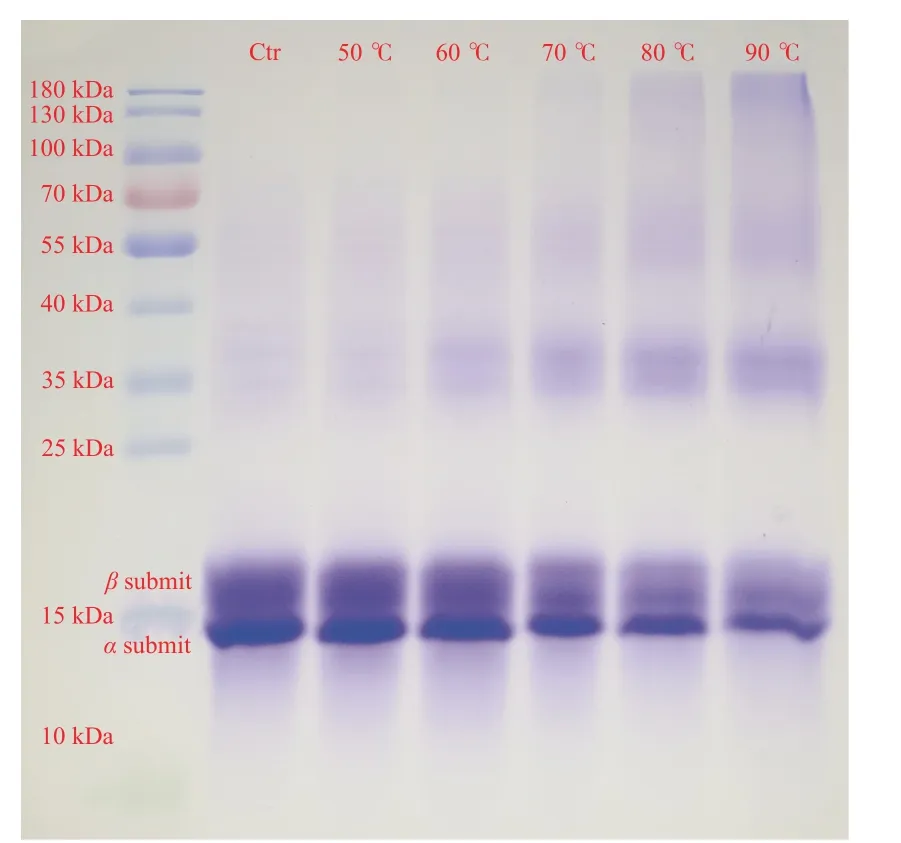
圖15 不同處理溫度對藻藍蛋白亞基分子量的影響Fig.15 Influence of different treatment temperatures on the molecular weight of phycocyanin subunits
3 結論
本研究以聚球藻 PCC7002 為原料,通過高壓均質得到純度為0.6950±0.0043 的藻藍蛋白,得率為10.5081%±0.0936%;通過殼聚糖絮凝和硫酸銨鹽析藻藍蛋白純度可提高到1.9084±0.2621,接近于工業級(A620/A280≥2.0)。本研究中藻藍蛋白的提取純化可為聚球藻藻藍蛋白的開發提供一定的理論基礎,促進對微藻資源的開發。
進一步地,本研究對聚球藻藻藍蛋白在熱處理過程中的褪色機理進行研究。從60 ℃起,熱處理引起的脫輔基蛋白有序空間結構的破壞導致依托于蛋白骨架的藻藍膽素天然構象發生轉變、藻藍蛋白紫外吸收和特征熒光明顯下降,溶液中具備呈色活性的藻藍蛋白分子因此大幅減少,藻藍蛋白溶液的藍色色澤大幅消褪;粒徑分析結果進一步表明,藻藍蛋白分子在60 ℃下開始聚集,80 ℃下更大程度的聚集可能使蛋白聚集體將四吡咯發色團包埋于其內,藻藍蛋白色澤消褪的程度加深。另外,FTIR 光譜和SDSPAGE 揭示,熱處理對藻藍蛋白分子中β亞基的破壞程度遠高于α亞基,且主要破壞的是藻藍蛋白的主要二級結構α-螺旋。因此,保持藻藍蛋白脫輔基蛋白結構的穩定或者至少保持藻藍膽素發色團依托蛋白結構的穩定,是保證藻藍蛋白在熱處理過程中保持穩定藍色色澤的關鍵因素所在。本研究對藻藍蛋白護色措施的研究、藻藍蛋白在食品工業中的應用提供了一定的理論基礎,然而本研究對于熱處理過程中藻藍蛋白三聚體-單體水平的變化以及這種變化是否是藻藍蛋白褪色的主要原因之一仍存在疑問,需要后續進一步的探討。

