強還原土壤滅菌處理對人參連作土壤細菌群落結構及土壤酶活的影響
閆寧,戰宇,苗馨月,王二剛,陳長寶,李瓊
(長春中醫藥大學吉林省人參科學研究院,長春 130117)
人參(Panax ginsengC.A.Mey)為五加科人參屬植物[1],主要分布在中國東北地區、俄羅斯東部和朝鮮地區,因其具有抗腫瘤、抗炎、免疫調節等藥理作用[2],作為名貴的藥材從我國古代一直沿用至今。由于人參的藥理與保健作用受到廣泛關注,其在醫藥市場上的需求也日益增多。但連作障礙嚴重制約了人參產業的可持續發展。據報道,土壤微生物群落和多樣性失衡、有益微生物減少、病原微生物和各種土傳植物病害致病菌富集,以及各種相關因素之間的相互作用進一步加劇人參連作障礙的發生[3-4],因此,改良土壤是攻克人參連作障礙問題的核心。
土壤微生物屬于生態系統中的生產者和分解者,是影響有機質分解、土壤肥力、養分循環和植物養分有效性的關鍵因素[5-6],其數量和種類決定著植物的生長發育和健康狀況。土壤中最豐富的微生物類群是細菌,它們在土壤有機質和無機質的轉化中扮演著重要的角色[7-8]。在非菌落化過程中,它們與植物根際相互作用,釋放出營養物質,影響植物生長。除此之外,一些細菌可以通過分泌有益化合物或控制病原菌生長來維持植物健康[9]。細菌的多樣性通常受土壤條件、植物季節性和年齡的影響[10]。基于土壤微生物、土壤質量和植物健康之間的相互關系,通過調節土壤微生物群落關系可以有效改善連作障礙問題。
農業管理措施主要包括種植技術管理、水肥管理、病蟲害防治3個方面[11]。其中,專業的種植技術可以保障有機農作物品質,適宜的水肥管理可以提高農產品的品質與生產效率,避開病蟲害高發期進行作物種植可以保障農作物在生長初期不受病蟲侵害。而這些農業管理措施均是通過改變土壤理化性質及土壤微生物活性和組成來影響植物多樣性、土壤健康和生產力。據宋時麗等[12]報道,在使用化肥的基礎上,復合菌劑可優先降解腐熟的有機物料,釋放養分并促進有機質分解酶活性,以此來提高小麥土壤有機質等養分。氯化苦土壤熏蒸法(soil fumigation,SF)具有廣泛的生物滅活性,一度被當作緩解人參連作障礙的有效方法,但因其對非目標微生物和土壤生態系統有負面影響,致使人們不斷尋求更有效環保的方法[13]。強還原土壤滅菌(reductive soil disinfestation,RSD)是在土壤中加入易分解的有機改良劑(如小麥或米糠等),加水灌溉至飽和后覆蓋不透水的塑料薄膜,保持2~4周,可有效殺滅90%以上的病原菌,是一種新型土壤改良方法[14-15]。RSD作用機制與好氧分解過程中積累毒副產物(如有機酸、金屬離子、氨、硫化氫和揮發物等)、殺滅好氧病原菌和抑制土壤病原微生物的活性等有關[16-18]。有機基質、土壤溫度和厭氧培養時間是保證抑菌效果的主要因素[19-20]。
RSD不僅能夠改善土壤酸化和鹽漬化問題,對調節土壤微生物群落結構和組成也有積極影響[21],有望成為改良人參連作土壤的綠色方法。目前,RSD主要應用于番茄[22]、水稻[23]等作物,在人參連作土壤改良上應用較少,因此,本研究設置3種方式對老參地進行改良處理,并通過Illumina Miseq高通量測序技術分析測定3種方式改良后的人參連作土壤細菌群落結構、物種豐度及組成,通過相關性分析土壤細菌群落多樣性與土壤酶活性的關系,以期證實強還原土壤滅菌改良人參連作土壤的效果要優于氯化苦熏蒸法。
1 材料與方法
1.1 研究區概況
試驗于2019年7月15日在吉林省吉林市昌邑區左家鎮北方藥用植物資源圃進行,試驗前該地已連續3年種植人參,土壤連作障礙嚴重。該區屬溫帶季風型大陸氣候,天氣多變,四季分明。年平均氣溫5.6℃,年平均降水量679 mm,年平均結凍期5個月以上,無霜期120 d左右,土壤母質類型為暗棕壤。
采用強還原土壤滅菌加土壤熏蒸(RSD+SF)、強還原土壤滅菌加復合菌(RSD+F)以及土壤熏蒸加復合菌(SF+F)3種土壤改良方式對試驗地進行處理,其中,采用氯化苦熏蒸土壤,復合菌為有益微生物菌劑,其目的是修復土壤菌群。RSD處理是將動物糞便(雞糞、牛糞、豬糞=1∶1∶1)與土壤均勻混合,澆水灌溉至100%持水能力,覆蓋0.1 mm藍色塑料薄膜,高溫悶棚40 d,土壤溫度在30~40℃之間,40 d后揭膜、通風、排水使土壤自然變干;SF處理是將氯化苦(大連綠峰化學股份有限公司,中國遼寧)注射到距表層15—20 cm的土壤中,覆蓋0.1 mm厚藍色塑料薄膜進行熏蒸消毒,40 d后揭去薄膜,自然晾曬2~3 d后重復翻地3次,保證氯化苦完全揮發。復合微生物菌劑(石家莊沃福沃肥業有限公司)主要包含枯草芽孢桿菌、哈茨木霉菌等。每個處理面積約為30 m2(2 m×15 m),隨機排列分布,重復3次。于2019年10月20日移栽大小相近的2年生健康參苗。試驗基地田間管理均按當地傳統方法進行。
1.2 樣品采集
分別于2020年6、7、8、9和10月在試驗區采樣,每個處理組采用S形取樣法隨機采集人參5株,抖落根際土壤于自封袋中。樣品平行采集3份,共采集9份人參根際土壤樣品。收集的樣品4℃冷藏保存,用于土壤微生物多樣性分析及土壤酶活性檢測。
1.3 供試材料
2年生健康人參品種為大馬牙,幼苗購自吉林省撫松縣萬良鎮人參交易市場;動物糞便購自吉林省吉林市昌邑區左家鎮居民養殖場,將雞糞、牛糞、豬糞等量混合后自然發酵;藍色塑料薄膜(厚度0.1 mm)購自吉林省鑫豐裕塑料有限公司;土壤熏蒸用氯化苦(有毒,需使用專用注射器)購自大連綠峰化學股份有限公司;復合微生物菌劑產自石家莊沃福沃肥業有限公司。
1.4 測定方法
1.4.1 總DNA提取及檢測 利用DNA Kit試劑盒(Omega Bio-tek,USA)提取土壤總DNA,利用NanoDrop 2000進行檢測DNA濃度和純度,利用1%瓊脂糖凝膠電泳檢測DNA質量。
1.4.2 PCR擴增 用338F(5’-ACTCCTACGGGAG GCAGCAG-3’)和806 R(5’-GGACTACHVGGGTW TCTAAT-3’)引物擴增V3~V4可變區,擴增體系20μL:5×FastPfu緩沖液4 uL,2.5 mmol·L-1dNTPs 2μL,5μmol·L-1引物各0.8μL,FastPfu聚合酶0.4μL;DNA模板10 ng。擴增程序:95℃預變性3 min;95℃變性30 s,55℃退火30 s,72℃延伸45 s,27個循環,最后72℃延伸10 min。所用儀器為ABIGeneAmp?-9700型PCR儀。
1.4.3 Illumine Miseq測序 使用NEXTFLEX?Rapid DNA-Seq Kit(BIOO SCIENTIFIC,USA)構建Miseq文庫。利用Illumina公司的Miseq PE300平臺(上海美吉生物醫藥科技有限公司)進行測序。
1.4.4 土壤酶活性測定 利用相關試劑盒(江蘇科特生物科技有限公司)測定土壤漆酶(soil laccase,SL)、土壤過氧化氫酶(soil catalase,SCAT)、土壤酸性磷酸酶(soil acid phosphatase,SACP)、土壤蔗糖酶(soil sucrase,S-SC)、土壤脲酶(soil urease,S-UE)活性。
酶活定義:土壤漆酶活性以37℃條件下每克土壤每分鐘氧化1 nmol底物ABTS所需的酶量為1個酶活;土壤過氧化氫酶活性以37℃每克風干土樣每天催化1μmol H2O2降解所需酶量為1個酶活;土壤酸性磷酸酶活性以37℃中每克土壤每天釋放1 nmol酚所需酶量為1個酶活;土壤蔗糖酶活性以37℃每克土壤產生1 mg還原糖所需酶量為1個酶活;土壤脲酶活性以37℃每克土壤中產生1 μg NH3-N所需酶量為1個酶活。
1.5 數據處理
采用微生物多樣性云分析平臺進行數據處理,使用Execl 2013進行圖表的制作,采用SPSS 23.0對數據進行顯著性分析。
2 結果與分析
2.1 不同土壤改良方式對土壤細菌群落多樣性的影響
從3種方式改良的土壤樣品稀釋曲線(圖1)可以看出,細菌屬水平Shannon指數曲線趨向平坦,表明測序數據量足夠大,能夠反映樣品中絕大多數的微生物信息。
圖1 樣品稀釋曲線Fig 1 Sample dilution curve
經3種方式改良后的土壤細菌群落多樣性存在顯著差異(表1)。從Ace指數與Chao指數中可以看出,RSD+F組處理均顯著(P<0.05)高于其他處理,說明經RSD+F改良處理后的土壤中細菌群落多樣性最高,RSD+F組的Shannon指數為4.79,顯著(P<0.05)高于其他組,而且該組的Simpson指數最低,僅為0.01,說明經該組改良后的土壤細菌群落豐度最高,與Shannon指數結果一致。
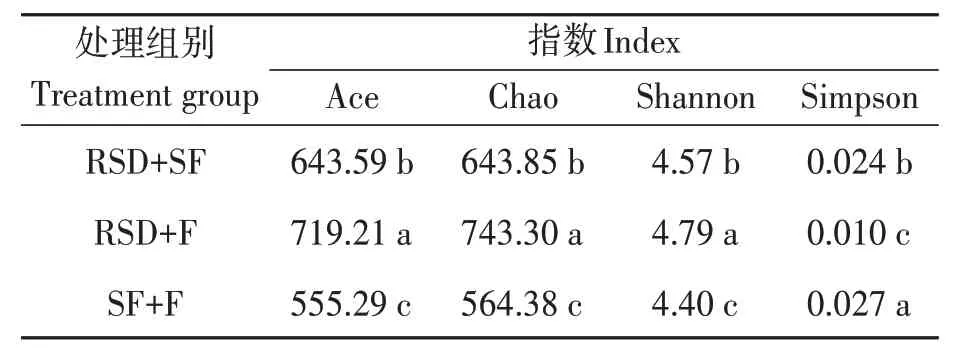
表1 土壤細菌多樣性指數Table 1 Diversity index of soil bacteria
2.2 不同土壤改良模式對土壤細菌群落組成的影響
2.2.1 對土壤細菌群落多樣性的影響 土壤微生物群落的組成和多樣性是維持植物多樣性、土壤健康的必要條件。由Venn圖(圖2)可知,RSD+SF組共有795個菌屬,RSD+F組共有656個菌屬,而SF+F組僅有519個菌屬,表明經3種方式改良土壤的細菌群落組成具有明顯差異。RSD+SF組與RSD+F組的的菌屬數量多于SF+F組,說明強還原處理相較于氯化苦熏蒸技術可有效增加細菌屬的數量,提高土壤群落的多樣性。
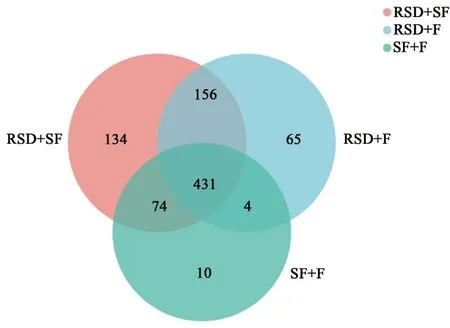
圖2 土壤細菌屬水平Venn圖Fig.2 Venn map of soil bacterial community
2.2.2 對土壤細菌門水平的影響 經3種方式改良后,土壤細菌門水平的群落豐度如圖3所示,可以看出,變形菌門(Proteobacteria)、放線菌門(Actinobacteria)在3個處理組中豐度均超過35%,厚壁菌門(Firmicutes)和芽單胞菌門(Gemmatimonadetes)在RSD+SF組和SF+F組的豐度均高于RSD+F組,而RSD+F組的酸桿菌門(Acidobacteria)和綠彎菌門(Chloroflexi)的相對豐度高于RSD+SF組和SF+F組。
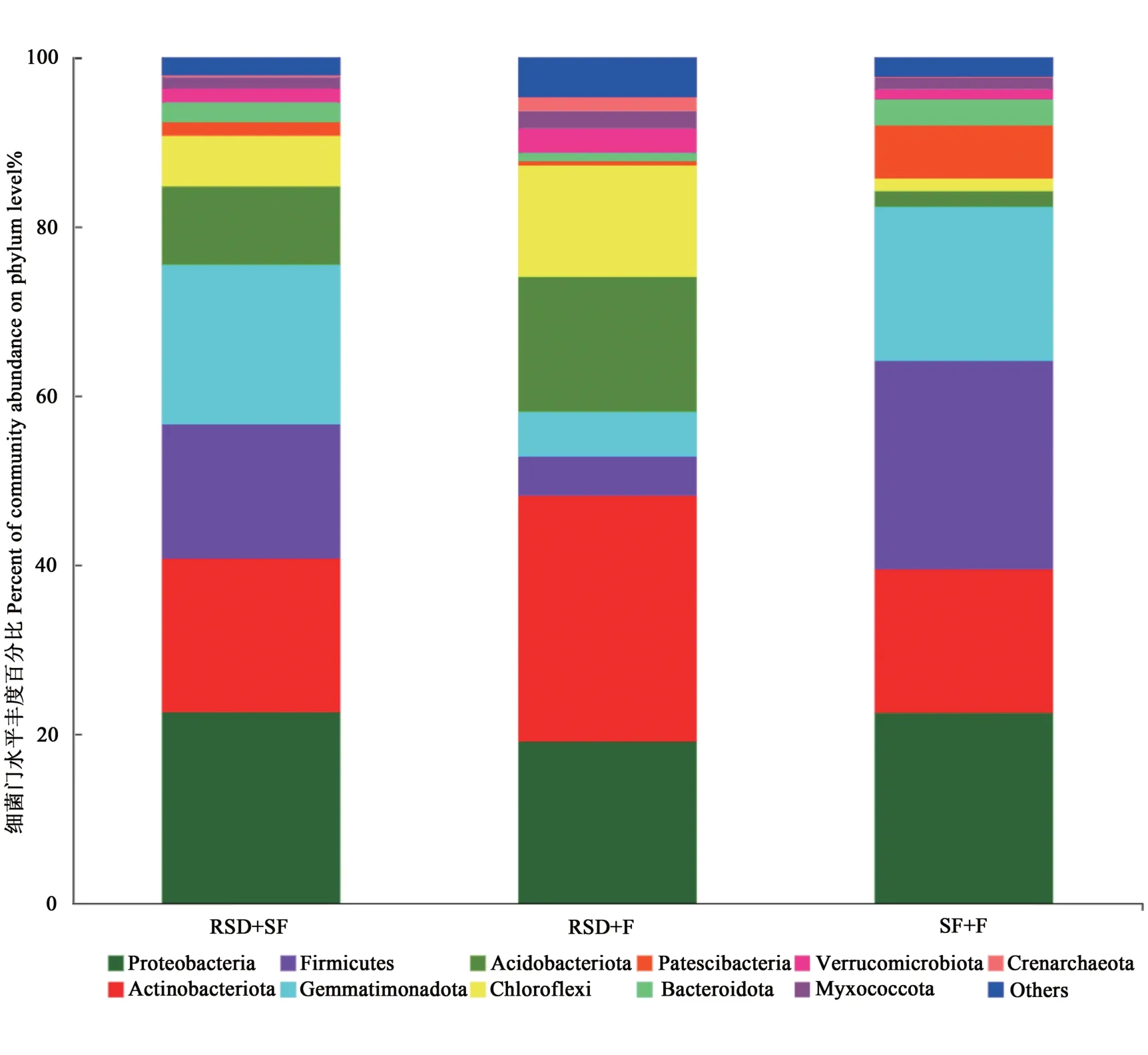
圖3 土壤細菌門水平群落豐度Fig.3 Soil bacterial phylum horizontal community abundance
2.2.3 對土壤細菌屬水平的影響 由圖4可知,3種方式改良后,土壤中優勢細菌在屬水平的種群及豐度均存在著差異。其中經RSD+SF組處理后的土壤前10的優勢菌群依次為芽單胞菌屬(Gemmat imonas)、芽 孢 桿 菌 屬(Bacill us)、norank_f_Gemmatimonadaceae、norank_f_norank_o_Vicinamibacterales、unclassified_f_Thermomonosporaceae、Mi crob ispor a、uncl ass i fied_f_Gemmati monadaceae、Sphingomonas、norank_f_noranko_Gaiellales、Nitrolancea。經RSD+F組處理后,土壤前10的優勢菌群依次為norank_f_noranko_Gaiellales、norank_f_nor ank_o_Vicinamibacterales、鞘氨醇單胞菌屬(Sphingomonas)、norank_f_norank_o_Aci dobacter iales、Cand id atus_Udaeobacter、Gaiella、norank_f_norank_o_norank_c_KD4-96、芽孢桿菌屬(Bacillus)、類諾卡氏屬(Nocardioides)、節桿菌屬(Arthrobacter)。而經SF+F組處理后的土壤前10的優勢菌群依次為芽孢桿菌屬(Bacillus)、norank_f_Gemmatimonadaceae、芽單胞菌屬(Gemmatimonas)、Ramlibacter、Roseis olib act e、節桿菌屬(Arth robacter)、norank_f_LWQ8、Unclassified_f_Sporolactobacillaceae、小雙孢菌屬(Microbispora)、類芽孢桿菌屬(Paeni bacillus)。
2.3 不同土壤改良方式對土壤酶活性的影響
2.3.1 土壤漆酶活性變化分析 對比不同方式改良后的人參連作土壤在不同月份的漆酶活性(圖5)可以發現,3個處理組的漆酶活性均呈先降低后升高的趨勢,其中RSD+SF組在8月的漆酶含量最低,僅為53.63 nmol·min-1·g-1;SF+F組和RSD+F組在7月份的漆酶含量最低,分別為39.03和75.31 nmol·min-1·g-1。這可能與7、8月正處于夏季,土壤溫度較高,導致土壤漆酶活性降低有關。韓曉磊等[24]報道,隨溫度的升高,土壤中的漆酶活性顯著降低,與本研究結果一致。
2.3.2 土壤過氧化氫酶活性變化分析 從圖6可以看出,RSD+SF組與RSD+F組的過氧化氫酶活性要顯著高于SF+F組,其原因可能是人參連作土壤經強還原滅菌處理后比經氯化苦熏蒸處理能增加更多的屬水平細菌數量有關,該結果與李冰等[25]報道的土壤過氧化氫酶活性與土壤細菌多樣性呈正相關的結果一致。

圖6 不同方式改良后人參土壤不同月份的過氧化氫酶活性Fig.6 Catalase activity in different months of Ginseng soil improved by different methods
2.3.3 土壤酸性酸化酶活性變化分析 酸性磷酸酶活性與土壤的pH有關,對比不同方式改良后的人參土壤在不同月份的酸性磷酸酶活性(圖7)可以發現,RSD+SF組與RSD+F組的酸性磷酸酶活性顯著高于SF+F組,說明經強還原滅菌處理人參連作土壤可能提高土壤的pH。這一結果與王涵等[26]的酸化抑制堿化激活酸性磷酸酶活性結論一致。
2.3.4 土壤蔗糖酶活性變化分析 從圖8可以看出,除了6月和10月,其他月份的蔗糖酶活性高低順序為RSD+SF組>RSD+F組>SF+F組,因為蔗糖酶的活性能夠表征土壤的肥力水平[27],因此這一結果表明經強還原土壤滅菌處理后的連作土壤肥力要強于氯化苦熏蒸處理。
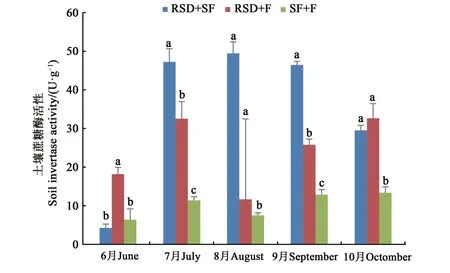
圖8 不同方式改良后的人參土壤不同月份的蔗糖酶活性Fig.8 Sucrase activity in different months of Ginseng soil improved by different methods
2.3.5 土壤脲酶活性變化分析 從圖9可以看出,3個處理組RSD+SF組的脲酶活性均呈先升高后降低的趨勢,其中在8月時的脲酶活性均最高,具體表現為RSD+F組>RSD+SF組>SF+F組,脲酶活性依次為6 451.12、4 978.66、3 218.60 U·g-1,因為脲酶是土壤中氮轉化的重要酶類之一[28],該結果表明經強還原滅菌處理后的連作土壤中的氮含量要高于經氯化苦熏蒸處理后的連作土壤中的氮含量。
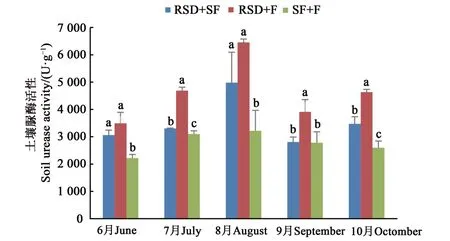
圖9 不同方式改良后的人參土壤在不同月份的脲酶活性比較Fig.9 Urease activity in different months of Ginseng soil improved by different methods
2.4 土壤細菌群落多樣性與土壤酶活性相關關系分析
圖10為經3種方式改良后的土壤不同細菌群落結構與土壤酶活性的相關關系。可以看出,在總豐度前30的屬細菌中,不同細菌群落結構與土壤酶活性存在差異,其中土壤漆酶與Candidatus_Solibacter呈顯著正相關關系(P<0.05);土壤過氧化氫酶與Ph enylob act erium呈顯著負相關關系(P<0.05);土壤酸性磷酸酶與多種菌屬呈正相關關系,其中與norank_f_nor ank_o_norank_c_K D4-96和norank_f_nor ank_o_Gai el lales呈 顯 著 正 相 關 關系(P<0.05),與Cand id atus_Udaeobacter呈極顯著正相關關系(P<0.01);土壤蔗糖酶與Roseisolib acter呈顯著負相關關系(P<0.05),與其他菌屬的相關系數均較低;土壤脲酶影響著多種菌屬,其中與norank_f_nor ank_o_Vicinamibacter al es呈顯著正相關關系(P<0.05),與unclass ified_f_Gemmat i monadaceae呈顯著負相關關系(P<0.05),與Paenibacill us(類芽孢桿菌屬)、unclass ified_f_S porolactobacillaceae以及Raml ibacte均呈極顯著負相關關系(P<0.01)。
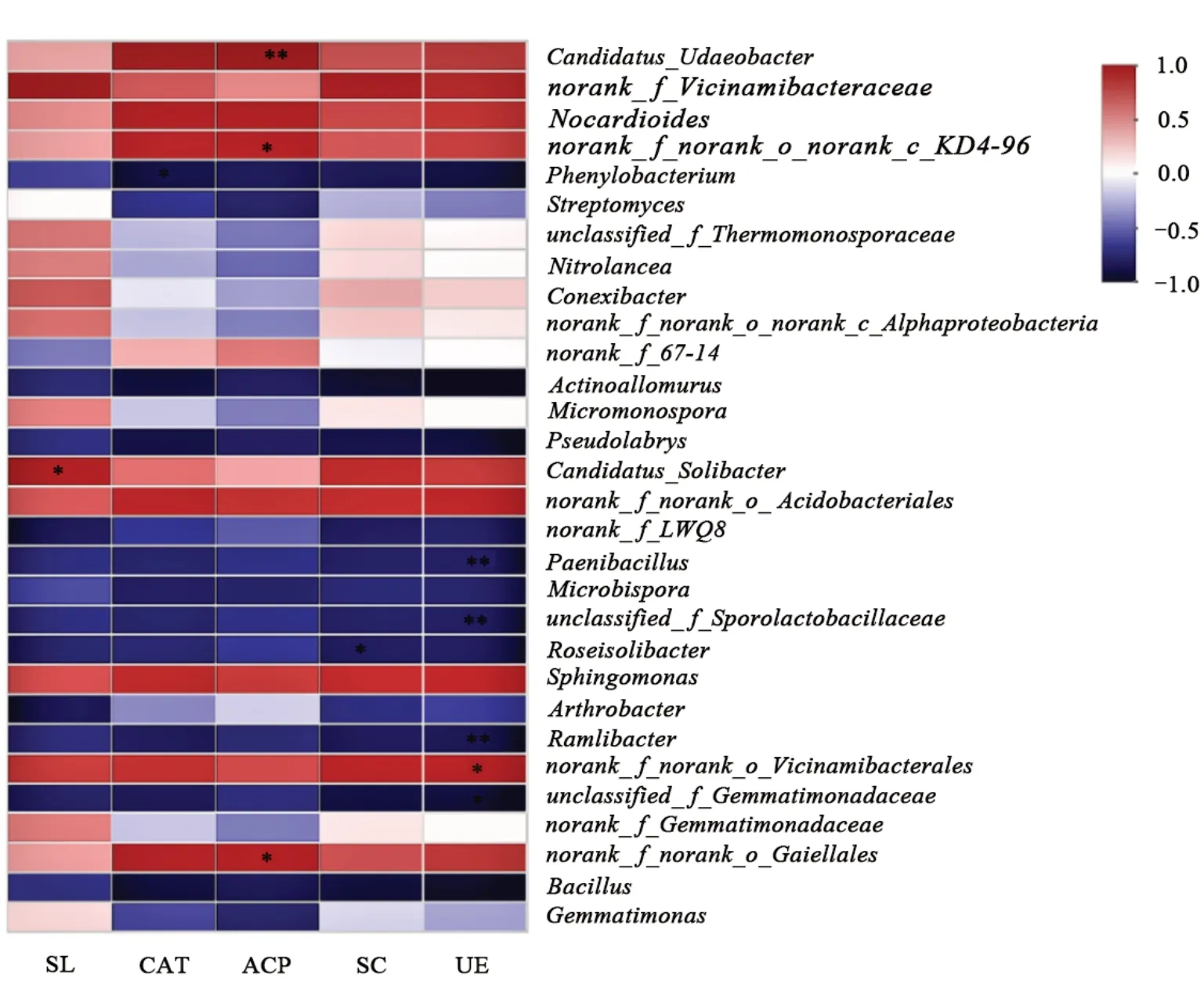
圖10 土壤細菌群落與土壤酶活性相關性Fig.10 Correlation between soil bacterial community and soil enzyme activity
3 討論
研究表明,隨著人參栽培年限增加,人參根際土壤中的有害真菌屬的數量會增多,而有益細菌屬的數量會減少[29],因此可以通過增加有益細菌屬的數量及豐度來緩解人參連作障礙問題。本研究通過分析3種方式改良后的人參連作土壤中的有益細菌屬數量及豐度發現,RSD+SF組和RSD+F組的有益細菌屬數量均高于SF+F組,細菌群落豐度也不同,原因可能與人參連作土壤經強還原土壤滅菌處理后,因輸入較多的有機物而具有較高的碳固存潛力,并有效抑制土壤中的病原真菌微生物,從而使土壤中有益微生物占領有利生態位有關,這與Ali等[30]的研究結果一致。除此之外,經3種方式處理后的人參連作土壤中各自存在著不同的優勢菌群,其中Baci l lus(芽孢桿菌屬)為3種改良土壤中共有的優勢菌群,該菌屬在SF+F組中所占的豐富度最高,高達9.16%,而在RSD+F組所占的豐富度最低,僅為1.82%。Bacillus具有巨大的遺傳多樣性和代謝多樣性,在土壤生態系統中發揮著從養分循環到植物抗逆性等多種生態作用,被認為是有效拮抗病原菌生長的有益菌屬[31]。而芽孢桿菌屬的成員具有多種有益的特性,通過獲取營養、產生植物激素來全面改善生長、保護植物免受病原體和其他非生物脅迫,直接或間接地幫助植物生長[32]。其中,芽孢桿菌通過參與促進植物生長的各種直接和間接機制,包括增溶和礦化氮、磷和其他營養物質以及產生植物激素、鐵載體、抗菌化合物和水解酶[33],從而具有誘導系統抗性(induced systems resistance,ISR)和對非生物脅迫的耐受性[34-35]。Norank_f_norank_o_Vi ci namib acterales、S phingomonas、norank_f_nor ank o_Gaiellales為RSD+SF組與RSD+F組的共有優勢菌群,推測這可能與強還原土壤滅菌處理增加這3種有益細菌屬的數量有關。
土壤酶參與土壤生態系統中的碳、氮、硫和其他養分的循環,其活性大小能夠反映某種土壤狀況下生物化學過程的相對強度,因此測定相應酶的活性,可以間接了解某種物質在土壤中的轉化情況[36]。土壤漆酶是由氮消耗引起的重要酚氧化酶,可通過降解底物來保護環境[37-38]。改土后的土壤漆酶與Cand id atus_Soli bacter呈顯著正相關關系(P<0.05),其中RSD+F組的土壤漆酶活性顯著高于其他處理,這可能是由于強烈的土壤強還原環境可加速腐殖質的分解,從而提高土壤漆酶活性[39-40]。土壤過氧化氫酶廣泛存在于土壤中,其活性與土壤有機質含量和微生物數量有關。RSD+SF與RSD+F組的土壤過氧化氫酶活性先呈上升的趨勢,這可能與強還原滅菌處理中的有機物料可轉化生成土壤有機質,而有機質的數量與過氧化氫酶的活性呈正相關有關[41]。研究表明,土壤酸性磷酸酶可參與植物體內的有機磷的分解及再利用過程[42]。改土后的土壤酸性磷酸酶與nor ank_f_nor ank_o_nor ank_c_KD4_96、norank_f_norank_o_Gaiellales以及Candidatus_Udaeobacter呈顯著正相關關系(P<0.05),RSD+SF組和RSD+F組的土壤酸性磷酸酶活性顯著高于SF+F組,猜測與強還原滅菌處理使Cand id at us_Ud aeob act er等菌群數量增加,導致有效磷被大量富集,使人參被迫提高根系酸性磷酸酶基因表達,從而增加土壤酸性磷酸酶活性有關[43]。土壤蔗糖酶可直接參與有機質的代謝過程,不僅能夠表征土壤生物學活性強度,也可作為土壤熟化程度和土壤肥力水平的指標[44]。改土后的土壤蔗糖酶與玫瑰桿菌屬(Roseisolibacter)呈顯著負相關關系(P<0.05),Ros ei sol ibacter僅為SF+F組的優勢細菌屬,其豐度高達3.82%(表2),這與SF+F組的蔗糖酶活性要顯著低于其他組的結果一致。土壤脲酶能促進尿素的水解,酶促產物氨是植物可用的氮源之一,其活性可以反映土壤供氮的能力[45]。改土后的土壤脲酶與norank_f_norank_o_Vi ci namibacterales呈顯著正相關關系(P<0.05),經3種方式改良處理后的脲酶活性均先呈上升趨勢,以RSD+F組的脲酶活性上升趨勢最為明顯,這可能與強還原土壤滅菌處理可有效增強土壤的供氮能力從而改善人參連作土壤的營養狀況有關[46]。
強還原土壤滅菌已被證實是控制許多土傳病原體和疾病的有效且環保的方法。在本研究中,3種土壤改良方式在不同程度上均增加人參連作土壤的有益細菌屬的數量及豐富度,并提高了土壤酶活性,其中RSD+SF及RSD+F組的有益細菌屬的數量、豐富度及土壤酶活性要高于SF+F組,可能與強還原土壤滅菌技術相較于氯化苦熏蒸處理更適合微生物的生長與繁殖,并增加土壤的群落豐度,厭氧微生物形成優勢菌群后,增強根系分泌物對特定的細菌種群的選擇性,促進了植物對營養物質的吸收,從而提高土壤酶活性有關[47]。該結果初步證實強還原土壤滅菌緩解人參連作障礙的效果要優于氯化苦熏蒸法。

