一株后生元菌株的抑菌特性研究及其細菌素基因簇的挖掘
張曉妍,沙沈菲,郭麗丹,賈 爽,周婉婷,陳雨瀅,汪立平,2,3,
(1.上海海洋大學食品學院,上海 201306;2.農業部水產品貯藏保鮮質量安全風險評估實驗室,上海 201306;3.上海海洋大學食品熱加工工程技術研究中心,上海 201306)
隨著當今高密度集約化養殖模式的推進,水產動物病害頻發,感染性疾病特別是細菌感染嚴重制約了水產養殖業的健康可持續發展。實驗室前期從陜西漢中某大鯢養殖場的病鯢體內分離出了一株嗜水氣單胞菌()。嗜水氣單胞菌是我國流行最廣泛的一種典型人-畜-水生動物共患致病菌,它不僅是引起魚類運動性氣單胞菌敗血癥的主要病原,也是兩棲類、爬行類以及哺乳類動物的重要病原。抗生素類藥物因高耐藥性、藥物殘留和破壞養殖微生態平衡等局限,已無法滿足水產養殖病害防治愈來愈高的需求。因此,當前迫切需要尋找可替代抗生素的治療藥物來應對嗜水氣單胞菌引起的疾病感染。
近三十年來,飼料添加劑作為水產養殖業的抗生素替代物引起了科學界的廣泛關注。益生菌、益生元及后生元作為最有前景的飼料添加劑之一,可用于防治水產動物的細菌性、病毒性及寄生蟲性疾病。然而,益生菌作為一種活菌制劑,對體內環境要求較為苛刻,如遇高溫、胃酸等環境便會失活,這成為了擴大其應用的障礙。研究指出,益生菌對機體的作用不一定與活菌有直接關系,起關鍵作用的極有可能是菌株代謝產物或菌體成分,這些活效因子正式被國際益生菌組織命名為后生元(Postbiotic)。后生元又稱滅活益生菌,是益生菌經加工處理后的菌體及其代謝產物的統稱。經過篩選的后生元,即便經過高溫或腸胃消化液處理仍可保有高度功能活性,且比活性益生菌具有更好的安全性、吸收性和機體分布性,有利于促進宿主健康。
可產生細菌素的乳酸菌被認為是應用于食品、醫療等領域的潛在后生元,如日本的熱滅活植物乳植物桿菌L-137(L-137)。細菌素是細菌代謝過程中產生的一類具有生物活性的多肽或蛋白質。天然來源的細菌素因其無毒副作用、不易產生耐藥性、無殘留和無污染等特點,符合水產品安全生產的需要,有望成為人類擺脫“耐藥菌危機”的新手段。用它來對付大鯢感染的特定病原,對于減少其疾病感染、耐藥菌的產生和傳播都具有重要意義,是極具潛力和創新的替代選擇。基于此,本文篩選了一株對中國大鯢病原嗜水氣單胞菌有拮抗作用的產細菌素乳酸菌株,并對其進行了抑菌特性的研究和細菌素基因簇的挖掘,以評估其作為后生元菌株的潛在應用價值。
1 材料與方法
1.1 材料與儀器
指示菌嗜水氣單胞菌Ah2 陜西漢中某大鯢養殖場病鯢體內腹水分離所得;鯉魚上皮瘤細胞EPC上海海洋大學水產學院病原庫贈予;篩選用泡菜、豆豉、腐乳、酸奶和奶酪樣品 上海、武漢和青島市售食品;LB 和MRS 肉湯干粉培養基 廣東環凱微生物科技有限公司;無菌脫纖維羊血平板 青島海博生物技術有限公司;抗菌藥物藥敏紙片 杭州微生物試劑有限公司;乙酸乙酯 分析純,上海泰坦科技股份有限公司;Ezup 柱式基因組DNA 抽提試劑盒(細菌)、改良Bradford 法蛋白濃度測定試劑盒、過氧化氫酶(3000 U/mg)、木瓜蛋白酶(≥15 U/mg)、胃蛋白酶(≥2500 U/mg)、胰蛋白酶(≥180 U/mg)、蛋白酶K(≥20 U/mg)、Triton X-100 生工生物工程(上海)股份有限公司;胎牛血清 杭州四季青生物工程材料有限公司;M199 培養基、0.25%胰酶消化液美國Gibco 公司;雙抗 北京蘭杰柯科技有限公司;T培養瓶 無錫耐思生命科技股份有限公司;超低分子量3.3~20.1 kD 蛋白質Marker 北京索萊寶科技有限公司;Tricine-SDS-PAGE 凝膠配制試劑盒上海萬生昊天生物技術有限公司;SDS、Tris BBI(上海)生命科學有限公司;2×Tricine loading buffer中科瑞泰(北京)生物科技有限公司。
SPX-250B-Z 生化培養箱 上海博訊實業有限公司醫療設備廠;7200 型紫外可見分光光度計 尤尼柯(上海)儀器有限公司;A200 型梯度PCR 儀 杭州朗基科學儀器有限公司;H2050R 臺式真空冷凍離心機 湘儀離心機儀器有限公司;RV8V 旋轉蒸發儀德國IKA;JY-SCZ2+電泳儀 北京君意東方電泳設備有限公司;FE28 酸度計 瑞士METTLER TOLEDO;IX71 光學倒置顯微鏡 日本OLYMPUS;Gel Doc 凝膠成像系統 美國BIO-RAD;SU5000 掃描電子顯微鏡 株式會社日立制作所。
1.2 實驗方法
1.2.1 產細菌素乳酸菌株的篩選
1.2.1.1 指示菌Ah2 菌液的制備 將甘油管凍存的指示菌Ah2 劃線接種至固體培養基,28 ℃靜置孵育24 h;挑取單菌落接種至10 mL LB 肉湯,28 ℃、150 r/min 搖床培養8 h 后得種子液,將種子液以1%的接種量接入LB 肉湯,上述條件培養后即得指示菌Ah2 菌液。
1.2.1.2 乳酸菌無細胞上清液的制備 從市售泡菜、豆豉、腐乳、酸奶和奶酪共20 份樣品中各取1 g 加入含9 mL 的0.85%無菌生理鹽水均質袋中,均質15 min。10 倍稀釋至10,取各濃度稀釋液100 μL均勻涂布在含CaCO的MRS 固體平板上,30 ℃孵育24~48 h。挑取產生溶鈣圈的菌落劃線純化3 次。將長好的單菌落接種至10 mL MRS 液體培養基中,30 ℃、150 r/min 搖床培養24 h 得種子液,將種子液以2%接種量接入液體培養基,上述條件培養后得發酵液。取適量體積發酵液于4 ℃、10000 r/min 離心15 min 后收集上清液。將上清液用磷酸鈉緩沖液(pH7.0)調節至pH6.0,以此消除有機酸的干擾。0.22 μm 濾膜過濾后,加入適量過氧化氫酶使之終濃度為1 mg/mL,以此消除過氧化氫的作用。以上處理后即得無細胞上清液(Cell free supernatant,CFS)。
1.2.1.3 產細菌素優良乳酸菌的篩選 基于多肽抗菌性測定法改良,采用穩定性優于紙片擴散法和牛津杯法的打孔法結合雙層平板法篩選具有優良抑菌活性的產細菌素菌株。于10 mm 平皿中預先倒一層含2%(w/v)瓊脂的素瓊脂培養基,將1‰(v/v)上述制得的指示菌Ah2 菌液與冷卻至50 ℃的LB半固體培養基(1%瓊脂含量)預先混合后傾注平板,使板內菌濃度約為10CFU/mL,制備成雙層平板。凝固1 h 后,用直徑6 mm 的無菌槍頭垂直打孔,槍頭尖端挑出孔內瓊脂。吸取50 μL 待測菌CFS 加至孔內,4 ℃擴散2 h,28 ℃正置培養6~8 h 觀察結果,每個待測菌株設置三個重復。游標卡尺測量并記錄抑菌直徑。通過抑菌直徑評價各菌株的抑菌活性,后續研究選擇抑菌活性最佳的菌株進行。
1.2.1.4 產細菌素優良乳酸菌的鑒定 將篩選得到的產細菌素乳酸菌株接種到MRS 肉湯中,30 ℃、150 r/min 搖床振蕩培養24 h 后,于4 ℃、12000 r/min離心1 min,棄上清。采用Ezup 柱式基因組DNA抽提試劑盒(細菌)提取菌株基因組DNA,用細菌16S rDNA 通用引物27F(5′-AGAGTTTGATCCTGG CTCAG-3′)和1492R(5′-GGTTACCTTGTTA CGA CTT-3′)進行PCR 擴增,擴增條件為94 ℃ 3 min,94 ℃1 min,60 ℃ 1 min,72 ℃ 1 min,35 個循環。擴增產物送至上海生物工程有限公司測序,經NCBI 數據庫同源性比對后,鄰接法構建系統發育樹鑒定到種。
1.2.1.5 產細菌素優良乳酸菌的生長曲線與細菌素產量動態分析 挑取優良菌株單菌落接種至10 mL MRS 液體培養基中,30 ℃,150 r/min 搖床培養18 h得種子液,種子液以2%的接種量接入500 mL 液體培養基,上述條件培養至48 h。每間隔4 h 取樣測定菌株發酵液的細胞密度OD、pH 及菌株CFS 的抑菌活性,繪制生長動態圖。CFS 根據1.2.1.2 方法制備,抑菌活性參照1.2.1.3 方法測定,每個測定數據設置三個重復。
1.2.1.6 產細菌素優良乳酸菌株的藥敏特性分析參照1.2.1.3 方法制備雙層平板。表面待干后貼上標準藥敏紙片,置30 ℃生化培養箱24 h。游標卡尺測量并記錄抑菌圈直徑。菌株對10 種抗生素的藥敏特性檢測參照國標進行。
1.2.2 乳酸菌產細菌素的抑菌特性探究
1.2.2.1 細菌素的初步純化 取上述制得的CFS 與乙酸乙酯以1:1(v/v)萃取。萃取3 次,每次萃取2 h。CFS 一次全部加入,乙酸乙酯體積3 等分依次加入,每次加入后均需振蕩混勻。待分層清晰后,將上層萃取液轉移至旋蒸瓶,40 ℃、80 r/min 旋蒸除去乙酸乙酯,即得細菌素粗提物。冷凍干燥后用適量超純水懸浮,即得細菌素粗提液(Crude extract of bacteriocin,CEB)。適當稀釋CEB 用于考馬斯亮藍法蛋白測定試劑盒測定細菌素粗提液的蛋白濃度。
1.2.2.2 細菌素的穩定性分析 將適量稀釋的CEB(蛋白濃度約6.47 mg/mL)分別按以下處理進行細菌素的酸堿耐受性、熱穩定性、酶敏感性和貯藏穩定性測定:a.用對應緩沖液調節CEB 的pH 至2.0~10.0,37 ℃水浴4 h 后調回pH6.0,使用不含CEB 的對應pH 緩沖液作為對照。緩沖液種類如下:甘氨酸鹽酸鹽緩沖液(pH2.0),檸檬酸-磷酸鹽緩沖液(pH3.0~6.0),磷酸鈉緩沖液(pH7.0),Tris 鹽酸鹽緩沖液(pH8.0~9.0)和甘氨酸-氫氧化鈉緩沖液(pH10);b.-20、60、80、100 和121 ℃分別處理各30 min,冷卻至室溫,以未處理的CEB 為對照;c.加入終濃度為1 mg/mL 木瓜蛋白酶、胃蛋白酶、胰蛋白酶和蛋白酶K 溶液,37 ℃溫浴2 h 后,80 ℃加熱 15 min使蛋白酶失活,以未處理的CEB 為對照;d.4 ℃下分別儲存1、3、6 和9 個月,以未處理的新鮮CEB 為對照。以上參照1.2.1.3 測定抑菌活性,每個處理組設置三個重復。
1.2.2.3 細菌素的抑菌譜檢測 基于1.2.1.3 所述雙層平板法結合打孔法測試細菌素對16 種指示菌的抑制效果。每孔加入50 μL 適量稀釋的CEB(蛋白濃度約6.47 mg/mL),每種指示菌設置三個重復。
1.2.3 優良乳酸菌產細菌素對嗜水氣單胞菌Ah2 的抑菌效果評估
1.2.3.1 抑菌強度測定與溶血反應 參考國標和陽離子抗菌肽方法測定細菌素對Ah2 的最小抑菌濃度(Minimum inhibitory concentration,MIC)和最小殺菌濃度(Minimum bactericidal concentration,MBC)。于96 孔板中等比稀釋CEB(起始蛋白濃度約為1.08 mg/mL),共10 個濃度梯度。將10 μL 不同濃度稀釋液與90 μL 含Ah2 菌懸液(約10CFU/mL)混合,分別以Ah2 菌懸液和CEB 為陽性有菌對照和陰性無菌對照,28 ℃孵育12 h。肉眼觀察是否有細菌沉淀,肉眼無可見細菌沉淀對應最小濃度數值即為MIC。從MIC 起向高濃度選4 個濃度梯度,每個濃度梯度取50 μL 加至血平板中28 ℃靜置培養24 h,觀察溶血反應,無Ah2 溶血圈對應最小濃度數值即為MBC。每個梯度設置三個重復。
1.2.3.2 細胞毒性變化分析 將復蘇后的EPC 細胞置于含有培養液(M199 培養基、10%(v/v)FBS 和1%(v/v)雙抗)的T瓶中25 ℃孵育至80%的細胞密度,調整細胞濃度至2×10/mL。取0.1 mL 加入24 孔板中,將1.2.3.1 測得的MIC 和MBC 對應孔溶液各10 μL 分別加入含有細胞的孔中,作用12 h。分別以Ah2 菌液和CEB 為陽性有菌對照和陰性無菌對照。光學倒置顯微鏡觀察Ah2 引起的細胞形態變化,確定細菌素對Ah2 的抑菌效果。每個濃度設置三個重復。
1.2.3.3 顯微結構變化分析 參考辛維崗等的方法制備樣本,掃描電子顯微鏡(Scanning electron microscope,SEM)觀察經LP01 處理后指示菌Ah2超微結構的變化,初步探究細菌素LP01 的作用機制。
1.2.4 細菌素的分子量測定與凝膠原位抑菌活性檢測
1.2.4.1 細菌素分子量的測定 將CEB 適當稀釋用于紫外全波長掃描定性,驗證其是否為肽或蛋白類物質。其次,采用Tricine-SDS-PAGE 電泳測定分子量。首先預電泳,即不加樣品于30 V 電壓下運行約30 min;將樣品按說明書變性處理后,于凝膠兩側平行上樣,每孔10 μL,80 V 運行30 min,以樣品條帶尾部跑至濃縮膠前沿為準;最后100 V 運行4~5 h,當條帶距離凝膠底部約0.5~1 cm 時,停止電泳。將其中一半凝膠用于考馬司亮藍R250 凝膠染色1 h 后脫色處理,根據marker 條帶判斷細菌素分子量范圍。
1.2.4.2 細菌素抑菌活性的驗證 將電泳后的另一半凝膠參照鄧曉娟等所述方法用于凝膠原位檢測,即將凝膠轉移至無菌平皿中,加入1% Triton X-100(v/v)溫和搖動20 min,使細菌素在凝膠原位復性;棄去Triton X-100 并用無菌水漂洗2 次后,加入0.1 mol/L、pH7.2 的磷酸緩沖液溫和搖動30 min,棄去緩沖液。將凝膠置于按1.2.1.3 方法制備的含指示菌Ah2 雙層平板上,28 ℃培養過夜,觀察有無抑菌透明帶。
1.2.5 產細菌素乳酸菌株的全基因組測序及細菌素基因簇的挖掘 通過Illumina Hiseq×10 平臺(2×150 bp)進行雙端測序(PE150),利用組裝軟件SOAPdenovo2 局部組裝及優化形成多條基因組scaffolds,得到菌株的全基因組序列。通過在線軟件BAGEL4,挖掘菌株的抗菌物質相關基因簇,預測植物乳植物桿菌M4L1 可能產生的細菌素種類。
1.3 數據處理
以上所測數據均包含3 次生物學重復,以平均值±標準差方式呈現。利用Origin 9.0 和IBM SPSS 25.0 統計軟件分別對數據進行處理與分析。
2 結果與分析
2.1 產細菌素乳酸菌株的篩選
2.1.1 產細菌素優良乳酸菌的篩選與鑒定 分別從泡菜、豆豉、酸奶、干酪和腐乳的20 份樣品中共分離出近80 株乳酸菌。篩選得到4 株對Ah2 具有較好拮抗作用的菌株(圖1、表1),CFS 抑菌直徑范圍在(16.85±0.14)mm 至(25.13±0.27)mm 之間,存在顯著差異(<0.05),最終確定抑菌活力最佳菌株M4L1進行后續研究。菌株M4L1 在MRS 瓊脂平板上形成乳白色、凸起、表面光滑且圓潤的菌落,革蘭氏染色結果顯示為一株革蘭氏陽性菌,呈直或彎的桿狀,單個、有時成對或成鏈狀(圖2)。16S rDNA 序列(Genbank 登錄號:MZ753464.1)結合系統發育分析鑒定M4L1 為植物乳植物桿菌()。

圖1 四株乳酸菌對Ah2 的抑菌效果對比Fig.1 Comparison of inhibition effect on four strains of lactic acid bacteria against Ah2

表1 四株乳酸菌的抑菌活性Table 1 Antimicrobial activity of four strains of lactic acid bacteria
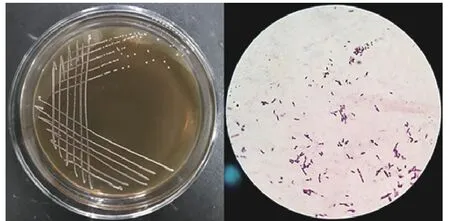
圖2 菌株M4L1 的菌落形態和顯微形態圖Fig.2 Colony and microscopic morphology of M4L1
2.1.2 植物乳植物桿菌M4L1 的生長動態及抑菌活性規律 如圖3 所示,M4L1 從4 h 起進入對數生長期,在24 h 時達到最大生物量,24~44 h 間處于穩定期,44 h 后進入衰亡期;同時,CFS 的抑菌直徑也從4 h 起明顯增加,在穩定期(24 h)達到最大,而抑菌圈直徑的變化反映了細菌素的抑菌活性即細菌素產量的變化,由此說明細菌素從M4L1 對數生長期起開始分泌至穩定期達到最大產量,與M4L1 的生長規律相符合。該規律體現了植物乳植物桿菌M4L1 產生的細菌素為次級代謝產物,其產量與M4L1 的生物量有關,因此選定24 h 為植物乳植物桿菌M4L1發酵培養的最佳時間。

圖3 植物乳植物桿菌M4L1 的生長動態及抑菌活性規律Fig.3 Growth dynamics and antimicrobial regularity of L.plantarum M4L1
2.1.3 植物乳植物桿菌M4L1 的藥敏特性 拮抗菌株對10 種抗生素的藥敏特性見表2。該菌對復方新諾明、頭孢曲松、氨芐西林、氯霉素和四環素等5 種抗生素高度敏感,對紅霉素中度敏感,對其余4 種藥物耐藥。該結果與許多報道的相近,說明不同來源的植物乳植物桿菌存在一些類似的藥敏特性。

表2 植物乳植物桿菌M4L1 的藥敏特性Table 2 Antibiotic susceptbility of L. plantarum M4L1
2.2 植物乳植物桿菌產細菌素LP01 的抑菌特性
2.2.1 細菌素LP01 的穩定性 采用有機溶劑萃取法對M4L1 產細菌素進行初步純化,得到細菌素半純化產物并命名為LP01。根據以下公式計算抑菌活性的變化:抑菌活性變化率(%)=(處理組CEB 的抑菌圈直徑-對照組CEB 的抑菌圈直徑)/對照組CEB 的抑菌圈直徑×100。酸堿耐受性測試中(圖4A),LP01 在過酸(pH2)和過堿(pH10)處理后仍保持較高的抑菌活性,在pH7 時抑菌活性達到最大,與對照組相比顯著增加了6.22%(<0.05)。pH8~10時抑菌活性發生了顯著下降(<0.05),但最低仍保持了80.02%±0.94%的抑菌活性,與食品工業已商用的拮抗添加劑Nisin A 相比,LP01 可耐受更廣泛的酸堿環境;經-20~121 ℃處理30 min 后(圖4B),其抑菌活性無顯著變化(>0.05);經9 個月貯藏期后(圖4C),抑菌活性僅下降了9.19%;LP01 經4 種蛋白酶處理后(圖4D),抑菌活性發生了不同程度的顯著下降(<0.05),表明其具有蛋白質的性質。而經胃蛋白酶和胰蛋白酶處理后抑菌活性仍有70.95%±1.11%和67.45%±0.91%,體現出其良好的消化酶耐受性。綜上,細菌素LP01 不僅在廣泛的pH 和溫度下具有良好的穩定性,且具備良好的消化酶耐受性和貯藏穩定性。

圖4 細菌素LP01 的耐受性Fig.4 Tolerance of bacteriocin LP01
2.2.2 細菌素LP01 的抑菌譜 細菌素LP01 對測試中的14 株菌均有不同程度的抑制效果(表3)。其中,有8 株革蘭氏陰性菌,除腐敗希瓦氏菌外抑菌直徑均大于25 mm,尤其是我國最重要的人畜共患“超級細菌”鮑曼不動桿菌,其抑菌直徑高達(32.53±0.22)mm;另有6 株革蘭氏陽性菌,尤其是冷藏食品中常見腐敗菌單增李斯特氏菌和口腔疾病齲齒病原變形鏈球菌,其抑菌直徑高達(36.67±0.29)和(28.90±0.36)mm。然而LP01 對腐生葡萄球菌抑制作用低,對真菌如德巴利漢遜酵母和釀酒酵母幾乎無抑制。綜上,LP01 能夠抑制一些人畜共患致病菌、水產病原菌及食品腐敗菌等,體現出細菌素LP01 具有較廣的抑菌譜。

表3 細菌素LP01 的抑菌譜Table 3 Antibacterial spectrum of bacteriocin LP01
2.3 細菌素LP01 對嗜水氣單胞菌Ah2 的抑菌效果
2.3.1 溶血與細胞毒性變化 將CEB 等比稀釋后,測得LP01 對Ah2 的MIC 約為12.94 μg/mL,該數值低于大多數抑制嗜水氣單胞菌的細菌源抗菌肽和經典人源抗菌肽LL-37 的MIC 值,MBC 約為25.88 μg/mL,LP01 具有良好的抑菌強度。將MIC、MBC 組用于溶血檢測和細胞毒性試驗觀察LP01作用Ah2 前后的溶血與細胞毒性變化。結果顯示(圖5A、B):MIC 組觀察到-溶血圈、EPC 細胞裂解死亡現象,與陽性對照相比Ah2 溶血性和毒性均有降低,MIC 有效抑制了Ah2 的生長,使之維持在較低的細菌濃度;MBC 組未觀察到溶血圈、EPC 細胞大小均勻且形態完好,與陰性對照幾近一致,MBC 完全殺滅了Ah2。以上表明Ah2 具有較強的細胞毒性,但經LP01 處理后,其引起的溶血和細胞毒性均有所減緩,細菌素LP01 對Ah2 具有明顯的抑制效果。

圖5 細菌素LP01 對Ah2 引起的溶血活性和細胞毒性的影響Fig.5 Effect of bacteriocin LP01 on hemolysis and cytotoxicity caused by Ah2
2.3.2 顯微結構變化 通過SEM 觀察LP01 作用Ah2前后菌體細胞結構的變化。圖像顯示,經MIC 處理后(圖6B1),Ah2 菌體細胞發生扭曲,表面出現褶皺,細胞質膜和細胞壁之間形成了電子透明區,與未處理的Ah2 相比(圖6A1)有輕微質壁分離的現象;經MBC 處理后(圖6C1、C2),細胞因相互擠壓而收縮變形,細胞質內容物溶出,細胞幾乎完全破裂。可見細菌素LP01 對Ah2 的細胞壁造成了一定程度的破壞,而細胞質內容物的溶解推測或許是膜通透性轉變的結果。

圖6 指示菌Ah2 的SEM 圖Fig.6 SEM images of indicator Ah2
2.4 細菌素LP01 的分子量與原位抑菌活性
紫外全波長掃描分析顯示,LP01 在肽和蛋白對應吸收波長處均有吸收峰,而前者吸收峰更顯著(圖7),說明LP01 為肽類細菌素。Tricine-SDS-PAGE電泳顯示LP01 在染色凝膠上呈現出清晰良好的譜帶,判斷細菌素LP01 分子量范圍在3.3~4.0 kDa 內。凝膠原位活性檢測顯示,指示菌平板的凝膠上只出現了一條抑菌透明帶(圖8),和染色凝膠的譜帶相吻合,直觀說明該條帶即為LP01 的譜帶,以此確定LP01為小分子肽類細菌素。

圖7 細菌素LP01 的紫外全波長掃描圖Fig.7 UV full-wavelength scanning of bacteriocin LP01

圖8 細菌素LP01 的Tricine-SDS-PAGE 電泳圖Fig.8 Tricine-SDS-PAGE of bacteriocin LP01
2.5 植物乳植物桿菌M4L1 的潛在細菌素基因簇
根據M4L1 的全基因組序列信息(登錄號:SA MN26138624)可知,其總基因組大小為3273432 bp,其中,鳥嘌呤和胞嘧啶(G+C)占總DNA 的平均含量的44.37%;將基因片段經過組裝優化形成了251 條基因組scaffolds;CDS(蛋白質編碼區)共3215 個,基因平均長度為852.10 bp;非編碼區rRNA、sRNA和tRNA 的數量分別為2、48 和57。另外,利用BAGEL4 挖掘菌株M4L1 可能產生的細菌素。結果顯示,M4L1 細菌基因組中存在2 個潛在熱點區域(Areas of Interest, AOI),檢測到有三種蛋白質與來自植物乳植物桿菌的II 類細菌素序列達100%一致,分別為Plantaricin K、Plantaricin E 和Plantaricin F。其中Plantaricin F 為其雙甘氨酸前導肽。Plantaricin K 所在生物合成基因簇中(圖9A),有一個ORF(Open reading frame)編碼具有輸出細菌素功能的特定免疫蛋白;Plantaricin E 所在生物合成基因簇中(圖9B),大多數ORFs 與plnD、plnI、plnH 和plnS 具有同源性,表明它們同屬于pln 操縱子,參與植物乳植物桿菌細菌素的產生。另外,位于同一操縱子的Plantaricin E 基因上游有一個lanT 基因編碼ABC 轉運蛋白、ATP 結合蛋白和滲透酶蛋白PlnG。其中結構保守的ABC 轉運蛋白是細菌素合成核心蛋白,含有該蛋白的細菌素通常具有抗菌活性。綜上推測,植物乳植物桿菌M4L1 或產生不止一種細菌素,即上述關于細菌素LP01 的抑菌特性研究結果可能涉及多種細菌素。

圖9 植物乳植物桿菌M4L1 的細菌素基因簇圖譜Fig.9 Genetic organization map of bacteriocin gene clusters of L. plantarum M4L1
3 結論
本研究從發酵腐乳中篩出一株可抑制Ah2 的優良M4L1。首先,菌株的酸堿、熱、消化酶耐受性等是決定其能否應用為后生元的關鍵。細菌素LP01 的耐受性分析結果表明:經酸堿處理后的LP01 對Ah2 的抑菌活性最低仍保持在80.02%±0.94%;經多種消化酶處理后,抑菌活性最低仍保留了67.45%±0.91%;在-21~121 ℃幾乎無抑菌活性的喪失。細菌素LP01 不僅分子量小,還表現出優良的酸堿、熱、消化酶耐受性及貯藏穩定性。其次,作為一種抑菌物質,抑菌活力的范圍和強度是評價其抑菌效果的重要指標。抑菌譜檢測發現,細菌素LP01 具有廣譜抑菌特性,能夠有效抑制包括水產致病菌、食品腐敗菌及人畜共患致病菌在內的多種病原菌;通過研究其抑菌效果發現,經LP01 處理后Ah2 的溶血性和細胞毒性明顯降低;經進一步的SEM 觀察推測,LP01 的抑菌或殺菌作用或許是細胞膜通透性改變的結果;另外,基因預測到M4L1 包含2 個潛在的細菌素合成基因簇。由此可見,作為一株生物安全菌株,植物乳植物桿菌M4L1 具備良好的產細菌素能力。因此,細菌素LP01 不僅有望作為生物防腐劑用于控制食品中存在的多藥耐藥菌株,還為水產動物病害與人類疾病防治藥物的篩選提供了新方向。
后生元作為一種滅活益生菌,通過其代謝產物發揮益生功效。既不需要以活菌形式存在,也無需在動物胃腸道內定殖,彌補了傳統益生菌的不足。本文研究的M4L1 及其細菌素LP01 具有作為保護劑拮抗多種病原體的能力,是水產病害防治潛在的后生元菌株,對促進水產養殖業健康發展具有重要的意義。后續還須對其高度純化以深入探討其抑菌效果、結構與作用機制等,以期得到乳酸菌更豐富的細菌素資源庫。

