雨生紅球藻蛋白酶解產物的制備和抗氧化活性評價
何宛詩,許 瑾,曹 庸,王忠銘,劉曉娟,
(1.中國科學院廣州能源研究所,廣東省新能源和可再生能源研究開發與應用重點實驗室,廣東廣州 510640;2.華南農業大學食品學院,廣東省功能食品活性物重點實驗室,廣東廣州 510642)
雨生紅球藻()是一種單細胞綠藻,被認為是繼螺旋藻、小球藻之后的又一高經濟價值微藻,2010 年被國家衛生和計劃生育委員會批準為新食品原料,富含蝦青素、多糖、蛋白質、維生素和微量元素等營養成分。為解決全球對“超級抗氧化劑”蝦青素的龐大需求,國內外許多微藻企業為量產蝦青素規模化養殖雨生紅球藻,綠A 微藻養殖基地年產雨生紅球藻粉可達10 噸以上,中國已成為世界雨生紅球藻蝦青素市場的產能大國。然而,提取完蝦青素后產生了大量的工業藻渣,大多作為動物飼料或被直接丟棄,造成環境污染和資源浪費。作為微藻資源,雨生紅球藻渣中營養成分豐富,其中蛋白質含量為20.8%~22.2%。截止目前,藻渣蛋白的加工性質已有相關研究,但蛋白質及蛋白質相關產品的功能活性研究仍有待進一步完善。
微藻具有健康效益,螺旋藻、小球藻等被稱為“潛在的益生元”,因此微藻作為新型膳食補充劑的研究受到廣泛關注。微藻中蛋白含量豐富,如小球藻和斜生柵藻分別含有51%~58%和50%~56%蛋白質,是一類潛在的、可利用的可再生蛋白資源。微藻蛋白的研究主要分為兩個方向:其一是探究蛋白質本身的結構組成和功能性質等;其二是研究蛋白酶解物及多肽的生理活性。研究表明,微藻蛋白酶解物顯示多種生理功能,如抗氧化、抗高血壓、抗炎活性等,經純化的微藻多肽還具有較強的抗癌和抗菌等活性,有成為功能性食品、營養品或藥物的潛力,研究前景廣闊。Norzagaray 等對杜氏鹽藻等三種綠藻藻渣進行蛋白酶解,酶解物的抗氧化活性顯著高于藻渣,對ABTS 和DPPH 自由基有較高的清除能力,且其對彈性蛋白酶的抑制作用暗示了其抗衰老的潛能。不同蛋白酶作用下的小球藻多肽在體外顯示較強的DPPH、羥自由基清除能力和還原力,并能降低Bel7402 人肝癌細胞的ROS 水平,增強秀麗隱桿線蟲抗HO的作用以及老齡小鼠血清中抗氧化酶的活力。
目前雨生紅球藻的研究關注點主要停留在蝦青素,對其蛋白酶解物的探究有限。有研究表明,不同蛋白酶作用下雨生紅球藻酶解物的抗氧化能力不同,疏水性、含硫和芳香族氨基酸的含量、隨機線圈、-折疊的占比均比原蛋白要高,這些在組成和結構上的特點很可能與其強抗氧化能力相關。因此,本研究以雨生紅球藻渣為原料,通過單因素實驗、響應面優化開發制備抗氧化酶解物,以體外抗氧化活性和氨基酸組成予以評價,可為雨生紅球藻渣的高值化利用及后續研究提供參考價值,使藻渣“變廢為寶”,提高經濟價值,為藻源天然抗氧化劑的開發提供新途徑。
1 材料與方法
1.1 材料與儀器
雨生紅球藻渣 荊州天然蝦青素有限公司提供;堿性蛋白酶(200000 U/g)、2,2’-聯氮-雙-3-乙基苯并噻唑啉-6-磺酸(ABTS,98%) 上海源葉生物科技有限公司;木瓜蛋白酶(≥1000000 U/g) 上海藍季科技發展有限公司;胰蛋白酶(250000 U/g) 北京拜爾迪生物技術有限公司;胃蛋白酶(≥500000 U/g)Sigma-aldrich 上海貿易有限公司;鄰苯二甲醛(OPA,98%)、二硫蘇糖醇(DTT,≥98%)、L-亮氨酸(99%) 上海易恩化學技術有限公司;四硼酸鈉(≥99.5%)、十二烷基硫酸鈉(SDS,92.5-100.5%) 天津市大茂化學試劑廠;總抗氧化能力(T-AOC)FRAP法試劑盒 蘇州格銳思生物科技有限公司;七水合硫酸鐵(FeSO·7HO)標準品 南京建成科技有限公司;其他試劑均為分析純。
AL104 天平 梅特勒-托利多公司;PB-10 pH計 賽多利斯科學儀器(北京)有限公司;HSJ-2A 磁力水浴鍋 常州澳華儀器有限公司;Avanti J-E 落地式高速大容量離心機 美國貝克曼庫爾特有限公司;ALPHA 2-4 LDplus 冷凍干燥機 國Marin Christ公司;多功能酶標儀 PerkinElmer EnSpire; rapid N exceed 杜馬斯快速定氮分析儀 德國Elementar 公司;855-4507 磺酸型陽離子樹脂分離柱 日本日立公司;L-8900 全自動氨基酸分析儀 日本日立公司。
1.2 實驗方法
1.2.1 雨生紅球藻渣蛋白的酶解工藝 蛋白提取參考Zhu 等、邱月的方法,并稍作修改。取5.0 g的雨生紅球藻渣按料液比1:20 溶解于0.05 mol/L磷酸緩沖液中,加堿調節pH 至11.5,在56 ℃下水浴加熱30 min,期間保持攪拌狀態。4000 r/min 離心15 min 后,將上清液pH 調至4.2,在4 ℃下靜置過夜。8000×g 離心15 min 后棄上清,將蛋白溶液pH 調至中性,冷凍干燥后獲得雨生紅球藻蛋白。用蒸餾水復溶藻蛋白,將pH 調至所用蛋白酶的最適pH,加入一定量的蛋白酶進行酶解反應。酶解結束后,將酶解物于沸水中加熱10 min 滅酶活,冰浴15 min 后離心(6000 r/min,20 min),除去沉淀物后獲得蛋白酶解液。
1.2.2 蛋白酶篩選 將雨生紅球藻蛋白用蒸餾水配制為底物濃度5%的蛋白溶液,以堿性蛋白酶、木瓜蛋白酶、胰蛋白酶和胃蛋白酶為水解用酶,將pH 調至四種酶的最適pH,加入0.3%(w:w)的酶,并于最適溫度中酶解1 h。酶解上清液用于測定各蛋白酶解物的ABTS 清除率和水解度,篩選最優水解酶。各蛋白酶最適水解條件見表1。
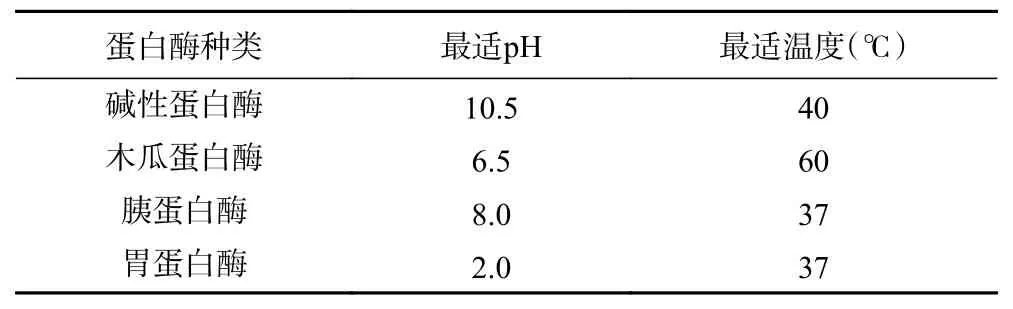
表1 不同蛋白酶的最適反應條件Table 1 The optimum reaction conditions of different proteases
1.2.3 單因素實驗 以底物濃度、加酶量、溫度、pH、時間作為實驗因素,按下述描述分別進行酶解單因素實驗。酶解結束后,將酶解物于沸水中加熱10 min 滅酶活,冰浴15 min 后離心(6000 r/min,20 min),上清液用于分析各因素對酶解物的ABTS自由基清除率和水解度的影響。
1.2.3.1 底物濃度對酶解物的影響 將雨生紅球藻蛋白用蒸餾水配制成底物濃度為1%、3%、5%、7%、9%的蛋白溶液,將pH 調至10.5,加入0.3%(w:w)的酶,在40 ℃下酶解3 h。
1.2.3.2 加酶量對酶解物的影響 將雨生紅球藻蛋白用蒸餾水配制成底物濃度為5%的蛋白溶液,將pH 調至10.5,分別加入0.1%、0.3%、0.5%、0.7%、1.0%(w:w)的酶,在40 ℃下酶解3 h。
1.2.3.3 溫度對酶解物的影響 將雨生紅球藻蛋白用蒸餾水配制成底物濃度為5%的蛋白溶液,將pH調至10.5,加入0.3%(w:w)的酶,在30、35、40、45、50 ℃下酶解3 h。
1.2.3.4 pH 對酶解物的影響 將雨生紅球藻蛋白用蒸餾水配制成底物濃度為5%的蛋白溶液,將pH 調至7.0、8.0、9.5、10.5、11.5,加入0.3%(w:w)的酶,在40 ℃下酶解3 h。
1.2.3.5 時間對酶解物的影響 將雨生紅球藻蛋白用蒸餾水配制成底物濃度為5%的蛋白溶液,將pH 調至10.5,加入0.3%(w:w)的酶,在40 ℃下酶解1、2、3、4、5 h。
1.2.4 響應面優化試驗 根據單因素實驗的結果,選擇溫度、pH 和時間為影響因素,以ABTS 清除率為響應值,采用Design-Expert V8.0.6.1 設計三因素三水平的響應面分析試驗。試驗因素及水平見表2。
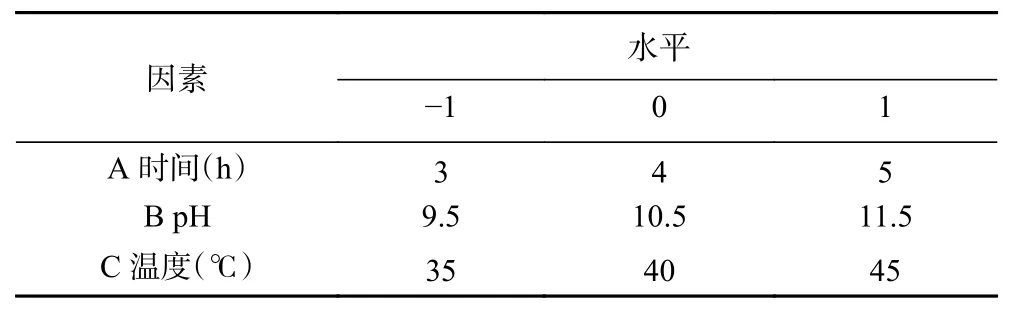
表2 響應面試驗因素水平表Table 2 Factors and levels of response surface analysis
1.2.5 最優條件酶解物的抗氧化活性評價 各取10 mg 雨生紅球藻蛋白與最優酶解物的凍干樣,用蒸餾水溶解為10 mg/mL 的溶液,并按比例稀釋成各濃度的樣品溶液。通過抗氧化指標的測定,對比酶解底物與酶解產物的ABTS 自由基IC和FRAP 值。
1.2.6 水解度的測定 水解度參照Nielsen 等的OPA 法進行測定,并稍作修改。
1.2.6.1 L-亮氨酸標準曲線制作 準確稱取0.10 g干燥的L-亮氨酸,用蒸餾水溶解并定容到50 mL,此時溶液的濃度為2.0 mg/mL。然后從該溶液中分別吸取0、0.2、0.4、0.6、0.8、1.0、1.2 mL,用蒸餾水定容至25 mL,制成L-亮氨酸標準溶液。
1.2.6.2 OPA 工作液的配制 將7.620 g 四硼酸鈉和200 mg SDS 溶解至150 mL 蒸餾水中,將160 mg OPA 于黑暗避光處溶解至4 mL 乙醇,二者混合后加入176 mg DTT,最后用蒸餾水在棕色容量瓶定容至200 mL,制得OPA 工作液。
1.2.6.3 水解度的測定 將400 μL L-亮氨酸標準溶液加入到3 mL OPA 工作液中,室溫下孵育2 min后,吸取200 μL 在96 孔酶標板并在340 nm 波長下測定吸光度。蛋白酶解物的水解度測定同上,所得吸光度對應標準曲線計算酶解物中游離氨基酸的含量(C,g/mL)。
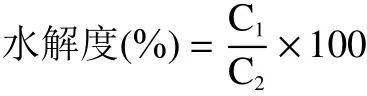
式中:C表示酶解物的游離氨基酸含量,g/mL;C表示底物的蛋白含量,由杜馬斯燃燒法測定,0.1594 g/mL。
1.2.7 抗氧化活性測定
1.2.7.1 ABTS 自由基清除率測定 ABTS 自由基清除率的測定參照Norzagaray 等的方法,并稍作修改。ABTS 儲備液(終濃度為7 mmol/L ABTS 和2.45 mmol/L 過硫酸鉀)在室溫、避光環境中靜置過夜,使用前用0.01 mol/L 磷酸緩沖液(pH7.4)稀釋成工作液,使其在734 nm 波長處的吸光度為0.70±0.05。測定時,將酶解物稀釋160 倍,在96 孔板中加入ABTS 工作液100 μL 和樣液100 μL,振蕩混勻,室溫避光處放置10 min 后在734 nm 處測定吸光度(A),同時以ABTS 工作液100 μL+蒸餾水100 μL為空白(A),磷酸緩沖液 100 μL+樣液100 μL 為對照(A)。該法可測定樣品對ABTS 自由基的清除能力,顏色越淺則代表清除能力越強。
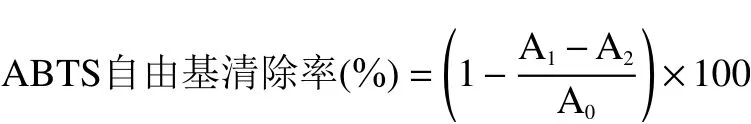
式中:A表示空白組的吸光值;A表示酶解物的吸光值;A表示對照組的吸光值。
1.2.7.2 FRAP 能力測定 FRAP 能力測定參照總抗氧化能力試劑盒說明書進行,并稍作修改。在避光條件下,吸取TPTZ 溶液975 μL 與TPTZ 稀釋液9750 μL混合后,加入檢測緩沖液975 μL 均勻混合,制成FRAP工作液,使用前37 ℃預溫,現配現用。在96 孔板中依次加入30 μL FeSO·7HO 標準溶液(濃度為0、0.2、0.3、0.6、0.9 和1.2 mmol/L)和170 μL FRAP 工作液,振蕩混勻后在室溫下避光反應10 min,于593 nm 波長處測定吸光度。樣液測定同上,樣品的FRAP 值以達到相同吸光度所需FeSO的濃度表示。該法可測定樣品對三價鐵離子的還原能力,顏色越深則代表還原能力越強。
1.2.8 抗氧化酶解物的氨基酸組成分析 按照GB 5009.124-2016 的方法,對最優酶解物進行前處理和上樣測定。酸水解過程中色氨酸完全被破壞,蛋氨酸和胱氨酸部分被破壞。氨基酸組成分析采用全自動氨基酸分析儀進行,具體上樣檢測的條件為:色譜柱采用磺酸型陽離子樹脂分離柱(4.6 mm×60 mm),進樣量20 μL;檢測器為鎢燈檢測器;流動相采用檸檬酸(鋰)PF 緩沖液,流速:洗脫泵0.35 mL/min,衍生泵0.30 mL/min;反應柱溫:135 ℃;檢測波長通道1為570 nm,通道2 為440 nm。
1.3 數據處理
實驗均采用3 次平行處理,數據均采用平均值±標準差(mean±SD)表示,采用SPSS 22.0 統計軟件進行數據處理,不同處理組之間的差異用多重比較分析(LSD)、單因素方差分析(One-way analysis of variance,One-way ANOVA)進行處理,<0.05 表示差異顯著。
2 結果與分析
2.1 蛋白酶篩選
蛋白酶種類對雨生紅球藻蛋白酶解物的ABTS清除能力和水解度的影響如圖1 所示。各酶解物的抗氧化能力順序為:堿性蛋白酶>胰蛋白酶>木瓜蛋白酶>胃蛋白酶,各酶之間存在顯著性差異(<0.05),堿性蛋白酶解物的ABTS 自由基清除率達51.58%±0.66%。且堿性蛋白酶解物中游離氨基酸含量相對最低,水解度顯著低于另外三種酶解物(0.05)。
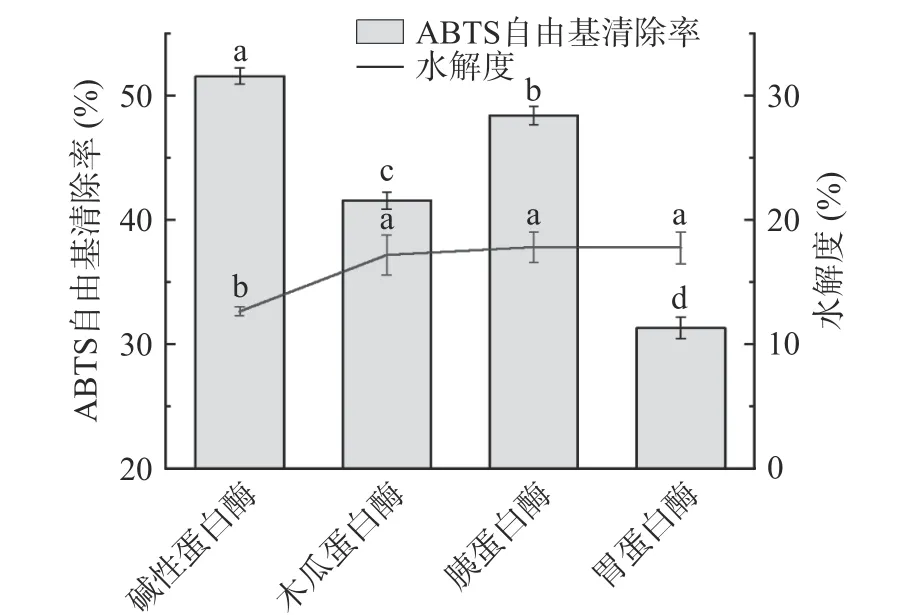
圖1 不同蛋白酶對酶解物ABTS 自由基清除率和水解度的影響Fig.1 Effect of different proteases on the ABTS free radical scavenging rate and degree of hydrolysis of hydrolysates
堿性蛋白酶是一種具廣泛選擇性和特異性的內切酶,對蛋白質羧基側的疏水性氨基酸和芳香族氨基酸具有較強的專一性,傾向于剪切Glu、Met、Leu、Tyr、Lys 和 Gln 的肽鍵,比其它酶更容易產生強抗氧化的疏水性多肽,而雨生紅球藻中富含這些氨基酸。另外,該酶的一個重要應用就是水解植物殘渣的殘留蛋白質,如果皮、果核等,酶解產物的自由基清除能力顯著高于胰蛋白酶、木瓜蛋白酶等,與本研究結果一致,且在較寬的pH 范圍內顯示出優異的蛋白質溶解性。馬艷芳發現螺旋藻經過堿性蛋白酶作用的水解物DPPH 自由基清除能力優于木瓜蛋白酶、風味蛋白酶和胰蛋白酶的產物。也有學者采用含堿性蛋白酶的復合酶來水解微藻,充分發揮協同作用。
水解度是常用于體現酶解程度的指標,定義為被蛋白酶作用斷裂的肽鍵的占比。理論上,高水解度、低分子量的肽會有更高的抗氧化活性,因為蛋白質酶解程度增加會生成許多小分子肽和游離氨基酸,伴隨著可電離基團(NH和COO)增多,同時在分子結構上疏水區域逐漸暴露,這些變化都可能增加酶解物的抗氧化活性。但是,近年來越來越多學者發現,水解度并不是決定酶解物抗氧化活性的主要因素,它與自由基清除率并非簡單的線性關系,不存在明顯的相關關系。酶解反應實質上是抗氧化肽不斷形成和分解的過程,過度水解可能會破壞肽鏈中原本能發揮功能活性的區域。酶解物的綜合活性還與肽鏈特殊空間結構、氨基酸序列等多種因素有關,水解度僅是判斷產物抗氧化能力的輔助指標。綜合考慮后選擇堿性蛋白酶作為實驗用酶。
2.2 單因素實驗
2.2.1 底物濃度對酶解物ABTS 自由基清除率和水解度的影響 不同底物濃度對雨生紅球藻蛋白酶解物的ABTS 自由基清除能力和水解度的影響如圖2所示。在抗氧化活性方面,酶解物的ABTS 清除能力隨底物濃度增加而增加,9%濃度的清除能力顯著高于其他組別(0.05),清除率達84.67%±0.85%。在酶解程度方面,各濃度的水解度無顯著差異(>0.05)。酶解物底物濃度在合適范圍內(0%~10%)增加,底物與酶結合的位點隨之增多,產生更多抗氧化能力強的物質,濃度過大會抑制產物的活性,研究顯示在制備鹿血酶解物和螺旋藻肽時,分別在底物濃度9%和10%的水平下抗氧化能力達到峰值。因此選擇底物濃度9%的水平進行響應面優化試驗。

圖2 底物濃度對酶解物ABTS 自由基清除率和水解度的影響Fig.2 Effect of substrate concentrations on the ABTS free radical scavenging rate and degree of hydrolysis of hydrolysates
2.2.2 加酶量對酶解物ABTS 自由基清除率和水解度的影響 不同加酶量對雨生紅球藻蛋白酶解物的ABTS 自由基清除能力和水解度的影響如圖3 所示。在抗氧化活性方面,加酶量在0.7%之前,酶解物ABTS自由基清除能力隨加酶量加大而增強,0.7%加酶量的酶解效果最佳,清除率達72.56%±1.02%,之后則開始減弱;水解度也呈現出相似的趨勢,在同一點達到最大值。隨加酶量增大,自由基清除率和水解度反而減弱的原因可能是,產物與酶在酶過量時會形成復合物,阻礙底物與酶的結合,從而抑制了酶解作用。從經濟成本和環境保護的角度綜合考慮,應選擇用量少、抗氧化效果最高的水平進行實驗,因此響應面優化試驗選擇加酶量0.7%水平。
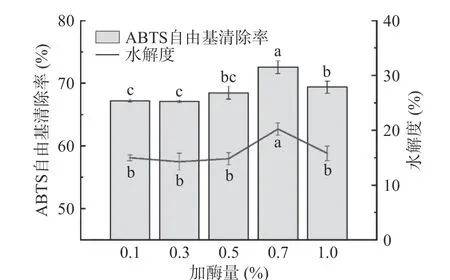
圖3 加酶量對酶解物ABTS 自由基清除率和水解度的影響Fig.3 Effect of dosage of proteases on the ABTS free radical scavenging rate and degree of hydrolysis of hydrolysates
2.2.3 溫度對酶解物ABTS 自由基清除率和水解度的影響 不同溫度對雨生紅球藻蛋白酶解物的ABTS自由基清除能力和水解度的影響如圖4 所示。當溫度達到45 ℃前,ABTS 自由基清除率隨溫度增加而呈現先升高后減弱的趨勢,在40 ℃達到最大值,清除率達67.12%±0.22%,溫度大于45 ℃后清除率回升。過高溫下產物抗氧化能力回升的結果也曾出現在其它研究中,具體原因還未查明,可能是該溫度可激活另一個抗氧化酶切位點。當溫度大于30 ℃時,酶解物水解度與30 ℃相比顯著降低(0.05),且隨著溫度的增加水解度無顯著變化(0.05)。原因可能是在多因素的影響下,酶的最適溫度較表1有所降低,30 ℃之后蛋白酶活性開始減弱,催化速率變小。因此選擇溫度35~45 ℃水平進行響應面優化試驗。
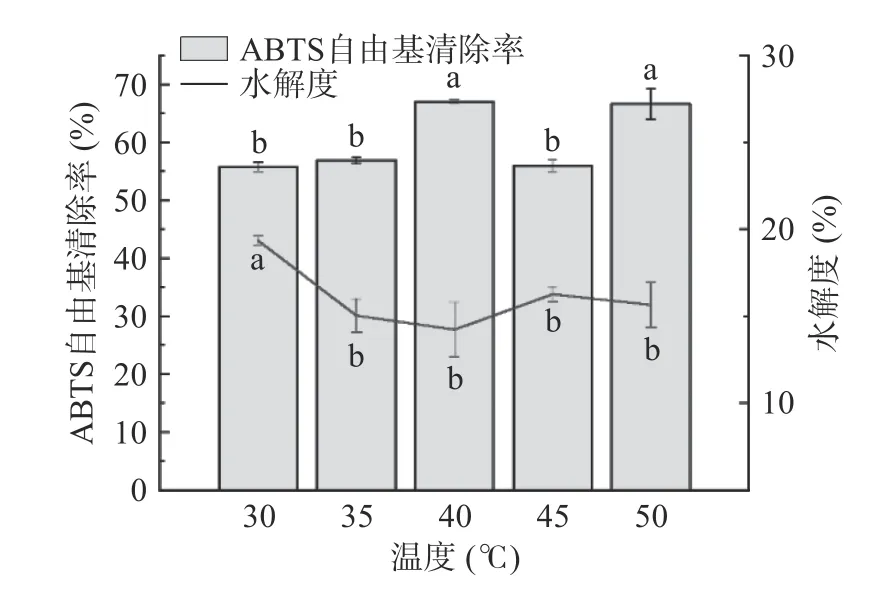
圖4 酶解溫度對酶解物ABTS 自由基清除率和水解度的影響Fig.4 Effect of temperature on the ABTS free radical scavenging rate and degree of hydrolysis of hydrolysates
2.2.4 pH 對酶解物ABTS 自由基清除率和水解度的影響 不同pH 對雨生紅球藻蛋白酶解物的ABTS自由基清除能力和水解度的影響如圖5 所示。pH調至大于8 時,酶解物的ABTS 自由基清除率隨著pH 的升高而增加,pH 為11.5 的酶解效果最佳,清除率達69.88%±0.22%。各pH 條件下酶解物的水解度無顯著差異(>0.05)。反應體系的pH對酶活力、酶分子和底物分子的狀態等有很大影響,一般而言堿性蛋白酶在中等堿性環境下很穩定,多數微藻抗氧化肽的酶解條件為pH7~9。鷹嘴豆多肽的研究很接近上述結果,表示該酶也能在強堿環境下(pH10~12)發揮效果,猜測這與堿溶酸沉法提取蛋白的pH 與酶解最適pH 相同是有關的。有研究表明堿性蛋白酶解物在pH12 時溶解度仍然很高,不會影響進一步應用,因此在該pH 范圍內酶解蛋白是可行的,綜合考慮后選擇pH9.5~11.5 進行響應面優化試驗。
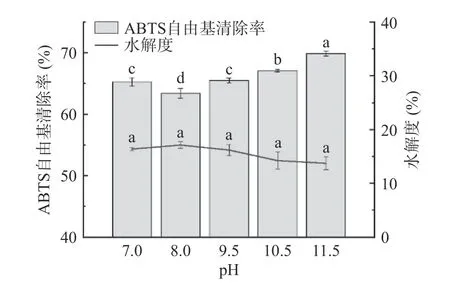
圖5 pH 對酶解物ABTS 自由基清除率和水解度的影響Fig.5 Effect of pH on the ABTS free radical scavenging rate and degree of hydrolysis of hydrolysates
2.2.5 時間對酶解物ABTS 自由基清除率和水解度的影響 不同時間對雨生紅球藻蛋白酶解物的ABTS 自由基清除能力和水解度的影響如圖6 所示。4 h 前,酶解物ABTS 自由基清除能力隨時間增長而增加,在4 h 達到頂峰,清除率達78.14%±0.74%,之后則開始減弱。1、3 h 的水解度顯著低于其它三個時間點(0.05)。4 h 后酶解物抗氧化活性降低的原因可能是長時間酶解使部分強抗氧化肽被水解成肽鏈更短、抗氧化更弱的短肽。因此選擇時間3~5 h 水平進行響應面優化試驗。
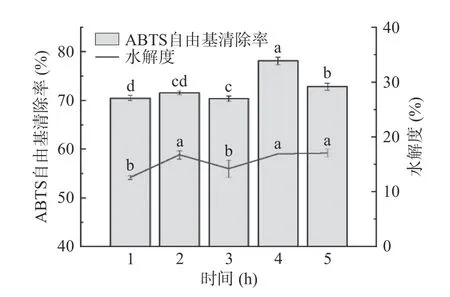
圖6 時間對酶解物ABTS 自由基清除率和水解度的影響Fig.6 Effect of time on the ABTS free radical scavenging rate and degree of hydrolysis of hydrolysates
2.3 響應面優化試驗
2.3.1 響應面試驗結果 選擇對ABTS 自由基清除率影響效果較大的3 個因素酶解時間(A)、酶解pH(B)和酶解溫度(C)進行響應面試驗,得到的試驗方案、結果和方差分析見表3、表4。模型項的0.01,失擬項的>0.05,說明模型擬合成功,方程擬合度高。回歸模型的決定系數()為0.9395,說明ABTS 自由基清除率的實測值比預測值擬合較好;調整決定系數()為0.8616,表明該模型能解釋86.16%的響應值變化。根據值,各因素對雨生紅球藻蛋白酶解物抗氧化活性的影響順序為pH>溫度>時間。
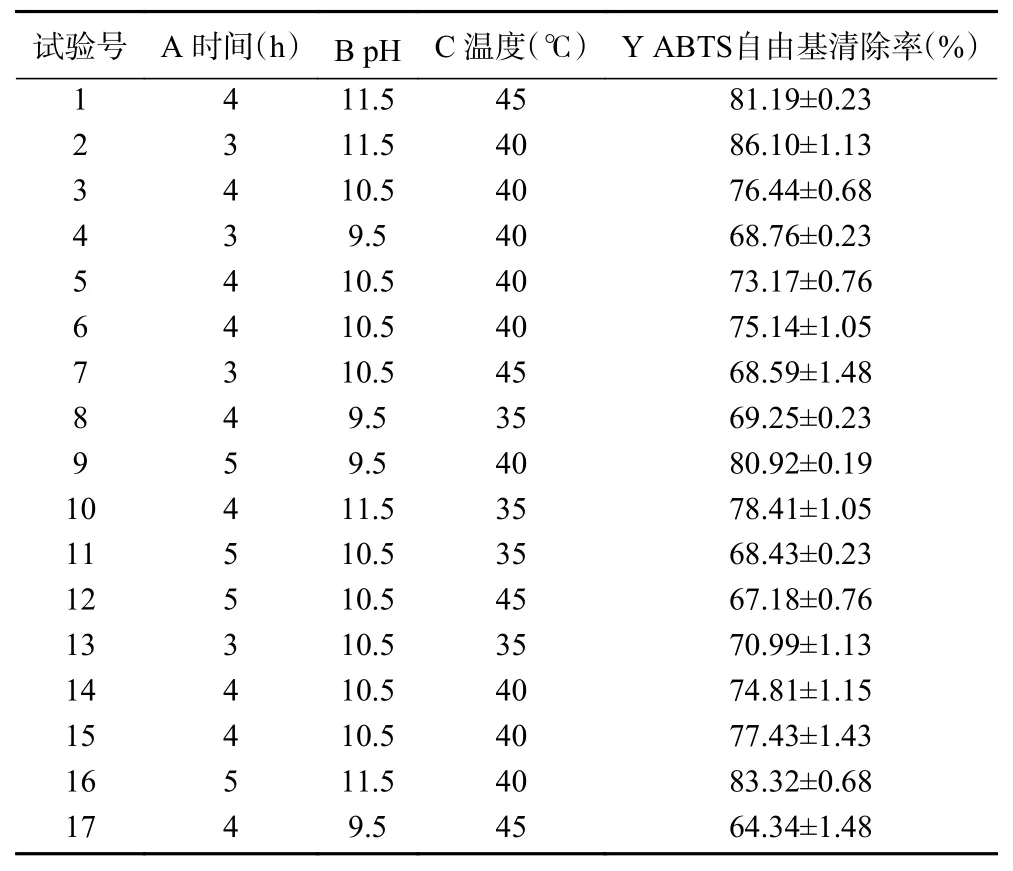
表3 響應面優化實驗設計及結果Table 3 Experiment design with results for response surface analysis
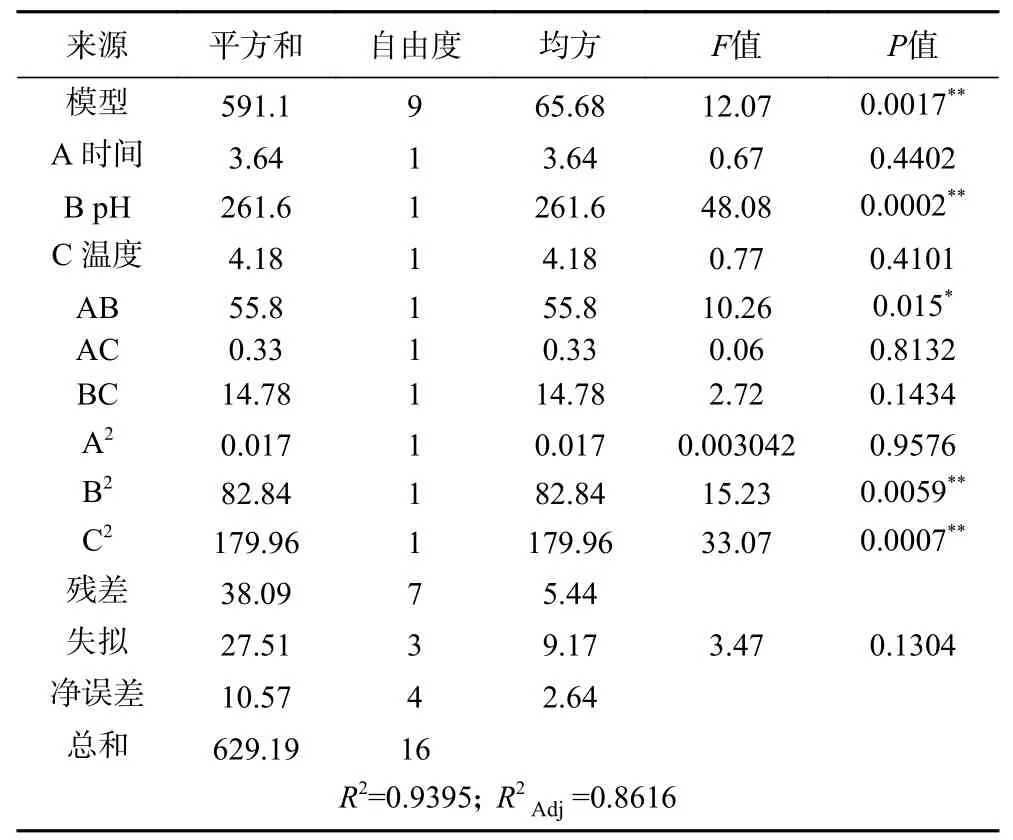
表4 回歸方程的方差分析Table 4 Analysis of variance (ANOVA) of regression equation
響應面回歸方程為:Y=75.40+0.67A+5.72B-0.72C-3.74AB+0.29AC+1.92BC-0.063A+4.44B-6.54C
圖7(a)響應面顯示,pH 越大、時間越小,清除率越高;沿pH 方向的響應面坡度較時間方向陡峭,說明pH 對清除率的影響更大。圖7(b)響應面曲面較均勻,坡度陡峭度中等,最高值對應的點在接近中心的位置;沿溫度方向的響應面坡度較時間方向軸陡峭,說明溫度對清除率的影響更大。圖7(c)響應面曲面向上延伸,在溫度方向接近中心的位置、pH 方向最大值處取到清除率最大值。根據坡度陡峭度判斷各因素對清除率的影響程度,為pH>溫度>時間,與方差分析結果一致。
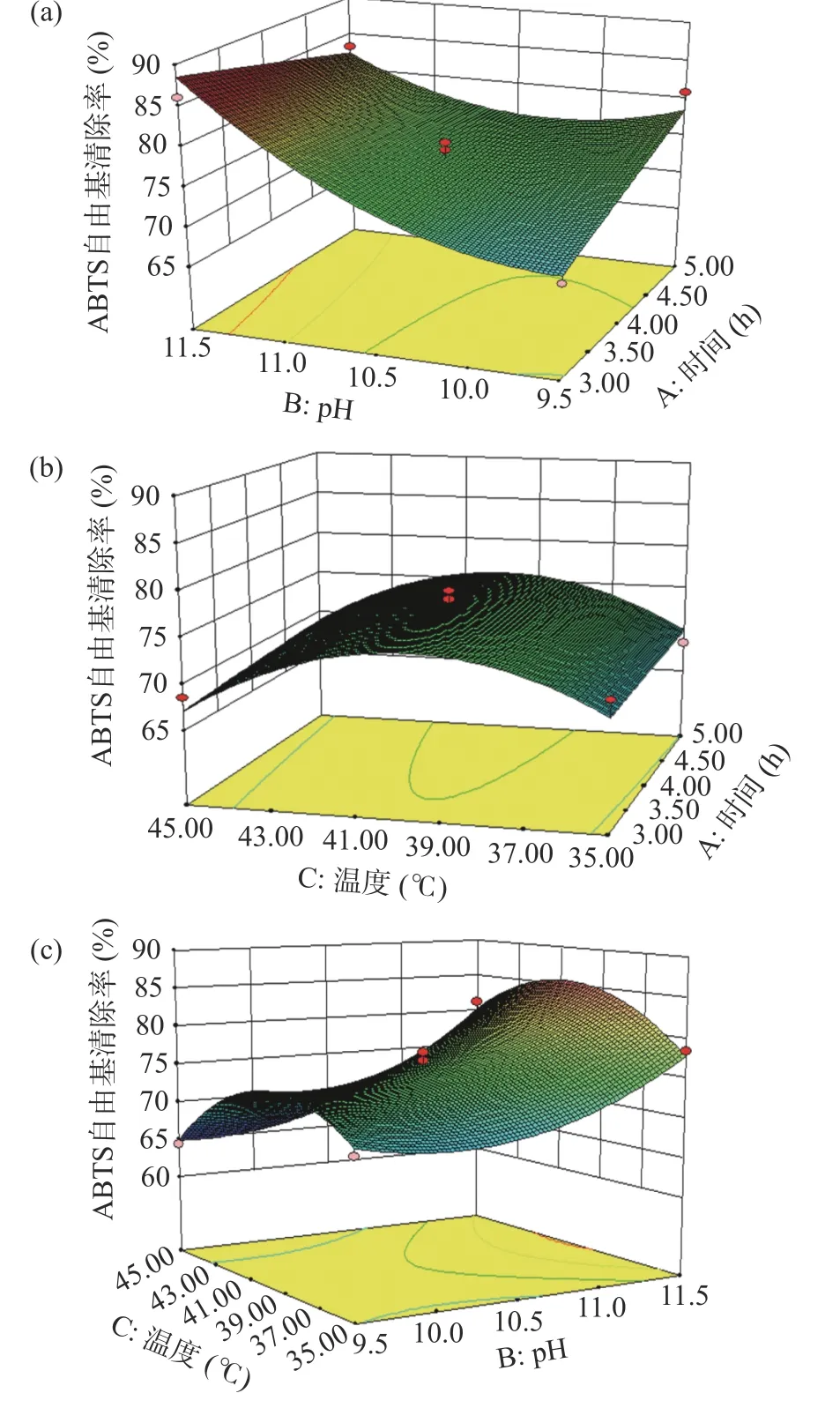
圖7 兩因素之間交互作用對ABTS 自由基清除率影響的響應面圖Fig.7 Response surface diagram of interaction between two factors on ABTS free radical scavenging rate
2.3.2 驗證試驗 根據系統給出的最優條件為溫度40.4 ℃、pH11.5、時間3 h。為了驗證模型的可靠性且考慮到實際可操作性,采用溫度40 ℃、pH11.5、時間3 h 進行驗證實驗,所得酶解物的實際清除率為86.02%±5.69%,與軟件預測值88.58%相近,說明通過響應面法優化得到的回歸模型方程及最佳條件可靠。
2.4 最優酶解物的抗氧化活性及組成
2.4.1 最優酶解物的體外抗氧化活性 如圖8 所示,隨著物質濃度的增加,最優酶解物的ABTS 自由基清除能力逐步增強,并在1000 μg/mL 時達到75.53%±0.25%,此后清除率隨濃度遞增的速度開始減緩。如圖9 所示,最優酶解物的FRAP 值隨著物質濃度的增加越來越大,在9000 μg/mL 時達到最大值76.20±8.53 μmol/L FeSO·7HO,此后還原能力基本不變。

圖8 最優酶解物的ABTS 自由基清除率Fig.8 ABTS free radical scavenging rate of optimal hydrolysate
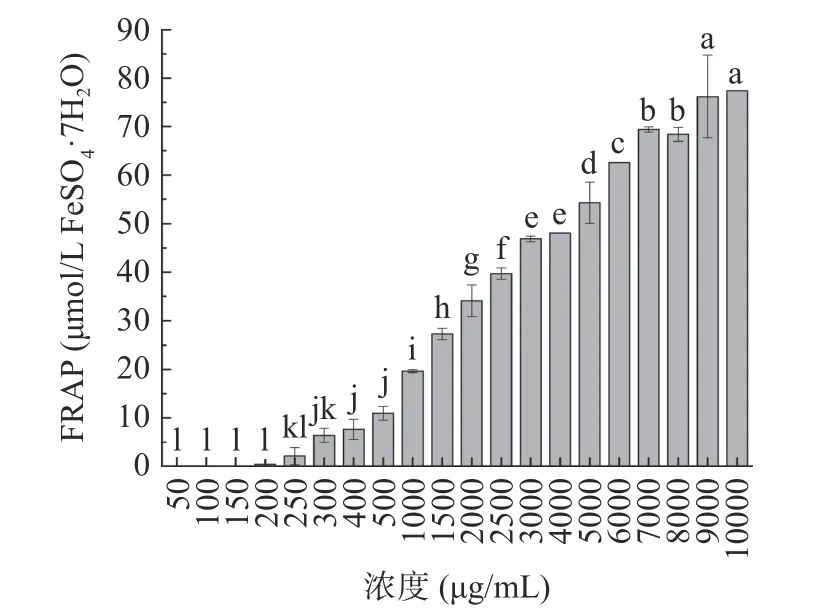
圖9 最優酶解物的FRAP 能力Fig.9 FRAP of optimal hydrolysate
經過酶解后,雨生紅球藻酶解物比蛋白顯示更強的體外抗氧化活性,結果如表5 所示。酶解物的ABTS 自由基清除率的IC值為481.574 μg/mL,極顯著低于藻蛋白(0.01);對比發現,其IC值優于舌狀蜈蚣藻蛋白酶解物(880 μg/mL)和紫菜渣餅酶解物(1010 μg/mL)。為評價不同物質的亞鐵離子還原能力,對比每克原料的FRAP 值:雨生紅球藻酶解物的FRAP 為19.641 μmol FeSO·7HO/g(濃度為1000 μg/mL),極顯著高于藻蛋白(0.01),高于藍鯊皮膚抗氧化肽的FRAP 數值(9.23 μmol FeSO·7HO/g)。由此可見,該酶解物具有較強的抗氧化作用,且活性具備劑量效應關系,濃度與活性呈正相關關系。

表5 雨生紅球藻蛋白酶解物的抗氧化活性評價Table 5 Antioxidant activity of Haematococcus pluvialis hydrolysate
2.4.2 最優酶解物的氨基酸組成 如表6、表7 所示,最優酶解物中氨基酸種類豐富,含17 種氨基酸,必需氨基酸有7 種,分別是Lys、Phe、Met、Thr、Ile、Leu 和Val,必需氨基酸占總氨基酸的含量達到34.44%,與FAO/WHO 提出的EAA/TAA 為40%接近,且優于鏈帶藻蛋QL96 蛋白質。酶解物中含量最高的是Glu(16.41%)和Asp(12.33%),這兩種氨基酸是中樞神經系統重要的興奮性神經遞質,也是哺乳動物腸細胞ATP 的主要來源,可通過脫羧基或轉氨基等作用轉化為其他營養物質,在機體內發揮健康效應,且有研究表明Glu 和Asp 的含量與抗氧化能力呈正相關關系。由此可知雨生紅球藻蛋白酶解物的營養價值較高。
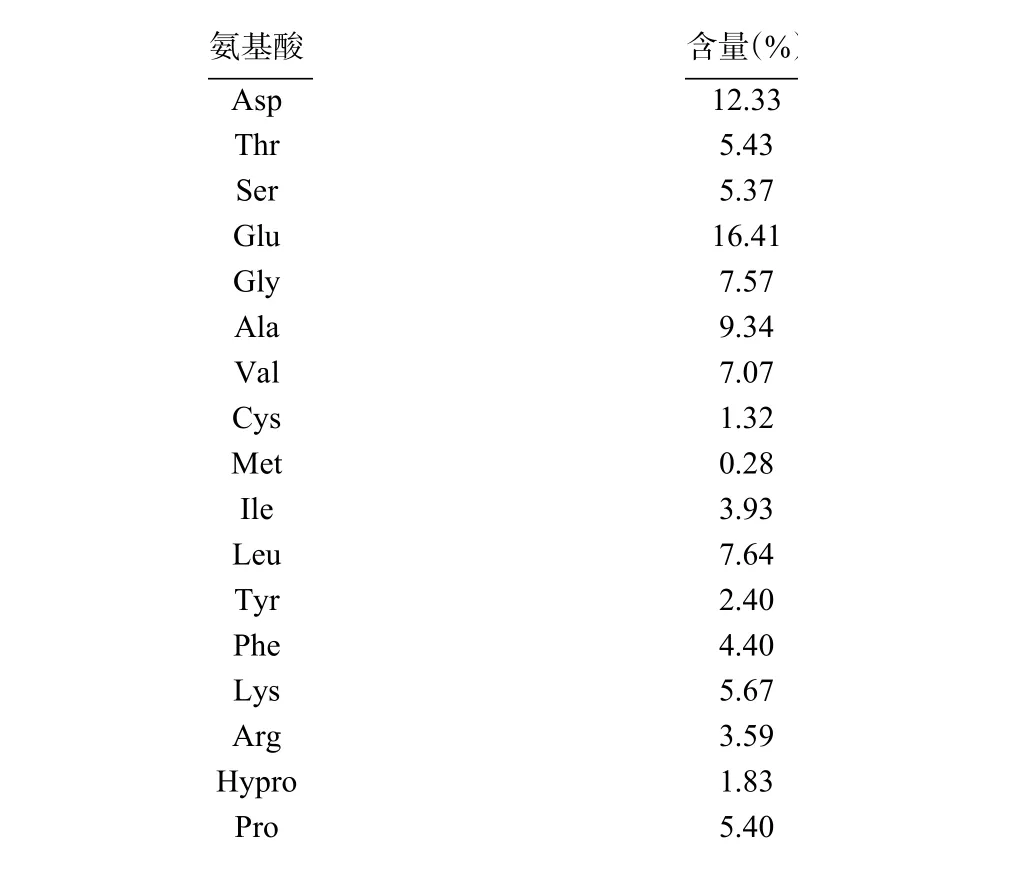
表6 雨生紅球藻蛋白酶解物的氨基酸組成Table 6 Amino acid content of Haematococcus pluvialis hydrolysate

表7 不同類型氨基酸與總氨基酸含量比例Table 7 Ratio of different types of amino acids to total amino acids
按氨基酸類型分析,雨生紅球藻蛋白酶解物的酸性氨基酸、堿性氨基酸、芳香族氨基酸、脂肪族氨基酸和極性氨基酸的含量比例為4:1:1:11:3,接近Pavlicevic 等歸納得出的海洋源抗氧化生物活性肽的結構組成,這說明該蛋白酶解物中很大可能存在強抗氧化的藻源多肽。疏水性氨基酸的含量高達38.07%,分別是Phe、Val、Leu、Ile、Ala、Pro 和Met,這些氨基酸有助于促進疏水性較強的肽段的形成,可通過多種途徑增強物質清除自由基的能力,如促進酶解物在脂質-水界面處的溶解,使其更易于進入疏水性的靶器官,或作為供氫體發揮功效,也可充分利用其與金屬離子螯合(如Fe和Cu)的性質。酸性氨基酸(Glu 和Asp)和堿性氨基酸(Lys 和Arg)在抗氧化中也起著重要作用,其所帶電荷直接決定酶解物對金屬離子的螯合能力,含量分別為28.75%和9.26%。以上三類與抗氧化高度相關的氨基酸占總氨基酸含量的76.08%,較好地解釋了該酶解物的抗氧化活性。
此外,芳香族、脂肪族和極性氨基酸也可提供相應的自由基消除能力。芳香族氨基酸既可以利用自身存在的咪唑環供氫和捕捉自由基,也可能利用和其他氨基酸的作用來增強疏水性能力,以提高物質的抗氧化功能,其消除自由基的能力約是脂肪族氨基酸的二倍以上。脂肪族氨基酸能增強基于肽的依布硒啉類似物的谷胱甘肽過氧化物酶活性,但其對抗氧化酶解物的作用機理還有待證實。極性氨基酸可螯合金屬離子以發揮抗氧化作用,還能與非極性氨基酸相互協同來增強自由基清除能力。綜上所述,雨生紅球藻蛋白酶解物可作為天然抗氧化劑的一種來源,營養價值高,有可觀的健康效應。
3 結論
本研究利用單因素實驗和響應面優化試驗,通過抗氧化指標進行測定篩選,制備了具較強抗氧化活性的雨生紅球藻蛋白酶解物。最終確定的最佳酶解條件為:以堿性蛋白酶為實驗用酶,底物濃度為9%(w:v),加酶量為0.7%(w:w),酶解溫度40 ℃,pH11.5,酶解時間為3 h。用最優方案制備的酶解物的ABTS自由基清除率IC值為481.574 μg/mL,亞鐵離子還原能力為19.641 μmol FeSO·7HO/g(1000 μg/mL),抗氧化活性極顯著高于藻渣蛋白(<0.01)。該酶解物的氨基酸種類豐富,必需氨基酸含量達34.4%,且內含較多疏水性氨基酸,營養價值較高。本研究為雨生紅球藻渣的綜合利用及后續研究提供了理論基礎,為進一步分離純化雨生紅球藻抗氧化肽提供了參考價值,為藻源天然抗氧化劑的開發提供新途徑。

