高考化學產率純度類計算的錯誤例析
吉林 趙鑫光
通過對近幾年全國各地高考真題的統計分析,可知在每套高考化學試卷中涉及計算的題目分值大約為16~24分,可見計算的考查在高考化學中占有相當大的比例,在這些涉及計算的試題中,常考的一類就是有關產率和純度的計算,這部分內容經常在工藝流程題和化學實驗綜合題的最后一問中出現。由于試題位置靠后,需要用到的相關原理和數據較多,有時計算還比較復雜,所以考生在考場上的答題準確率并不高。本文以一道高三下學期校內模擬考試中的相關試題進行數據統計和分析,總結出相關的錯誤類型和錯誤原因,并加以分析和糾正,以求對廣大教師在今后指導解決類似題目時有所幫助和借鑒。
一、試題呈現
【例題】某興趣小組利用“碘在酸性條件下被氯酸鉀氧化后與氯化鈣發生復分解反應”的原理制備一水合碘酸鈣晶體,其制備流程及裝置如圖1所示(加熱及夾持裝置略去):


圖1
用恒壓滴液漏斗加入30%的鹽酸進行步驟①,充分反應制備碘酸氫鉀(KIO3·HIO3),同時有黃綠色氣體生成。再經過步驟②③④通過重結晶最終得到2.04 g產品,則產率為________%(保留1位小數)。
可能用到的相對原子質量:O—16 Cl—35.5 K—39 Ca—40 I—127
【參考答案】50.0
二、試題解析
根據題干中的實驗步驟可知,整個實驗過程中,發生反應的化學方程式如下:



三、錯誤例析
本次參加考試的為同一班級52名考生,這些考生均進行過完整的一輪復習,整張試卷的分數從98分到71分均有分布。其答題結果的統計所得數據如表所示:

計算結果50.0%44.9%52.3%46.9%25.0%62.5%其他答案人數108913435
通過上述數據可以看出,這個題目正確率只有19.23%,屬于得分率相當低的題目,接下來對這些錯誤答案的得出原因逐一分析。



(4)得到25.0%這個錯誤答案的原因是考生在解題過程中雖然反應物的量的問題和產物的存在形式都處理比較恰當,但忽略了物質之間的比例關系,誤將一水合碘酸鈣的物質的量以0.02 mol計算,故得到的產率是正確答案的一半。
(5)得到62.5%這個錯誤答案的原因比較偶然,雖然只有三名考生得到這個答案,但錯誤的原因卻不一樣,其中一名考生將題干中給的2.83 g誤寫成2.03 g,而另兩名考生是將I2的摩爾質量誤算為354 g·mol-1,這兩個錯誤雖然不同,但巧合的是都得到了62.5%這個結果。
由上述分析可將本類試題的易錯點歸納為以下幾點:
(1)由于沒有考慮反應物的量的問題,錯用I2的物質的量作為計算依據的共有21名考生,這反映出有相當一部分考生在考試過程中,忽略了有兩種或兩種以上反應物存在的化學反應在進行定量計算時,必須先確定各反應物間的相對量關系,哪種反應物過量、哪種反應物不足,并用不足量的反應物的量作為計算依據的基本要求,針對上述錯因,在試題講評過程中,教師應要求學生在做題過程中養成對數據的敏感性,尤其注重化學計量關系,必須使用不過量的物質的量作為計算依據。
(2)由于審題不仔細,一部分考生沒有注意到有關物質結晶水的問題,憑主觀臆斷將無水碘酸鈣作為產物的存在形式進行計算,這反映出很多考生在考試進行過程中由于時間緊張、存在畏懼心理等因素導致審題不仔細認真,把本應該得到的分數丟掉。針對上述錯因,在試題講評過程中,教師應告知學生面對考試首先要放平心態、不要緊張,其次要認真、逐一圈畫流程圖或裝置圖中所給的有用信息,例如反應物或產物的化學式、質量、體積等關鍵信息,并準確應用信息進行解題。
(3)除上述兩個主要問題外,還有誤判物質之間的比例關系、看錯題干中的數據、簡單數學計算錯誤等非智力因素導致的丟分,在這里也提醒廣大教師在講評試題時應注意提醒學生對這些方面錯誤的防范。
四、針對訓練
在講評完上述試題后,針對考試出現的問題,要及時加強練習,鞏固成果。在課后作業中,選擇信息較多,但呈現形式多樣的試題,這類試題的關鍵信息并沒有直接在題干文字中給出,而是出現在表格、圖像、流程圖、裝置圖中,以訓練學生的讀題、審題、提取信息、應用信息等方面的能力。一段時間后可以選擇考查知識點或解題方法相似的題目進行5分鐘左右的課堂小考,測試復習效果。
【練習】硫代硫酸鈉易溶于水,難溶于乙醇,在酸性條件下極不穩定,易分解,具有較強的還原能力,在42~45℃熔化,50℃分解。某化學實驗小組設計以下步驟制備硫代硫酸鈉晶體(Na2S2O3·5H2O)。

圖2
(1)本實驗制得Na2S2O3·5H2O晶體的產率為________%(保留1位小數)。
(2)用硫代硫酸鈉可以測定過碳酸鈉(2Na2CO3·3H2O2)樣品的純度,準確稱量0.100 0 g過碳酸鈉樣品于碘量瓶中,加入50 mL蒸餾水,并立即加入6 mL 2 mol·L-1的磷酸溶液,再加入1 g KI固體(過量),搖勻后于暗處放置10 min,用0.100 0 mol·L-1的Na2S2O3標準溶液滴定至溶液呈很淺的黃色,加入適當的指示劑,繼續滴加Na2S2O3至滴定終點,滴定前后滴定管中Na2S2O3標準溶液的體積如圖所示。
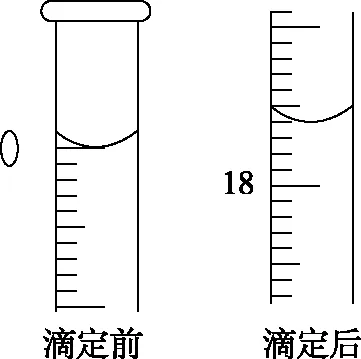
根據實驗數據計算產品中H2O2的質量分數為________%(保留4位有效數字)。
【參考答案】(1)71.0 (2)29.92


【分析】本題的易錯點有以下幾點:首先計算硫代硫酸鈉的理論產量時,應該先判斷哪種反應物過量,找出不過量的起始反應物,才能準確計算出產率;其次在滴定管讀數時,應注意滴定管的刻度,上面的數值小,下面的數值大;第三是要注意滴定管刻度的分度值,注意到了以上幾點才能保證讀數正確。
作為針對性訓練,選擇上面題目的原因有以下幾點:
(1)此題在工藝流程圖中給出了多種反應物的用量,在計算理論產量時需要先確定硫粉和亞硫酸鈉的量的關系,哪種物質過量、哪種物質不足,并用不足的量進行后面產率的計算,這與考試題中的考查角度相似,可以強化考生對反應物量的敏感程度,養成良好的分析試題的習慣。
(2)此題中產物為Na2S2O3·5H2O,這與考試題中的產物Ca(IO3)2·H2O類似,都是結晶水合物,重點考查考生辨識信息的能力和讀題的仔細認真程度,該問可以強化考生對摩爾質量的準確計算,尤其是要留意結晶水的部分,這與考試題中的考點也比較相似。
(3)此題第二問主要考查滴定實驗中的讀數問題,其信息以圖的形式給出,強調從圖中讀取信息的能力,并考查有關滴定管讀數的基礎知識和關鍵能力。只有認真讀圖并正確讀數,才能完成后面的計算,這雖然是一個非常小的知識點,但對學生能力的考查具有較大的區分度,可以很好地檢驗出考生在試題講評和習題訓練后的效果。
五、小結


