類風濕關節炎患者SIRL-1表達及其調控NETs形成的作用①
王 嵐 袁佳儀 司玉瑩 陳念貞 宗 明 范列英 (同濟大學附屬東方醫院檢驗科,上海 200120)
中性粒細胞外捕網(neutrophil extracellular traps,NETs)是以中性粒細胞染色質解聚為DNA 骨架,附著組蛋白、蛋白酶和其他顆粒蛋白(如髓過氧化物酶、彈性蛋白酶)等形成的纖維網狀結構,在清除病原體等有害物中起重要作用。但NETs 過度形成或NETs 產物清除失調將導致組織損傷、炎癥并誘發自身免疫性疾病[1]。研究顯示,RA 患者外周血中性粒細胞自發形成NETs 增多,NETs 產物與抗環瓜氨酸肽抗體(anti-citrullinated protein antibodies,ACPAs)和炎癥標志物水平相關,可能是促進ACPA生成的主要機制之一[2-3]。目前RA 患者體內NETs形成增多的機制尚未闡明。SIRL-1 是表達于中性粒細胞、單核細胞等髓系吞噬細胞表面的抑制性受體,SIRL-1 mAb能夠通過與SIRL-1特異性結合活化SIRL-1 信號、抑制 NETs 形成[4-5]。SIRL-1 基因多態性可影響其在單核細胞上的表達,與特應性皮炎發病相關[6]。本研究分析RA 患者外周血髓系吞噬細胞(中性粒細胞、單核細胞)和關節滑膜組織SIRL-1表達,探討SIRL-1對RA-NETs形成的作用。
1 資料與方法
1.1 資料
1.1.1 研究對象 外周靜脈血取自2019 年11 月至2020 年1 月于同濟大學附屬上海市東方醫院就診的RA 患者38 例和同期健康體檢者(healthy con?trol,HC)46例,樣本來自血常規檢查后的剩余血液。RA 組女 34 例,男 4 例,平均年齡(51.39±9.83)歲;HC 組女38 例,男8 例,平均年齡(55.16±14.46)歲,兩組性別和年齡分布差異無統計學意義(P=0.371 0,P=0.160 7)。RA和OA關節滑膜組織蠟塊(RA患者5例,OA患者4例)來自關節鏡手術切除和病理檢查后的剩余滑膜組織。RA 患者符合2018 年修訂的中國類風濕關節炎診療指南,OA 患者符合中華醫學會骨科學分會“骨關節炎診療指南(2018 年版)”。研究方案經同濟大學附屬東方醫院醫學倫理委員會審批備案[2016(倫)審第(011)號]。
1.1.2 主要試劑與儀器 聚-L-賴氨酸溶液、BSA、Triton X-100(Sigma-Aldrich 公司);Hanks 平衡鹽溶液、RPMI1640 培養基、FBS(Gibco 公司);Ficoll-PaquePLUS(GE Health 公司);流式抗體CD11b/CD14/CD15/CD16、FITC 標記羊抗鼠 IgG(BD 公司);SIRL-1 mAb(Hycult 公司);兔抗MPO 單克隆抗體(Abcam公司);DyLight 594 標記的羊抗鼠IgG(Introgen 公司);Hoechst 33342、SYTOXTMGreen Nucleic Acid Stain(Thermo Fisher Scientific 公司);Fluoromount-G熒光封片劑(Southern Biotech 公司);流式細胞術分析儀(BD Calibur);多功能酶標儀(Spectra Max M5);熒光顯微鏡(Leica DM6000B)。
1.2 方法
1.2.1 免疫組化 將 5 例 RA 和 4 例 OA 滑膜組織切片高溫脫蠟,滴加3%H2O2,室溫靜置15 min 清除內源性過氧化物酶。加入20%正常山羊血清封閉液室溫孵育30 min,加入一抗SIRL-1 mAb(1∶100 稀釋)4 ℃濕盒過夜,第2 天室溫下復溫1 h,加入相應二抗室溫孵育1 h,DAB 顯色,蘇木精復染,沖洗,烤干,封片。顯微鏡下觀察,陽性部位呈褐色,胞核呈藍色。200 倍視野下計數每個視野下陽性細胞數,每張切片計數30個視野。
1.2.2 流式細胞術 收集30 例RA 患者、38 例HC新鮮EDTA 抗凝血,取100 μl 全血進行流式細胞術分析。采用特異性二抗FITC 標記SIRL-1 mAb,通過 FSC/SSC 和 CD11b、CD14、CD15、CD16 篩選中性粒細胞、單核細胞和嗜酸性粒細胞。每個樣本計數10 000 個細胞,檢測 SIRL-1 表達,FlowJo 軟件處理數據。
1.2.3 人外周血中性粒細胞分離 采用Ficoll-PaquePLUS梯度密度離心法從EDTA 抗凝血中分離最下層細胞,加入紅細胞裂解液靜置10 min,Hanks 緩沖鹽溶液洗2 次,分離得到原代中性粒細胞,含10%FBS的RPMI1640培養基重懸細胞并計數。
1.2.4 NETs 免疫熒光染色 預先配制0.001%多聚賴氨酸溶液包被細胞爬片,將計數完成的中性粒細胞按3×105個/孔接種于 24 孔板,37 ℃、5%CO2培養4 h,Hanks 平衡鹽溶液清洗3 次,4%多聚甲醛固定,0.25%TritonX-100 透化,1%BSA 封閉,加入兔抗MPO 單克隆抗體(1∶100)4 ℃孵育過夜。次日加入Alex Fluor 488 標記的抗兔 IgG(1∶200)室溫避光孵育 1 h。Hoechst 33342 復染,Fluoromount-G 封片,熒光顯微鏡下200 倍視野觀察NETs 形成情況。為更直接地觀察NETs 形成,采用活細胞膜不透性染料SYTOX Green 對胞外DNA 進行染色,熒光顯微鏡觀察拍照。
1.2.5 NETs 定量檢測 參照文獻[7-8],采用細胞膜通透性染料Hoechst 33342、活細胞膜不滲透染料SYTOX Green 和髓過氧化物酶(myeloperoxidase,MPO)熒光顯微鏡下可視化NETs 形成,并采用活細胞膜不滲透染料SYTOX Green通過熒光強度定量評估同個體來源的中性粒細胞NETs 形成。選擇分離純化的中性粒細胞(RA 組8 例,HC 組8 例),免疫熒光染色方法同上,酶標儀檢測:接種到黑色平底96 孔培養皿(3×105個/孔,200 μl 體系),根據實驗條件選擇是否采用SIRL-1 mAb 處理1 h,37 ℃、5%CO2培養3 h,SYTOX Green 染色20 min,如細胞膜完好,染料則不能與細胞內DNA 結合,Spectra Max M5 多功能酶標檢測熒光強度(Ex:485 nm,Em:520 nm)。
1.3 統計學處理 采用SPSS20.0 和Graphpad Prism 8.0 軟件進行統計分析和繪圖。符合正態分布的各組間比較采用兩獨立樣本t檢驗,非正態分布數據采用Kruskal-Wallis 檢驗。P<0.05 為差異具有統計學意義。
2 結果
2.1 RA 患者和OA 患者關節滑膜中SIRL-1 表達比較 采用SIRL-1 mAb對5例RA 關節滑膜和4例OA關節滑膜進行免疫組織化學染色,有棕色顆粒附著為陽性細胞,200 倍鏡下統計每個樣本30 個視野表達SIRL-1 的陽性平均細胞數,結果顯示,RA 患者表達 SIRL-1 的 陽 性 細 胞 數 少 于 OA 組[(3.943±2.889)個vs(12.780±7.284)個,P<0.05,圖1]。
2.2 RA 患者外周血SIRL-1 表達比較 流式細胞術結果顯示,RA 患者 CD14?CD11b+CD15+CD16+中性粒細胞、CD14+CD11b?單核細胞SIRL-1 表達低于HC(P<0.05,P<0.01);RA 患者CD14?CD11b+CD15+CD16?嗜酸性粒細胞表面SIRL-1 表達雖略低于HC,但差異無統計學意義(P>0.05,圖2)。
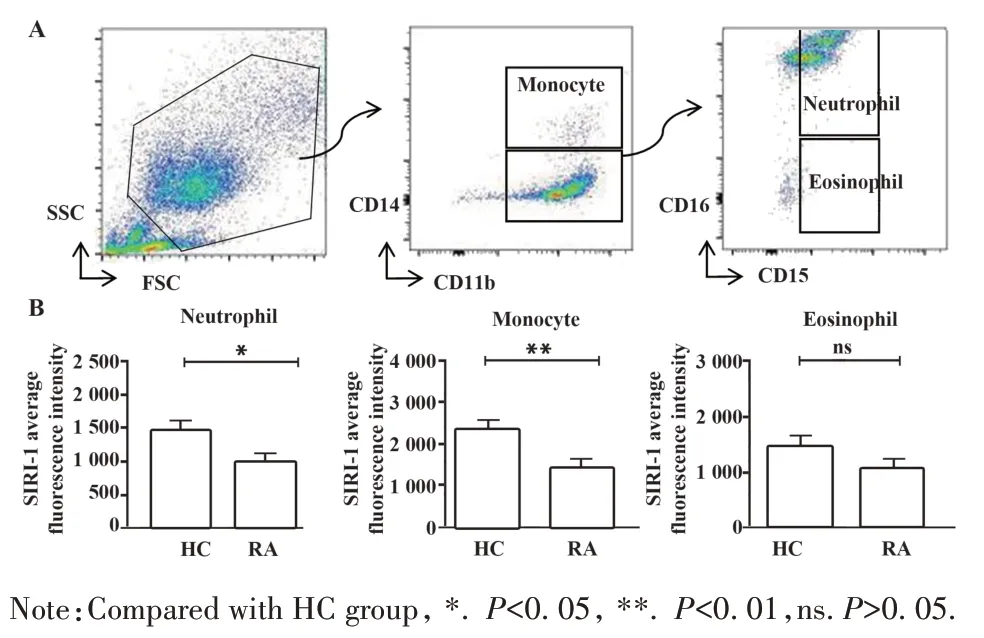
圖2 RA和HC外周血主要吞噬細胞SIRL-1表達Fig.2 Expression of SIRL-1 on surface of primary phago?cytes cells in peripheral blood from RA patients and HC
2.3 SIRL-1 抑制RA 患者中性粒細胞形成NETs與HC 組相比,RA 組大部分中性粒細胞分葉核結構消失,胞外可明顯觀察到大量Hoechst 33342 和MPO 共定位的NETs,RA 組中性粒細胞更易自發形成NETs;而SIRL-1 mAb 預處理的中性粒細胞NETs形成明顯減少(圖3A)。多功能酶標儀對同一樣本中性粒細胞的胞外DNA 進行檢測,結果顯示RA 組胞外DNA 熒光強度明顯高于HC組(P<0.001)。HC組中,與無 SIRL-1 mAb 處理相比,SIRL-1 mAb 處理后DNA 熒光強度有減弱趨勢,但差異無統計學意義(P>0.05);RA 組 SIRL-1 mAb 顯 著 降 低 細胞外NETs-DNA水平(P<0.05,圖3B)。

圖3 RA 患者中性粒細胞自發形成NETs 的情況及SIRL-1 mAb對RA-NETs的影響Fig.3 Spontaneous NETs formation produced by neutro?phils from RA patients and effect of NETs on formation mediated by SIRL-1 mAb
3 討論
NETs 在發揮胞外抗菌作用的同時暴露胞內成分,其清除缺陷及隨后反應過程的調節失衡會加重某些自身免疫性疾病嚴重程度[9]。NETs 釋放與ACPA 存在一定相關性,已有臨床研究證實RA 患者體內NETs增多并與RA 疾病活動度和ACPA 滴度呈正相關。目前已知PADI4 催化組蛋白瓜氨酸化導致染色質解聚是NETs 形成的必要環節[10]。本課題組前期研究發現,PADI4在RA患者外周血單個核細胞及關節滑膜組織中表達明顯升高,與RA 發生發展密切相關[11]。NETs 暴露瓜氨酸化蛋白刺激免疫系統被認為是促進ACPA 生成的主要機制之一,導致器官組織慢性、自身免疫性炎癥性損傷[3,12-13]。表明調控NETs形成對RA防治具有重要作用。
SIRL-1是2010年首次報道的免疫抑制受體,與PD-1、CTLA-4 等免疫抑制受體表達部位不同,目前僅發現SIRL-1 表達于髓系吞噬細胞表面,在中性粒細胞和多數單核細胞上高表達、部分髓樣樹突狀細胞上中度表達,而來源于淋巴干細胞的淋巴細胞和漿細胞樣樹突狀細胞不表達[14]。中性粒細胞和單核細胞均為髓樣干細胞分化而來,細胞膜上均帶有FcR 和補體受體。報道指出,SIRL-1 mAb 能夠激活中性粒細胞SIRL-1 信號,通過抑制FcR 受體介導的MEK-ERK 信號通路、抑制吞噬細胞內NADPH 氧化酶依賴性ROS 產生、抑制正常人抗中性粒細胞抑菌肽抗體誘導的NETs 形成[4]。本研究采用免疫組織化學染色法分析了RA和OA患者關節滑膜中SIRL-1表達,雖未特異性標記滑膜組織中的髓系吞噬細胞,但從免疫組化切片直觀判斷RA 關節滑膜組織中SIRL-1+細胞明顯少于OA關節滑膜組織。進一步采用流式細胞術分析外周血中性粒細胞、單核細胞和嗜酸性粒細胞SIRL-1 表達,發現RA 患者中性粒細胞、單核細胞中SIRL-1表達明顯降低。
現有研究顯示RA 患者外周血中NETs 形成明顯增多[15]。本研究通過細胞免疫熒光和酶標儀檢測胞外游離DNA 共同證實了RA患者的中性粒細胞比HC的中性粒細胞更易自發形成NETs。
為闡明SIRL-1 信號對RA 患者中性粒細胞形成NETs 的影響,課題組收集活動期RA 患者外周血和HC 外周血各8例,通過密度梯度離心法體外分離中性粒細胞,實驗組采用SIRL-1 mAb(1∶50)刺激中性粒細胞1 h,為保證抗體與細胞表面抗原充分結合,課題組將刺激時的反應體系維持在50μl,結果發現SIRL-1 信號能夠激活中性粒細胞表面SIRL-1 信號;采用SIRL-1 mAb 刺激的RA 中性粒細胞與未使用SIRL-1 mAb 組相比,NETs 形成水平明顯降低,與在系統性紅斑狼瘡中的觀點相似[5]。說明SIRL-1 mAb能夠調控SIRL-1信號,抑制NETs產生。
綜上,RA 患者關節滑膜和外周血中性粒細胞、單核細胞存在SIRL-1 表達降低的現象,RA 患者中性粒細胞更易自發形成NETs,SIRL-1 mAb 活化SIRL-1 信號抑制RA 中性粒細胞NETs 形成。提示SIRL-1 表達可能與 NETs 形成相關,調控 SIRL-1 信號可能為RA生物防治提供新的策略。