高中化學“氫氧化鋁的兩性”項目式教學
——胃藥“氫氧化鋁”的工作原理
楊鳳嬌,王 婭,姜紅波,王 艷,王冬梅,胡登衛,趙衛星,蘇小龍
(1.寶雞文理學院 化學化工學院,陜西 寶雞 721013;2.樂陵民生教育高級中學,山東 德州 253600)
1 項目主題內容
在高中化學體系中,氫氧化鋁是第一個需要學生詳細學習的兩性氫氧化物,其性質有至關重要的作用[1]。本項目對氫氧化鋁性質的探究包含酸堿中和反應的相關知識、氨水的相關性質以及氫氧化物的制取方法等。學生通過平時生活中的觀察發現,藥品“氫氧化鋁”對治療胃酸過多有顯著的效果,以文獻查詢、實驗探究、小組討論等形式對“氫氧化鋁”藥品的有效成分—氫氧化鋁的性質進行探究,了解到氫氧化鋁的性質不同于一般氫氧化物,應用所學知識和規律進行推理判斷有一定難度[2]。本項目旨在引導學生發現生活中的問題,并能運用化學原理對其進行解釋,培養學生發現問題、解決問題的能力,強化學生的探究能力、創新意識和小組合作能力[3]。
2 項目教學目標
(1)通過對藥品“氫氧化鋁”的實驗探究,學生能掌握氫氧化鋁的兩性,培養科學探究與創新意識。
(2)以圖表的形式分析藥品“氫氧化鋁”的作用并探究其工作原理,明確藥品“氫氧化鋁”中和胃酸的原理,探究其他藥品能否同樣達到中和胃酸且保護腸胃的效果,以此培養學生的證據推理能力。
(3)學生能從生活中發現問題并解決問題,將化學物質的性質應用于生活中,感受化學知識的重要作用,培養科學精神和社會責任感。
3 項目任務及教學流程
項目任務如表1所示。

表1 項目任務

續表1
4 項目教學設計實施過程
4.1 全方位認識藥品“氫氧化鋁”
“氫氧化鋁”是典型的抗酸藥,具有抗酸、吸著、局部止血和保護潰瘍等作用[5]。“氫氧化鋁”能對胃酸起到中和或緩沖的作用,抗酸作用緩慢而持久,但不會減少胃酸的分泌[6]。“氫氧化鋁”與胃酸作用時,產生的氯化鋁有收斂作用,能夠起到局部止血的效果,同時也可能產生便秘的副作用。“氫氧化鋁”與胃液混合形成凝膠,覆蓋在潰瘍表面形成一層保護膜,起機械保護作用。此外,鋁離子在腸內與磷酸鹽結合成不溶解的磷酸鋁隨糞便排出,因此,尿毒癥患者服用大量“氫氧化鋁”后可減少腸道磷酸鹽的吸收,進而減輕酸血癥。藥品“氫氧化鋁”的相關參數如表2所示。

表2 藥品“氫氧化鋁”的相關參數
4.2 “氫氧化鋁”治療胃病的原理探究
4.2.1 任務引導
【教師活動】學生通過對藥品“氫氧化鋁”的學習和了解,知道“氫氧化鋁”藥品屬于原料藥,以其作為研究對象是為了減少其他成分對實驗的干擾。學生通過學習藥品“氫氧化鋁”的相關參數,明確其主要作用是治療胃酸過多等,接下來需要了解其主要成分和治療胃酸過多的原理[7]。
【學生活動】明確藥品“氫氧化鋁”的主要成分是氫氧化鋁,查詢資料得知胃酸的主要成分為HCl,設計實驗進行探究。
4.2.2 探究實驗假設
查詢資料可知,胃酸的正常pH在0.9~1.8,飯后會被稀釋,pH上升到3.5左右。首先,設計實驗。使藥品“氫氧化鋁”與鹽酸溶液反應(見圖1),測量其反應前后的pH,記錄實驗數據。其次,設計對比實驗進行探究。(1)準備兩支試管并加入等量的藥品“氫氧化鈉”,然后分別滴加鹽酸,通入二氧化碳,觀察現象,記錄并對比分析。(2)準備一支試管,向其中加入一定量的鹽酸,用pH計測量其pH,將pH控制在0.9以下。(3)向試管中少量多次加入藥品“氫氧化鋁”粉末直到不再反應為止,測量反應結束時的pH,記錄并討論分析,找到選擇氫氧化鋁中和胃酸的原因。(4)設計對比實驗,比較氫氧化鋁分別與強酸、弱酸反應的結果。
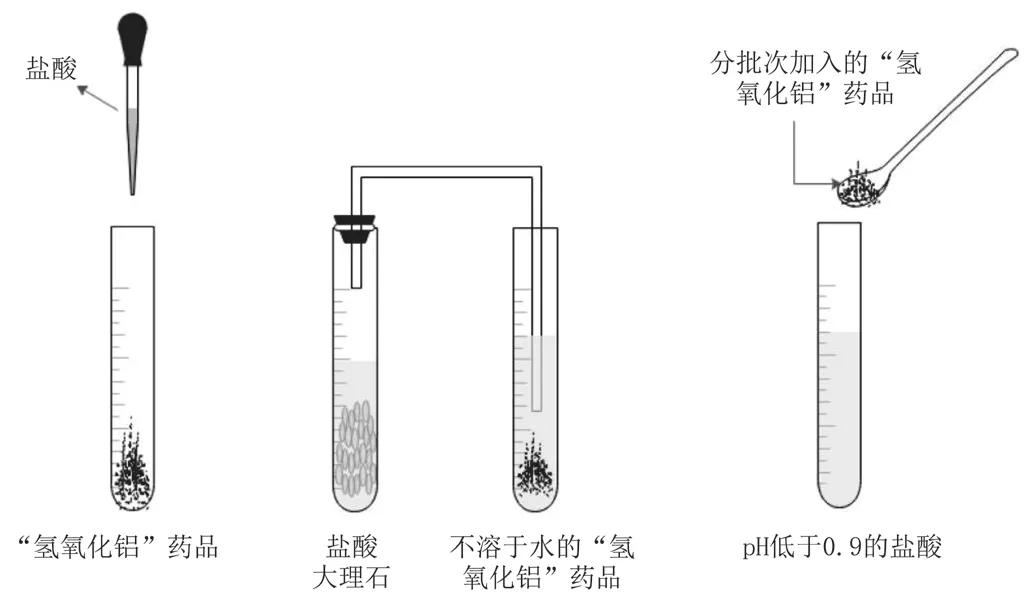
圖1 “氫氧化鋁”藥品與酸反應
4.2.3 實驗結果預測
(1)鹽酸與“氫氧化鋁”藥品發生反應,藥品白色粉末溶解;(2)“氫氧化鋁”藥品不溶于水,為白色沉淀,通入鹽酸與大理石制取的二氧化碳,無明顯反應;(3)向pH低于0.9的鹽酸溶液中少量多次加入“氫氧化鋁”藥品直至不反應,出現少許白色沉淀時,溶液的pH在3.0~4.0。
4.2.4 知識小結
氫氧化鋁能和強酸發生反應,但不和弱酸發生反應,中和胃酸時生成的氯化鋁顯酸性,對于胃里的酸性環境不會有太大影響且能中和過量胃酸,氯化鋁具有收斂作用,可局部止血,用于治療胃病很合適。
4.3 “氫氧化鋁”主要成分是否與堿反應探究
4.3.1 任務引導
【教師活動】氫氧化鋁治療胃酸過多的原理是氫氧化鋁能和胃酸中的主要成分鹽酸發生反應,且為酸堿中和反應,提問:氫氧化鋁能和堿發生反應嗎?如若發生反應,生成什么物質?
【學生活動】收集資料并提出預想的結果,根據所查資料設計實驗以驗證假設。
4.3.2 探究實驗假設
為了保證探究的完整性,準備“氫氧化鋁”藥品,分別與強堿、弱堿反應(見圖2),觀察、記錄現象并進行對比。分別向兩支試管中裝入等量藥品“氫氧化鋁”,向一支試管中滴加氫氧化鈉溶液,觀察實驗現象并記錄;向另一支試管中滴加氨水,觀察實驗現象并記錄[8]。

圖2 “氫氧化鋁”藥品與堿反應
4.3.3 實驗結果預測
(1)向“氫氧化鋁”藥品中滴加NaOH,白色粉末溶解;(2)向“氫氧化鋁”藥品中滴加氨水,白色粉末無明顯變化,不溶解。
4.3.4 知識小結
氫氧化鋁能和強堿發生反應,不能和弱堿發生反應。根據以上實驗可知,氫氧化鋁既能和酸反應,又能和堿反應,為兩性氫氧化物。
4.4 “氫氧化鋁”主要成分的制取
4.4.1 任務引導
【教師活動】通過分析“氫氧化鋁”藥品的參數可知,其主要成分為氫氧化鋁,提問:結合上面兩個探究實驗以及參考資料,應如何制備氫氧化鋁?其藥品的選擇有沒有特殊要求?
【學生活動】明確藥品“氫氧化鋁”的主要成分是氫氧化鋁,結合上面兩個探究實驗可知,氫氧化鋁會和強酸、強堿反應,因此不能選用強酸、強堿制備氫氧化鋁。查閱資料選擇合適的制備方法。
4.4.2 探究實驗假設
根據已學知識,氫氧化物可以通過離子與堿反應生成。由于氫氧化鋁會和強堿反應,但是不與弱堿反應,可以使用氨水與鋁離子反應制取氫氧化鋁(見圖3)。可設置對照實驗,分別逐滴加入NaOH和氨水,觀察現象并對比,收集生成的氫氧化鋁[9]。
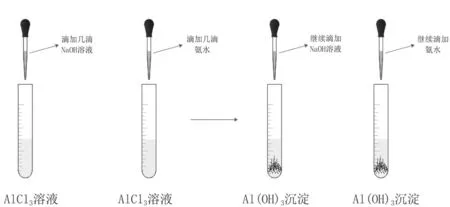
圖3 氫氧化鋁的制取
4.4.3 實驗結果預測
(1)開始滴入NaOH時產生白色沉淀,繼續滴加NaOH則白色沉淀消失;(2)開始滴入氨水時產生白色沉淀,繼續滴加氨水,白色沉淀不消失。
4.4.4 知識小結
氫氧化鋁會和強堿反應,因此,可用弱堿制取氫氧化鋁。同理,可用弱酸與偏鋁酸根反應制取氫氧化鋁。
5 知識鞏固與總結評價
5.1 知識鞏固
明確胃藥“氫氧化鋁”的主要成分為氫氧化鋁,通過查詢資料以及實驗探究可知,氫氧化鋁既能和強酸反應,又能和強堿反應:
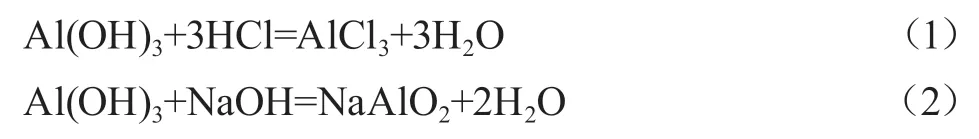
可見,氫氧化鋁是兩性氫氧化物,不與弱酸、弱堿反應,因此,可以使用弱酸、弱堿制備氫氧化鋁:
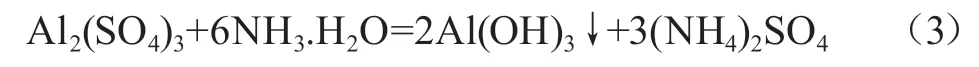
氫氧化鋁治療胃病的工作原理為其能中和胃酸,且生成的物質對人體沒有危害。
5.2 總結評價
在學生查閱資料時,教師要予以適當的指導并補充資料,對學生工作進行過程性評價。在學生設計實驗和實施過程中,教師要對學生的實驗設計方案進行指導并評價。實驗結束后,教師要了解學生對實驗結果的深層次認識,對學生的知識把握情況作出總結性評價,并及時對學生活動作出系統性評價。
6 項目教學設計反思
對氫氧化鋁兩性的探究以胃藥“氫氧化鋁”項目式教學設計展開,每個階段的任務和培養目標清晰明確。在實驗探究方面,學生作出了實驗假設,但鑒于學生思維的發散性,假設并不完善,因此,在進行教學實踐時,還要求教師有臨場應變能力。學生查到的以及教師提供的設備和藥品,對學生的探究行為起到了一定的限制作用,所以實驗的探究性較弱,還有待改進。在評價方面,教師給予學生較多的是口頭過程性評價以及對知識掌握情況的總結性評價,應設計多元化評價機制,通過多種途徑反饋學生對知識的理解程度。

