釹離子摻雜TiO2的吸附特性和光催化性能
阮運飛,梁春華
(凱里學院理學院,貴州凱里 556011)
二氧化鈦(TiO2)是一種白色的兩性氧化物,一般可以分為銳鈦礦型和金紅石型。二氧化鈦的性質穩定,光催化活性高,故而成為科學研究的熱點。在環境保護(如廢水處理、空氣凈化等)方面得到了大量研究[1]。但是二氧化鈦半導體的禁帶寬度較寬,只能吸收不足5%的太陽光譜能量且波長小于387 nm 的紫外光,從而使其光催化效率不高。因此,大量文獻報道采用稀土和過渡金屬元素摻雜[2]、貴金屬沉積[3]、非金屬元素摻雜[4]、敏化等[5]方法改性,可以提高TiO2對自然光的利用率,進而改善光催化效率。由于稀土元素的原子具有特殊的4f 電子結構,使其具有一些特殊的光電特性,稀土摻雜改性二氧化鈦引起了研究者的廣泛興趣。然而,有關釹離子摻雜TiO2的光催化活性研究報道比較少。本實驗采用簡單且成熟的溶膠-凝膠法制備三價釹摻雜的TiO2,以甲基橙作為目標物,研究了釹摻雜TiO2的吸附特性以及光催化性能。
1 實驗
1.1 試劑
鈦酸丁酯(分析純,國藥集團化學試劑有限公司),無水乙醇(分析純,湖南匯虹試劑有限公司),硝酸釹[Nd(NO3)3]·H2O(分析純,Sigma-Aldrich 公司),冰醋酸(分析純,武漢亞泰化工試劑廠)。
1.2 儀器
D/MAX-ⅢA 型X 射線衍射分析儀(日本理學公司),XPA 光化學反應裝置(南京胥江機電廠),UV-2550紫外-可見光光譜儀(日本島津公司)。
1.3 Nd3+-TiO2光催化劑的制備
常溫下,在分液漏斗中配制A 溶液(鈦酸丁酯34 mL、無水乙醇40 mL 混合均勻);在燒杯中配制B 溶液{將0.1 mol/L 硝酸釹[Nd(NO3)3]·H2O 溶液10 mL、冰醋酸10 mL、95%乙醇40 mL 混合,充分攪拌}。將A溶液滴入B 溶液,攪拌至形成Nd3+/TiO2溶膠,常溫放置形成凝膠。將凝膠置于烘箱110 ℃烘干后碾成粉末;將碾細的粉末放于馬弗爐600 ℃煅燒2 h 即得1.0%Nd3+摻雜的Nd3+-TiO2光催化劑,記為1.0%Nd3+-TiO2。采用同樣的方法制備1.5%Nd3+-TiO2、2.0%Nd3+-TiO2和純TiO2。
1.4 測試與表征
1.4.1 XRD
采用X 射線衍射分析儀進行表征。
1.4.2 光譜變化
采用紫外-可見光光譜儀進行分析。
1.4.3 光催化性能
用主波長為365 nm 的紫外燈和發射波長為400~800 nm 的高壓鈉燈作為光源進行測試。在反應器中加入一定體積已知濃度的甲基橙溶液和固定質量的Nd3+-TiO2構成懸浮體系。光源用石英管與反應液隔開置于反應管中央,外通冷凝水恒溫。開啟攪拌器,鼓入空氣,攪拌20 min 達到吸附-解吸平衡。接通光源,隔一段時間取樣一次,離心后,取上清液在λmax=463 nm 處測試吸光度。
1.4.4 吸附性能
配制不同質量濃度的甲基橙溶液,分別移取10 mL于離心管,實驗前將離心管先用錫箔紙包好,防止自然光影響,加入0.1 g Nd3+-TiO2粉末于離心管,放入氣流振蕩器,在常溫下振蕩24 h,離心分離后,取上清液測試吸光度。
2 結果與討論
2.1 表征
2.1.1 XRD
由圖1 可以看出,TiO2摻雜后沒有發現新的峰出現,但是隨著摻雜釹離子量的增加,TiO2的101 主特征峰強度減弱而且變寬泛。與標準譜圖庫對照,純TiO2和Nd3+-TiO2以銳鈦礦型存在,2θ=25.30°、37.80°、48.00°、62.75°、68.84°處的峰分別為銳鈦礦型TiO2的(101)(004)(200)(204)(116)晶面衍射峰[6]。
2.1.2 吸收光譜
由圖2 可以看出,在紫外光部分摻雜的材料和未摻雜的材料吸收光譜沒有明顯區別,而在可見光部分,未摻雜的TiO2無吸收峰出現,但是摻雜Nd3+的TiO2具有強且多的吸收峰(527、586、683、762、809、880 nm),說明通過摻雜拓展了TiO2的光吸收能力[7]。Nd3+-TiO2在可見光區強的光吸收能力與Nd 原子的電子結構有關。Nd 屬于f 區元素,價層電子構型為4f46s2,可見光區強的光吸收能力由f 電子的躍遷引起。因此,Nd3+的摻雜將有望TiO2在自然光中進行光催化處理污染物。

圖2 TiO2和Nd3+-TiO2的紫外-可見漫反射吸收光譜
2.2 吸附性能
由圖3 可以看出,TiO2通過Nd3+摻雜后對甲基橙的吸附效果比未摻雜二氧化鈦明顯增強,而且摻雜的量越多,吸附越明顯。因為稀土釹離子的摻雜可以抑制二氧化鈦晶體的生長,從而使二氧化鈦晶體變小而比表面積增大,所以吸附性能增強。2.0%Nd3+-TiO2對甲基橙的飽和吸附量達到20.79×10-6mol/g,而TiO2對甲基橙的飽和吸附量為10.89×10-6mol/g。采用Langmuir 吸附模型(ρe/Qe=ρe/Qmax+1/KaQmax[8])對甲基橙在不同Nd3+-TiO2上吸附的實驗數據進行分析,以ρe/Qe對ρe作圖,得直線的斜率為1/Qmax,截距為1/KaQmax,從而得到Ka、Qmax及R2(相關系數)見表1。表1 中數據說明Nd3+-TiO2的吸附能力比純TiO2強,相關系數R2都在0.9 以上,說明甲基橙在催化劑上吸附的實驗數據可以用Langmuir吸附模型擬合。

圖3 甲基橙在TiO2和Nd3+-TiO2催化劑上的吸附等溫線
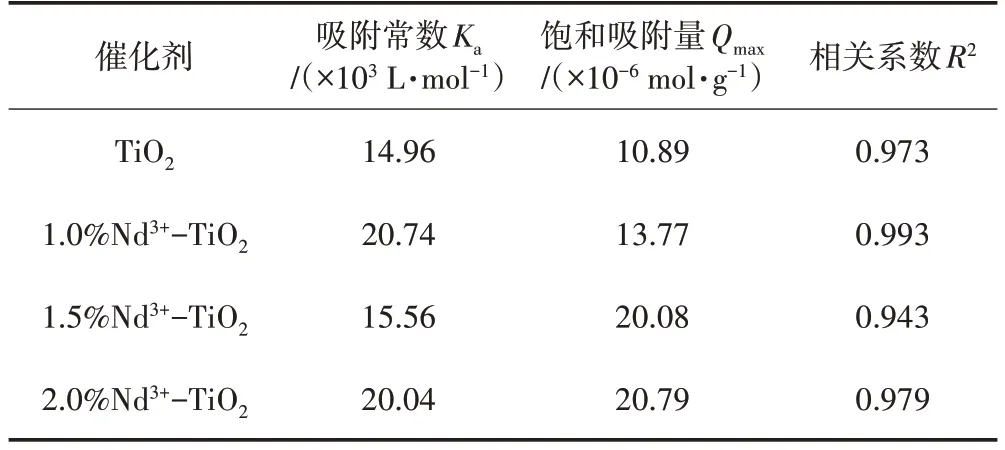
表1 甲基橙在Nd3+-TiO2催化劑上的吸附常數及相關系數
2.3 光催化性能
2.3.1 光催化活性
由圖4 可以看出,TiO2通過Nd3+摻雜后光催化活性明顯提高,隨著Nd3+摻雜量的增加,光催化活性增強,但是當Nd3+摻雜量達到1.5%時,光催化活性較強。之后,Nd3+摻雜量繼續增加,光催化活性反而不佳。因此,Nd3+的最佳摻雜量為1.5%。同時可以發現,TiO2通過Nd3+摻雜后在可見光下也有較好的活性,這與表征結果(紫外-可見漫反射的吸收光譜)相吻合,Nd3+-TiO2在可見光區存在明顯的吸收峰,原因是Nd3+摻雜拓寬了TiO2的光響應范圍至可見光區。
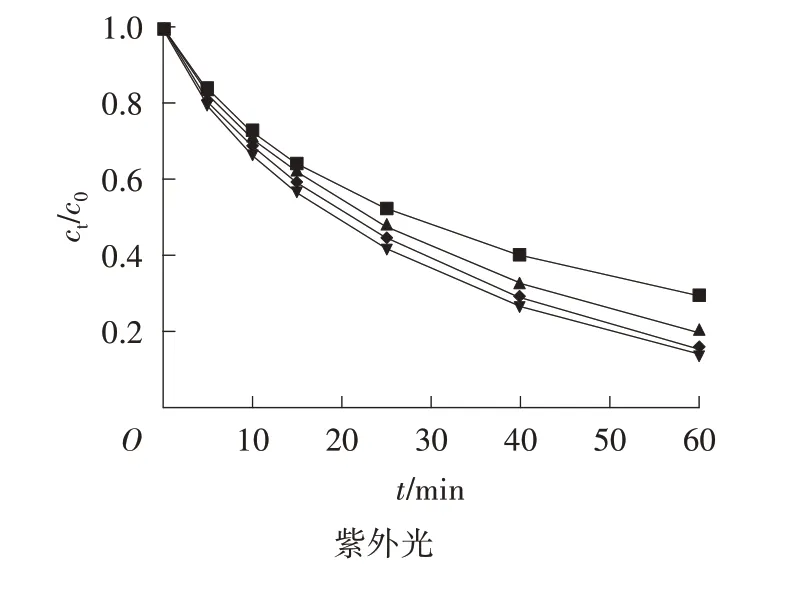
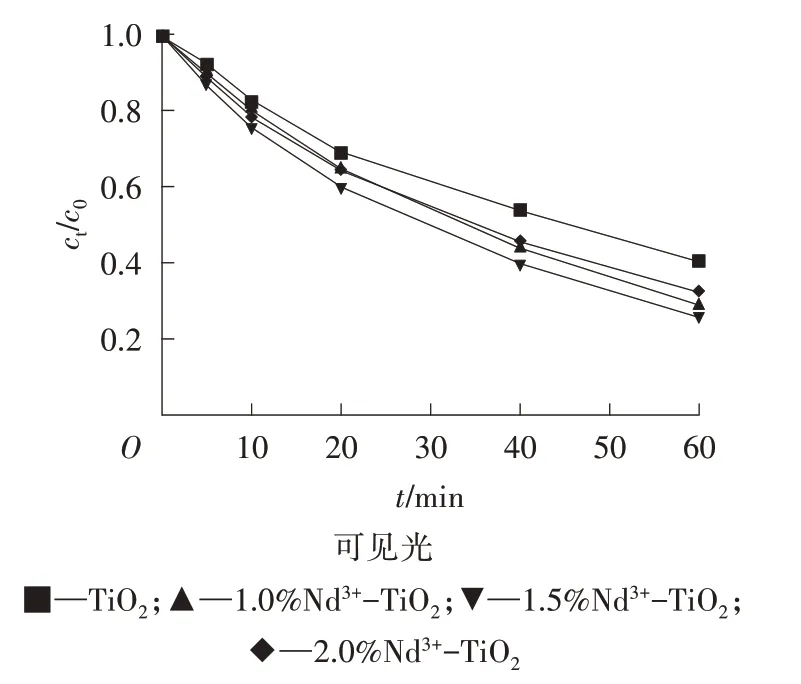
圖4 TiO2和Nd3+-TiO2的光催化活性
2.3.2 光催化動力學
當Kac0遠小于1時,吸附較弱,描述光催化反應動力學均采用假一級動力學模型[9]。本實驗的Kac0為0.78~1.02,吸附較強,因此采用蘭格謬爾-欣伍德整體模型進行描述[10],方程如下:
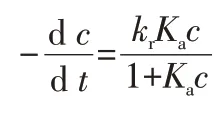
式中:-dc/dt表示甲基橙的降解速率;c表示甲基橙的濃度;Ka表示吸附速率常數;kr表示光反應速率常數;t表示反應時間。
因Kac遠大于1,所以可以簡化為:
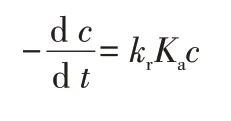
積分變形為:
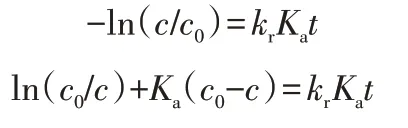
通過吸附實驗得到Ka,通過ln(c0/c)+Ka(c0-c)對t作圖,直線的斜率為krKa,因此可以求出kr。由圖5 可以看出,隨著Nd3+離子摻雜量的增加,反應速率常數kr增大;當摻雜量達到1.5%時,反應速率常數kr達到最大;之后,隨著Nd3+離子摻雜量的增加,反應速率常數反而減小。
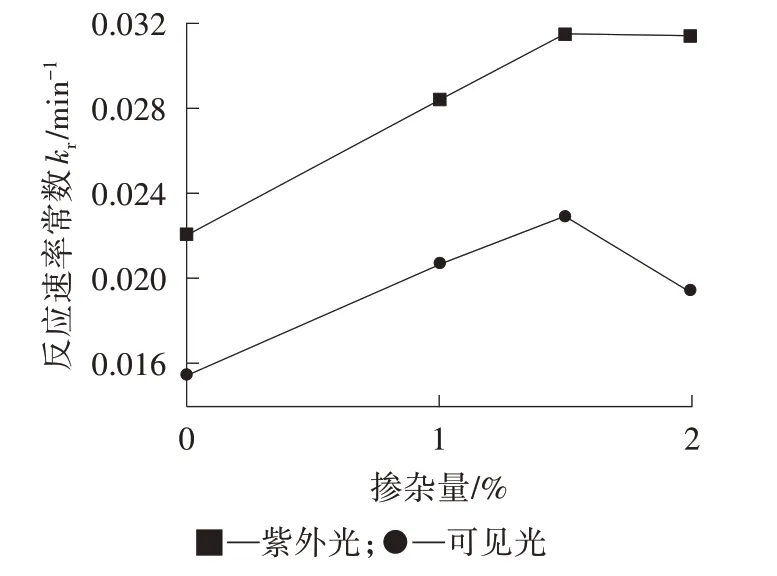
圖5 Nd3+-TiO2的kr與摻雜量的關系
3 結論
(1)采用溶膠-凝膠法制備的Nd3+-TiO2為銳鈦礦型,Nd3+的摻雜提高了晶體的熱穩定性,擴展了其光譜響應范圍。
(2)Nd3+摻雜提高了甲基橙在TiO2催化劑表面的吸附效果。
(3)Nd3+摻雜提高了TiO2的光催化活性,優化摻雜量為1.5%。

