TPM4對人胰腺癌細胞侵襲和遷移的影響
劉松柏,劉鵬,王興,朱昌毫,費曉斌,蔡浚哲,潘耀振
(1.貴州醫科大學 臨床醫學院,貴州 貴陽 550004;2.貴州醫科大學附屬腫瘤醫院 肝膽外科,貴州 貴陽 550008)
胰腺癌是最致命的惡性腫瘤之一[1],其惡性程度高、進展快、早期診斷困難且預后極差,被列為全球癌癥相關死亡的主要原因之一[2-3]。其近期5年總生存率僅為7.7%,中位生存期約為6 個月[4],它是美國癌癥相關死亡的第四大原因,也是全球第七大惡性腫瘤死亡原因[5]。由于胰腺癌早期無特異性臨床癥狀,絕大多數患者在發現時已中晚期。因此,迫切尋找胰腺癌早期診斷和治療的生物標記物具有重大意義。原肌球蛋白(TPM)是一種早期被發現的蛋白質,以絲狀肌動蛋白結合蛋白的形式存在于各種動物的細胞骨架和肌肉細絲中[6]。原肌球蛋白4(TPM4)是原肌球蛋白家族中肌動蛋白結合蛋白家族的一員,提供肌動蛋白細絲的結構穩定性,并調節細胞骨架功能[7]。此外,肌動蛋白-TPM4 微絲對收縮、細胞形態、細胞運動和細胞內小泡運輸都很重要[8]。目前越來越多的報道表明,TPM4參與了腫瘤的發展[9],但TPM4 在胰腺癌中的作用尚不清楚。本研究通過對TPM4 過表達或敲低,研究其對人胰腺癌細胞侵襲遷移的影響。
1 材料和方法
1.1 實驗材料
人胰腺癌細胞株:ASPC-1、BxPC-3、MIA PaCa-2、PANC-1、SW1990、HPDE均購自美國ATCC細胞庫;DMEM高糖培養基、RPIM1640、10%胎牛血清、0.25%胰蛋白酶等購自美國Gibco公司;小干擾RNA購自于中國廣州銳博生物科技有限公司,過表達慢病毒購自中國上海吉凱基因公司;Lip3000購于美國invitrogen;TPM4抗體購于中國武漢三鷹公司。
1.2 方法
1.2.1 生物信息學分析:通過TCGA、GEPIA等數據庫分析TPM4 在胰腺癌中的表達情況及與患者生存預后之間的關系。
1.2.2 細胞培養:所有細胞均在含10%胎牛血清的DMEM或RPIM1640,37 ℃,5% CO2培養箱中培養,提取對數期生長細胞進行后續實驗。
1.2.3 細胞轉染:取對數期生長細胞MIA PaCa-2、PANC-1,接種2×105個細胞于六孔板中,待細胞密度達到30%~40%時以Lip3000 脂質體為介質進行siRNA轉染,先使用無血清培養基分別孵育Lip3000及siRNA各5 min,隨后將二者混合孵育15 min后緩慢滴入細胞中,搖勻,培養箱中培養6 h后更換新鮮培養基,24~48 h提取RNA,驗證轉染效率,48~72 h提取細胞蛋白,進行Western blotting實驗驗證轉染效率。
1.2.4 細胞慢病毒感染:取對數期生長細胞MIA PaCa-2、PANC-1,接種1×105個細胞于培養瓶中,培養12 h后進行病毒感染,根據病毒MOI值將病毒體積吸入培養瓶中,搖勻,放入培養箱中培養,24 h后進行細胞換液,取對數期細胞進行后續實驗。
1.2.5 qRT-PCR檢測TPM4 mRNA表達水平:收集待測細胞,加入1 mL Trizol試劑,提取總RNA。然后使用PrimeScriptTMRT Reagent試劑盒(日本TaKaRa)逆轉錄RNA。qRT-PCR分析使用TB Green?Premix Ex TaqTM(日本TaKaRa)。選擇GAPDH作為內源性參照物,實驗結果的分析采用2-ΔΔCt方法計算,所有步驟均按說明書嚴格執行。
1.2.6 Western blotting檢測TPM4蛋白表達水平:收集待測細胞并加入200 μL裂解液(RIPA∶廣譜蛋白酶抑制劑∶磷酸化酶抑制劑∶PMSF=100∶2∶2∶1)。收集蛋白上清液,加入5×loading buffer(蛋白上清液:5×loading buffer=4∶1),95 ℃煮沸10 min。然后將各組細胞蛋白進行電泳分離,將凝膠中電泳分離的蛋白轉至PVDF膜上,5%脫脂牛奶室溫封閉2 h,TBST洗膜3 次后放入1∶1 000 稀釋的TPM4 抗體于4 ℃孵育過夜,TBST洗膜3次后加入二抗繼續于室溫孵育2 h,TBST洗膜3次后在化學發光儀中進行觀察。
1.2.7 劃痕實驗檢測胰腺癌細胞遷移能力:取siRNA干擾或過表達MIA PaCa-2、PANC-1細胞消化離心并接種于六孔板中,待細胞長滿整個孔徑時,將直尺置于孔徑上方,移液槍進行劃痕,PBS洗滌2次后于顯微鏡下進行拍照,并放置培養箱48 h后再次進行拍照,最后對各組細胞相對遷移距離進行比較。
1.2.8 Transwell實驗檢測胰腺癌細胞侵襲、遷移能力:取siRNA干擾或過表達MIA PaCa-2、PANC-1細胞消化離心并調整密度為2×105個/mL,取200 μL細胞懸液接種于含或不含基質膠(Matrigel膠∶無血清DMEM培養基=1∶8)的上室內,下室加入600 μL含20%胎牛血清的DMEM培養基,放置培養箱中培養24~48 h,PBS清洗2遍,1 mL 4%多聚甲醛室溫固定15 min,PBS清洗2遍,1 mL 0.3%結晶紫染色20 min,PBS清洗后烘干,最后顯微鏡下進行計數。
1.3 統計學分析
采用SPSS 25.0統計軟件分析,計量資料兩組間比較采用t檢驗,多組間比較采用單因素方差分析。P<0.05認為差異有統計學意義。
2 結果
2.1 TPM4在胰腺癌細胞中的表達
通過TCGA、GEPIA數據庫中篩選成對樣本進行數據分析,結果顯示TPM4 基因在胰腺癌中高表達,且與胰腺癌患者總體生存率及無病生存率呈負相關(見圖1A~C),進一步通過qRT-PCR對胰腺癌細胞系進行驗證,結果表明:與HPDE相比,TPM4在胰腺癌細胞系中高表達,其中以MIA PaCa-2、PANC-1 細胞最為顯著(見圖1D),因此選擇這兩株細胞作為后續實驗。
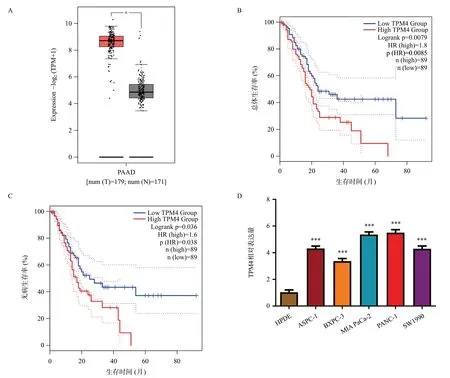
圖1 TPM4在TCGA、GEPIA數據庫及胰腺癌細胞系中高表達
2.2 TPM4轉染后的表達水平
針對以上結果,我們將siRNA及過表達慢病毒轉染MIA PaCa-2、PANC-1細胞,采用qRT-PCR進行驗證,結果表明:與對照組si-NC相比,敲低組三條si-TPM4表達量均降低,其中以si-TPM4#2最為顯著(圖2A、B),因此選擇si-TPM4#2作為后續研究。而與Control組相比,過表達組顯著上調TPM4表達量(見圖2C)。進一步通過Western blotting進行驗證,結果表明:過表達組TPM4表達量明顯高于Control組,敲低組TPM4表達量明顯低于si-NC組(見圖2D)。這些結果表明過表達及敲低組構建成功。
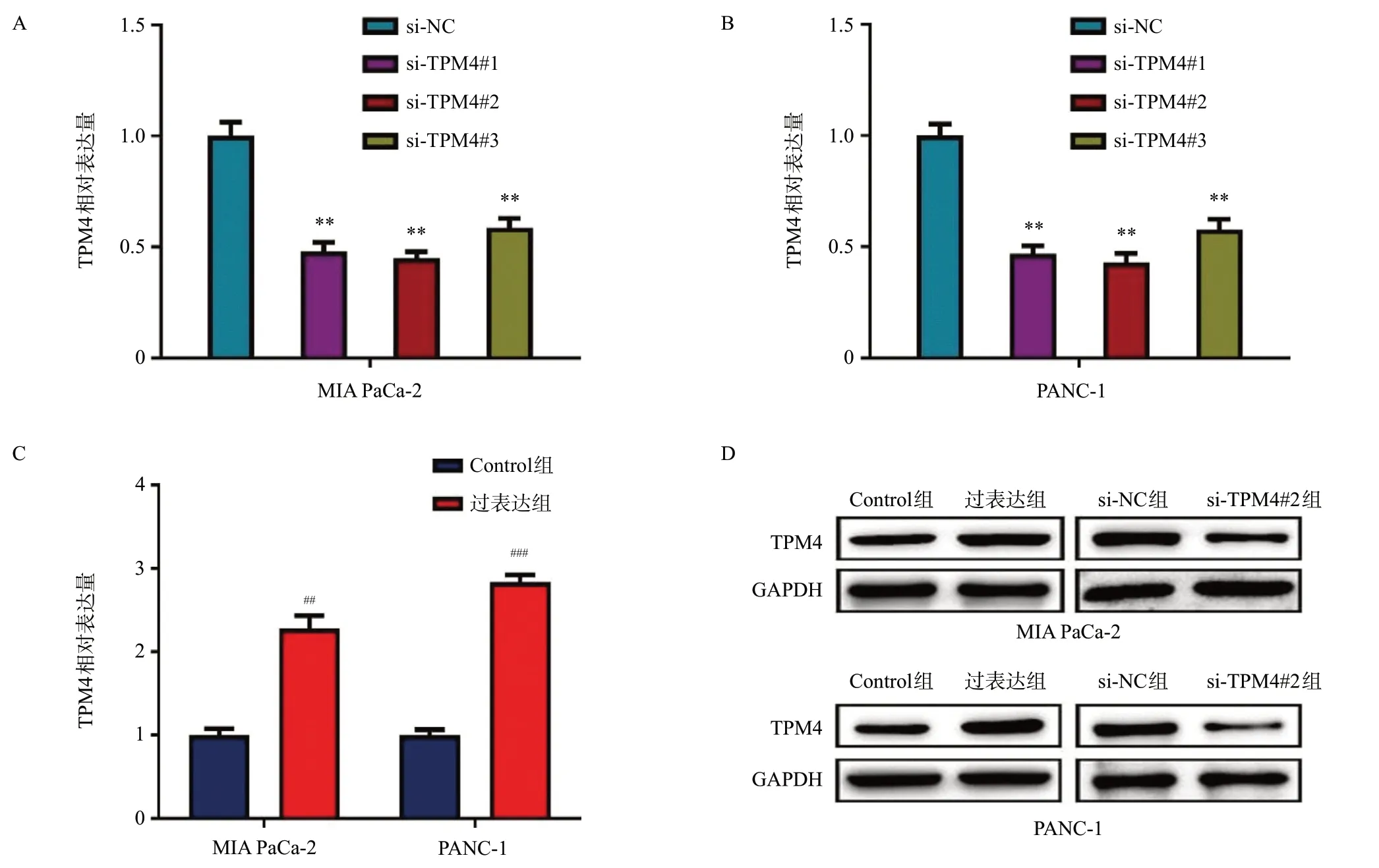
圖2 TPM4 siRNA及穩轉慢病毒效率驗證
2.3 TPM4對胰腺癌細胞侵襲和遷移能力的影響
為進一步研究TPM4 對胰腺癌細胞侵襲遷移能力的影響,我們首先采用傷口愈合實驗,結果表明:與Control組相比,過表達組胰腺癌細胞遷移能力明顯增強,而敲低組胰腺癌細胞遷移能力減弱(圖3A)。接下來通過Transwell實驗,結果表明:過表達組細胞侵襲遷移能力顯著增強,而敲低組細胞侵襲遷移能力減弱(圖3B)。這些結果都表明:過表達TPM4能促進胰腺癌細胞侵襲遷移。
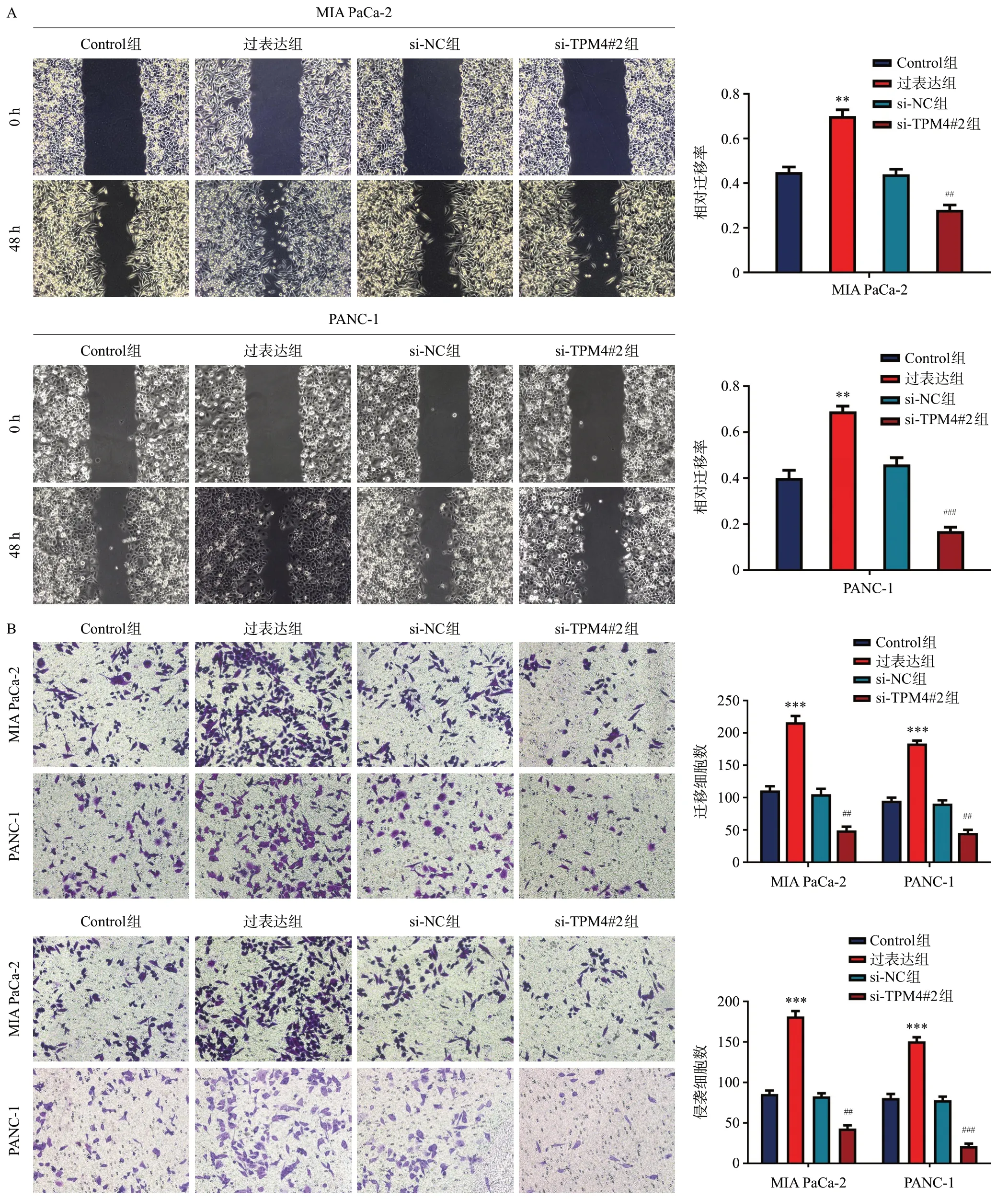
圖3 TPM4促進胰腺癌細胞侵襲和遷移(HE,×100)
3 討論
與其他癌癥不同,胰腺癌的發病率持續上升,存活率幾乎沒有改善,治療中的主要挑戰仍然是患者在確診時已進展為疾病晚期[10]。目前,手術是胰腺癌唯一潛在的治愈方法,但由于局部和遠期復發的高頻率,單靠手術治療的方法往往達不到預期臨床結局[11]。原肌球蛋白(TPM)是一類肌動蛋白相關蛋白家族,它沿著肌動蛋白細絲的主要α螺旋溝槽形成卷曲二聚體[12],與肌動蛋白、肌鈣蛋白、原肌球蛋白等其他肌節蛋白一起在調節肌肉收縮中發揮重要作用[13],在哺乳動物中,原肌球蛋白由4個不同的基因編碼:TPM1、TPM2、TPM3和TPM4組成[14]。據報道,TPM4被認為是幾種癌癥的潛在標志物,如卵巢癌患者血清中TPM4 水平較對照組升高[15],在腫瘤的發展中發揮重要作用。相關研究表明,TPM4在結腸癌組織和細胞系中的表達低于正常結腸組織和細胞系[16],而TPM4在肝癌組織[17]、食道癌組織[18]中的表達高于正常組織。此外,TPM4參與調節細胞運動,通過調節F-肌動蛋白的形成促進肺癌細胞遷移[19]。敲低TPM4 能夠抑制肺癌細胞增殖,促進肺癌細胞凋亡[20]。沉默TPM4 的表達能顯著抑制胃癌細胞的體外侵襲、遷移能力[21]。
為進一步研究TPM4 是否參與調節胰腺癌細胞侵襲、遷移。我們首先通過生物信息對TCGA、GEPIA等數據庫分析,發現TPM4基因在TCGA數據庫共享的大量樣本中癌組織的mRNA表達豐度顯著高于癌旁組織,并與臨床總生存率和無病生存率密切相關,提示TPM4 可能在胰腺癌中可能發揮致癌作用。其次,我們通過qRT-PCR對胰腺癌細胞系進行驗證,發現TPM4 在胰腺癌細胞系中高表達,提示TPM4 有望成為胰腺癌潛在的生物學標志物。最后我們通過對TPM4進行過表達或敲低,研究TPM4對胰腺癌細胞侵襲遷移能力的影響,發現過表達TPM4促進胰腺癌細胞侵襲遷移,敲低TPM4 則減弱胰腺癌細胞侵襲遷移。
總之,我們通過初步研究TPM4 在胰腺癌細胞中的作用,發現TPM4 在胰腺癌細胞中高表達,TPM4 能夠調節胰腺癌細胞侵襲遷移的能力,為胰腺癌早期臨床診斷、預后等提供參考,但其具體調控機制尚不清楚,仍需進一步探索。