基于文獻計量的骨關節炎與自噬研究態勢分析
袁長深 李 哲 官巖兵 廖書寧 陳樂偉 容偉明 梅其杰 段 戡
1.廣西中醫藥大學第一附屬醫院關節創傷骨科,廣西南寧 530023;2.廣西中醫藥大學研究生院,廣西南寧 530000
骨關節炎(osteoarthritis,OA)是一種以軟骨細胞減少、軟骨下硬化和滑膜炎為特征的退行性關節疾病。OA 發病率隨著老齡化社會的到來不斷上升。據統計,目前全球OA 患者已超過3 億,而我國40 歲以上人群原發性OA 的總患病率高達46.3%,已成為導致全世界疼痛、殘疾和加重社會經濟負擔的主要疾病之一[1]。該病發病機制尚不清楚,目前仍無有效手段阻止該病的進程。因此,深入研究OA 的發病機制,探索有效治療靶點至關重要。
OA 主要病理表現是軟骨細胞凋亡和細胞外基質丟失,維持其正常的生理結構、功能是治療的關鍵。自噬作為一種重要的細胞穩態機制,通過清除受損和功能失調的細胞器和大分子,維持OA 軟骨內環境的穩定。近年來研究發現,通過自噬增強體內平衡機制,可有效減緩OA 軟骨退變,降低OA 風險[2],有效激活自噬可能是未來治療OA 的一種方式[3]。因此,系統掌握OA 與自噬的動態變化,為從自噬角度研究OA 提供理論依據。
文獻計量學是運用統計學及數學等方法,將研究知識載體的關系和規律可視化,以探討該研究領域動態特征[4]。從OA 熱點研究領域——自噬進行研究,通過對OA 與自噬進行文獻計量學統計分析,可從整體角度分析其研究熱點和趨勢變化,對OA 研究具有重要的現實指導意義。
1 資料與方法
1.1 一般資料
本文以“Osteoarthritis/OA、autophagy”作為關鍵詞,以“Osteoarthritis/OA and autophagy”方式檢索PubMed數據庫中相關文獻,時間限定為2011 年1 月至2021 年12 月,文獻類型限定為artical;語種限定為英文。
1.2 研究方法
本文采用文獻計量學方法,以PubMed 文獻數據庫為基礎,使用citexs 數據分析平臺(www.citexs.com),分別選擇國家、機構、作者、關鍵詞、期刊、關聯疾病、關聯基因等因素對文獻進行大數據挖掘和分析,并可視化呈現該領域的總趨勢、分布情況、熱點變化等。從整體上把握OA 與自噬的研究概況,發現當前研究階段的重要問題,為今后深入研究提供參考。
2 結果
2.1 年度發文趨勢分析
檢索獲得有效文獻共480 篇,文獻年均發文量44 篇。OA 與自噬相關研究發文量從2011 年起穩定且快速增長,2014 增長率最快為120%,2019—2020 年增長最多為37 篇,2021 達到年發文量頂峰108 篇,提示該領域的研究得到快速發展,處于快速上升階段。見圖1。
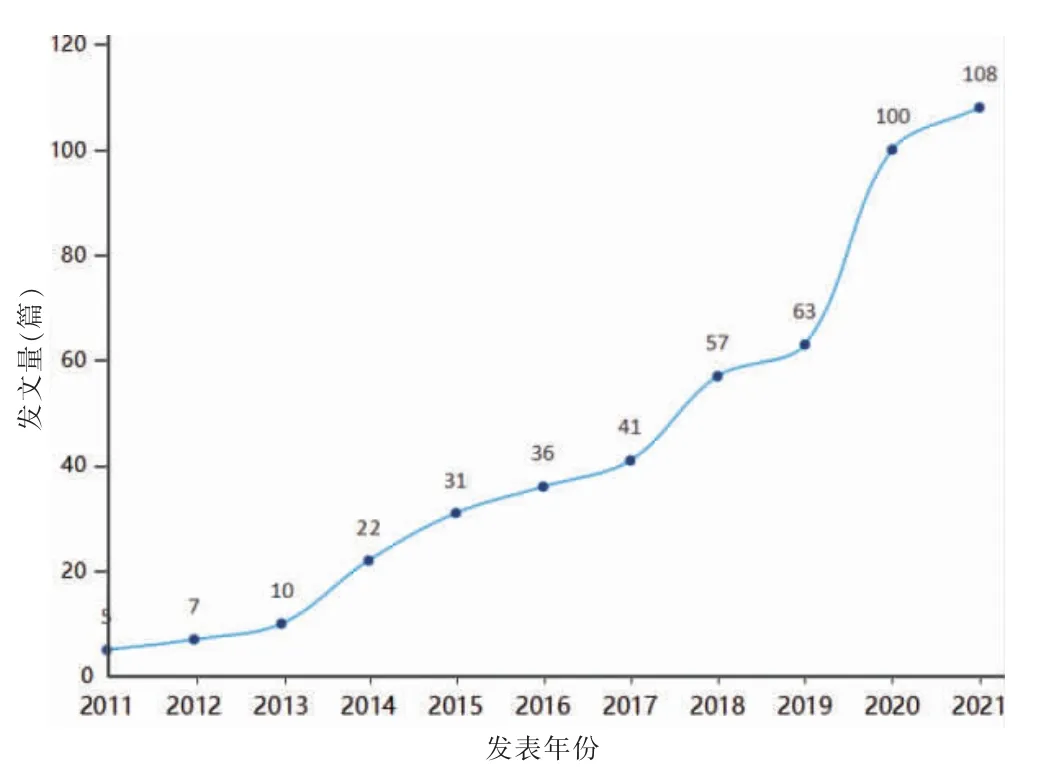
圖1 骨關節炎與自噬相關文獻的年度發文趨勢
2.2 研究國家分析
全球在OA 與自噬研究領域發文量最多的國家是中國(207 篇,43.13%),美國(49 篇,10.21%)和韓國(21 篇,4.38%)位居第二、三位。
2.3 研究機構分析
全球OA 與自噬研究領域發文量前20 位的國家研究機構如圖2 所示,其中斯克里普斯研究所和浙江大學發文量占據前2 位,分別發表13、10 篇,廣西醫科大學、廣西醫科大學第一附屬醫院、華中科技大學、大連醫科大學分別發表7 篇,并列第3 位。
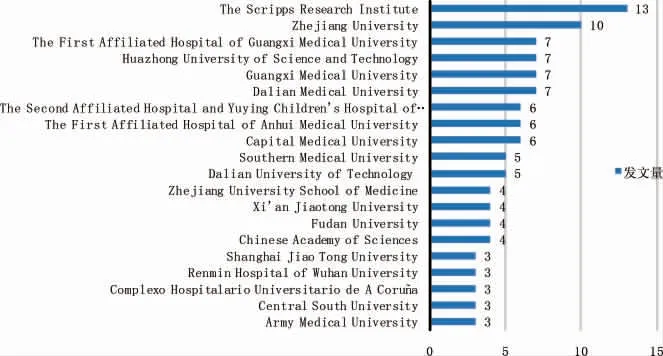
圖2 骨關節炎與自噬的研究機構分析
2.4 作者分析
全球在OA 與自噬研究領域發文量前15 的作者見表1。該領域作者產出文獻數量最多為4 篇,有7 名作者發表4 篇相關文獻,其中有6 名作者所在地為中國,3 名作者研究機構為華中科技大學,3 名作者研究機構為大連醫科大學。
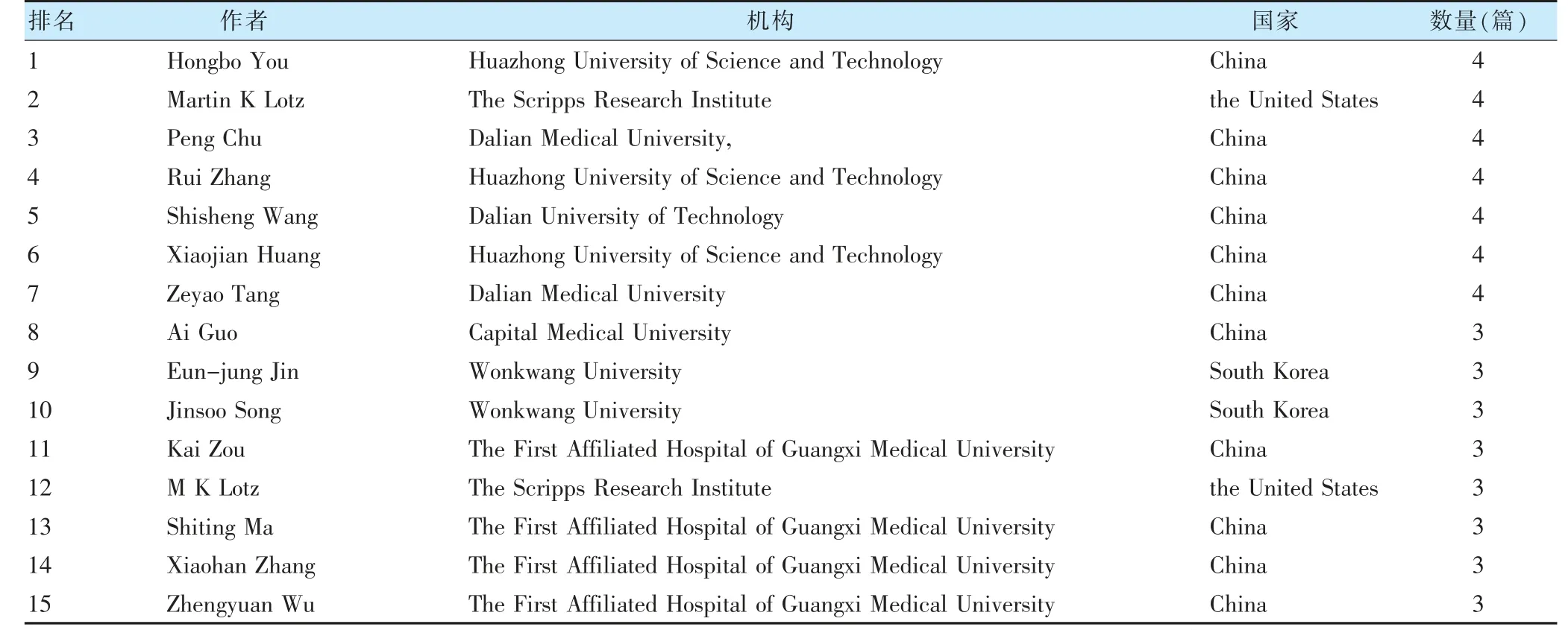
表1 骨關節炎與自噬的研究作者分析
2.5 發文期刊分析
發文量排名前30 的期刊如圖3 所示,其中刊載文獻量最多的期刊是Osteoarthritis Cartilage(24 篇);Autophagy 位居第二,刊載文獻量15 篇;Int J Mol Sci位居第三,刊載文獻量13 篇。

圖3 骨關節炎與自噬的發文期刊分析
2.6 關鍵詞熱點詞頻分析
關鍵詞是文獻研究目的、對象及方法等內容的高度凝練與概括。關鍵詞分析可反映某一研究領域在不同時間段內的主題及熱點的變化趨勢。檢索所得文獻中出現頻次前5 的關鍵詞分別是autophagy、apoptosis、chondrocytes、inflammation、cartilage。見圖4。

圖4 骨關節炎與自噬關鍵詞熱點詞頻
2.7 關鍵詞熱度隨時間變化分析
將2011 年1 月至2021 年12 月,分為4 個時間段,見圖5。表示OA 與自噬相關的關鍵詞詞頻在各個時間段的熱度排名及排名變化情況,圖6 表示2021 年OA 與自噬相關聯的關鍵詞詞頻隨時間推移的熱度排名。
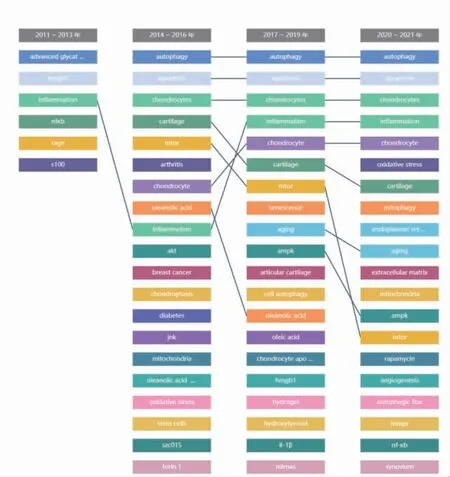
圖5 骨關節炎與自噬關鍵詞不同時間段的熱度排名及排名變化分析
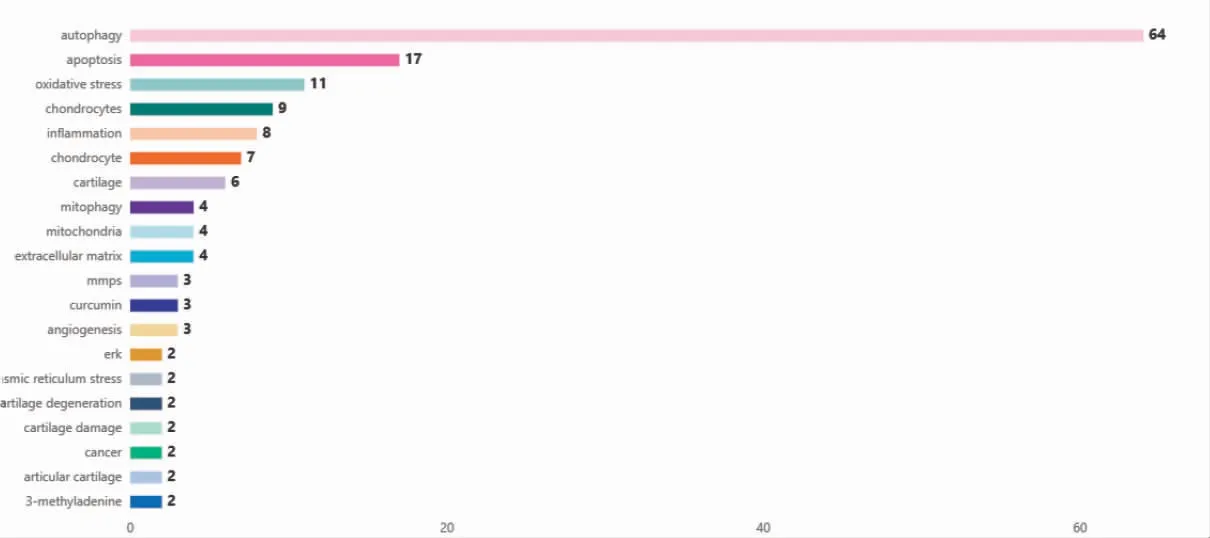
圖6 2021 年骨關節炎與自噬相關聯的關鍵詞熱度排名
2.8 關聯基因分析
對檢索所得文獻作關聯基因分析,其中文獻量最多的MTOR(143 篇);MAP1LC3A 位居第二,文獻量為116 篇;BECN1 位居第三,文獻量116 篇。見圖7。
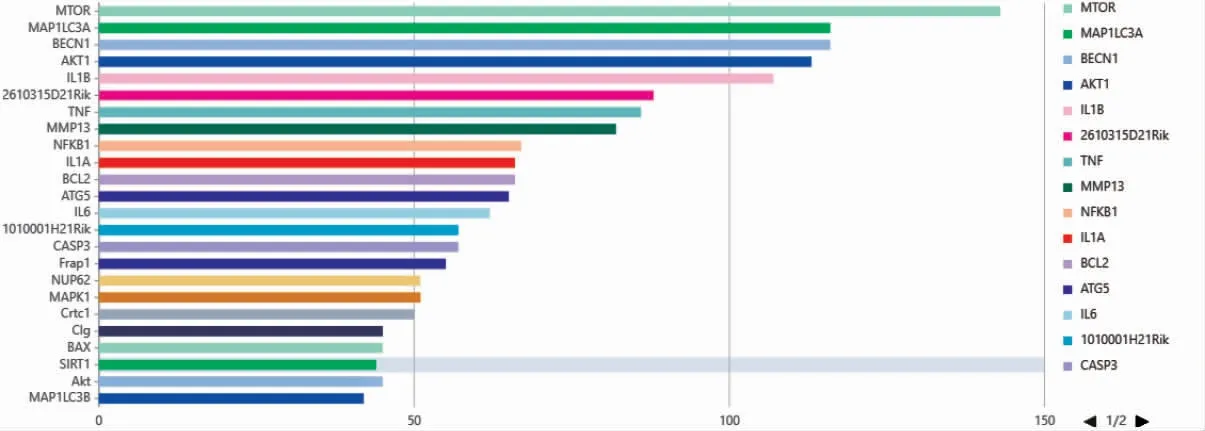
圖7 骨關節炎與自噬關聯基因分析
2.9 人工智能推薦文獻
根據檢索關鍵詞Osteoarthritis/OA 與autophagy,綜合文獻被引用數、發表時間、年份、影響因子等條件,獲得推薦文獻15 篇,其中近5 年文獻為11 篇,本文按照影響因子分數由高到低將其列出。見表2。

表2 骨關節炎與自噬相關的人工智能推薦文獻
3 討論
OA 作為全世界最常見的關節疾病之一,是老年人殘疾的主要原因,社會經濟負擔也因其不斷加重。隨著老齡化社會的到來,OA 已成為全世界亟須解決的公共衛生問題和社會問題[5]。而自噬作為一種高度保守的降解系統,在調節能量和營養、維持機體能量代謝方面發揮著至關重要的作用[6]。近年來,自噬在OA中的研究備受關注。已有研究證實,自噬可在一定程度上恢復受損軟骨細胞的功能,減緩OA 的發生進展[2]。本研究通過文獻計量學方法對OA 與自噬相關文獻進行數據挖掘和分析,并進行可視化,從整體上系統揭示OA 與自噬領域的研究概況,對今后該領域的研究具有一定參考意義。
從年度發文趨勢分析得知,OA 與自噬相關研究穩定且持續增長,近2 年發文量大幅度上升,2021 年發文量達108 篇,提示OA 與自噬研究仍處于上升階段,且自噬在OA 中的作用越來越受到全球范圍內學者的重視。根據作者、機構、國家、期刊可視化分析,可得知研究現狀的總體概況。
在關鍵詞詞頻及熱度分析中得知,“inflammation(炎癥)”一詞貫穿四個時間階段始終,提示學者們改變了早期將OA 定義為“非炎癥性”“磨損性”疾病的觀念,普遍認可OA 是一種“炎癥性”疾病。研究也證實在影像學觀察到關節的顯著變化之前,甚至在軟骨發生變性之前,關節內便存在炎癥[7]。除此之外,第一階段關鍵詞未在其他階段發現,表明第一階段研究處于起步階段;之后在各個階段中,穩定出現“autophagy(自噬)”“apoptosis(凋亡)”“chondrocytes(軟骨細胞)”“inflammation(炎癥)”“cartilage(軟骨)”“mtor(哺乳動物雷帕霉素靶蛋白)”等關鍵詞,提示第二階段至目前研究方向相對穩定;第三階段開始出現“aging(衰老)”“ampk”等關鍵詞;第二、三階段關鍵詞熱點“oleanolic acid(齊墩果酸)”在第四階段中消失不見;齊墩果酸是從龍膽科植物青葉膽全草或女貞子的果實中分離提取的一種五環三萜類化合物,具有抗氧化、抗炎和抗凋亡等作用[8]。有學者認為齊墩果酸對關節軟骨具有保護作用,但具體作用機制仍不清楚[9];第四階段中“Oxidative Stress(氧化應激)”“mitophagy(線粒體自噬)”“endoplasmic reticulum(內質網)”“extracellular matrix(細胞外基質)”“mitochondrion(線粒體)”“rapamycin(雷帕霉素)”“angiogenesis(血管生成)”“autophagic flux(自噬潮)”等成為新的研究方向。在2021 年關鍵詞熱度排名中,除常見關鍵詞外,氧化應激(oxidative stress,OS)排名第三位,儼然成為新的研究熱點。OS 會誘導OA 軟骨中端粒基因組的不穩定性和軟骨細胞功能障礙,這可能導致軟骨細胞衰老和軟骨老化[10]。研究顯示,OS 會導致細胞內的大分子和細胞器功能失調[11];而OS 所導致的軟骨與骨代謝異常,不僅加劇軟骨細胞和成骨細胞的退化,還在一定程度上抑制關節的整體修復能力[12];提示OS 的過度產生可能是OA重要發病原因。靶向復雜的OS 信號通路可能為OA的治療提供新的治療方式[13],這可能是今后研究的熱點原因之一。
在OA 與自噬關聯基因分析中,MTOR、MAP1LC3A、BECN1 是關聯性最高的基因。MTOR 作為自噬的主要負調控因子,在自噬過程中起到關鍵作用[14]。MTOR隨著OA 進展不斷上調,抑制關節軟骨中自噬相關信號通路,使自噬對軟骨的保護作用減弱,最終導致軟骨進一步退變[15]。研究也發現[16],在缺失MTOR 的OA小鼠模型中,自噬水平升高,而凋亡水平降低。MAP1LC3A又稱LC3,是第一個定位到自噬體膜的哺乳動物蛋白,在自噬體的形成中起到關鍵作用[17]。BECN1 又名Beclin 1,是一種調節自噬的基因。自噬始于ULK(自噬相關蛋白1 同源物)對Beclin 1 的磷酸化,這將激活VPS34(磷脂酰肌醇-3 激酶)在細胞膜上生成PI3P(磷脂酰肌醇3,4,5-三磷酸),然后進一步形成吞噬體;同時,Beclin 1 磷酸化下游的兩個泛素樣系統開始運行,其中包括LC3、ATG5 復合物與吞噬體膜上的PI3P 偶聯[18]。而在哺乳動物中,LC3 轉化為其磷脂酰乙醇胺偶聯和自噬體膜相關形式是自噬的起始步驟[19-20]。因此,MAP1LC3A 及BECN1 均是自噬形成中的關鍵部分,通常被用來做自噬相關標志物[21]。
數據分析平臺在進行文獻分析過程中綜合文獻被引用數、發表時間、年份、影響因子等條件列出OA與自噬推薦文獻,使研究者便于快速、系統回顧進行研讀。miRNA 是一類通過結合其靶信使RNA(mRNA)的3’非翻譯區(UTR)來調控基因表達的小型非編碼RNA,參與自噬的啟動、囊泡成核、囊泡延伸、自噬回收與囊泡融合等的各個階段,成為有效調控OA 進展的關鍵因素之一。而在近5 年推薦的11 篇文獻中,顯示僅有4 篇關于miRNA 調控自噬作用于OA 的研 究,包 括miR-107[22]、miR-375[23]、miR-335-5p[24]、miR-128a[25]。隨著研究的深入,將會發現更多對OA軟骨細胞自噬作用的miRNA。在其余推薦的文獻中,除我們熟知的MTOR 外,還包括FoxO 轉錄因子、轉錄因子EB(transcription foutor EB,TFEB)、自噬抑制劑PHF23 與去乙酰化酶Sirtuin1 等。FoxO 轉錄因子家族在發育、衰老和長壽方面具有重要作用。在哺乳動物中,FoxO 家族的四個成員(FoxO1、FoxO3、FoxO4 和FoxO6)擁有相似而又獨特的功能[26]。FoxO1 不僅在人OA 軟骨細胞中的過表達增加了自噬,減少炎癥介質和軟骨降解酶;而且可協調關鍵細胞應激反應來調節軟骨細胞活力,在軟骨發育、成熟和體內平衡中發揮關鍵作用[27]。TFEB 過表達可減少叔丁基過氧化氫誘導的自噬通量損傷、溶酶體功能障礙,提示TFEB 可能通過調節自噬來治療OA[28]。PHF23 作為一種新的自噬抑制劑,敲除PHF23 可通過促進自噬來保護軟骨細胞,而過表達PHF23 則降低自噬功能[29]。此外,最新研究顯示,人類軟骨細胞中Sirtuin1 表達隨著年齡的增加而減少,可通過與自噬相關基因ATG7 相互作用來調控自噬[30]。這些研究以miRNA、轉錄因子、自噬抑制劑及去乙酰化酶等各方面為切入點,不僅可作為OA潛在的治療靶點,而且可開拓OA 的治療思路。然而,仍需更多高質量的證據及研究以證實真正合適的OA治療靶點。
目前自噬在OA 發病機制中的作用尚未完全明了,但隨著研究不斷深入,將更有利于闡明自噬在OA中的重要作用。自噬作為OA 的治療靶點將具有廣闊的臨床前景,通過miRNA 及轉錄因子等調控自噬為OA 的臨床治療提供了更多選擇,而靶向復雜的OS 信號通路或調節MTOR 可能是治療OA 的有效方式。

