CT影像組學聯合傳統影像特征對胃腸道間質瘤Ki-67指數表達的預測價值
楊采薇,劉曦嬌,魏毅,張鑫,尹曉南,尹源,宋彬
胃腸道間質瘤(gastrointestinal stromal tumor,GIST)是最常見的間葉源性腫瘤,其起源于消化道間質的卡哈爾(Cajal)細胞或起源于具有多分化潛能的卡哈爾細胞的前體細胞(間質干細胞)[1]。GIST可發生于消化道任何部位,發病率約百萬分之十到百萬分之二十[1]。GIST免疫組化檢測通常表達CD117和DOG1陽性[2]。GIST的形成主要是由于編碼酪氨酸激酶受體KIT和血小板衍生生長因子受體α(PDGFRA)的基因發生突變,導致相應的酪氨酸激酶受體成為原癌基因的驅動因素[2]。GIST可能發生遠處轉移,最常見的轉移部位是肝和腹膜。評估GIST的生物學行為有助于患者的輔助治療及對治療方案做出個體化決策[3]。細胞增殖指數,也被稱為Ki-67增殖指數(Ki-67 proliferation index,Ki-67 PI),是指每個細胞群中Ki-67陽性染色細胞的百分比,Ki-67 PI是評估腫瘤異質性和細胞增長的一個重要的免疫組化標志物[4]。
之前的研究表明,CT影像學參數能有效進行Ki-67 PI與GIST風險分層的相關性評估[5],并且CT影像學特征對GIST術后復發風險的預測也具有很高價值[6]。然而,由于肉眼難以正確判斷CT圖像的所有信息,這些定性的影像征象分析可能會受到不同觀察者的影響。影像組學可以將數字圖像轉化為提取分析的高通量客觀數據,來評估腫瘤的病理生理學特征,這在一定程度上解決了腫瘤異質性難以評估和量化的問題[7]。之前研究也表明,影像組學可以應用于評估GIST的生物學行為,包括惡性潛能、有絲分裂計數、預后和基因突變狀態等[8,9]。因此,本研究目的為基于GIST的影像組學特征聯合增強CT征象對術前Ki-67 PI高表達進行無創性預測,挖掘具有診斷價值的影像組學特征和傳統CT征象,以期對臨床精準治療和預后評估提供術前指導。
材料與方法
1.研究對象
回顧性搜集我院2010年9月-2020年9月經手術病理確診的原發性GIST患者的病例資料。病例納入標準:有完整術前4周內的腹部增強CT圖像且圖像滿足影像分析與組學分析的要求;無其他腫瘤病史及腫瘤治療史;病例排除標準:手術標本未進行Ki-67的免疫病理學染色。
2.檢查方法
患者于CT檢查前一天清淡飲食,檢查當天禁食8 h,掃描前40 min~1 h口服溫開水600~1000 mL。采用飛利浦Brilliance 64、西門子Somatom Definition AS+ Somatom Definition Flash行CT檢查。掃描參數:管電壓120 kV,管電流145~200 mA,層厚 2~5 mm,層間距5 mm,視野30~50 cm,矩陣512×512,螺距1.0。患者取仰臥位并雙臂伸直置于頭側,掃描范圍為膈頂至恥骨聯合上緣。先行常規CT平掃,之后行增強掃描。增強掃描采用高壓注射器經肘靜脈團注對比劑碘普羅胺(拜耳先靈,1.0 mL/kg,3.0~4.5 mL/s),分別于注射對比劑后50 s、80 s采集動脈晚期和實質期圖像。
3.傳統影像學征象評估
所有圖像均傳輸至圖像存儲與傳輸系統(PACS),由兩位腹部影像診斷醫師(分別有6年和10年工作經驗)在Syngo Imaging Workplaces工作站(Version VB35A,Siemens AG,Erlangen,Germany)采用盲法獨立分析圖像。分析并記錄相關的影像特征,包括腫瘤大小(腫瘤橫軸面的最大長徑)、邊界、形狀、生長方式(包括外生型、腔內型和混合型)、有無壞死、有無鈣化、有無潰瘍、有無腫瘤內含氣、有無囊變、強化方式(均勻或不均勻)、強化程度、有無增粗的供血或引流靜脈、有無直接侵犯鄰近臟器、有無增大淋巴結、有無系膜脂肪浸潤及有無遠處轉移。強化程度在實質期圖像評估,輕度強化定義為CT值增加小于20 HU,中度強化定義為CT值增加20~40 HU,重度強化定義為CT值增加大于40 HU。當結果不一致時兩位醫生討論達成一致意見。
4.影像組學分析
圖像分割:在醫院PACS 系統中將所有納入患者的實質期CT圖像以DICOM格式導出并導入ITK-Snap 軟件(開源軟件,www.itk-snap.org)進行感興趣區(region of interest,ROI)勾畫,勾畫以手動方式在橫軸面圖像上進行。ROI應包含病灶所有成分,包括壞死、鈣化及血管,避開腸管、氣體及周圍系膜組織,邊緣距離腫瘤邊緣1 mm,勾畫出腫瘤最大層面的單層ROI圖像和腫瘤最大層面及鄰近層面(瘤周區域)的雙層ROI圖像。
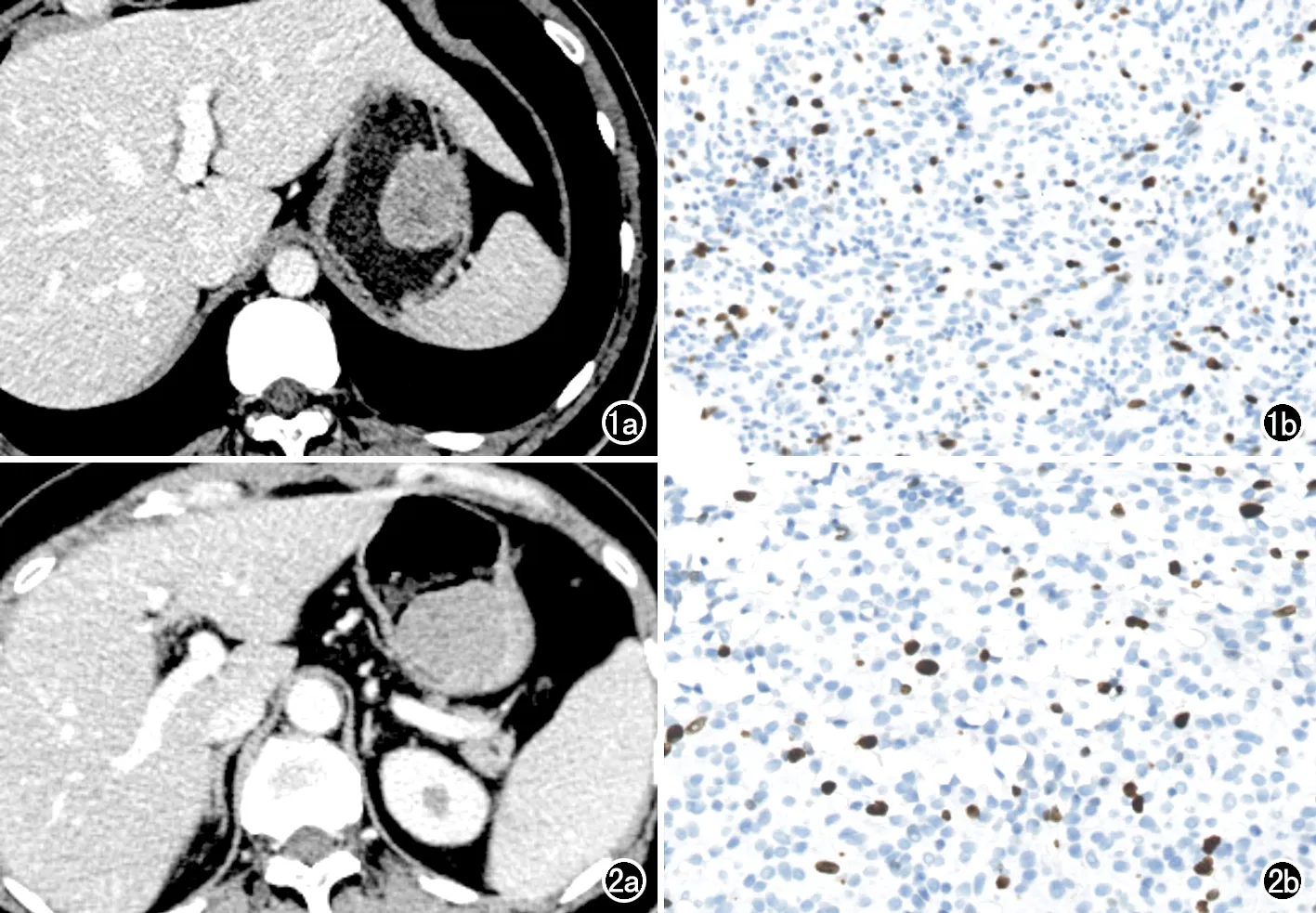
圖1 胃間質瘤患者,男,76歲。a)術前軸面增強CT圖像示胃大彎內生性黏膜下腫瘤,可見少許壞死,可見黏膜下強化、輕度強化及不均勻強化征象;b)術后病理證實為胃間質瘤,Ki-67增殖指數為7%,為高Ki-67表達。 圖2 胃間質瘤患者,男,42歲。a)術前軸面增強CT 圖像示胃底內生性黏膜下腫瘤,呈均勻中度強化;b)術后病理證實為胃間質瘤,Ki-67增殖指數為4%,為低Ki-67表達。
特征提取:將勾畫完成的ROI圖像分別導入IF軟件(GE healthcare)提取病灶特征,提取的組學特征包括Original、Ipris、Wavelets、LBP、PLBP、WILBP、CoLIAGe、Shearlets和Gabors。該軟件在完成離散化步驟的同時自動提取了組學特征參數。隨機篩選出50個腫瘤的ROI中提取的組學參數進行一致性參數評價,用于個體間的比較。在個體內和個體間比較中一致性參數評價值大于0.75的組學參數被納入組學模型的參數篩選中。
數據處理和模型構建:數據分析、模型建立及各模型的評價:選擇70%作為訓練集,30%作為驗證集,按照隨機分層抽樣原理得到分配結果。采用重復分層分割法以減少單一驗證數據集的偏向選擇。采用最適合于高維數據的LASSO算法從主要數據集中選擇最具預測性的組學特征和傳統影像特征。使用所選組學特征和傳統影像特征的線性組合,并以其LASSO系數加權,計算出組學特征和傳統影像特征得分,即Rad-score=a1X1+a2X2+...+ anXn+b。由于特征不滿足正態性,本研究采用Spearman等級相關系數冗余分析。Spearman相關系數顯示值為0.9,也就是說對于所有特征,都進行了兩兩相關的計算。當系數r≥0.9時,系統會隨機刪除一個特征,保留另一個特征。在訓練集中分別計算組學特征和傳統影像特征的得分,利用多變量邏輯回歸,結合組學特征及傳統影像學特征,建立組合模型。在驗證集中評估模型的性能。為了提高性能,考慮到本研究的樣本量有限,對模型進行了10倍的交叉驗證。在正則化L1邏輯回歸中,許多特征得到了效能改善。為了提高綜合模型的性能,在交叉驗證過程中獲得了最佳的λ值。在訓練集中劃分了10個獨立的子隊列,其中8個子隊列用于模型擬合,剩下的子隊列用于驗證集。每個子群都被當作一個驗證隊列,該程序被驗證了10次。重復10次后,每個子組都被視為驗證集。最后,在交叉驗證集中獲得了λ值,并用正則化L1邏輯回歸顯示結果。
5.Ki-67 PI分析
由病理學醫師盲法觀察腫瘤細胞的形態,記錄Ki-67 PI值,以閾值5%將GIST分類為高Ki-67 PI組(Ki-67 PI≥5%)和低Ki-67 PI組(Ki-67 PI<5%)。
6.統計學分析
采用SPSS 24.0軟件進行統計學分析。計量資料以均值±標準差表示,兩組間計量資料的比較采用t檢驗或Wilcoxon秩和檢驗。兩組間定性資料的比較采用卡方檢驗或Fisher確切概率法。將不同Ki-67 PI分組中差異有統計學意義的傳統影像征象、CT組學參數及兩者結合的參數分別進行模型建立,采用logistic回歸分析或多元回歸分析。在訓練集和驗證集中,通過受試者工作特征(receiver operating characteristic,ROC )曲線分析和曲線下面積(area under curve,AUC)評價傳統影像特征、影像組學和組合模型的診斷效能。對模型采用擬合度檢驗來校準ROC曲線,采用臨床預測模型的決策曲線分析(decision curve analysis,DCA)評估其性能。以P<0.05為差異有統計學意義。
結 果
1.臨床資料、病理學結果和傳統影像學征象
本研究最終納入患者305例,其中男162例,女143例,納入患者的平均年齡為(54.29±12.00)歲(年齡范圍21~83歲)。高Ki-67 PI組患者有138例,低Ki-67 PI組患者有167例(圖1、2)。在傳統影像征象中,腫瘤大小、強化方式、壞死、腫瘤內含氣、增粗的供血或引流靜脈、直接侵犯鄰近臟器及系膜脂肪浸潤在高Ki-67 PI組與低Ki-67 PI組間的差異有統計學意義(P值均<0.05)。兩組患者的臨床資料、病理學結果和傳統影像學征象見表1。
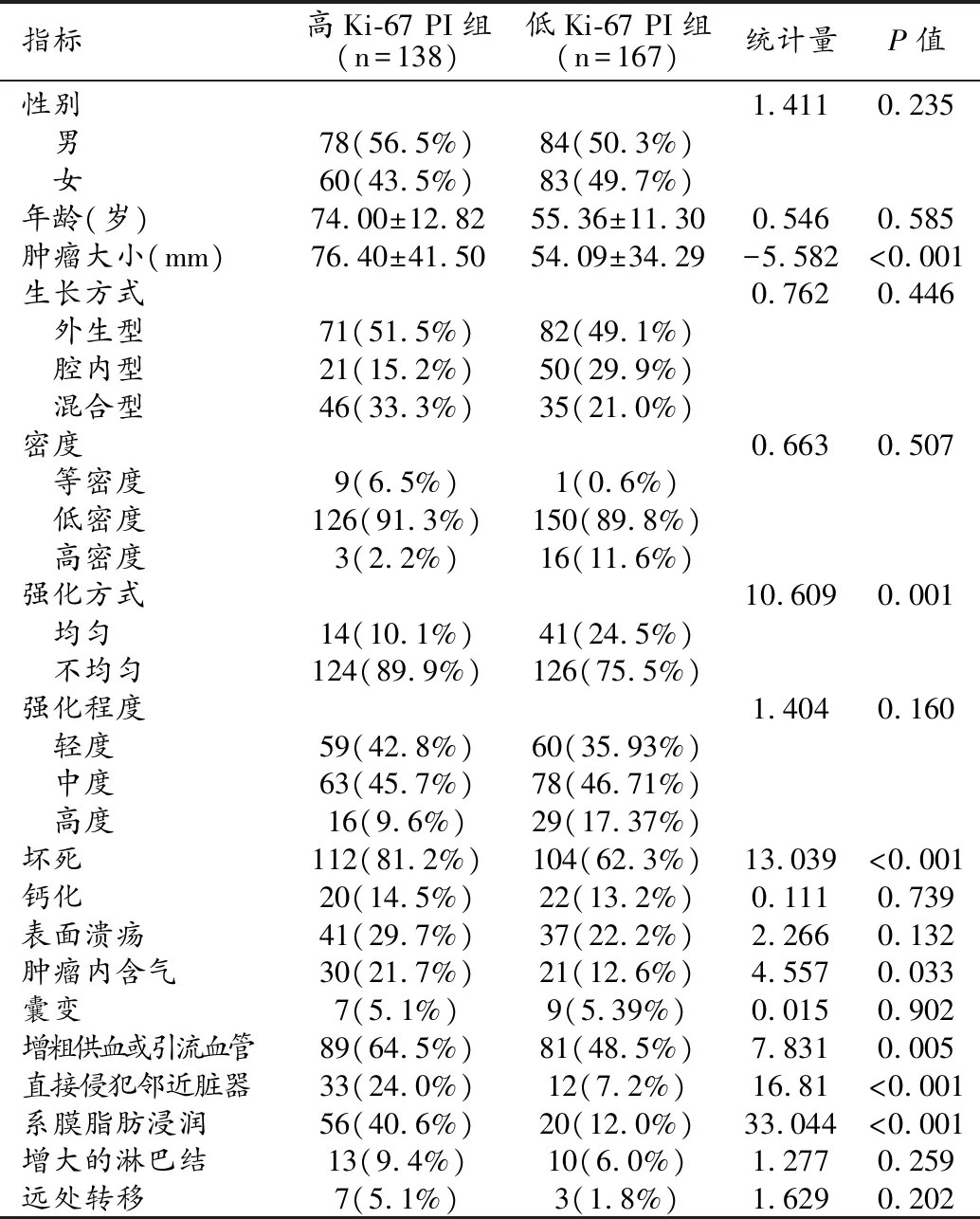
表1 臨床資料和傳統影像學征象比較 (n,%)
2.影像組學結果及各模型的診斷效能
IF軟件共生成5234個原始影像組學特征,通過一致性參數評價檢驗初步篩選出一致性參數大于0.75的892個組學特征,再經過Lasso-logistic回歸(L1正則化),最終篩選出11個影像組學特征,分別為Double_wavelet.LLL_lbp.3D.m2_firstorder_Skewness (cont. var.)、Double_textural_phenotype_level_30.40. (cont.var.)、Single_wavelet.HLH_lbp.3D.k_firstorder_Entropy (cont. var.)、Single_textural_phenotype_level_70.80. (cont. var.)、Double_CoLIAGe2D_WindowSize3_Entropy_firstorder_Minimum (cont.var.)、Double_Normalized_radial_lengths_standard_deviation (cont.var.)、Single_original_glszm_LargeAreaEmphasis (cont.var.)、Single_wavelet.HHL_lbp.3D.m1_firstorder_Median (cont.var.)、Double_CoLIAGe2D_WindowSize9_Difference.Entropy_firstorder_Range (cont.var.)、Single_wavelet.HLH_lbp.3D.m1_firstorder_Median (cont.var.)、Double_wavelet.HHH_lbp.3D.m1_firstorder_Mean (cont. var.);最終建立組學模型(圖3)。
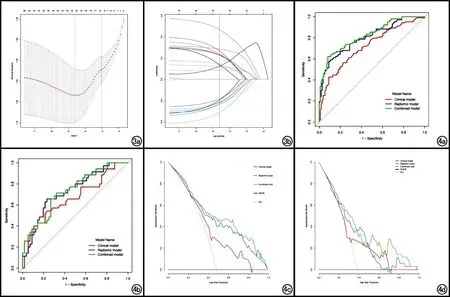
圖3 a)通過最小標準的10倍交叉驗證用于選擇LASSO模型中的調整參數(lambda)。繪制了二項式偏差與對數(lambda)的關系圖,沿X軸上部的數字表示預測因子的數量。在最佳值處用最小標準和最小標準的標準誤畫出點狀垂直線;b)396個影像組學特征的LASSO系數曲線。Y軸是系數的值,下方X軸表示對數(lambda)。上方X軸為非零系數的數目。垂直線畫在使用10倍交叉驗證選擇的值。 圖4 a) 訓練集中,傳統影像模型、組學模型及組合模型的ROC曲線; b) 驗證集中,傳統影像模型、組學模型及組合模型的ROC曲線; c) 訓練集中,傳統影像模型、組學模型及組合模型的DCA曲線; d) 驗證集中傳統影像模型、組學模型及組合模型的DCA曲線。注:Clinical model為傳統影像模;Radiomic model為組學模型;Combined model為多參數組合模型。
在組學模型中,訓練集和驗證集預測GIST Ki-67 PI表達的效能良好,AUC值分別為0.802(95%CI:0.744~0.860)和0.730(95%CI:0.623~0.836),準確度、敏感度和特異度見表2。
對于傳統影像征象,通過單因素差異性分析(Fisher's精確檢驗或Wilcoxon檢驗)、多因素邏輯回歸和Step AIC 逐步邏輯回歸,篩選得出傳統征象中的腫瘤大小、含氣及系膜脂肪浸潤這3個征象,并建立傳統影像模型。在該傳統影像模型中,訓練集和驗證集預測GIST Ki-67 PI表達的診斷效能尚可,AUC值分別為0.720(95%CI:0.651~0.788)及0.665(95%CI:0.547~0.784),準確度、敏感度和特異度見表2。
利用上述篩選出來有統計學意義的傳統影像征象和組學參數建立組合模型。組合模型在訓練集和驗證集預測GIST Ki-67 PI表達的AUC值分別為0.823(95%CI:0.768~0.878)及0.731(95%CI:0.626~0.836),準確度、敏感度、特異度值見表2。
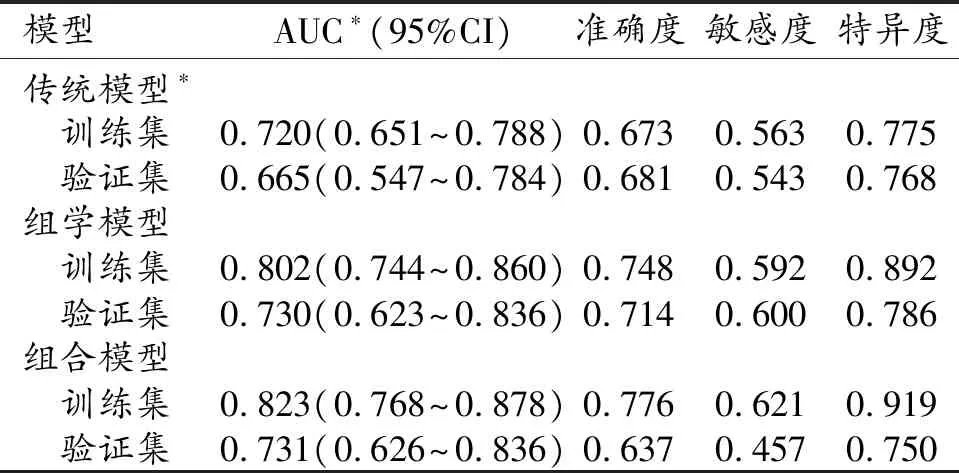
表2 傳統影像征象模型、組學模型及組合模型的診斷效能
在訓練集和驗證集中,傳統影像模型、組學模型及組合模型的ROC曲線和各模型的DCA決策曲線見圖4。組合模型的校準曲線見圖5,結果顯示訓練集和驗證集的預測觀察值與實際觀察值之間具有良好的一致性。
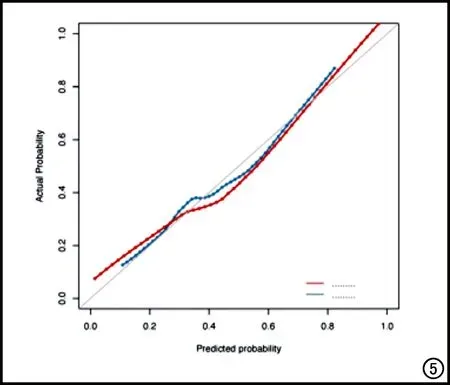
圖5 校準曲線。
討 論
本研究建立并驗證了基于增強CT的影像組學模型來預測GIST的Ki-67 PI表達水平,表明了這是一種有效的臨床決策和侵襲性評估的影像學方法。GIST具有不同的惡性潛能和生物學行為,侵襲性高的GIST具有高復發和轉移率。Ki-67 PI是評估腫瘤異質性和細胞增長的一個重要免疫組化標志物[4]。根據有絲分裂計數,Ki-67核蛋白在G1、S和G2三個期的增殖細胞中高度表達,而在G0期下調,意味著其參與腫瘤細胞增殖、侵襲性和惡性潛能的發生發展[4]。根據以往的研究,Ki-67 PI高表達是GIST侵襲性、惡性潛能和不良生存預后的獨立預測指標。高Ki-67 PI的GIST患者生存時間縮短,分子靶向治療的療效較差[10-13]。此外,Ki-67 PI與GIST的KIT或PDGFRA基因突變明顯相關,這可能有助于基因靶向治療的個體多學科規劃[14]。然而,目前臨床上采取活檢的方式獲得組織標本進行病理學檢測。作為有創檢查,活檢操作存在發生并發癥的風險,如引起腫瘤出血、腫瘤破潰并增加腫瘤播散的危險等[15]。創傷相對較小的超聲內鏡下細針穿刺活檢僅限于超聲內鏡可以達到的消化道管腔范圍內。由于穿刺獲得組織較少,診斷難度常較大,部分需要反復穿刺才能明確診斷。針對部分多發病灶的GIST存在各個病灶間基因突變類型不一致的情況,目前臨床無法實現一一穿刺。因此,術前對GIST的Ki-67 PI的非侵入性預測非常有價值。
相關研究表明,Ki-67 PI的高表達與GIST的惡性潛能顯著相關[13,16,17]。然而,Ki-67 PI在GIST患者的臨床治療中并不是一個明確的預后預測因素,Ki-67 PI的最佳臨界值仍不清楚。在以往的研究中,對于GIST高Ki-67值的臨界值確定說法不一,從2.5%到10%均有采用[13,16,17]。在本研究中,筆者根據以往的研究將 “Ki-67 PI >5%”定義為高Ki-67 PI組。本研究采用5%作為高、低Ki-67值臨界值的原因有兩個:一個是在病理、臨床和預后方面的研究中取得的結果不錯,并且與4%、6%的數值相差不大;第二是本研究的Ki-67值范圍從1%到50%波動,并且中位數的值為5%,因此選擇5%作為臨界值將GIST分為了高Ki-67 PI組和低Ki-67 PI組。以前研究發現[5],傳統形態學CT特征是GIST Ki-67 PI表達水平的預測因素,這與本研究結果一致。本研究多變量回歸分析結果顯示,腫瘤大小、含氣及系膜脂肪浸潤是Ki-67 PI高表達水平的獨立預測因素。然而,這些基于形態學的傳統影像特征可能會受到不同觀察者的影響。影像組學將影像圖像轉換為高通量的數字化數據,這些數據可以反映腫瘤的內在病理生理學。影像組學已被應用于預測各種腫瘤的Ki-67 PI表達水平。Gu等[18]建立了影像組學模型來預測非小細胞肺癌的Ki-67 PI表達水平,并取得了很好的準確度。Ma等[19]發現從動態增強MRI中提取的定量影像組學特征與乳腺癌的Ki-67 PI表達有關。此外,一項研究還建立了預測肝細胞癌Ki-67 PI狀態的影像組學組合模型,該模型具有較高的鑒別能力和良好的校準度[20]。
上述研究表明了影像組學預測Ki-67 PI表達水平的實用性,但目前很少有使用影像組學對GIST的Ki-67 PI狀態進行評估。因此,筆者使用基于增強CT的定量影像組學特征來預測GIST 的Ki-67 PI表達水平,結果表明該影像組學特征建立的組學模型在訓練集和驗證集組中顯示出比傳統影像學模型更高的診斷效能,AUC值分別為0.802和0.730;于是進一步建立一個包含傳統影像特征和影像組學特征的結合模型,在良好的校準下,取得了比傳統影像模型和影像組學模型更高、更穩定的預測效能(在驗證集中的預測性能更穩定),AUC值分別為0.823(95%CI:0.768~0.878)和0.731。上述結果可能證明了影像組學特征在反映腫瘤內異質性方面比臨床傳統形態學的影像分析更有優勢,可能間接表明GIST的細胞增殖狀態。
本研究存在以下局限性:首先,所有的臨床病理和影像學數據都是單中心回顧性的,然而生成的影像組學模型經過內部測試集的驗證,以減少偏差,并取得了令人滿意的性能;其次,與分子靶向藥物的治療效果和進一步預后有關的實驗未開展,我們期待建立一個更全面的預測模型來展開更多的研究。本研究結果需要在未來的研究中使用進一步的前瞻性和多中心研究來提高影像組學的預測性能。
綜上所述,本研究結果表明,基于增強CT的影像組學聯合傳統影像特征建立的組合模型具有無創預測GIST患者Ki-67 PI表達狀態的價值。