基于CPFD方法的燃煤電廠煙氣脫氯模擬研究
李恒凡, 焦世權, 李玉龍, 鄭子潘, 韓中合
(1. 華北電力大學 河北省低碳高效發電技術重點實驗室, 河北保定 071003;2. 華北電力大學 動力工程系, 河北保定 071003)
燃煤電廠煙氣中含有大量的SO2,若直接排放會造成空氣污染、酸雨和動植物破壞等嚴重的環境問題[1]。為了降低SO2的排放,國內大多數電廠都設置了煙氣脫硫裝置,其中石灰石-石膏濕法脫硫因脫硫效率高、原料來源廣泛和價格低廉等優點被國內大部分電廠采用[2],但是濕法煙氣脫硫由于脫硫漿液中Cl-濃縮等問題,需要不定時地外排一定量的脫硫廢水[3]。
脫硫廢水排出量與廢水中的氯離子濃度有關,一般控制氯離子質量濃度為10 000~20 000 mg/m3[4],隨著《水污染防治行動計劃》和《火電廠防污治理技術政策》的頒布實施,我國環保政策日益嚴格,對脫硫廢水排放的要求日益嚴苛。目前,廢水處理主要有化學沉淀-微濾膜法、流化床法、生物處理、混合零價鐵技術、蒸發池、蒸汽濃縮蒸發以及煙道蒸發技術等方法[5-6]。
以上處理技術都是在脫硫后處理廢水,并未從根源上解決廢水產生的問題。廢水產生的實質是Cl-濃度的累積,Takeda等[7]表明,煤中氯元素主要以HCl的形式隨著煤的熱解、燃燒和汽化遷移到煙氣中,煙氣中的HCl被吸收到脫硫漿液中,會抑制石灰石的溶解,脫硫廢水排出時,其中的Cl-隨著廢水排出,造成二次污染。因此,如果在HCl氣體進入到脫硫塔之前將煙氣中的HCl氣體脫除,能夠極大程度地減少濕法煙氣脫硫產生的廢水量,并解決廢水中Cl-的二次污染問題。
目前,一些學者對脫氯效率進行了研究。解海衛等[8]通過數值計算和實驗研究了垃圾發電廠煙氣脫酸系統,分析了不同影響因素對脫酸效率的影響。賈振南等[9]采用計算顆粒流體力學(CPFD)方法分析了脫硫塔壓力溫度和速度等因素對脫酸效率的影響,將模擬結果與實際運行參數進行對比,兩者吻合度較高。但是以上都是以生活垃圾燃燒為對象進行的脫酸研究[10],燃煤反應物與燃燒垃圾的反應物不同,其氯元素含量較低,使得燃煤電廠煙道脫氯與垃圾發電廠脫酸方面存在很大的不同。
筆者從脫硫廢水產生源頭分析,將Ca(OH)2漿液霧化噴射到尾部煙道,與煙氣中HCl進行中和反應,脫除煙氣中HCl。采用CPFD方法建立了脫氯過程中氣液之間的傳熱傳質模型及化學反應模型,以某330 MW鍋爐尾部煙道為研究對象,模擬計算了其中脫氯反應過程,得出煙氣性質、漿液性質和酸性氣體質量濃度對脫氯效率的影響。
1 數值模擬方法
CPFD方法是一種基于MP-PIC(multiphase particle-in-cell)方式的數值方法,非常適合大量顆粒與流體之間的耦合計算問題[11-12],因此筆者選取CPFD方法模擬計算Ca(OH)2漿液霧化液滴與煙氣之間的傳熱傳質及化學反應過程。
1.1 連續相(氣相)控制方程
煙氣在尾部煙道內流動,其控制方程包括連續性方程、動量方程、能量方程和組分方程,各方程的通用形式為:
(1)
式中:ρg為煙氣密度,kg/m3;ug為煙氣速度,m/s;Ψ為通用變量,代表氣體焓、質量分數、速度以及湍動能和耗散率;ΓΨ為輸運系數;SΨ為氣相作用源項及氣相與顆粒間作用源項;xi為空間坐標,i=1、2、3分別表示x、y、z軸。
1.2 離散相(液固)控制方程
建立如圖1所示的Ca(OH)2漿液液滴模型,假設Ca(OH)2顆粒周圍分布著連續的液相[13],即水在顆粒表面形成液膜。Ca(OH)2在溶解極限內向液膜擴散,并與從煙氣中擴散到液膜內的HCl和SO2反應,該反應僅在液膜內發生;與此同時,液膜中水在煙氣內不斷蒸發,使得液相逐漸減少,當漿液液滴中大部分自由水被蒸發后,化學反應終止。
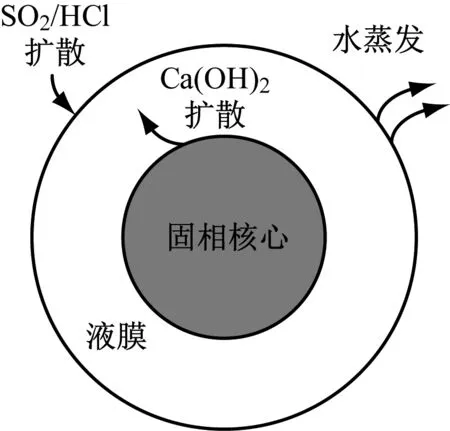
圖1 漿液液滴模型Fig.1 Slurry droplet model
針對脫酸反應過程,其反應速率的計算基于Arrhenius理論,采用非均相反應模型進行計算。計算過程中,在考慮Ca(OH)2漿液與HCl和SO2之間傳熱傳質的基礎上,同時計算漿液中Ca(OH)2的溶解和水分的蒸發,以提高計算精度。
漿液液滴在煙氣中主要受曳力、壓力梯度、顆粒間的法向應力梯度和重力的共同作用,其運動方程為:
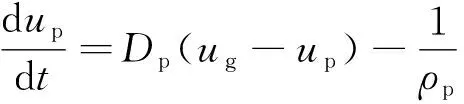
(2)
式中:up為顆粒速度,m/s;ρp為顆粒密度,kg/m3;φp為漿液的體積分數;τp為顆粒法向應力,N;Dp為相間曳力系數;t為時間,s;p為壓力,Pa;g為重力加速度,m/s2。
其中,相間曳力系數Dp為:
(3)
式中:Cd由Wen-Yu模型[14]確定,與雷諾數Re有關;rp為顆粒半徑,m。
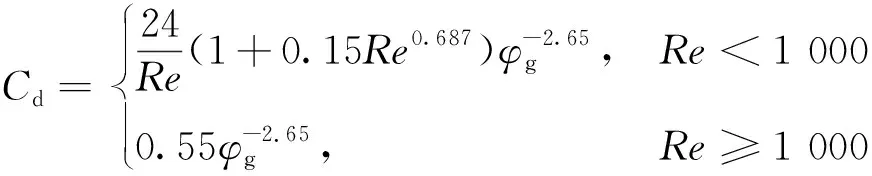
(4)
式中:Re=2ρgrp|ug-up|/μg,其中μg為流體黏度,Pa·s;φg為氣體體積分數。
顆粒間碰撞根據顆粒法向應力模型計算:
(5)
式中:Ps為材料參數;r為模型自有參數,2≤r≤5[14];φcp為粒子團的體積分數;ε為消除模型求解中的奇異點而構造的小量[15];φp為顆粒體積分數。
顆粒與氣體間的對流傳熱系數hp為:
(6)
式中:Rep為顆粒雷諾數,Rep=2ρgugrp/μg;dp為顆粒粒徑,m;λg為氣體導熱系數,W/(m·K);Pr為普朗特數。
針對液滴的蒸發與凝結過程,在計算時將其視為化學反應,陳國慶等[16]建立的化學方程及化學反應速率為:

(7)
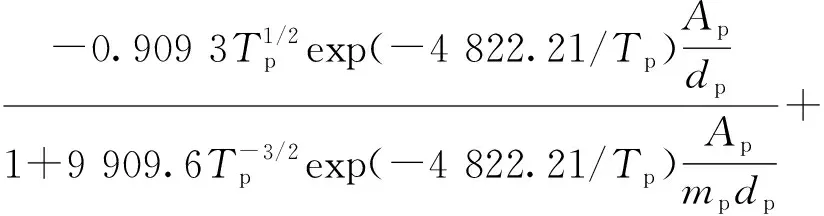
(8)
cp,vap=1.147 91×106-1.112 49×104T+
39.763 7×102T2-6.196 11×10-2T3+
3.557 92×10-5T4,T<647.13 K
(9)
ΔHf,liq=-1.573 8×107J/kg
(10)
式中:revap為水的蒸發速率,kg/(m2·s);cp,vap為水的比熱容,J/(kg·K);Tp為液滴溫度,K;Ap為漿液的表面積,m2;mp為液滴質量,kg;cH2O,bulk為水的濃度,mol/m3;T為煙氣溫度,K;ΔHf,liq為水的汽化潛熱,J/kg。
1.3 脫酸模型
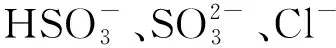
總反應式為:
(11)

(12)
采用Levenspiel[18]給出的關系式得到總的化學反應速率:
(13)
式中:rM為SO2或HCl的化學反應速率,mol/s;kg,M為SO2或HCl的氣相傳質系數,m/s;ρgas為SO2或HCl的質量濃度,kg/m3;ρaq為液相中Ca(OH)2的質量濃度,kg/m3;H為SO2或HCl的亨利數;kl為液相傳質系數,m/s;R為理想氣體常數,J/(mol·K);μ為液相中Ca(OH)2與SO2的擴散系數比,μ=DCa(OH)2,liq/DSO2,liq,其中DCa(OH)2,liq和DSO2,liq分別為Ca(OH)2和SO2在液相中的擴散系數。
2 物理模型及結果驗證
2.1 物理模型
根據某330 MW鍋爐空氣預熱器至除塵器之間的尾部煙道,建立三維模型,如圖2所示。煙道垂直高17.10 m,橫截面為3.82 m×2.30 m的矩形,Ca(OH)2漿液液滴霧化后通過布置在煙道中高4.25 m處的多個噴嘴垂直向上噴入煙道。煙氣入口采用速度入口(Velocity-inlet),出口為壓力出口(Pressure-outlet),其他壁面采用無速度滑移的絕熱壁面(Wall)。采用笛卡爾網格劃分計算區域網格,經網格無關性驗證后,確定總網格數為36萬。
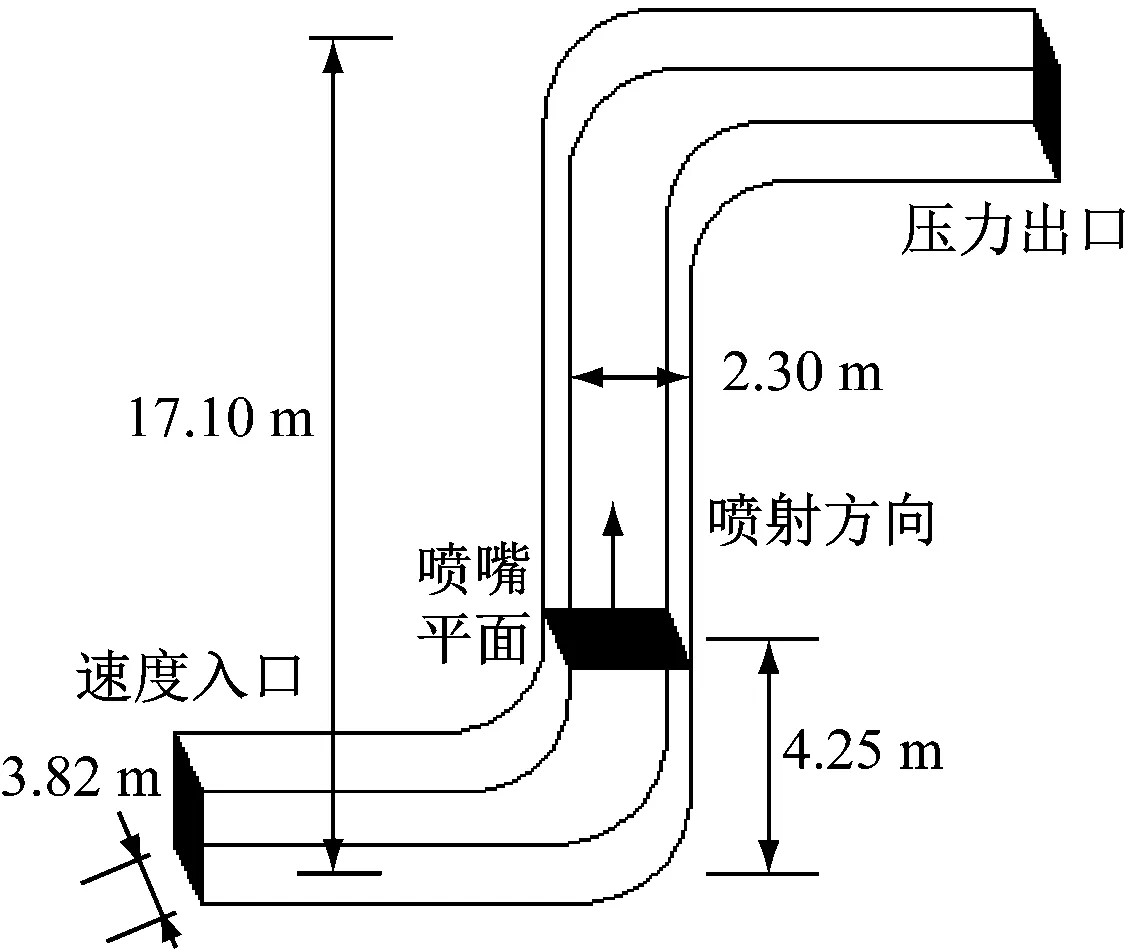
圖2 煙道噴霧模型Fig.2 Spray model in the flue gas
基于上文的化學反應速率方程,編寫液滴蒸發和脫酸程序,并分別嵌入到CPFD軟件中,計算尾部煙道噴入Ca(OH)2漿液的脫氯效果,除特殊聲明以研究相應影響因素的作用外,各參數取值如表1所示。

表1 操作參數Tab.1 Operation parameters
2.2 理論模型驗證
為了驗證所建立的脫酸模型的正確性,根據Hill等[17]搭建的圓柱形半干法噴霧脫硫干燥實驗臺結構(如圖3(a)所示)及測量結果,建立該實驗臺的物理模型并進行模擬計算,得到的脫硫效率模擬值和實驗結果如圖3(b)所示。由圖3(b)可知,模擬值與實驗值的差值較小,最大偏差為4.24%,驗證了所建立脫酸模型的正確性。
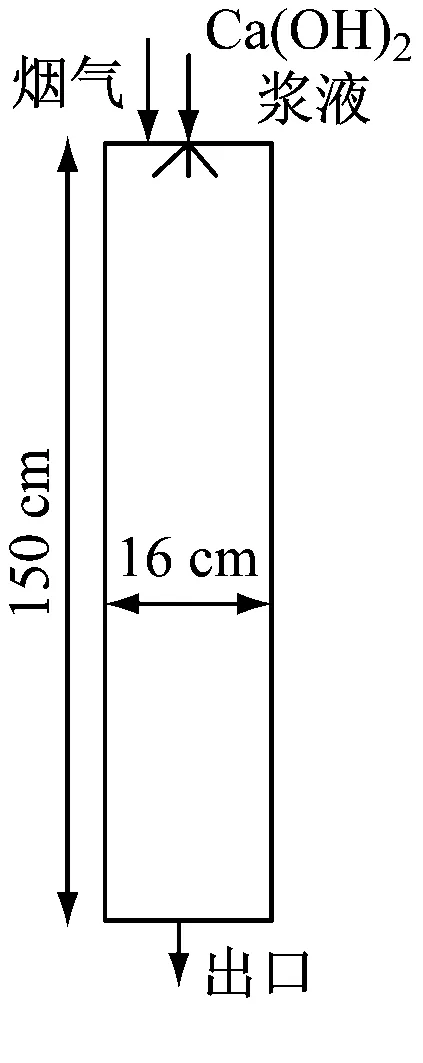
(a) 物理模型
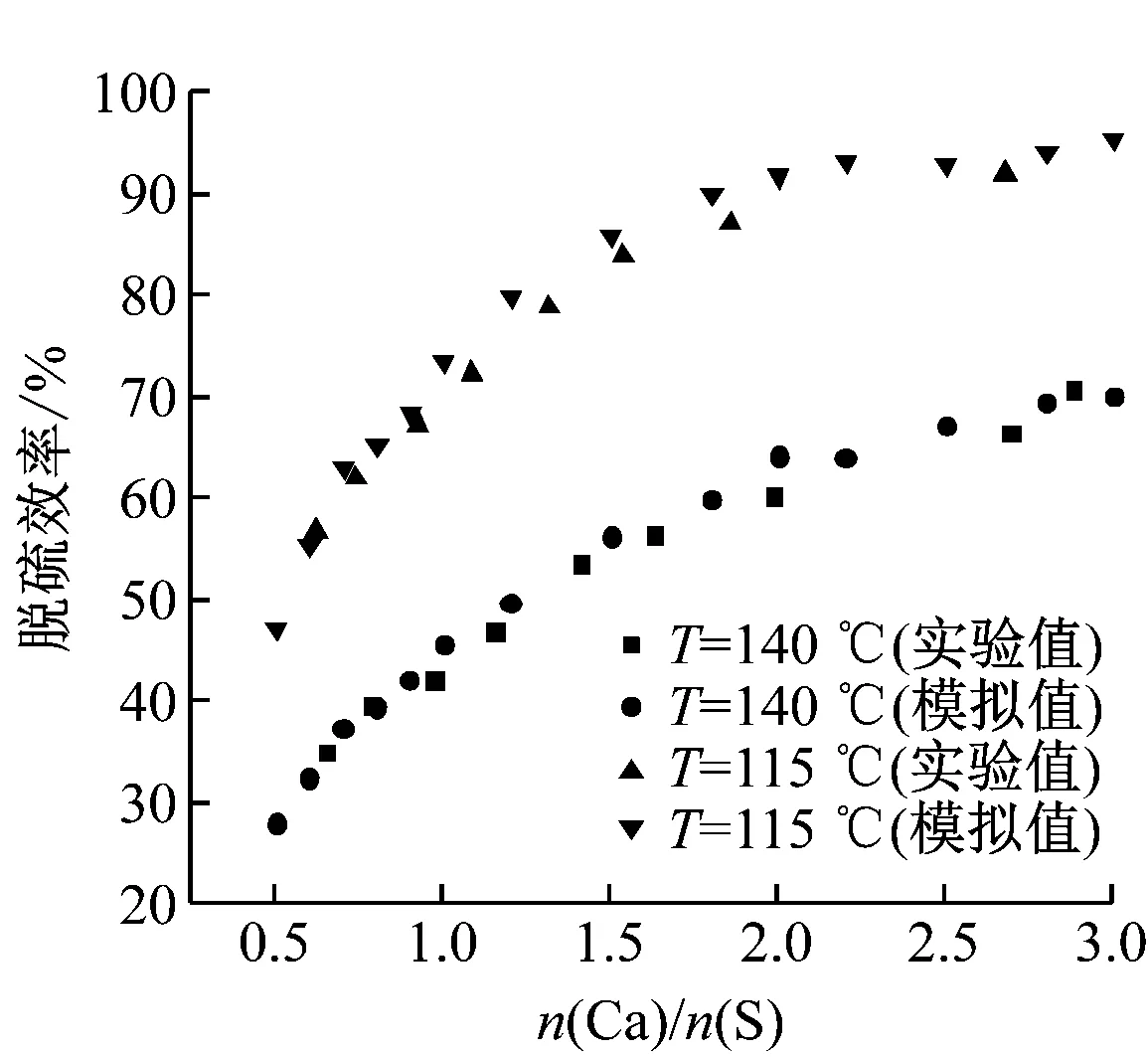
(b) 脫硫效率
3 計算結果及分析
3.1 化學計量比的影響
在操作參數下,當化學計量比SR(即Ca(OH)2漿液中所含Ca2+與煙氣中所含Cl-的物質的量之比)為1~6時,化學計量比對脫氯效率的影響如圖4所示。
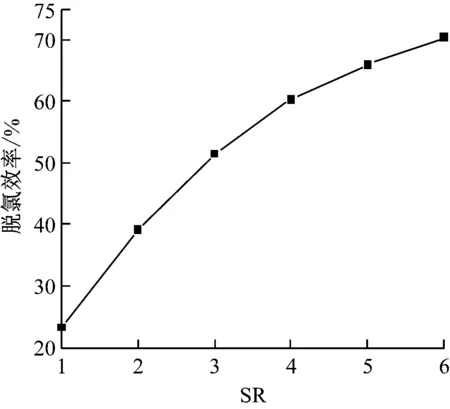
圖4 化學計量比對脫氯效率的影響Fig.4 Effect of calcium chloride ratio on dechlorination efficiency
改變化學計量比使得反應物濃度比發生變化,引起反應速率及脫氯效率的變化。由圖4可知,隨著SR的增加脫氯效率升高,但升高幅度逐漸減小,SR為3與SR為1時相比,脫氯效率由23.91%升高到51.43%,升高了27.52個百分點,而SR為6與SR為4時相比,脫氯效率由59.99%升高到70.19%,僅升高了10.20個百分點。隨著SR的增加,在酸性氣體總量不變的前提下,Ca(OH)2漿液的噴入量逐漸增加,由于漿液中Ca(OH)2質量分數(以下簡稱漿液質量分數)和液滴粒徑不變,使得漿液表面積增大,加快了脫氯反應速率,使反應更加完全,提高了脫氯效率;隨著脫氯反應的不斷進行,煙氣中HCl濃度逐漸降低,其擴散速率進一步下降,導致反應推動力減少,脫氯效率升高幅度減小,脫氯劑的利用率逐漸降低。SR為6時的脫氯效率較SR為4時僅升高了10.2個百分點,但是Ca(OH)2漿液的用量增加了50%,高SR雖然會導致較高的脫氯效率,但是原料的用料及漿液的配制等成本費用也會隨之增加,實際應用中,應考慮綜合成本問題,平衡脫氯效率、Ca(OH)2漿液用量和運行費用,選擇合理的SR,本文中SR為4時較為理想。
3.2 煙氣側的影響
3.2.1 煙氣速度的影響
在操作參數下,當煙氣速度為6~14 m/s時,計算模型的脫氯效率,結果如圖5所示。由圖5可知,煙氣速度相同時,隨著SR的增加,脫氯效率不斷升高,但是脫氯效率的增長比例逐漸減小。相同SR下,隨著煙氣速度的增加,脫氯效果變化不大,最大變化幅度僅在3.65%以內,說明煙氣速度幾乎不影響脫氯效果,這是因為Ca(OH)2漿液與HCl在煙道中的反應時間較短,Ca(OH)2漿液噴入煙道后,迅速與煙氣進行接觸反應,且煙道較長,液滴從噴入到出口處,在不同煙氣速度下均已完成蒸發,并與酸性氣體完全反應。
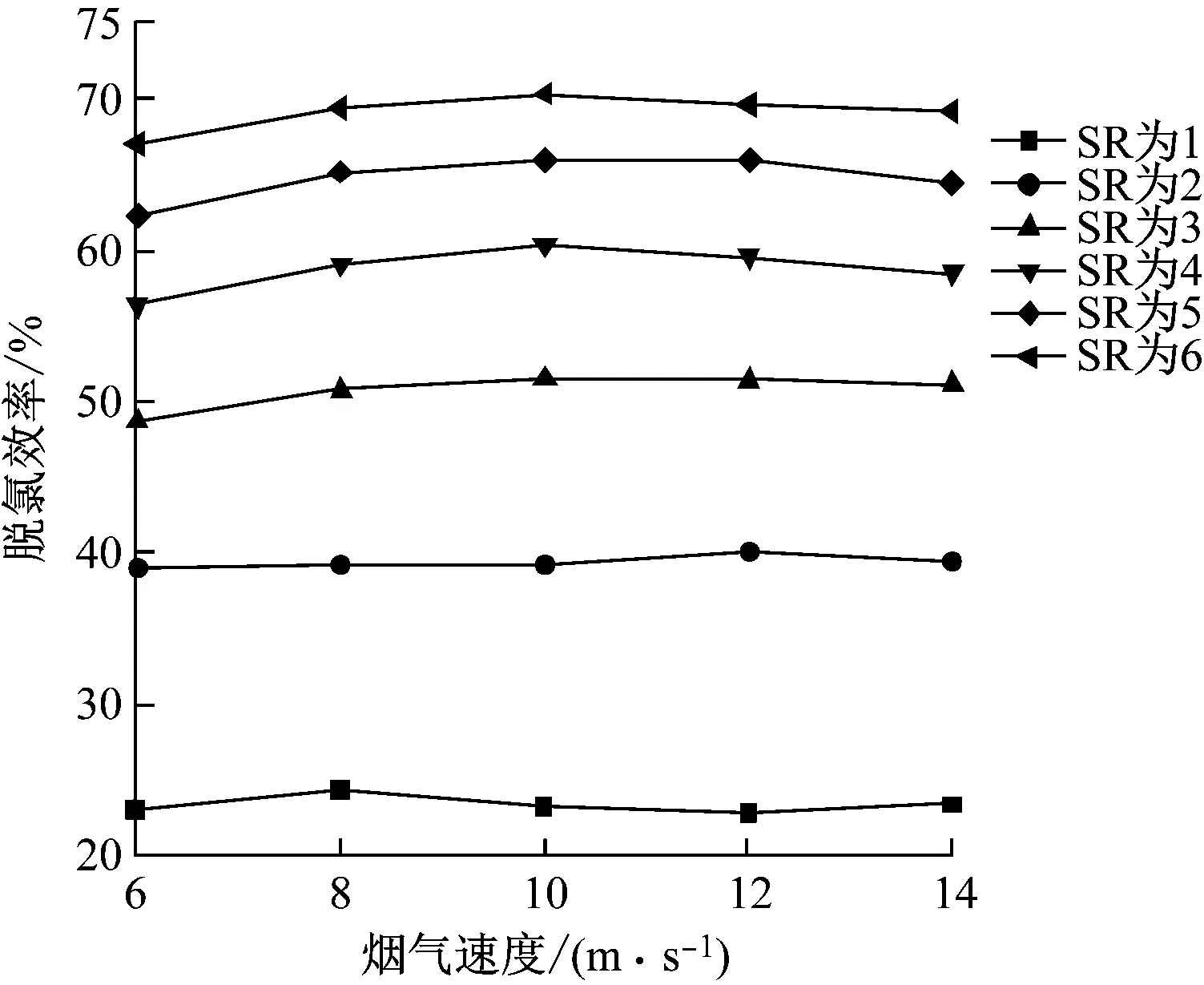
圖5 煙氣速度對脫氯效率的影響Fig.5 Effect of flue gas velocity on dechlorination efficiency
3.2.2 煙氣溫度的影響
在操作參數下,當煙氣溫度為383.15~433.15 K時,計算模型的脫氯效率,結果如圖6所示。由圖6可知,同一煙氣溫度下,隨著SR的增加,脫氯效率逐漸升高且升高幅度逐漸減小。相同SR時,煙氣溫度越高,脫氯效率越低,當SR為3時,煙氣溫度為383.15 K相對煙氣溫度為403.15 K時,脫氯效率由63.15%下降到56.51%,降低了約6.64個百分點;煙氣溫度為413.15 K相比煙氣溫度為433.15 K時,脫氯效率由51.43%下降到42.44%,降低了約8.99個百分點。煙氣溫度升高一方面使得煙氣與漿液之間的對流傳熱增強,加速了漿液內水分的蒸發速率,水分的減少使得酸性氣體與堿性漿液的反應時間減少,從而降低了脫氯效率;另一方面,煙氣溫度升高使得液膜溫度升高,增加了各離子在其中的擴散速度,進而提高脫氯效率。根據模擬結果可以看出,前者的作用明顯大于后者,使得脫氯效率隨煙氣溫度升高而降低。
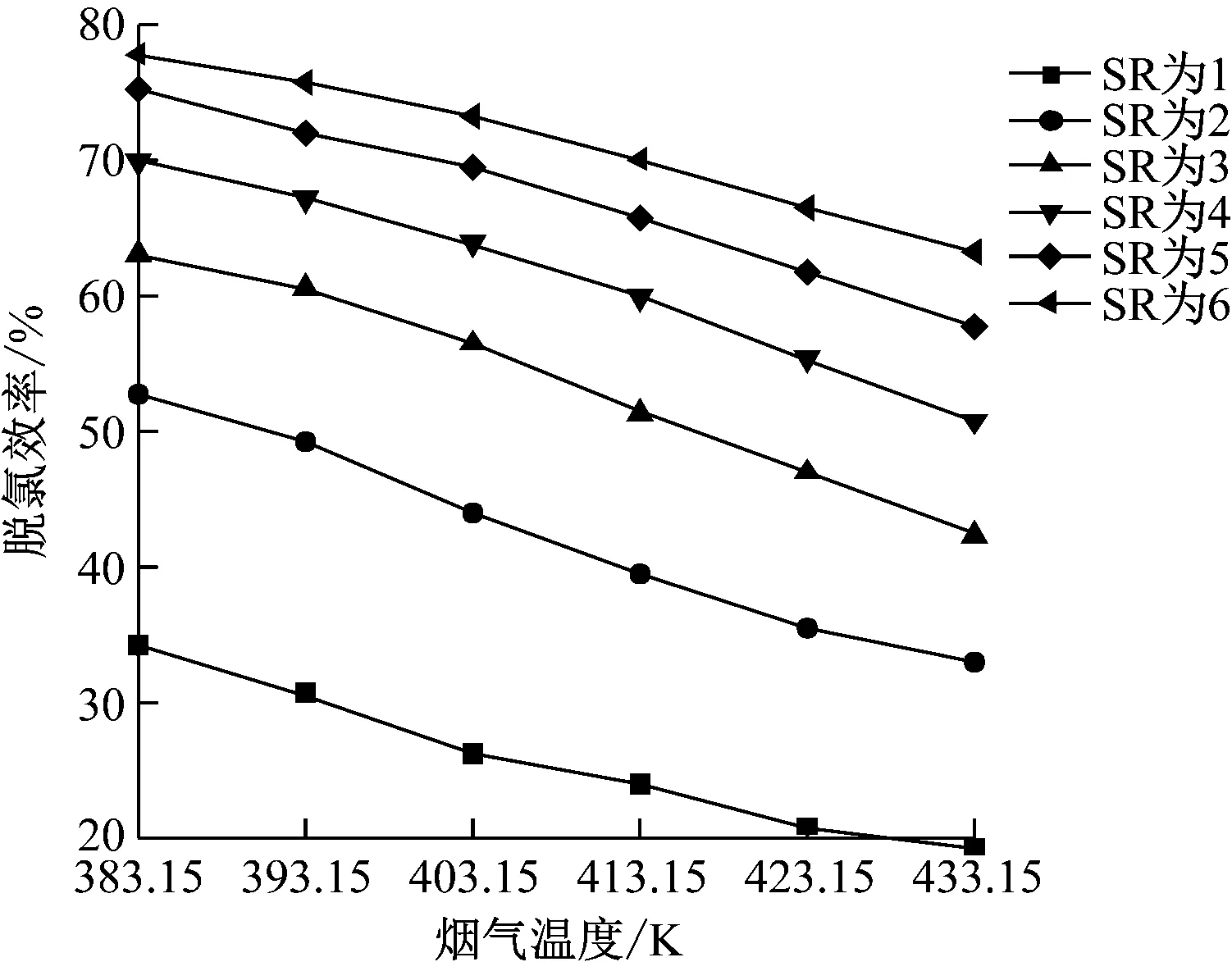
圖6 煙氣溫度對脫氯效率的影響Fig.6 Effect of flue gas temperature on dechlorination efficiency
3.3 液滴側的影響
3.3.1 液滴溫度的影響
在操作參數下,當液滴溫度為303.15~343.15 K時,計算模型的脫氯效率,結果如圖7所示。由圖7可知,液滴溫度對HCl氣體與Ca(OH)2漿液液滴之間的反應基本沒有影響,相同SR時,脫氯效率的最大變化在1.1%以內。這是因為液滴與周圍相同溫度的煙氣進行換熱,液滴吸收熱量,其溫度逐漸升高直至沸騰;而液滴的粒徑很小,升溫階段很短,使得由于液滴初溫差異引起的升溫階段的時間很短,從而對脫氯反應的影響較小。
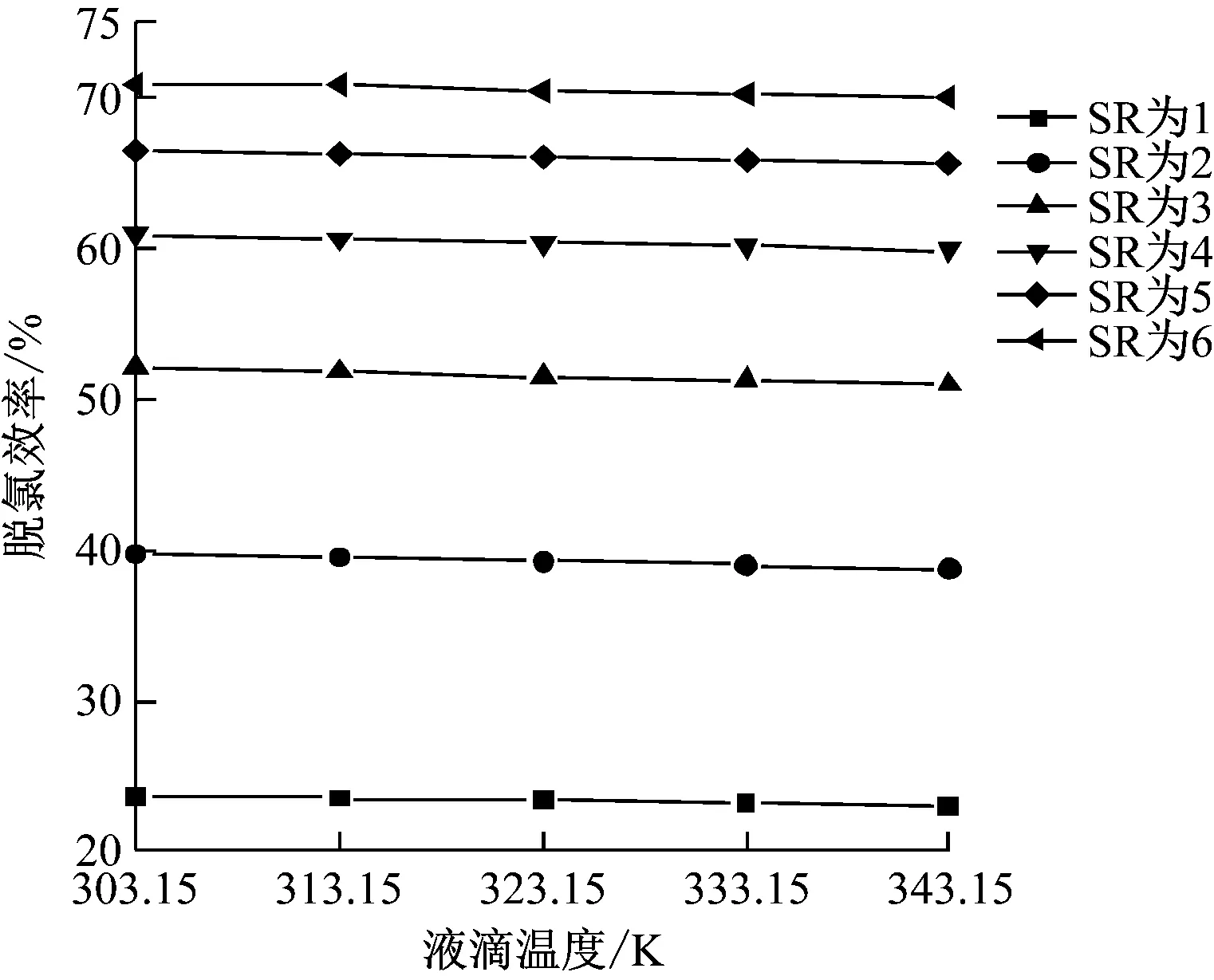
圖7 液滴溫度對脫氯效率的影響Fig.7 Effect of droplet temperature on dechlorination efficiency
3.3.2 液滴平均粒徑的影響
在操作參數下,當漿液液滴平均粒徑(以下簡稱液滴粒徑)為20~140 μm時,計算模型的脫氯效率,結果如圖8所示。由圖8可知,同一液滴粒徑下,脫氯效率隨著SR的增加而升高,當SR大于3時,脫氯效率增長趨勢減緩,不同液滴粒徑下的脫氯效率變化趨勢幾乎相似。相同SR時,脫氯效率隨著液滴粒徑的增大先升高后降低,當液滴粒徑為80 μm時,脫氯效率最高。當SR為3時,液滴粒徑為20 μm相比液滴粒徑為80 μm,脫氯效率由29.90%升高到51.43%,上升了21.53個百分點;液滴粒徑為80 μm相比液滴粒徑為140 μm,脫氯效率由51.43%下降到43.19%,降低了8.24個百分點。漿液初始粒徑主要通過漿液比表面積和完全蒸發時間2個相互制約因素來影響脫氯效率。當漿液初始粒徑減小時,漿液的比表面積增大,促進了反應的進行,但液滴粒徑減小使得漿液中液相蒸發速率加快,完全蒸發時間縮短,降低了反應速率。因此,漿液比表面積和其完全蒸發時間兩者中誰是主導因素決定了液滴粒徑對脫氯效率的影響。由計算結果可知,當液滴粒徑小于80 μm時,完全蒸發時間占主導,隨著液滴粒徑的增大,完全蒸發時間延長,提高了脫氯效率,而當液滴粒徑大于80 μm后,漿液比表面積占主導地位,隨著液滴粒徑的增大漿液比表面積迅速減小,降低了脫氯效率。綜合以上2種因素,使得當液滴粒徑為80 μm時,脫氯效率最高。
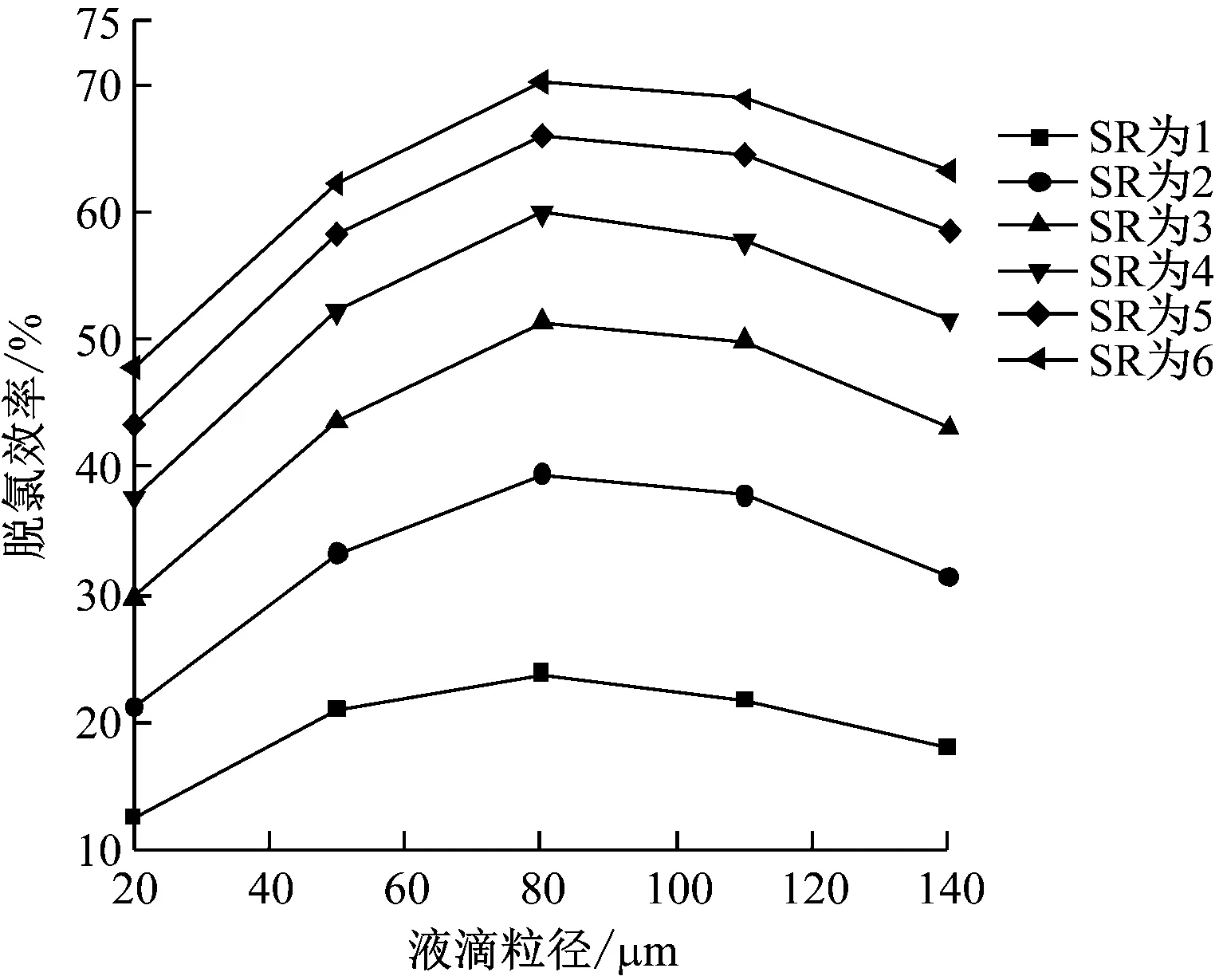
圖8 液滴粒徑對脫氯效率的影響Fig.8 Effect of droplet size on dechlorination efficiency
當液滴粒徑增大后,完全蒸發時間和液滴運動軌跡增長,增大了液滴觸壁的危害。因此在實際應用中,一定要選擇一個合理的液滴粒徑,在不影響尾部煙道穩定運行的前提下,尋求最高的脫氯效率。
3.3.3 漿液質量分數的影響
在操作參數下,當漿液質量分數為3%~20%時,計算模型的脫氯效率,結果如圖9所示。由圖9可知,同一漿液質量分數下,脫氯效率隨著SR的增加而升高,但升高幅度減小,不同漿液質量分數下的脫氯效率變化趨勢幾乎相似。相同SR時,漿液質量分數越大,脫氯效率越低且降低幅度越小,當SR為3時,漿液質量分數為5%相比漿液質量分數為10%,脫氯效率由51.48%下降到35.35%,降低了約16.13個百分點;漿液質量分數為15%相比漿液質量分數為20%,脫氯效率由25.01%下降到19.74%,降低了約5.27個百分點。當漿液質量分數增大時,因為噴入Ca(OH)2總量和液滴粒徑不變,減少了漿液液滴的數目,使得氣液相接觸面積減小,HCl氣體與液膜的傳質面積減小,造成脫氯效率下降;同時,相同SR時,漿液質量分數增大使得噴入水量減小,煙氣溫度升高,水蒸氣的蒸發加速。傳質面積減小、水蒸氣蒸發加快共同促使脫氯效率明顯下降。
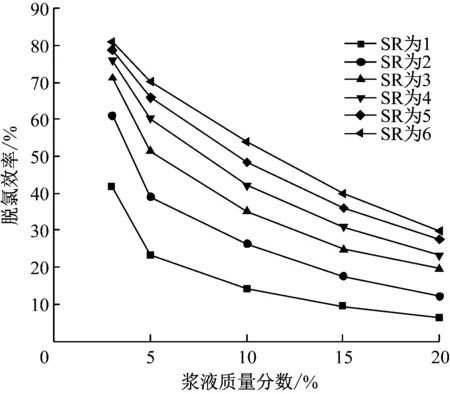
圖9 漿液質量分數對脫氯效率的影響Fig.9 Effect of slurry concentration on dechlorination efficiency
隨著漿液質量分數的減小,為了維持相同SR值,噴入的水量增加,漿液完全蒸發時間和運動軌跡延長,可能產生液滴觸壁等危害。在實際應用時,一定要選擇一個合理的漿液質量分數,確保機組安全運行。
3.4 酸性氣體質量濃度的影響
3.4.1 HCl質量濃度的影響
在操作參數下,當HCl質量濃度為40~100 mg/m3時,計算模型的脫氯效率,結果如圖10所示。由圖10可知,不同HCl質量濃度下脫氯效率隨著SR的增加升高幅度逐漸減小,且變化趨勢一致。相同SR時,隨著HCl質量濃度的增加,脫氯效率逐漸升高,當SR為3時,HCl質量濃度由40 mg/m3提高到70 mg/m3時,脫氯效率由35.75%升高到47.06%。HCl與Ca(OH)2發生中和反應生成H2O和CaCl2,而CaCl2在水中的溶解度很高,根據拉烏爾定律,CaCl2的大量溶解降低了漿液表面水蒸氣的分壓,縮短了漿液液滴蒸發速率。水分的生成、蒸發速率減慢都使得液滴完全蒸發時間延長,增加了反應時間,提高了脫氯效率。
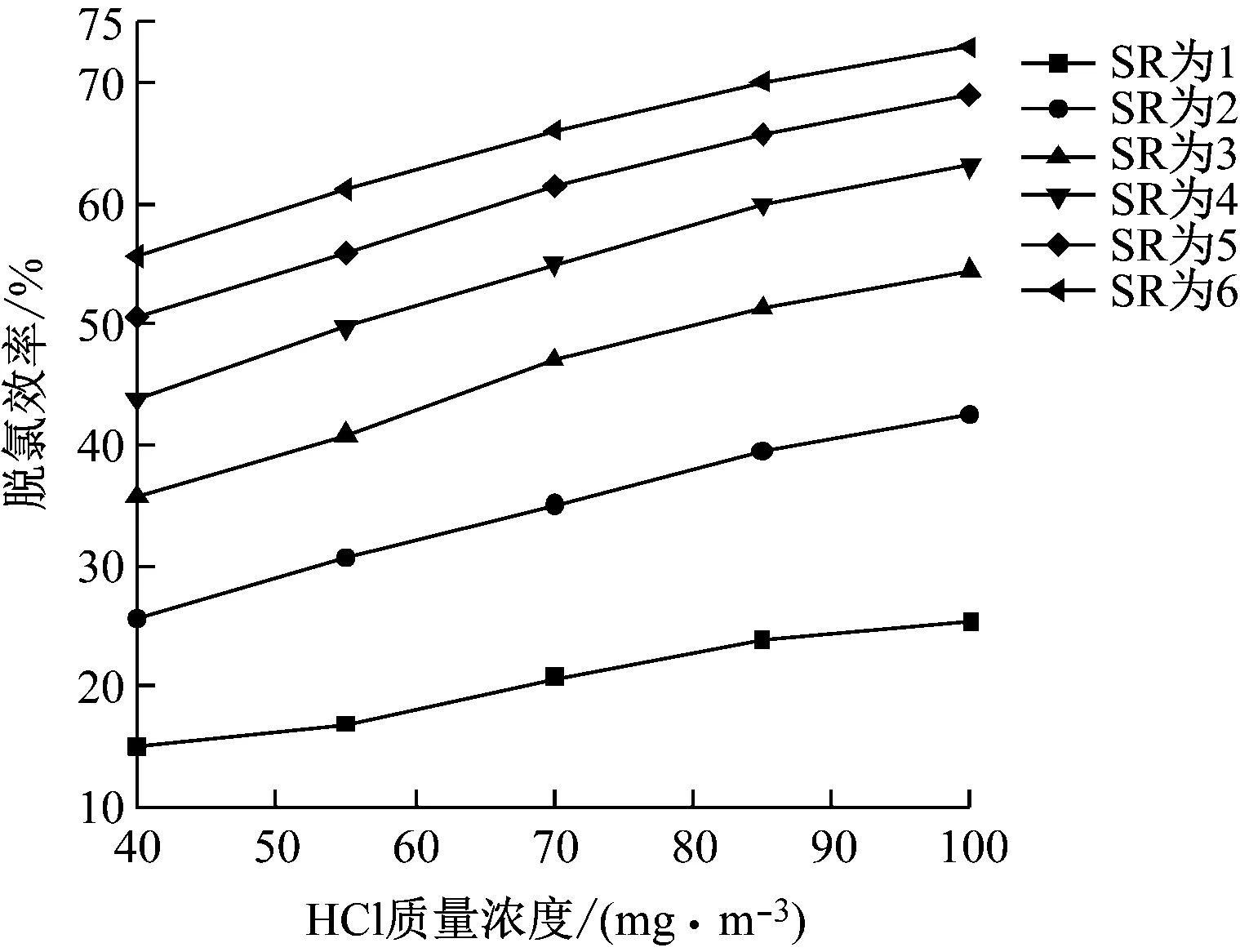
圖10 HCl質量濃度對脫氯效率的影響Fig.10 Effect of HCl concentration on dechlorination efficiency
3.4.2 SO2質量濃度的影響
在操作參數下,當SO2質量濃度為1 500~2 500 mg/m3時,計算模型的脫氯效率,結果如圖11所示。由圖11可知,同一SO2質量濃度下,脫氯效率隨著SR的增加而升高,但升高幅度減小,不同SO2質量濃度下的脫氯效率變化趨勢幾乎相似。相同SR時,不同SO2質量濃度下的脫氯效率幾乎不變,這是因為n(Ca)/n(S)較小,SO2與Ca(OH)2漿液反應較弱,同時HCl的傳質阻力遠遠小于SO2的傳質阻力,HCl相較SO2與Ca(OH)2漿液反應時,具有優先反應的優勢,較低含量下的HCl氣體能夠與堿性漿液全部接觸反應,使得增加SO2質量濃度幾乎不影響脫氯效率。
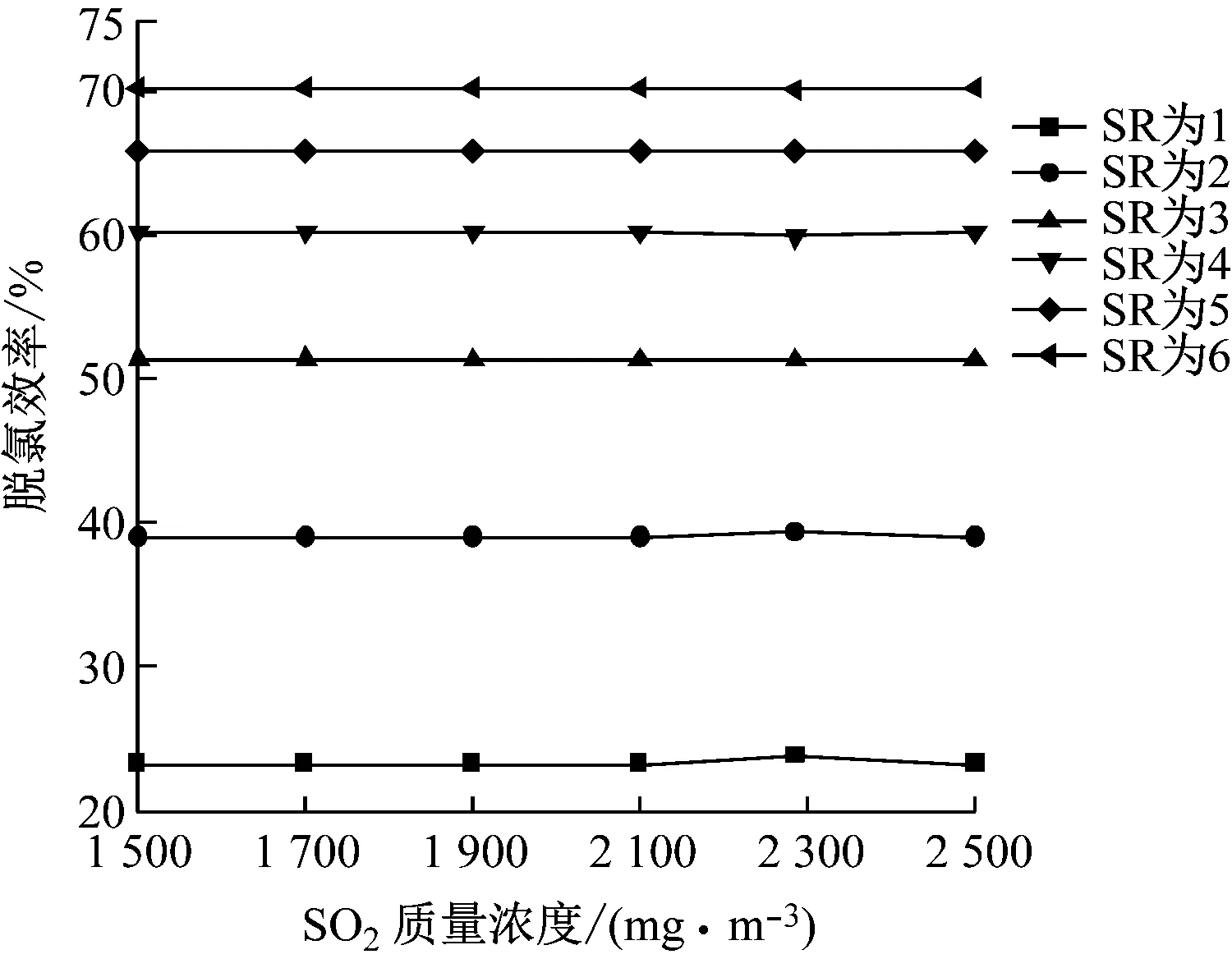
圖11 SO2質量濃度對脫氯效率的影響Fig.11 Effect of SO2 concentration on dechlorination efficiency
4 結 論
(1) 隨著化學計量比的增加,脫氯效率逐漸升高,但升高幅度逐漸減小。因此,必須根據實際情況合理地選擇SR值,以保證脫氯效率,并節約吸收劑用量、降低運行費用。
(2) 相同SR時,煙氣速度、液滴溫度和煙氣中SO2質量濃度對脫氯效率的影響較小,脫氯效率的變化不超過3.65%;煙氣溫度升高、漿液質量分數增大和HCl質量濃度減小都會降低脫氯效率;脫氯效率隨著液滴粒徑的增大先升高后降低,當液滴粒徑為80 μm時,脫氯效率最高。
(3) 液滴粒徑和HCl質量濃度對脫氯效率的影響較大,同時對Ca(OH)2漿液的用量、完全蒸發時間和運動軌跡的影響較大,在實際應用時,必須選擇合理的液滴粒徑和漿液質量分數,使其不會對尾部煙道及后續的除塵器等產生不利影響。

