水稻OsAKT2的鉀吸收功能及其在地上部分K+回流中的潛在作用
黃亞楠,李俊林,蘇彥華
(1 中國科學院南京土壤研究所/土壤與農業可持續發展國家重點實驗室,江蘇南京 210008;2 中國科學院大學,北京 100049;3 山東省蠶業研究所,山東煙臺 264002)
K+是植物生長發育所必需的三大礦質營養元素之一,也是植物體中含量最豐富的無機陽離子,可占植物干重的10%。K+在調節酶活性、蛋白質合成、細胞滲透勢、細胞內電荷平衡以及提高植物對環境脅迫的適應能力等方面有重要作用[1–2]。土壤溶液中的K+濃度在0.01~20 mmol/L波動,而細胞質中的K+濃度維持在50~100 mmol/L范圍內且相對穩定[3]。植物中有大量負責K+吸收和轉運的功能部件,包括高親和的鉀轉運體(在鉀濃度<0.2 mmol/L下起作用)和低親和的鉀離子通道(在鉀濃度>1 mmol/L下起作用),它們決定了植物體內諸多功能和調控特性各異的鉀吸收系統[4]。一般鉀離子通道吸收的K+約占植物總吸鉀量的50%[5],其中Shaker型K+通道被認為是介導植物鉀離子吸收、轉運和細胞內動態平衡最為重要的一類鉀通道[6]。
土壤溶液的K+經植物根表皮和皮層細胞中的鉀離子通道吸收,再通過根中柱鞘和木質部薄壁細胞中的鉀離子通道將K+運輸到植物地上部。葉片保衛細胞作為K+發揮功能的終端,其中的鉀離子通道通過調節K+的吸收和外排來調控氣孔開關[4–7]。在植物的生長發育過程中,K+具有很強的移動性,葉片中多余的K+可沿韌皮部向下回流到根系中,衰老葉片組織中的K+也可重新分配到幼嫩及生長發育較旺盛的組織。植物體內的這種鉀循環可表征地上部鉀營養狀況并調節根系對K+的吸收[8]。耐低鉀型大麥能夠高效地將K+轉運至功能葉,從而使新生葉保持正常的光合作用和代謝活動[9]。煙草葉片的鉀含量是表征煙葉品質的重要指標,由老葉向新葉的K+回流會導致成熟期煙草葉片中K+的流失,從而影響煙葉品質[10]。葉片中K+的分布及含量都會對植物的生理功能產生一定的影響。作為重要的滲透調節物質,K+參與調控氣孔開關過程。保持葉片較高的K+濃度使得保衛細胞可以吸收更多的水分,促進氣孔的開放[11]。另外K+會影響光合作用所需要酶類的活性、ATP合成、葉綠素含量等。缺K+通常會導致植物光合作用效率下降,并影響光合作用產物的轉運[12–13]。但迄今為止,植物地上部K+回流的結構基礎和分子機制還有待進一步深入探索。
鉀離子通道AKT2主要在韌皮部表達,兼具K+吸收和外排活性,但吸收活性占主導地位。韌皮部AKT2介導自上而下的K+運輸,與植物地上部分K+的回流途徑相吻合;而其K+外排活性主要體現在對韌皮部細胞極化狀態(由H+內流引起)的平衡方面,進而協助蔗糖/H+共轉運體將地上部光合同化產物蔗糖經由韌皮部的向下運輸過程[14–16]。擬南芥韌皮部AKT2缺失會降低細胞內鉀離子和蔗糖含量以及膜電位對K+的依賴性,導致植株生長減緩、發育延遲[14–16]。AKT2的表達豐度受到光照和光合同化產物的誘導,這也暗示其可能參與韌皮部蔗糖的運輸[15]。脫落酸處理會增加AKT2的表達豐度,提示AKT2在植物應對干旱脅迫時有重要作用[14]。在鹽脅迫條件下,水稻OsAKT2的缺失會使得植株韌皮部的K+降低,導致自上而下的K+再分配過程受損。此外,OsAKT2還調節K+和蔗糖從老葉到新葉中的轉運,并影響籽粒形成和產量[17]。
通過歸納分析本領域最新研究進展及本課題組前期工作,發現水稻OsAKT2主要定位于地上部韌皮部細胞[18],且主要介導K+的吸收,推測其可能在地上部K+回流和再分配過程中發揮潛在作用。為此,通過蛙卵電生理技術研究了OsAKT2介導K+運輸的功能特征,包括其電流本身特性、鉀濃度依賴性、離子選擇性及對鉀通道抑制劑的響應情況。進一步模擬田間生長環境,利用實時熒光定量PCR試驗測定OsAKT2基因表達的晝夜節律特征及對外界脅迫條件的響應規律。
1 材料與方法
1.1 質粒構建
將水稻OsAKT2(GenBank: JN989970.1)基因經酶切位點SmaI/NotI構建到pCI載體上,用質粒小提試劑盒(Axygen,AP-MN-P-250)提取質粒,并濃縮至 1 μg/μL 待用。
1.2 蛙卵注射與電生理檢測
非洲爪蟾(Xenopuslaevis)冰浴麻醉1 h后,用手術刀在其腹部切開小口取出蛙卵,置于1 mg/mL的膠原酶A中消解1~2 h,挑選出健康飽滿的蛙卵放入 ND96 溶液 (96 mmol/L NaCl、1.8 mmol/L CaCl2、2 mmol/L KCl、1 mmol/L MgCl2、5 mmol/L HEPES,pH7.4)中培養。通過微量注射儀(Nanol 2000,WPI,Sarasota,FL,USA),將 59.8 nL 的 pCIOsAKT2質粒cDNA注射到蛙卵中,等量的無菌水注射到蛙卵中作為陰性對照。在相應的處理條件下,用“注射OsAKT2的蛙卵產生的電流”減去“注射H2O的蛙卵產生的電流”得到“OsAKT2產生的凈電流”,以扣除各離子處理對蛙卵本身的影響。注射后的蛙卵置于19℃的ND96溶液中培養(含50 mg/L慶大霉素),每天更換一次培養液,并及時去除壞死細胞。2~3天后用雙電極電壓鉗放大器(Axoclamp 900A, Foster City, CA, USA)檢測蛙卵細胞電流。在檢測電流時,鉗制電壓為-40 mV,階越電壓為 10 mV,施加的電壓范圍從-160 mV 到+50 mV,刺激間隔為 2 s。基本檢測浴液含有 1.8 mmol/L CaCl2、1 mmol/L MgCl2、5 mmol/L HEPES-NaOH,pH 調整為7.4,KCl和NaCl濃度根據實驗設置進行調整(用于調整溶液中的恒定離子強度)。用pClampfit 10.3(Molecular Devices)初步分析電生理數據。
檢測所用處理溶液如下:
OsAKT2的鉀吸收特征檢測: 0、1、2、5、10、20、50、100 KCl (mmol/L)。
OsAKT2 的離子選擇性檢測: 100 LiCl、100 NaCl、100 RbCl、100 NH4Cl、100 KCl (mmol/L)。
通道抑制劑對OsAKT2的影響檢測: 1 BaCl2、1 CsCl、25 TEACl、50 KCl (mmol/L)。
1.3 水稻生長試驗
以粳稻日本晴 (Oryzasativa.ssp.JaponicNipponbare)為供試水稻材料。水稻幼苗在改良的IRRI溶液中生長,光周期為16 h光照/8 h黑暗,溫度設定為27℃/25℃ (光照/黑暗),光強度為 400 μmol/(m2·s),相對濕度設定為70%。將10天苗齡(從水稻發芽后算起)的水稻幼苗移至不同的處理液中:0 mmol/L K+、1 mmol/L K+、20 mmol/L K+、0 mmol/L NH4+、1 mmol/L NH4+、10 mmol/L NH4+、180 mmol/L sorbitol、15% PEG-6000,分別處理 0、4、8、12、20 和 24 h后收獲植株,用于RNA提取。
其中改良的IRRI營養液配方為:0.5 mmol/L(NH4)2SO4、0.3 mmol/L KH2PO4、0.35 mmol/L K2SO4、1 mmol/L CaCl2·2H2O、1 mmol/L MgSO4·7H2O、0.5 mmol/L Na2SiO3、20 μmol/L NaFeEDTA、20 μmol/L H3BO3、0.32 μmol/L CuSO4·5H2O、9 μmol/L MnCl2·4H2O、0.77 μmol/L ZnSO4·7H2O、0.39 μmol/L Na2MoO4·2H2O、pH調至5.8。不同的銨處理濃度采用(NH4)2SO4調節,其他離子成分保持不變;不同的鉀處理濃度使用KCl調節,并分別用NaH2PO4和Na2SO4取代KH2PO4和K2SO4,其他離子成分保持不變。
1.4 水稻地上部分OsAKT2基因表達豐度的測定
使用總RNA提取試劑(R401-01,南京諾唯贊生物科技有限公司)對收獲后的水稻地上部樣品進行總RNA提取。用反轉錄試劑HiScriptⅢRT-SuperMix for qPCR (+gDNA-wipper,R323-01,南京諾唯贊生物科技有限公司)將1 μg總RNA反轉錄成cDNA。實時熒光定量PCR酶為ChamQ Universal SYBR qPCR Master Mix (Q711-02,南京諾唯贊生物科技有限公司)。引物由南京金斯瑞生物科技有限公司合成。使用熒光定量PCR儀LightCycler 480 (Roche,Switzerland)檢測基因表達情況,反應條件為:95℃(30 s),95℃ (10 s)、60℃ (15 s)、72℃ (15 s),44 個循環。以水稻的看家基因OsActin作為內標,用2–ΔΔCT方法分析目的基因的相對表達量。
1.5 Shaker鉀通道的系統進化樹分析與關鍵位點序列比對
鉀通道序列由NCBI (http://www.ncbi.nlm.nih.gov/)網站下載獲得,利用DNAMAN對這些鉀通道序列進行比對分析,并構建Shaker鉀通道系統發育樹。
1.6 數據處理與分析
使用SPSS 16.0進行統計分析,采用SigmaPlot 12.5繪圖,所示數據為平均值±標準誤SE (n>3)。多重比較采用Duncan法,差異顯著水平為5%。
2 結果與分析
2.1 OsAKT2的氨基酸序列分析
由圖1a可看出,OsAKT2在通道孔區域具有特征性的序列TxxTxGYGD,屬于典型的Shaker型鉀離子通道。根據電壓依賴特征和鉀離子跨膜流動方向,Shaker型K+通道又可劃分為3類:內向鉀離子通道(Kin),主要包括AKT1和KAT1類鉀通道;外向鉀離子通道(Kout),主要包括SKOR和GORK類鉀通道;以及弱整流型鉀離子通道(Kweak),主要是AKT2鉀通道。與內向、外向鉀離子通道不同,弱整流型鉀離子通道AKT2在S4跨膜區上的關鍵氨基酸均為帶正電的賴氨酸K (圖1b),這可能對其整流性有重要作用。系統進化樹的結果顯示,水稻OsAKT2在進化上與單子葉植物玉米的ZMK2的親緣關系最近,大麥HvAKT2次之,與雙子葉植物擬南芥的AtAKT2 (56%)等AKT2家族成員也有較高的相似度(圖1c)。綜上,水稻鉀通道OsAKT2與AKT2的其它家族成員具有較高的同源性,且氨基酸序列在進化上具有保守性。

圖1 不同Shaker型K+通道的關鍵序列比對及系統進化樹分析Fig.1 Sequence alignment and phylogenetic tree analysis of Shaker K+ channels
2.2 OsAKT2的鉀濃度響應
弱整流型擬南芥AtAKT2通道可以同時介導K+的吸收和外排,且電壓依賴性較弱[14,19]。借助雙電極電壓鉗電生理技術,發現水稻OsAKT2主要介導K+的吸收,但是缺少明顯的外排活性(圖2a)。從電流-電壓的關系可看出,當外界鉀離子濃度高于5 mmol/L時,OsAKT2的電流開始顯著增加,而K+濃度達到100 mmol/L時電流基本接近飽和值(圖2b和c),反映了其對外界K+的吸收具有反饋調節機制。在 50 mmol/L K+且膜電位大于–50 mV 時,記錄到明顯的內向電流,且隨著膜電位的降低,電流變得更大(圖2c)。OsAKT2的電流具有濃度依賴性和電壓依賴性。盡管OsAKT2在生物信息學和結構分析上屬于AKT2通道,但是OsAKT2的電流性質與已報道的擬南芥弱整流型AtAKT2明顯不同。
用米氏方程擬合OsAKT2的K+吸收動力學曲線,發現在各個膜電位下,Km值(達到1/2最大吸收速率時的鉀濃度)均大于 43 mmol/L (圖 2c),是一個典型的低親和力鉀離子通道(在大于1 mmol/L K+濃度下介導K+吸收) (圖2d)。在葉片衰老過程中,老葉中的K+要運輸至生長旺盛的葉子、果實及種子中,可能會造成細胞內K+釋放,導致老葉中K+瞬時增加達到10 mmol/L[20],而OsAKT2正是在此濃度范圍下發揮最適作用,揭示OsAKT2可能在地上部分K+回流和分配中有重要作用。
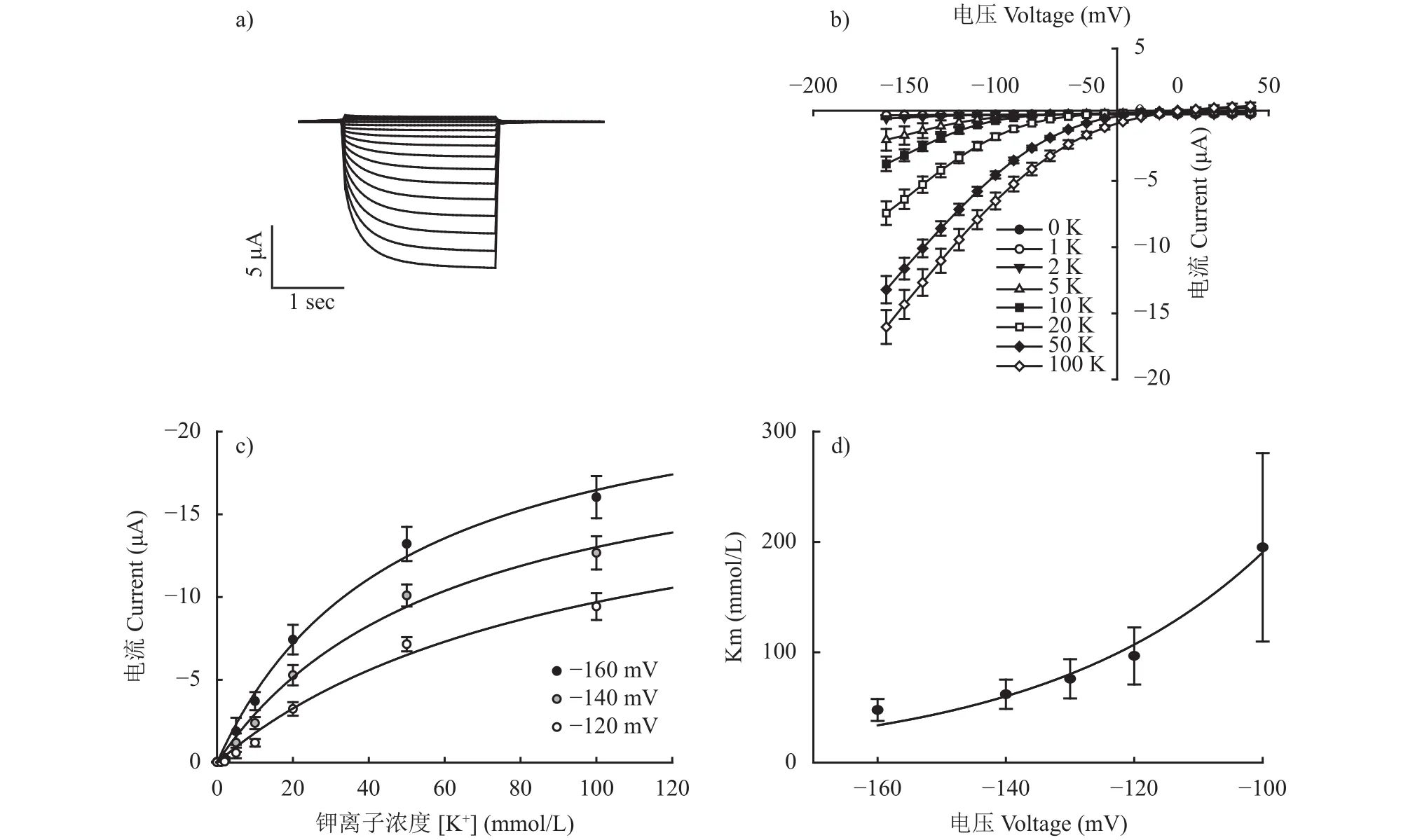
圖2 OsAKT2的鉀吸收特征Fig.2 K+ transport kinetics in OsAKT2 expressing Xenopus oocytes
2.3 OsAKT2的離子選擇性
對比與K+半徑相近的堿金屬陽離子通透性發現,在不同膜電位下,OsAKT2對K+的吸收具有較高的選擇性,基本不能通透Li+和Na+,對Rb+有輕微的通透能力(圖3)。OsAKT2對NH4+有很大的通透性,約占K+吸收量的22%左右(以OsAKT2對K+的吸收量為標準,100%),推測OsAKT2可能參與體內NH4+的再分配,在緩解體內NH4+毒害方面有一定作用。
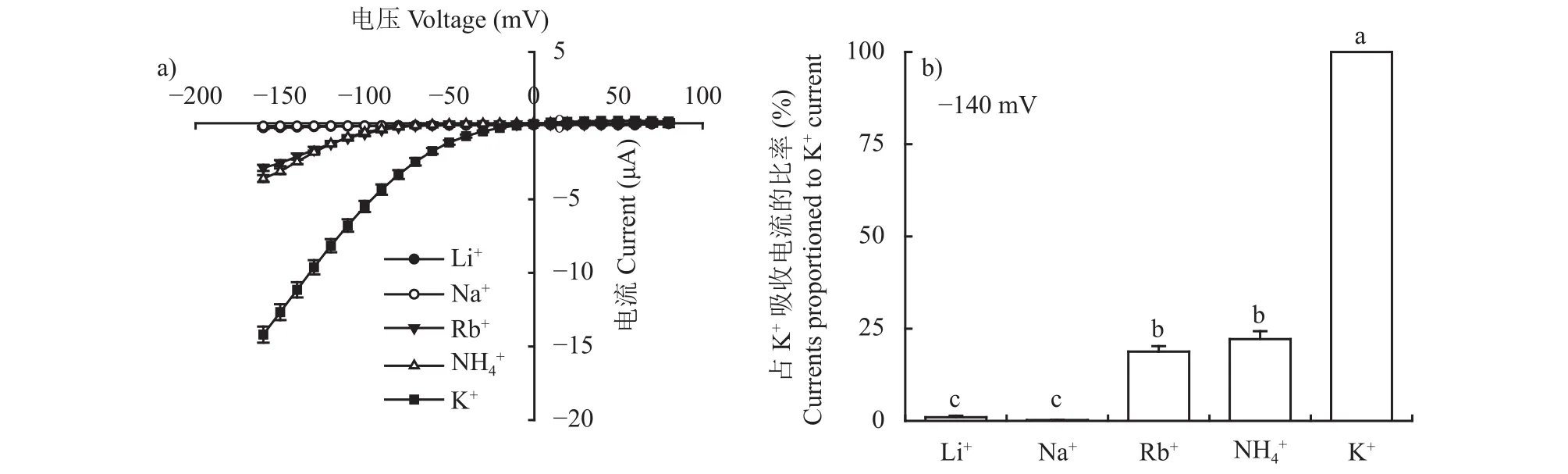
圖3 OsAKT2對一價陽離子的吸收電流?電壓曲線(a)和一價陽離子吸收電流相對于K+吸收電流的比例(b)Fig.3 I?V curves of monovalent ion uptake by OsAKT2 (a) and the current proportion of monovalent ions relative to that of K+ (b)
2.4 鉀離子通道抑制劑對OsAKT2的影響
我們檢測了K+通道專性抑制劑Ba2+、Cs+和TEA對OsAKT2通道活性的影響,以驗證在蛙卵表達系統中產生的電流是否為專一性的鉀吸收電流。結果顯示,Ba2+、Cs+對OsAKT2電流的抑制作用具有電壓依賴性(圖4a),膜電位越負,抑制效果越顯著,在膜電位從–80 mV到–160 mV的范圍內,Cs+對OsAKT2電流的抑制率從42%增加到了94%;Ba2+對OsAKT2電流的抑制率雖然從42%增加到了78%(圖4b),但較其他高度專一的K+通道來說抑制率較低,這與圖3中OsAKT2對離子的通透性特征相吻合(主要通透K+,但是也可以通透一定量的NH4+)(圖4c)。而TEA對OsAKT2電流的抑制作用沒有電壓依賴性,在膜電位從–80 mV到–160 mV的范圍內,TEA的抑制率基本維持在70%~79% (圖4d)。總之,OsAKT2通道活性受K+通道抑制劑較高程度的抑制,表明OsAKT2產生的電流為專一性的鉀吸收電流(圖4)。

圖4 OsAKT2在鉀通道抑制劑Ba2+、Cs+和TEA處理下的電流?電壓曲線(a)和穩態電流(b、c、d)Fig.4 I?V curves (a) and steady currents (b, c, d) of the OsAKT2 by the external application of K+ channel blockers Ba2+, Cs+ and TEA
2.5 不同供銨、供鉀及脅迫處理對OsAKT2基因表達豐度的影響
為了進一步揭示OsAKT2的作用條件及分子機制,測定了不同供銨、供鉀及干旱脅迫(模擬葉片衰老的過程)條件下OsAKT2的表達特征。模擬晝夜光照變化,發現OsAKT2的基因表達受光照條件影響,在光照條件下其表達豐度較低,而在黑暗中OsAKT2表達水平較高(圖5),具有一定的晝夜節律。在處理20 h時OsAKT2基因的表達豐度達到最高,因此在該處理時間進行各處理的基因豐度比較。缺鉀(圖5a)和缺銨(圖5b)處理均會顯著增加OsAKT2的表達量,而OsAKT2主要介導地上部K+的吸收(圖2),推測OsAKT2在水稻氮、鉀營養虧缺時可促進地上部分離子的回流以保障植物完整的生長發育進程。此外,相比于正常條件,利用sorbitol(山梨醇)處理模擬滲透脅迫增加了OsAKT2基因的表達豐度,PEG處理無顯著效果(圖5c)。在不同脅迫處理條件下均未改變OsAKT2的晝夜節律變化,這可能是植株應對脅迫條件的一種策略。

圖5 不同處理條件下OsAKT2基因的表達豐度Fig.5 OsAKT2 gene expression level in response to different treatments
3 討論與結論
植物Shaker型鉀通道是一類電壓門控的K+離子通道,在K+的吸收、轉運以及維持細胞內離子動態平衡等方面發揮重要作用[21]。盡管OsAKT2在結構和基本性質上都與典型的AKT2鉀通道相似,如二者在氨基酸序列上高度同源,且表現出較高的鉀離子選擇性,同屬于弱整流型Shaker類鉀通道(圖1),但是其也表現出一些特殊電流性質。利用非洲爪蟾卵母細胞作為外源表達系統,發現OsAKT2主要介導K+的吸收,缺少明顯的外向活性,且表現出明顯的電壓依賴性(圖2),這與已知的擬南芥AtAKT2的“雙向”電流明顯不同[14]。AtAKT2的外向活性(不受電壓影響)有其特殊的生理意義:K+的外流能夠阻止韌皮部細胞內由于H+內流引起的過度去極化,進而通過蔗糖/H+共轉運體驅動蔗糖的運輸[22]。而水稻OsAKT2缺少明顯的外排活性,意味著其可能缺少蔗糖運輸的功能。另外,研究表明OsAKT2主要定位在韌皮部[18],且負責K+的吸收,那么OsAKT2很可能參與了將植株地上部分多余的K+經由韌皮部運往根系,一方面給韌皮部負載提供所需的營養物質,另一方面也作為地上部鉀營養狀況的重要信號對根系吸收K+進行反饋調節。植株地上部分的K+回流有利于水稻等糧食作物維持其生長部位的功能,但是對于農業生產中需要保持葉片高鉀水平的作物如煙草等較為不利。
OsAKT2對于維持細胞內K+濃度穩定發揮著關鍵作用。本研究發現OsAKT2對外界K+濃度的變化很敏感,且顯示出典型的低親和力特性(Km為43 mmol/L,遠大于高親和系統介導的0.2~1 mmol/L K+的吸收[23]),與已知的其它Shaker型鉀通道一致[24]。植物細胞質中的K+濃度一般維持在50~100 mmol/L范圍內[25],這種最佳的K+濃度有利于細胞質中酶的活化[9]。水稻OsAKT2對K+具有較高的選擇性(圖3),且會抑制根系對Na+的吸收[17],表明OsAKT2可能有助于提高植物的抗鹽能力。此外,水稻OsAKT2對NH4+表現出一定的通透性(圖3),且缺銨處理會顯著上調OsAKT2的表達水平,說明OsAKT2可能對水稻氮素營養吸收轉運具有潛在的貢獻。植株內多余的NH4+或可通過OsAKT2再回流到根系并進行氨同化,降低植株體內游離NH4+含量,從而緩解NH4+毒害。這一結果對于將來研究水稻體內NH4+回流及再分配有一定的參考價值。
OsAKT2基因的表達呈現出明顯的避光性,與AtAKT2基因受光照誘導的特性相反,說明水稻和擬南芥兩種植物具有不同的晝夜節律和光合產物分配機制。擬南芥AtAKT2鉀通道參與的蔗糖分配過程具有光依賴性[15],AKT2的一個重要作用就是激活韌皮部質膜協助光合產物的向下運輸,從而有效的裝載糖類物質[26]。而水稻OsAKT2基因在光照下表達較弱(圖5),且OsAKT2功能缺失并不影響水稻地上部植株的蔗糖含量[17],表明OsAKT2可能不參與協助蔗糖的運輸,這也與OsAKT2缺少明顯的外向活性及其可能對應的蔗糖運輸功能這一特征相一致(圖2)。黑暗條件下,氣孔關閉不再提供蒸騰拉力,植物為了滿足正常的生長需求,其體內存在一定的離子循環,此時OsAKT2的表達豐度升高(圖5),顯示OsAKT2具有潛在的K+回流作用。這些不同植物之間的特異性節律變化可能是植物表現出的適應性進化,具體生理機制有待進一步探索。本研究中基因表達試驗采用的是10天苗齡(2~3葉期)的水稻幼苗,該結果可以在一定程度上反映OsAKT2介導地上部分的K+回流,而老葉到新葉的K+回流可能需在4~5葉期的幼苗中進行驗證,在此時期,第一片葉已開始進入衰老階段,便于新的完全展開葉和老葉之間進行比較。
缺氮、缺鉀以及干旱等脅迫環境因素會加速葉片老化,縮短植物生育期。本研究發現在這類脅迫條件下OsAKT2基因的表達水平會顯著上調,這可能有助于K+從衰老器官運輸到生長旺盛的新器官,反映了植物對外界環境的適應性生存策略。相關研究也發現,過表達大麥HvAKT2和HvHAK1能夠通過調節葉片H+內穩態和細胞信號傳導來提高大麥的耐旱性[27]。而對于喜鉀作物煙草來說,保持葉片充足的K+是其品質保證,沈方科等[28]發現環割或斷根處理可以阻斷物質在韌皮部的運輸,從而減少K+向地下部分回流,提高煙葉鉀含量。綜上,水稻OsAKT2可能在地上部K+的再分配過程中發揮重要作用,這為通過超表達OsAKT2來提高植物抗逆性提供了可能。

