血液學指標在子宮內膜異位癥相關性卵巢癌早期診斷中的研究
奚曉雪,沈 晨,楊 建,梁寶權,付 婷,陳 婷,曹天越,錢永紅,王慧玲,居頌文,侯順玉*
(1.南京醫科大學姑蘇學院 南京醫科大學附屬蘇州醫院 蘇州市立醫院 婦產科,江蘇 蘇州215002;2.蘇州市中醫醫院 婦產科,江蘇 蘇州215003)
子宮內膜異位癥(EMs,簡稱“內異癥”)的惡變率約0.7%-2.5%,通常累及卵巢,是卵巢癌的高危因素[1]。內異癥惡變而來的卵巢癌稱為子宮內膜異位癥相關性卵巢癌(EAOC),包括透明細胞癌和子宮內膜樣癌。卵巢子宮內膜異位癥和早期以囊性表現為主的EAOC的鑒別診斷給婦科醫生帶來巨大挑戰。隨著內異癥的發病率不斷升高,內異癥惡變的病例數也在逐年增加,內異癥惡變的早期識別、診斷及治療越來越受到重視。手術病理是診斷EAOC的金標準,但嚴格的診斷標準使內異癥惡變漏診增多[2]。因此,內異癥惡變的預測及風險評估指標的建立,對內異癥惡變早期發現及預后改善有重要的臨床意義。
1 資料與方法
1.1 研究對象選取2013年1月1日至2018年8月31日于南京醫科大學附屬蘇州醫院首次手術治療并且根據病理診斷為子宮內膜異位癥的194例患者及EAOC的37例患者為研究對象,分為內異癥組和EAOC組。EAOC的診斷標準[3]:①發生于同側卵巢內的卵巢惡性腫瘤與子宮內膜異位癥;②發生于一側卵巢的惡性腫瘤與同期發生于對側卵巢的子宮內膜異位癥。EAOC患者排除標準:①既往有子宮內膜異位癥手術史;②術前曾行化療或其他治療;③合并其他惡性腫瘤或其他部位惡性腫瘤轉移至卵巢。本研究獲得南京醫科大學附屬蘇州醫院倫理委員會的批準及參與患者的知情同意。
1.2 方法收集下列病例信息:患者年齡,中性粒細胞百分比(NEUT%)、淋巴細胞百分比(LYM%)、單核細胞百分比(MXD%)、嗜酸性粒細胞百分比(EO%)、中性粒細胞絕對值(NEUT#)、淋巴細胞絕對值(LYM#)、單核細胞絕對值(MXD#)、白細胞計數(WBC)、血小板計數(PLT)、總膽紅素(TBIL)、直接膽紅素(DBIL)、間接膽紅素(IBIL)、白蛋白(ALB)、C反應蛋白(CRP)、血清糖類抗原125(CA125)、人附睪蛋白4(HE4)。計算中性粒細胞/淋巴細胞比值(NLR)、單核細胞/淋巴細胞比值(MLR)、血小板/淋巴細胞比值(PLR)、嗜酸性粒細胞/淋巴細胞比值(ELR)、C反應蛋白/白蛋白(CRP/ALB)、系統性免疫性炎癥指數(SII=血小板計數*中性粒細胞計數/淋巴細胞計數)、全系統性炎癥反應指數(SIRI=中性粒細胞計數*單核細胞計數/淋巴細胞計數)。
1.3 統計學方法采用SPSS 23.0統計軟件進行數據分析。計數資料以率(%)表示,正態分布計量資料以均數±標準差表示,非正態分布計量資料以中位數(四分位間距)表示,計數資料的比較采用卡方檢驗或Fisher’s精確檢驗,計量資料的比較采用Mann-Whitney U 檢驗,Kruskal-Wallis 單因素ANOVA檢驗評估兩組以上組間檢測指標的差異。Pearsonχ2檢驗分析計數資料不同組間的關聯性。連續變量由受試者工作特征曲線(ROC curve)獲取最佳截斷值(optimal cutoff value),并根據最佳截斷值進行分層。Logistic回歸分析構建聯合診斷指標。P<0.05差異具有統計學意義。
2 結果
2.1 內異癥組和EAOC組外周血炎癥指標及腫瘤標志物水平比較內異癥組患者中位年齡39.00(29.00-47.50)歲,EAOC組患者中位年齡51.00(47.0-56.50)歲,兩組相比較差異無統計學意義(Z=3.314,P=0.07)。EAOC組患者WBC、NEUT%、NEUT#、CA125、HE4、NLR、SII、SIRI均高于內異癥組(P<0.05),內異癥組患者LYM%、ALB高于EAOC組(P<0.05)。年齡、MXD%、EO%、LYM#、MXD#、PLT、TBIL、DBIL、IBIL、CRP、MLR、PLR、ELR、CRP/ALB在兩組間的差異無統計學意義。見表1。
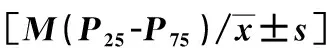
表1 內異癥組和EAOC組外周血炎癥指標及腫瘤標志物水平的比較
2.2 內異癥惡變危險因素的多因素分析將WBC、NEUT%、NEUT#、CA125、HE4、NLR、SII、SIRI、LYM%、ALB納入二元Logistic回歸分析,結果提示,在調整了NEUT%、CA125、NLR、SII、SIRI、LYM%后,WBC(P=0.023)、NEUT#(P=0.014)、HE4(P<0.001)、ALB(P=0.045)與內異癥惡變發生顯著相關。見表2。
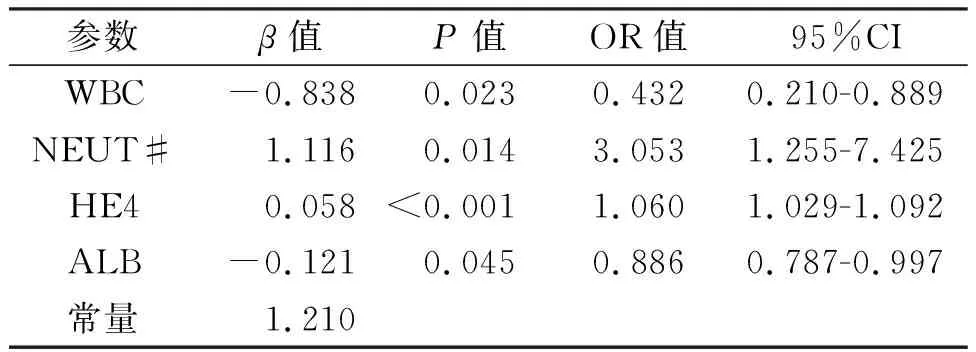
表2 內異癥惡變危險因素的多因素分析
2.3 ROC曲線對內異癥惡變的診斷效能分析以內異癥組為參考人群,繪制ROC曲線,分析內異癥惡變危險因素的惡變預測效能。WBC、NEUT#、HE4及聯合指標的曲線下面積(AUC)分別為0.615(P=0.027)、0.638(P=0.008)、0.780(P<0.001)、0.831(P<0.001),聯合指標AUC大于各指標單獨診斷AUC。WBC、NEUT#、HE4及聯合指標的靈敏度、特異度見表3、圖1。
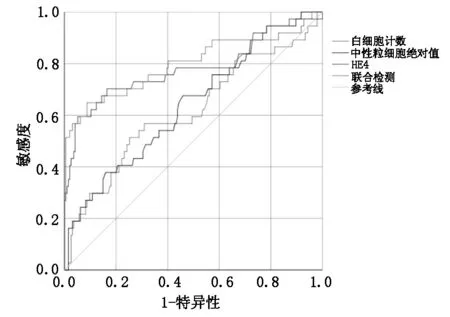
圖1 WBC、NEUT#、HE4及聯合指標診斷內異癥惡變的ROC曲線
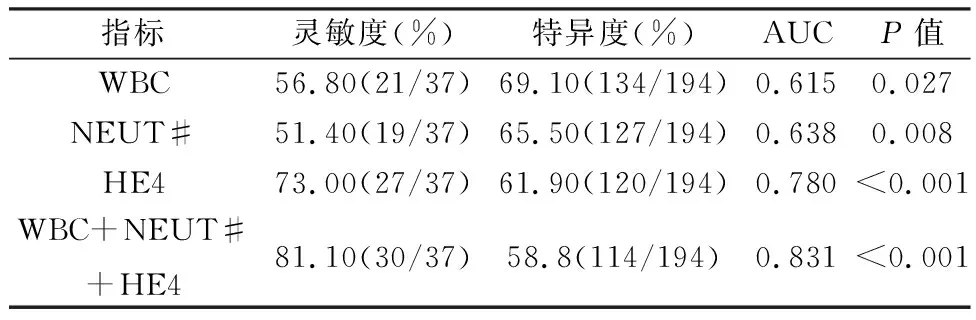
表3 WBC、NEUT#、HE4及聯合指標的診斷效能
3 討論
關于內異癥的起源,目前有多種學說,如“經血逆流”、“體腔上皮化生學說”、“誘導學說”等;此外,內異癥的形成可能還與遺傳、免疫炎癥、在位內膜生物學特性等因素有關[4]。生育期是內異癥的高發時段,極少數見于初潮前和絕經后女性。卵巢癌多見于中老年婦女。本研究發現EAOC組中位年齡大于內異癥組,但差異無統計學意義,一方面可能與EAOC本身診斷期別相對較早有關,另一方面可能與本研究納入病例數量偏少有關。
EAOC的發生機制尚不清楚,有報道稱內異癥慢性炎癥狀態可能誘導EAOC[5]。過多的血紅蛋白、血紅素和鐵等分解產物沉積在異位組織,導致氧化應激反應并破壞了氧化還原平衡,參與炎癥微環境的形成[6-7]。炎癥可直接作用于細胞,誘導DNA突變、癌基因激活及失活抑癌基因,促進細胞增殖以及侵襲和轉移,在EAOC的發生發展中發揮重要作用[8]。
EAOC和內異癥患者炎癥狀態有何區別,目前關于先天免疫和獲得性免疫的全身性細胞反應的研究較少,多集中在細胞因子水平和人類白細胞抗原-G(HLA-G)等基礎研究[9]。
本文比較并分析了內異癥及EAOC兩者血液學指標,包括NEUT%、LYM%、MXD%、EO%、NEUT#、LYM#、MXD#、WBC、PLT、TBIL、DBIL、IBIL、ALB、CRP、CA125、HE4、NLR、MLR、PLR、ELR、CRP/ALB、SII、SIRI。EAOC組患者WBC、NEUT%、NEUT#、CA125、HE4、NLR、SII、SIRI均高于內異癥組(P<0.05),內異癥組患者LYM%、ALB高于EAOC組(P<0.05)。將上述因素納入二元Logistic回歸分析后發現WBC、NEUT#、HE4、ALB與內異癥惡變發生顯著相關。
WBC、NEUT#反應機體炎癥狀態,HE4最初在附睪上皮細胞中發現,作為美國FDA認證的卵巢癌標志物,特異性高于CA125,特別是診斷早期卵巢癌[10]。白蛋白在肝臟合成,維持血管內膠體滲透壓,幫助血液中物質轉運和清除氧化自由基。白蛋白亦可以作為機體營養狀態的評估指標。有研究表明低白蛋白血癥與持續性全身炎癥反應相關[11]。ALB雖與內異癥惡變相關,但利用ROC曲線對內異癥惡變的診斷效能分析,ALB的AUC預測效能不滿意。WBC、NEUT#、HE4均為臨床易獲取的血液學指標,聯合檢測對內異癥惡變評估具有較好的效能(靈敏度81.10%)。
除了血液學指標,評估子宮內膜異位癥惡變的無創性影像學方法也逐漸受到研究學者青睞[12]。由于內異癥及EAOC囊液中血紅蛋白和鐵相關化合物的濃度不同,內異癥囊腫與EAOC兩者囊液的吸收光譜存在差異[13]。特定的光學成像系統可以通過監測吸收光譜中的特定波長來實現對顏色變化的視覺檢測,從而早期發現EAOC[14]。上述成像系統包括電子吸收光譜、近紅外方法和MR橫向弛豫測量法,目前用于臨床前研究或正在開發中,未來也許可以應用于臨床。
綜上,本研究通過比較和分析內異癥患者及EAOC患者血液學指標來探索具有較高敏感性和特異性的生物標志物,以期應用于臨床,從而早期發現內異癥惡變,降低醫療成本和提高患者生活質量。

