拐棗多糖的反復凍融回流工藝優化及抗氧化活性研究
楊 靜,李 博,張延妮
(1.楊凌質量技術檢測檢驗所,陜西楊凌 712100;2.陜西師范大學生命科學學院,陜西西安 710119)
拐棗學名枳椇(),為鼠李科枳椇屬植物(),分布在我國甘肅、陜西等地。它可以直接食用,也可以開發為功能性食品。《唐本草》最早記錄了該植物的藥用應用,被稱為金果樹,此外《救荒本草》、《雷公炮炙論》等多部醫藥著作中都對其有介紹。拐棗含有多種化學成分,包括多糖類、黃酮類和酚酸類等,其中多糖類是其最主要化學成分。現已研究發現,多糖在免疫調節、抗氧化、抗腫瘤、降血糖等方面都具有獨特的藥理活性。因此,拐棗中多糖的提取成為了拐棗開發、利用的重要一環。
科學地選擇提取方法在藥物分析、食品分析及環境分析等中都是極其重要的,它可以提高有效成分的提取率,降低雜質的含量,使有效成分更具有代表性。在多糖提取的常用方法中,目前已應用于拐棗中多糖提取的方法有超聲-微波輔助法、回流法、酶法、超聲波輔助法等,也取得了一定的效果,但每種方法都存在一定的局限性,對于拐棗中多糖提取時存在的挑戰沒有完全解決,拐棗開發的需求依然在呼喚性能更優越的提取方法,或針對以上方法的不足進行改進的措施。反復凍融技術是利用凍結-解凍過程中細胞內部的冰晶體對細胞壁的機械作用而使其破裂,該技術實驗條件溫和,不破壞熱不穩定性成分,也容易在工業上放大,是一種環境友好且經濟的提取方法。反復凍融法已用于油菜花粉多糖、刺麒麟菜多糖、枸杞多糖和小球藻多糖的提取,均取得了較好的效果;當反復凍融法進一步與回流法結合起來用于枸杞多糖的提取時,顯示出消耗少、效率高的優勢。而反復凍融技術結合回流法尚未應用于拐棗中多糖的提取。為了提高拐棗多糖提取物的抗氧化等活性,本研究在設計提取工藝上,在對拐棗粉末樣品進行傳統回流提取之前,疊加反復凍融的預處理,從而減少拐棗粉末樣品在高溫回流環節中的持續時間和頻次,從理論上減少熱不穩定多糖可能的損失并提高其生物利用度;同時,通過探索溶脹溶劑用量、冷凍時間及溫度、凍融循環次數等對多糖含量的影響規律,優化提取工藝,最后對得到的多糖提取物進行抗氧化性方面的評價,以期為拐棗多糖的深入研究及開發應用提供參考。
1 材料與方法
1.1 材料與儀器
拐棗 采自陜西旬陽,經陜西師范大學生命科學學院植物學教研室鑒定為鼠李科枳椇屬植物(),于40 ℃烘干,粉碎,過60 目篩保存備用;牛血清白蛋白(BSA 批號S12014)、1,1-二苯基-2-三硝基苯肼(DPPH 批號190301)、2,2-聯氮-二(3-乙基-苯并噻唑-6-磺酸)二銨鹽(ABTS 批號24146)及葡萄糖標準品(批號70925)購自上海源葉生物科技有限公司;所有其他使用的化學品和溶劑均為分析純試劑。
101 型電熱鼓風干燥箱 北京科偉永興儀器有限公司;F120 型粉碎機 北京中興偉業儀器有限公司;RE-52AA 旋轉蒸發儀 上海亞榮生化儀器廠;FDU-1200 真空冷凍干燥機 東京理化;UV6100S型紫外可見分光光度計 上海美普達儀器有限公司。
1.2 實驗方法
1.2.1 拐棗中多糖的提取 參照云南小粒咖啡花中多糖提取的工藝流程,取100 g 拐棗粉末置于凍存管中,加入一定量的蒸餾水溶脹后,置于冰箱冷凍室(-20 ℃)冷凍一定時間后取出,放入一定溫度的水浴鍋中解凍4 h,再次重復以上操作(凍存、放置及解凍)一定次數,將溶脹的拐棗及溶液倒入圓底燒瓶中,加入100 mL 石油醚,于45 ℃水浴回流1 h,過濾濾去拐棗殘渣,分液后棄去石油醚層,剩余溶液與拐棗一并倒入圓底燒瓶中,加蒸餾水150 mL,在65 ℃水浴2 h 后減壓濃縮至25 mL,加入75 mL 乙醇,溶液中的沉淀即為粗多糖,將沉淀溶于水,然后用Sevage 法除蛋白質,再通過透析除去單糖,再次用乙醇從提取液中將多糖沉淀下來,沉淀冷凍干燥后即得拐棗多糖提取物,其質量記作m。
1.2.2 單因素法優化拐棗多糖的提取 以多糖含量為指標,對以上提取工藝中的四個與凍融過程有關的條件進行考察。溶脹加水量的考察:固定凍結時間為3 h、解凍溫度為50 ℃,凍融次數為3 次,按照以上工藝流程獲得一系列不同溶脹加水量(分別為10、20、30、40 和50 mL/100 g)時的多糖提取物;凍結時間的考察:固定加水量為30 mL/100 g,解凍溫度為50 ℃,凍融次數為3,按照以上工藝流程獲得一系列不同凍結時間(分別為1、2、3、4、5 h)時的多糖提取物;解凍溫度的考察:固定加水量為30 mL/100 g,凍融次數為3,凍結時間3 h,按照以上工藝流程獲得一系列不同解凍溫度(分別為30、40、50、60、70 ℃)時的多糖提取物;凍融次數的考察:固定加水量為30 mL/100 g,解凍溫度為50 ℃,凍結時間3 h,按照以上工藝流程獲得一系列不同凍融次數(分別為1、2、3、4、5 次)時的多糖提取物。
1.2.3 正交試驗優化法提取拐棗多糖 按照L(3)正交表設計,以多糖含量為指標,以溶脹加水量、解凍溫度、凍融次數、凍結時間為考察因素,每個因素設置三個水平(見表1),進行拐棗多糖的提取。
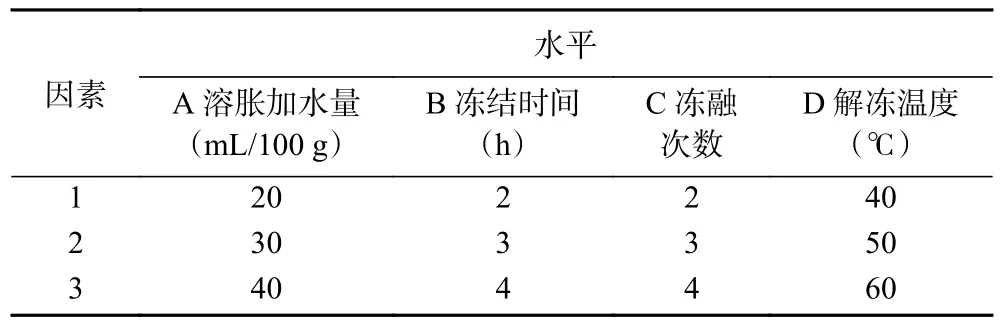
表1 正交試驗因素水平表Table 1 Factors and levels of the orthogonal test
1.2.4 拐棗多糖提取物中多糖含量的分析 應用蒽酮-硫酸法對多糖提取物中的多糖進行含量測定。
1.2.4.1 標準曲線的建立 稱取100 mg 葡萄糖(105 ℃烘干至恒重),用蒸餾水溶解后定容于100 mL容量瓶中。分別吸取1.00、2.00、3.00、4.00、5.00、6.00 mL 置于6 個100 mL 容量瓶中,用蒸餾水定容,然后從各容量瓶中吸取2.00 mL 溶液分別加入到6 支容量為20 mL 的帶塞試管中,以蒸餾水作空白對照,往7 支試管中分別加入8.0 mL 蒽酮-硫酸試劑(蒽酮-硫酸試劑由75 mL 無水硫酸、25 mL 蒸餾水和0.2 g 蒽酮混合而成),加完后立刻置冰水中冷卻5 min,再將7 支試管同時浸入沸水浴中,加熱10 min 后取出,于冰水中冷卻至室溫,在620 nm 波長處測定其吸光度,以容量瓶中葡萄糖的濃度為橫坐標,吸光度為縱坐標,繪制葡萄糖溶液標準曲線。
1.2.4.2 拐棗中多糖含量的測定 稱取干燥至恒重的拐棗多糖提取物0.1000 g,用蒸餾水定容于50 mL容量瓶中。吸取2.00 mL,按1.2.4.1 中的步驟測定吸光度值,計算拐棗中多糖含量Y,含量Y 計算公式如下:
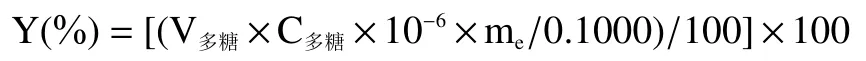
其中V=50.00 mL;C為容量瓶中溶液多糖的濃度,單位為μg/mL;m為1.2.1 中所獲拐棗多糖提取物,單位為g。
1.2.5 拐棗多糖提取物的紅外光譜分析 將拐棗多糖提取物與KBr 粉末(1:100)研磨混勻壓片后,在4000~400 cm范圍內進行紅外光譜掃描,以分析提取物中的官能團及物質種類。
1.2.6 拐棗多糖提取物的抗氧化活性評價
1.2.6.1 拐棗多糖提取物對DPPH 自由基清除能力的測定 參照文獻[27]將DPPH 溶液(0.2 mmol/L,無水乙醇配制,與蒸餾水等體積混合后在517 nm 處測量其吸光度并記為A)和拐棗多糖提取物水溶液(將拐棗多糖提取物粉末溶解于蒸餾水中,配制成4.00 mL 濃度分別為0.005、0.01、0.02、0.04、0.06、0.08、0.10 mg/mL 的溶液,與無水乙醇等體積混合后在517 nm 處測量其吸光度并記為A)等體積混勻,使其充分混合,室溫靜置,避光反應半小時,然后在517 nm 處測量混合反應液的吸光度并記為A;陽性對照選擇相同濃度梯度的系列抗壞血酸(V)溶液,同樣進行吸光度測量。最后按照以下公式計算對DPPH 自由基的清除率:
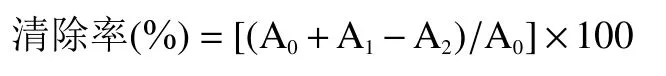
1.2.6.2 拐棗多糖提取物對ABTS 自由基清除能力的測定 先配制兩種儲備液,稱取0.096 g ABTS 溶于蒸餾水,定容于25 mL 容量瓶得到儲備液1,稱取0.033 g 過硫酸鉀溶于蒸餾水,定容于25 mL 容量瓶得到儲備液2,每次實驗前取兩個儲備液各500 μL等體積新鮮混合,室溫避光反應18 h,作為母液,再將母液用無水乙醇稀釋50 倍作為后續反應液,取2mL 該反應液與蒸餾水等體積混合后在734 nm 處測量其吸光值,記為A;將2.00 mL 拐棗多糖提取物溶液(濃度梯度為0.50、1.00、2.00、3.00、4.00、5.00 mg/mL,與等體積蒸餾水混合后在734 nm 處的吸光度記為A)與2.00 mL 母液稀釋后的反應液混合,室溫避光反應6 min后在734 nm 處測量其吸光度,記為A,陽性對照選擇相同濃度梯度的系列V溶液。按照以下公式計算清除率:
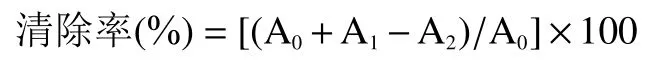
1.2.6.3 拐棗多糖提取物對Fe還原能力的測定參照文獻[29]的測定方法,將75 μL 拐棗多糖提取物溶液(濃度分別為0.10、0.20、0.40、0.60、0.80、1.0 mg/mL)與75 μL 的磷酸鹽緩沖液(0.20 mol/L,pH6.60)及75 μL 1%鐵氰化鉀溶液混合,于50 ℃恒溫反應20 min,再加入30 μL 10%三氯乙酸溶液,避光反應10 min,待反應結束后在混合反應液中加250 μL 的蒸餾水,再加入50 μL 0.1%的三氯化鐵溶液,避光室溫反應10 min,然后在700 nm 處測定一系列混合液的吸光度。陽性對照選擇相同濃度梯度的系列V溶液。
1.3 數據處理
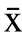
2 結果與分析
2.1 單因素優化實驗結果
2.1.1 溶脹加水量對多糖含量的影響 把1.2.2 中獲得的多糖粉末按1.2.4 中的步驟,測定吸光度值并計算多糖的含量(多糖測定方法的方法特性:定量方程為A=0.0077C+0.0010,其中C 為葡萄糖溶液的濃度,單位為μg/mL,A 為吸光度值,線性范圍為10~60 μg/mL,相關系數為0.9995),溶脹加水量的影響趨勢如圖1 所示。
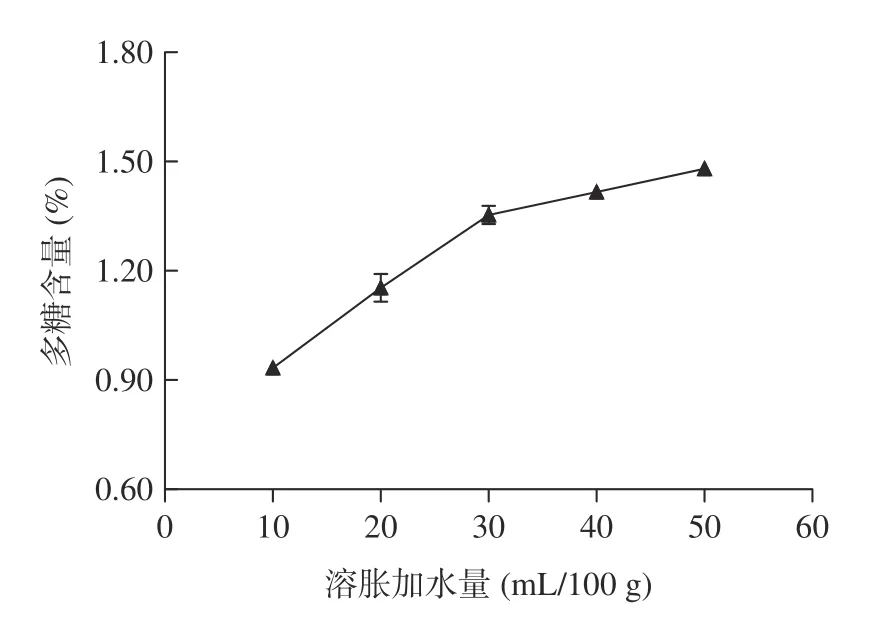
圖1 拐棗中多糖的含量隨溶脹加水量的變化Fig.1 Variation of the content of polysaccharides in Hovenia dulcis along with water content added
由圖1 可以看出,多糖含量隨加水量的增加先快速上升,當加水量大于30 mL/100 g 時,含量的增加趨于平緩,原因可能是當溶脹加水量達到30 mL/100 g后,細胞吸水量達到飽和,進一步加大含水量不會起到增強效果。溶脹的拐棗粉末中的水在凍結時形成冰晶體,可以產生張力,從而破壞細胞壁的組織結構,有利于多糖釋放到溶液中。可以初步把較佳溶脹加水量定為30 mL/100 g。
2.1.2 凍結時間對多糖含量的影響 凍結時間對多糖含量的影響如圖2 所示。
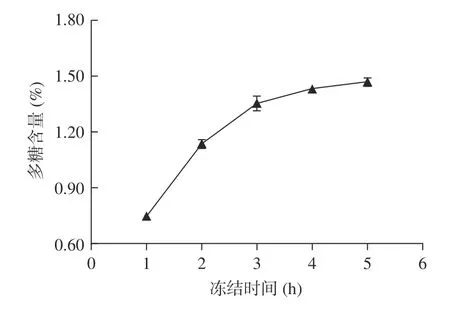
圖2 拐棗中多糖的含量隨凍結時間的變化Fig.2 Variation of the content of polysaccharides in Hovenia dulcis along with freezing duration
從圖2 可以看出,在一定范圍內,隨著凍結時間的延長,多糖含量明顯增大,但當凍結時間超過3 h后,多糖含量的增加趨于平緩。隨著凍結時間的延長,最終可以造成植物細胞壁三維網狀結構的完全破壞和多糖的完全釋放,本實驗結果顯示凍結時間達到3 h 后,細胞內冰晶增長趨于飽和,這個規律和同類提取方法體現的規律較為一致,所以可以初步把較佳凍結時間定為3 h。
2.1.3 解凍溫度對多糖含量的影響 解凍溫度對多糖含量的影響如圖3 所示。
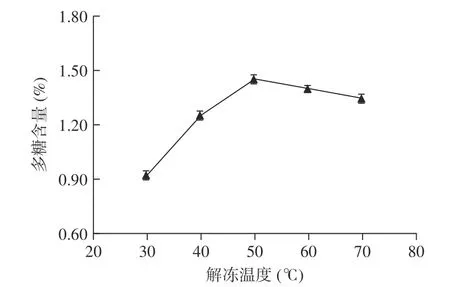
圖3 拐棗中多糖的含量隨解凍溫度的變化Fig.3 Variation of the content of polysaccharides in Hovenia dulcis along with defrosted temperature
從圖3 可以看出,在實驗考察的溫度范圍內,從30 ℃開始,當解凍溫度逐步升高時,多糖的含量也逐步增加,當解凍溫度為50 ℃時,多糖含量最高,當溫度超過50 ℃后,多糖含量稍微有所減低;本實驗中高于一定溫度后含量有所降低的原因可能是:雖然增加溫度一般有利于待提取組分從植物中溶解出來,然而過高的解凍溫度可能導致樣品解凍時樣品內部溫度均勻性變差從而增大傳質阻力,從整體上在溶解動力學上不利于待提取組分的溶出,另一個可能的原因是超過50 ℃的溫度加速了微量熱不穩定性多糖的分解,該規律與凍融法提取枸杞中多糖的規律相似。可以初步把較佳解凍溫度定為50 ℃。
2.1.4 凍融次數對多糖含量的影響 凍融次數對多糖含量的影響如圖4 所示。
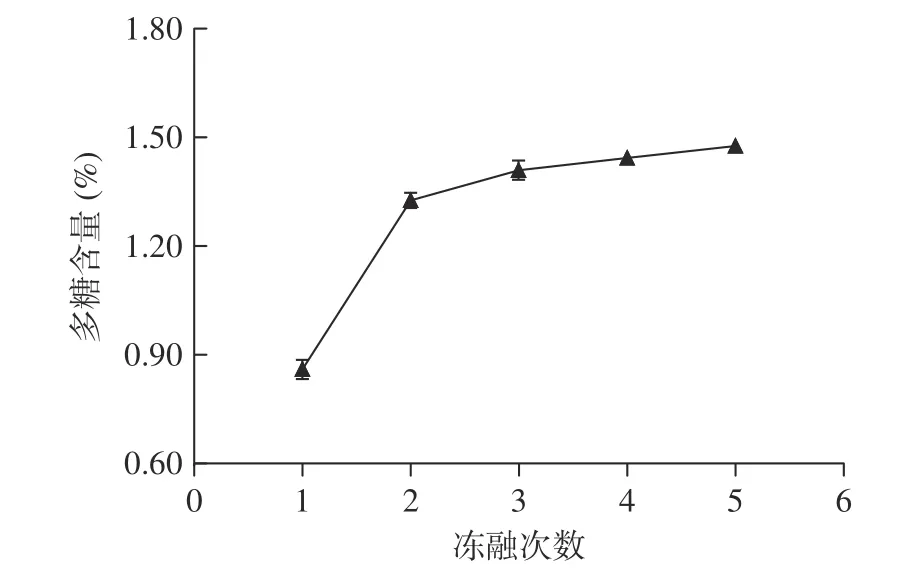
圖4 拐棗中多糖的含量隨凍融次數的變化Fig.4 Variation of the content of polysaccharides in Hovenia dulcis along with the times for freezing-melting repetition
從圖4 可以看出,在一定范圍內,隨著凍融次數的增多,多糖含量逐漸增大,但超過3 次以后多糖含量增加并不明顯,可能是因為多次凍融后細胞壁結構基本被破壞所致。可以初步把較佳凍融次數定為3 次。
2.2 正交試驗優化結果
為進一步優化拐棗多糖提取工藝的最佳條件,避免單因素輪換優化法中因素組合不夠均勻等弊端,在單因素輪換法初步優選的基礎上,以多糖含量為考查指標,采用L(3)正交設計對溶脹加水量、解凍溫度、凍融次數、凍結時間等四個因素在不同水平的組合進行了考察,試驗結果見表2。
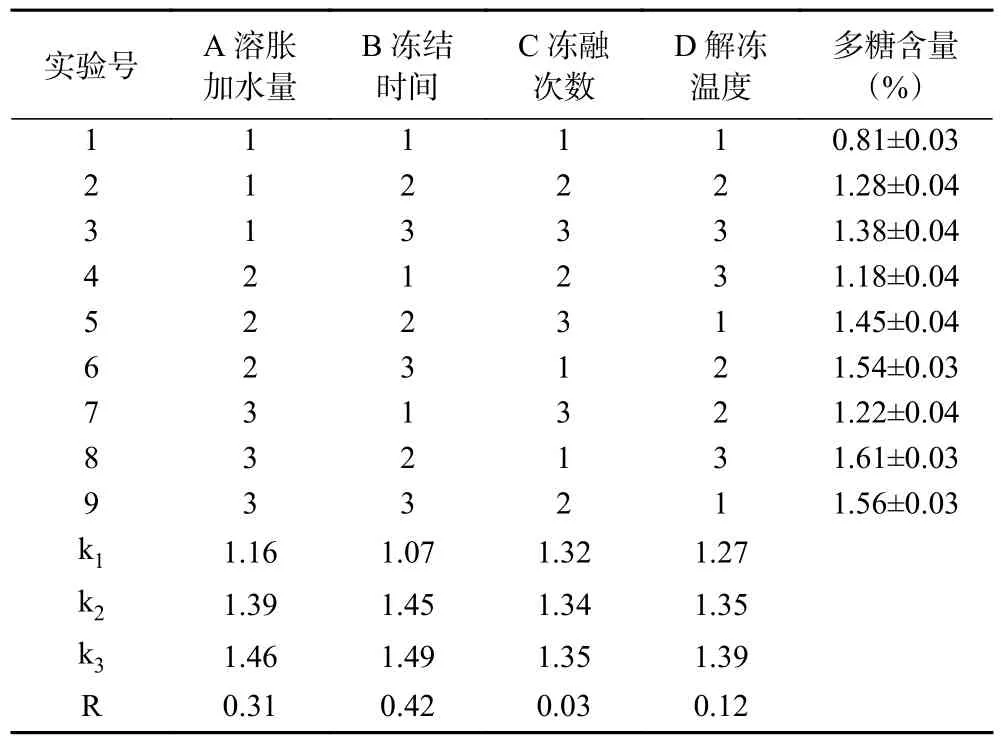
表2 正交試驗結果Table 2 Results of orthogonal test
由表2 可知,各考察因素對拐棗多糖含量的影響程度是不同的,R 越大說明在考察的水平范圍某因素對考察指標的影響越大,從而四個因素對拐棗中多糖含量的影響大小順序依次為:B>A>D>C。對于因素C,由于不同水平影響的區別非常小,從效率和成本出發,選擇最低水平,而其它三個因素選擇考察指標Y最大值對應的水平。最終反復凍融回流法提取拐棗多糖工藝的最佳條件組合為ABCD,即:溶脹加水量40 mL/100 g,凍結時間4 h,凍融次數2 次,解凍溫度60 ℃時,此時多糖含量較高。在此組合下進行驗證試驗3 次,多糖含量為1.68%±0.03%,高于正交試驗最高組即第8 組結果(1.61%±0.03%),說明正交試驗最佳條件組合的優選結果(ABCD)可靠。
2.3 拐棗多糖提取物的紅外光譜表征
拐棗多糖提取物的FT-IR 光譜如圖5 所示,主要吸收峰歸屬如下:3373 cm處的吸收峰來自多糖的羥基伸縮振動;2930 cm處的吸收峰也是多糖的特征吸收之一,這是由烷基的C-H 伸縮振動引起的;1610 cm處的吸收峰是羰基的特征峰,表明多糖中有糖醛酸的存在;1080 cm處的吸收峰往往是吡喃糖環的特征吸收峰,表明吡喃糖的存在。這些紅外吸收信號都是多糖典型結構的特征吸收,在一定程度上驗證了多糖的存在。
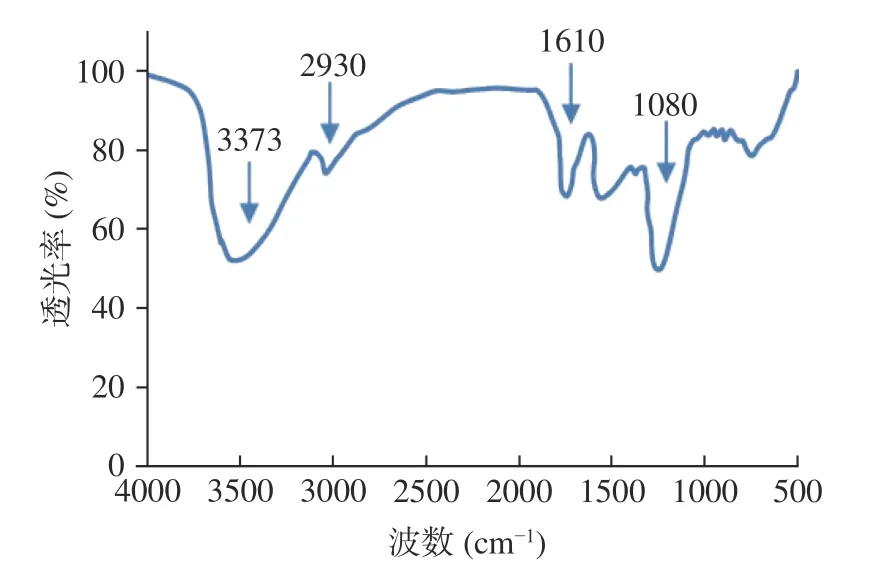
圖5 拐棗多糖提取物的紅外光譜圖Fig.5 Infrared spectrum of the polysaccharide extract from Hovenia dulcis
2.4 拐棗多糖提取物的抗氧化活性
2.4.1 拐棗多糖提取物對DPPH 自由基的清除能力DPPH 法是測定物質抗氧化性的常用方法。圖6為拐棗多糖提取物溶液對DPPH 自由基的清除率隨提取物溶液濃度的變化圖,由圖可以看出,拐棗多糖提取物溶液對DPPH 自由基的清除率隨著提取物溶液濃度升高而增強,但當多糖提取物濃度高于0.02 mg/mL 后,清除率的增加趨于平緩,與同樣濃度的V溶液相比,拐棗多糖提取物的清除能力比V稍弱。當濃度達到0.10 mg/mL 時,V和拐棗多糖提取物對DPPH 自由基的清除率可分別達到98.12%和86.73%。經過計算,拐棗多糖的IC為0.014 mg/mL,表明其具有較強的抗氧化性活性。
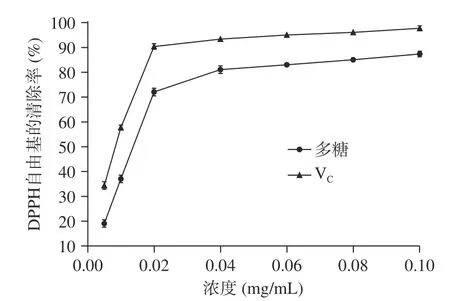
圖6 拐棗多糖提取物溶液對DPPH 自由基的清除率Fig.6 Clearance ratios of the polysaccharide extract from Hovenia dulcis to DPPH free radical
2.4.2 拐棗多糖提取物對ABTS 自由基的清除能力ABTS 光度法常用于檢測活性物質對自由基的清除能力,特別是基于ET 機制的清除能力。圖7 為拐棗多糖提取物溶液對ABTS 自由基的清除率隨提取物溶液濃度的變化趨勢圖,由圖7 可以看出,拐棗多糖提取物溶液對ABTS 自由基的清除率隨多糖提取物濃度的升高而增強,但當多糖提取物濃度高于1.0 mg/mL 時,清除率的增加趨于平緩,從圖7 還可以看出,拐棗多糖提取物對ABTS 自由基的清除能力與V相當。當提取物溶液濃度達到2.0 mg/mL時,V和拐棗多糖提取物對ABTS 自由基的清除率可分別達到94.85%和91.33%。
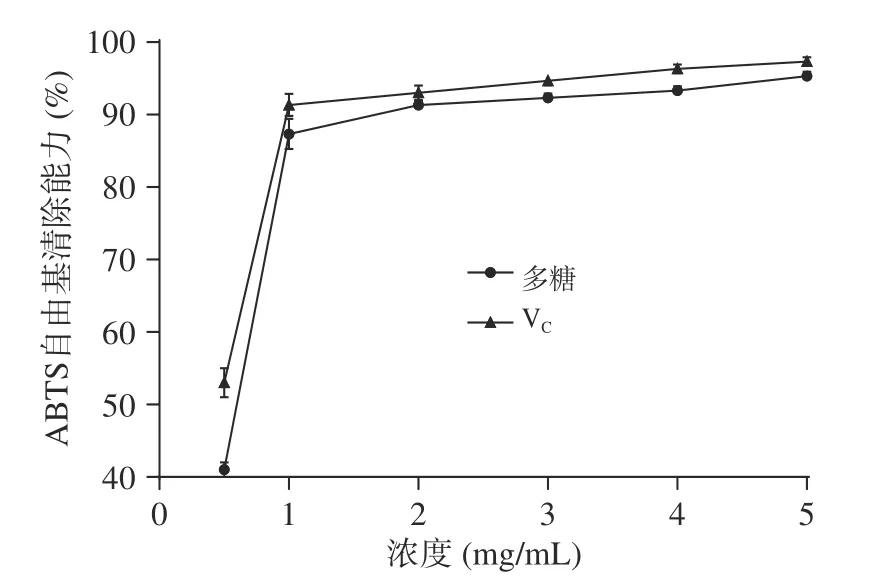
圖7 拐棗多糖提取物溶液對ABTS 自由基的清除率Fig.7 Clearance ratios of the polysaccharide extract from Hovenia dulcis to ABTS free radical
2.4.3 拐棗多糖提取物對Fe的還原能力 Fe的還原實驗常用來評價物質的總抗氧化能力。拐棗多糖提取物溶液的總抗氧化能力測試實驗結果見圖8,吸光度值越大表明溶液的抗氧化能力越強,由圖8可以看出,吸光度值隨拐棗多糖提取物溶液濃度的增大而明顯增大,表明拐棗多糖提取物溶液的抗氧化能力隨濃度增大而提高,盡管如此,拐棗多糖提取物的抗氧化能力和V相比還有一些差距。當拐棗多糖提取物溶液的濃度為1.0 mg/mL 時,其體現出的抗氧化性能力達到V的80%。
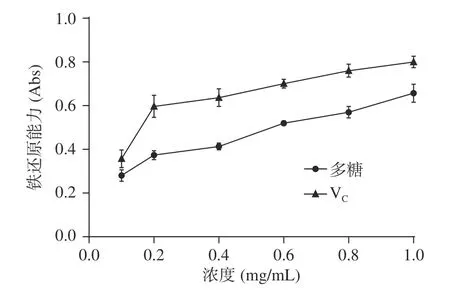
圖8 拐棗多糖提取物溶液的抗氧化實驗結果Fig.8 Results of anti-oxidation test of the polysaccharide extract from Hovenia dulcis
反復凍融法能夠破碎細胞壁,加速細胞內含物的釋放,這和文獻報道較為一致。關于拐棗中多糖的含量,不同的報道中這一數據差別較大,由于拐棗產地和采收季節等影響實驗結果的因素較多,準確定量地評價該工藝提升提取的直接效果還需要更系統的研究;盡管如此,采用該工藝制備的多糖和類似研究獲得的提取物具有相媲美的抗氧化活性。
3 結論
反復凍融回流提取法提取拐棗中多糖工藝操作簡單、環保,所需條件在現代工業生產中比較容易獲得,適合各種破壁工藝提取。該工藝的較佳條件為:溶脹加水量40 mL/100 g,凍結時間4 h,凍融次數2 次,解凍溫度60 ℃時,在此條件下拐棗中多糖的含量為1.68%±0.03%;拐棗多糖提取物的紅外光譜表明其含有糖醛酸,這也許是該提取物抗氧化性較強的原因之一;拐棗多糖提取物對DPPH 自由基及ABTS 自由基都表現出較強的清除能力,這些抗氧化作用在一定濃度范圍內呈現出了濃度依賴性。在最佳工藝條件下獲得的拐棗多糖提取物具有顯著的抗氧化活性,作為一種天然資源,其市場前景廣闊。

