磺胺甲惡唑脅迫下人工濕地植物與根際微生物的響應
胡勁召,張璇,王永強,徐佳敏,盧洪斌,葉長兵,劉曉暉,陳中兵,盧少勇*
1.海南熱帶海洋學院
2.湖泊水污染治理與生態修復技術國家工程實驗室, 中國環境科學研究院
3.玉溪師范學院化學生物與環境學院
4.捷克生命科學大學環境科學學院
磺胺類抗生素(sulfonamides,SAs)是我國生產、銷售和使用量最大的抗生素之一,具有抗菌譜廣、穩定性高、親水性較強的特性,能干擾和抑制細菌的生長與繁殖[1-2]。磺胺類抗生素在自然水體表層水中檢出濃度在ng/L~μg/L量級,在污泥、沉積物及土壤中檢出濃度在μg/kg~mg/kg量級[3]。水環境中的SAs主要來源于畜禽養殖廢水、生活污水和污水處理廠出水。阮悅斐等[4]在養殖水體沉積物中發現磺胺甲噻二唑、磺胺二甲氧嘧啶的檢出率較高,濃度為1.5~30.1 μg/kg。Samaraweera等[5]對位于科倫坡和希卡杜瓦的2個市政污水處理廠連續7 d和24 h進出水樣品中17種常見抗生素進行監測,發現所有出水樣品中均可檢測到磺胺甲惡唑(sulfamethoxazole,SMX)、甲氧芐氨嘧啶(trimethoprim)、諾氟沙星(norfloxacin)、氧氟沙星(ofloxacin)和環丙沙星(ciprofloxacin),在污水處理過程中抗生素僅被部分去除。由于抗生素不斷進入水環境,對水生動植物和人類健康構成極大威脅[6-7]。
人工濕地(constructed wetlands,CWs)常被用于去除水中常規污染物,同時作為二級污水處理系統對包括抗生素在內的新污染物可以起到良好的凈化效果[8-10]。人工濕地內植物的吸收和富集與微生物的生物降解對污染物的去除起到重要作用。人工濕地植物作為濕地生物過程中的主體,是濕地生態系統的重要組成部分,在濕地運行中起著非常重要的作用[11]。Liang等[12]研究發現,水生植物蘆葦、香蒲、香根草和美人蕉對人工濕地中的SMX去除率約為73%。楊月琴等[13]研究不同水生植物對布洛芬和羅紅霉素的去除效果,發現美人蕉對布洛芬的去除率最高(69.74%),花葉蘆竹對羅紅霉素的去除率最高(94.06%)。植物通過光合作用將氧氣運輸到植物根系,為微生物提供良好的生存環境,促進微生物對水體中污染物的降解。然而,人工濕地植物在處理含抗生素廢水的過程中會受到抗生素的長期脅迫,由于抗生素濃度和植物本身的耐受程度不同,植物的響應機制也存在差異[7]。Liu等[14]研究了不同濃度鹽酸環丙沙星、鹽酸土霉素和磺胺甲嘧啶對蘆葦的潛在影響,發現抗生素濃度大于10 g/L時對根活性和葉綠素有毒性作用,而濃度為0.1~10 g/L時對植物根系活力和葉片葉綠素有促進作用。Liu等[15]研究發現,模擬廢水中紅霉素濃度為0.06 mg/L時,羊角月牙藻(Pseudokirchneriella subcapitata)的生物量開始下降。此外,抗生素可能通過影響根際微生物群落的結構和功能間接影響植物發育。有研究表明,抗生素脅迫可以減少微生物多樣性,抑制與硫和氮循環相關的功能細菌群[16]。Zhang等[17]研究發現,四環素濃度為1 μg/L時,可以顯著改變序批式活性污泥反應器(SBR)中微生物群落結構,Shannon-Weiner指數和Simpson指數達到最大值。Button等[18]研究發現,SMX進入濕地系統后微生物群落優勢菌群相對豐度減少,微生物活性受到了抑制。
目前針對高濃度抗生素脅迫下植物與根際微生物聯合修復中植物理化指標及根際微生物群落的響應特征研究仍然不足。筆者以人工濕地中分布較廣泛的5種挺水植物為研究對象,探究濕地典型挺水植物與根際微生物聯合修復對不同濃度SMX的去除效果,選擇根系較發達的唐菖蒲和風車草,對其根系活力、活性氧與抗氧化系統在不同濃度SMX脅迫以及溫度變化下的響應差異進行評價和分析,同時探究根際微生物群落結構組成與功能的變化,以期為植物與根際微生物聯合修復技術在水污染處理中的應用提供理論依據。
1 材料與方法
1.1 試驗材料
供試水生植物唐菖蒲(A)、風車草(B)、燈心草(C)、水蔥(D)和水芹(E),購自江蘇宿遷飛達花卉園藝公司。選取SMX為目標抗生素,其純度為98%,購自上海百舜生物科技有限公司。Hoagland營養液為格林凱爾公司生產。
1.2 試驗設計
用去離子水洗凈植物根系,將植物根部表面附著的沉積物去除,用1/5 Hoagland營養液水培60 d至植物生長穩定。選取生理表型一致的植株作為試驗對象,在營養液中加入 0、1、10、30、50、100 mg/L不同濃度梯度的SMX進行處理,以0 mg/L為對照,不同處理中水生植物的種植密度為16株/m2,設置3個平行,每5 d更換1次營養液,運行周期為60 d。試驗于2019年在山東農業大學園藝實驗站進行,自然光照,培養溫度為20~25 ℃,濕度為60%~80%。試驗的前30 d,對不同濃度SMX在5種植物與根際微生物聯合修復中的去除效果進行測定與分析。依據SMX的去除效果,對2組去除效果較好的植物,采集其葉片及根部進行植物活性氧、抗氧化系統的測定;并在人工模擬氣候室中,調節溫度分別為4、8、12、24 ℃,測定溫度脅迫下2種植物活性氧、抗氧化系統的變化;對2種植物在0 mg/L(CK)、1 mg/L(S1)、50 mg/L(S50)營養液培養下的根際微生物進行采集,進行微生物群落多樣性分析。
1.3 抗生素的測定
1.3.1 色譜條件
使用液相色譜串聯質譜LC-30AD+LCMS-8060(Shimadzu,日本)測定抗生素濃度。色譜柱為InertSustainTM Bio-C18(2.1×100 mm,1.9 μm),流動相A相為0.1%甲酸,B相為乙腈,流速為0.4 mL/min;柱溫為 40 ℃,進樣量為 2 μL,洗脫方式為梯度洗脫。梯度洗脫程序:0~1.0 min,90% A相,10% B 相,流速 0.40 mL/min;1.0~8.0 min,5% A 相,95% B 相 , 流 速 0.40 mL/min;8.0~ 10.0 min,5%A 相,95% B 相,流速 0.40 mL/min;10.0~10.10 min,90% A相,10% B相,流速0.40 mL/min。
1.3.2 色譜條件
離子源為ESI,加熱模塊溫度為400 ℃,霧化氣流速為3.0 L/min;干燥氣流速為10.0 L/min,加熱氣流速為 10.0 L/min;掃描模式為多反應監測(multiple-reaction monitoring,MRM),接口溫度為 300℃,駐留時間為17 ms;DL溫度為250 ℃。
1.3.3 標準曲線與檢測限
抗生素檢測采用內標法定量,內標物質為磺胺甲惡唑-d4(SMX-d4)。各抗生素的標準曲線為f(x)=383 987x+589 143,相關系數(R2)為0.996 8。檢出限為 0.03 μg/L,定量限為 0.10 μg/L,精密度為 4.12%,回收率為96.33%。樣品抗生素檢出限與定量限按照信噪比3倍與10倍設定,分別進行了場地空白、方法空白和平行樣試驗,用于控制背景值影響及交叉影響。
1.4 根系活力與抗氧化系統指標測定
1.4.1 根系活力的測定
根系活力采用TTC法[19]測定。稱取混合根系樣品0.5 g 放入遮光處理的試管中,加入0.4% TTC溶液和磷酸緩沖液等量混合液10 mL,使根充分浸沒,在37 ℃水浴鍋中保溫3 h后加入2 mL硫酸,對照為先加硫酸再加根系。將根取出,吸干水分后與3~4 mL乙酸乙酯一起磨碎,將紅色提取液移入試管中,并將殘渣洗滌干凈,使最終體積為10 mL,在485 nm下比色。
1.4.2 抗氧化系統的測定
稱取0.5 g新鮮葉片,加入2 mL磷酸緩沖液(0.05 mol/L,pH為7.8),冰浴研磨,轉移至離心管中,再以2 mL的緩沖液清洗研缽,4 ℃下10 000 r/min離心20 min后,取上清液冷藏保存。依據湯葉濤等[20]的研究方法測定丙二醛(MDA)、過氧化氫(H2O2)和超氧陰離子(O2-)濃度。超氧化物歧化酶(SOD)、過氧化物酶(POD)和過氧化氫酶(CAT)的活性測定與Liu等[21]的方法相同。
1.5 高通量測序
1.5.1 DNA提取
參考de Bulgarelli等[22]的方法,隨機取植物根部(5 g)浸沒于無菌PBS溶液中,180 r/min孵育10 min后取出,此過程重復3次,將3次洗滌液匯總后過0.22 μm濾膜,收集濾膜備測植物根部微生物菌群。備測濾膜置于-80 ℃超低溫冰箱,避光保存。
1.5.2 微生物多樣性檢測與分析
根據 E.Z.N.A.? soil DNA kit (Omega Bio-tek,Norcross, GA, 美國)說明書進行DNA 抽提,使用1%的瓊脂糖凝膠電泳檢測DNA的提取質量,使用NanoDrop 2000 UV-vis spectrophotometer (Thermo Scientific, Wilmington,美國)測定DNA濃度和純度。利用高通量測序技術對系統內的不同微生物聚集形態進行分析,引物由上海生工生物工程股份有限公司制備,PCR 反應:預變性,95 ℃,3 min;變性,95 ℃,30 s;退火,56 ℃,30 s;延伸,72 ℃,40 s 變性至延伸步驟,重復35次。序列F:TCCTACGGGAG GCAGCAGT; 序 列R:GGACTACCAGGGTATCTA ATCCTGTT。在97%的相似水平下對所有序列進行OTUs (operational taxonomic units)劃分并與RDP(Ribosomal Database Project)數據庫比對,基于此進行物種組成、Alpha多樣性及群落結構分析。
1.6 數據統計分析
所有數據均采用Excel 2016軟件進行預處理,并用Origin 2017軟件進行繪圖;采用Alpha多樣性分析評價微生物群落的豐富度和多樣性,利用PICRUSt功能預測軟件進行微生物群落代謝功能預測。使用單因素方差法分析不同植物對相同濃度SMX的去除率以及同一植物在不同濃度SMX脅迫下生理指標間的差異性,其中當P<0.05時認為具有顯著性差異。
2 結果與討論
2.1 5種人工濕地植物對SMX的去除效果
5種植物水培30 d后對不同初始濃度的SMX(1~100 mg/L )的去除率如圖1所示。由圖1可見,當SMX濃度為1和10 mg/L 時,對SMX去除率最高的是水芹(65.39%、52.97%),其次是風車草(61.47%、48.56%)。SMX濃度為30~100 mg/L時,對SMX去除率最高的為風車草(35.87%~43.22%),其次是唐菖蒲(27.45%~35.21%)。值得注意的是,水蔥、水芹對SMX的去除率隨著時間的推移而顯著下降。SMX濃度較低時,抗生素對植物的脅迫作用較弱,此時植物根部通過主動吸收和物理吸附去除SMX,而高濃度SMX可能對這2種植物的根系產生較強影響。SMX的去除分為2個階段:前期大量SMX被吸附于植物根部;隨著抑制作用增強,根系活力受到影響,無法吸收根表富集的SMX,使得SMX從根部重新釋放于水中。周品成等[23]研究發現,隨著水培液中抗生素濃度的增加,高濃度(大于100 μg/L)的抗生素會抑制植物生長,使植株株高和葉綠素濃度顯著小于對照處理;Liu等[14]發現較高濃度(大于10 μg/L)環丙沙星、土霉素和磺胺嘧啶對蘆葦根活力及葉片葉綠素合成有抑制作用,而較低濃度(0.1~1.0 μg/L)抗生素則有促進作用。5種人工濕地植物中,唐菖蒲和風車草對1~100 mg/L的SMX的平均去除率分別為27.45%~45.32%和35.87%~61.48%。唐菖蒲為根莖型植物,耐污能力較強,而風車草為須根型植物,根系發達,能夠更好地適應和耐受抗生素環境,生物代謝活性高,這可能是2種植物具有較強SMX去除性能的重要原因。研究表明,人工濕地植物對抗生素環境的耐受性很可能取決于其根系發達程度,根系越發達,分泌的根系分泌物就越多,從而更好地緩解抗生素的脅迫和改善周圍的根際環境,降低外界環境毒性[22]。
2.2 SMX脅迫下唐菖蒲和風車草生理指標變化
2.2.1 根系活力
根系活力大小可以反映根系代謝強度大小。由圖2可見,SMX濃度為1和10 mg/L時,2種植物的根系活力均高于SMX濃度為0 mg/L時,說明植物根系對SMX脅迫有一定的抵抗能力,可通過提高代謝作用來緩解SMX對自身的傷害。鮑陳燕等[24]研究發現,在土霉素、恩諾沙星濃度為50~100 μg/L時,水芹根系活力并未受到抑制,反而進一步促進了水芹根系的生長。但張天瑩等[25]研究發現,磺胺二甲基嘧啶濃度達到10 mg/L、環丙沙星濃度達到5 mg/L時,均能抑制小麥的根系活力,且隨著抗生素濃度的升高小麥根系氧化還原力降低,根系活力逐漸減弱。本研究中,SMX濃度高于30 mg/L時,2種植物的根系活力顯著下降(均低于SMX濃度為0 mg/L時),且SMX濃度越大,根系活力受抑制程度越強,進而影響植物固氮能力,并且原生質形成和葉酸合成也會受到抑制,從而影響谷胱甘肽轉移酶和一系列抗氧化系統酶的合成表達[26]。可見,抗生素濃度一旦超過臨界濃度,就會抑制植物根系活力,影響根系養分的吸收。這與廖德潤等[27]的研究結果類似,其研究表明,低濃度的抗生素對空心菜植株的生長具有刺激效應,而高濃度條件則表現出抑制效應。
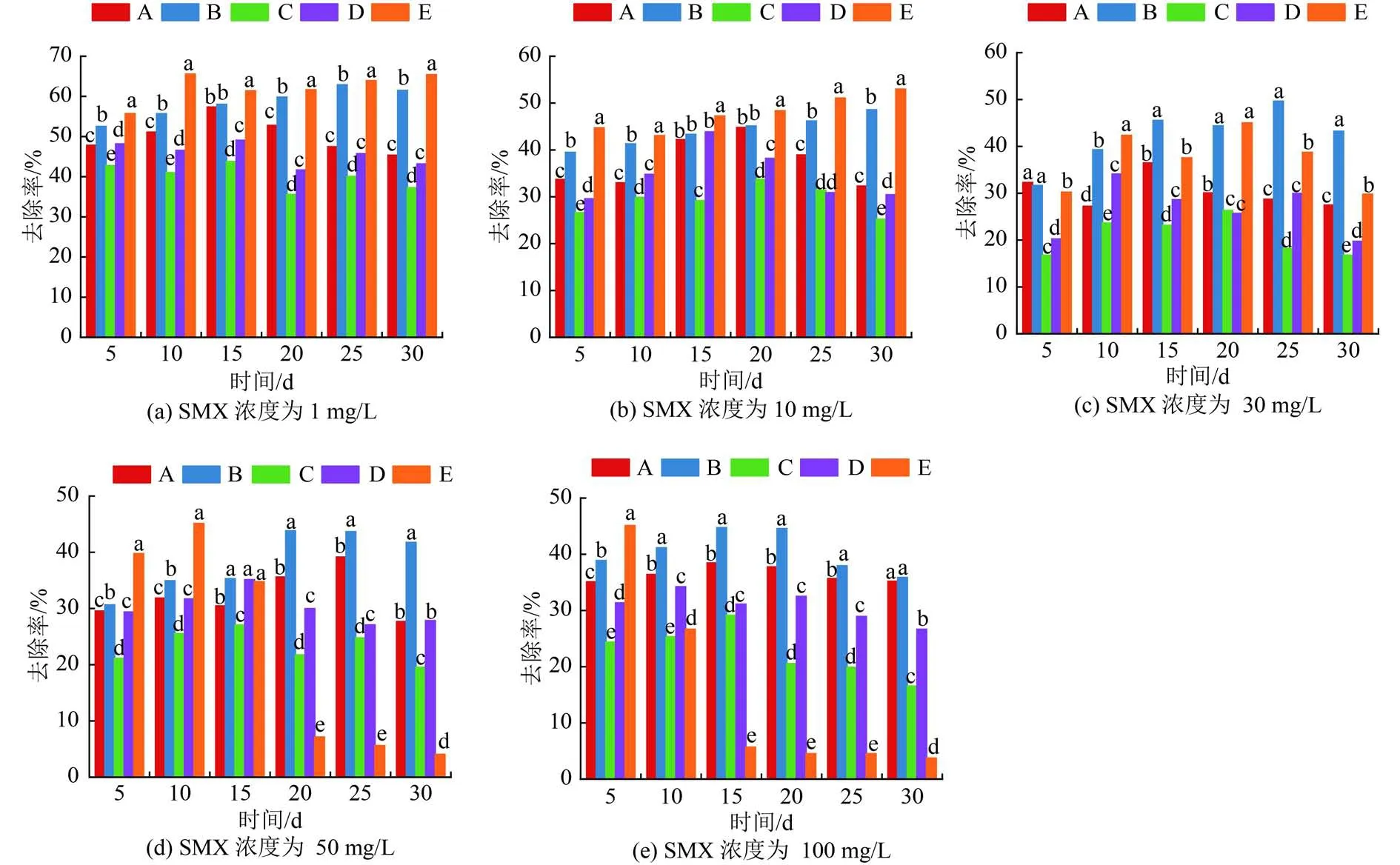
圖 1 5種植物水培30 d后對不同初始濃度SMX的去除率Fig.1 Removal rates of SMX with different initial concentrations of five plants after 30 days of hydroponic cultivation

圖 2 不同SMX濃度下唐菖蒲和風車草根系活力變化Fig.2 Changes of root activity of Gladiolus hybridus and Cyperus alternifolius in the presence of different initial concentrations of SMX
2.2.2 活性氧與抗氧化系統指標
植物細胞在代謝過程中,會通過光還原反應、梅勒反應及光呼吸等過程產生一系列活性氧自由基(ROS),如超氧陰離子(O2-)、過氧化氫(H2O2)、丙二醛(MDA)等[28]。ROS常被稱為植物體內的毒副作物,當ROS積累到超過植物抗氧化清除能力的程度時,可造成膜脂過氧化及蛋白質、DNA損傷。MDA是膜脂過氧化作用的終產物,也是表征膜系統受害程度的重要指標。本研究中,唐菖蒲和風車草體內ROS、H2O2和MDA隨SMX濃度上升而不斷增加(圖3)。當SMX濃度超過10 mg/L時,與0 mg/L相比,唐菖蒲和風車草體內MDA濃度最高增加1.66和1.45倍。Nie等[29]觀察到究乳糖酸紅霉素、鹽酸環丙沙星和SMX脅迫下羊角月牙藻(Pseudokirchneriella subcapitata)發生脂質過氧化,MDA濃度顯著增加。楊彎彎等[30]也觀察到抗生素脅迫下銅綠微囊藻中MDA濃度增加的現象。
植物體內抗氧化酶主要包括SOD、CAT、POD。SOD是超氧化物自由基清除劑,可將超氧化物催化轉化為O2和H2O,在植物抵抗外界環境脅迫中起著非常重要的作用。當植物處于逆境時,CAT等保護酶能有效地清除過氧化物所產生的活性氧物質,防御植物細胞膜過氧化,降低植物受傷害的程度。POD是植物體內普遍存在的、活性較高的一種酶,其活性大小反映了植物生長條件的好壞。由圖3可知,與對照組相比,SMX濃度為1 mg/L時,CAT、POD、SOD活性均升高,說明植物在SMX存在時受到了氧化脅迫,誘導了抗氧化酶活性,以清除過多的ROS,使植物對環境的適應能力增強而有利于水體污染物的去除。這與陳友媛等[31]的研究結果一致。當SMX濃度為50和100 mg/L時,由于植物體內ROS大量產生并積累,抑制了抗氧化酶的活性,該SMX濃度已經超過植物自身抗氧化酶系統保護的范圍,說明抗氧化酶系統保護是有限的。Riaz等[32]在試驗中發現,氟喹諾酮類抗生素濃度為300 mg/L時,抗氧化酶系統無法保護小麥免受抗生素增加的脅迫。因此,在SMX脅迫下,會促進植物體內ROS的產生,抑制植物抗氧化酶系統。
2.3 溫度脅迫下唐菖蒲和風車草生理指標變化
溫度是影響植物生長發育最重要的非生物因素之一[33],其不僅影響植物的生長,而且對植物體內的ROS含量、抗氧化酶系統產生明顯影響。通過人工模擬氣候室的溫控系統進行調控,不同溫度脅迫下唐菖蒲和風車草ROS含量及抗氧化酶活性變化如圖4所示。由圖4可知,隨著溫度降低,SOD、CAT、POD含量均減少。研究表明,低溫脅迫下植物抗氧化防御系統會遭到破壞,酶活性下降[34]。但本研究發現,O2-和MDA含量隨溫度的降低而逐漸增加。這是由于植物體內的活性氧一般處于動態平衡,低溫脅迫能引起植物體內活性氧含量增加,植物膜脂過氧化程度加大,導致植物MDA產生量增加[35]。李任任等[36]研究也發現,低溫出苗下,甜菜幼苗葉片中MDA含量較高。因此,溫度的變化在一定程度上刺激植物活性氧含量增加,抑制了植物抗氧化酶的活性。
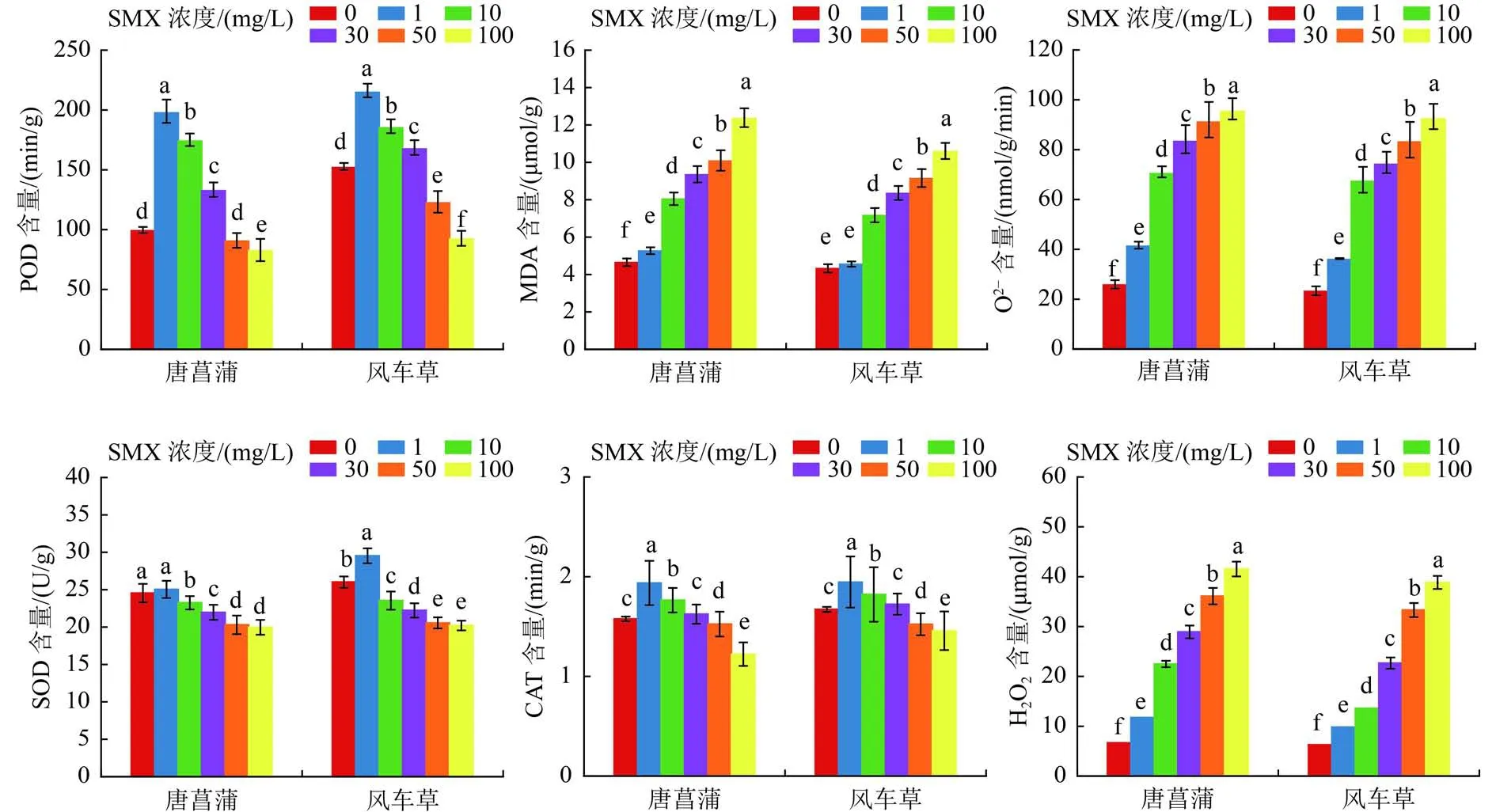
圖 3 不同濃度SMX對唐菖蒲和風車草的活性氧自由基含量和抗氧化酶活性的影響Fig.3 Effects of SMX at different concentrations on reactive oxygen species content and antioxidant enzyme activity of Gladiolus hybridus and Cyperus alternifolius
2.4 微生物群落多樣性分析
2.4.1 多樣性與豐富度指數
采用α多樣性指數(Shannon-Weiner指數、ACE指數、Chao指數、Simpson指數和樣品覆蓋率)評價唐菖蒲和風車草的物種豐富度和微生物群落多樣性[37-38],結果如表1所示。由表1可知,所有樣本覆蓋率均超過98%,說明序列分析可以覆蓋幾乎完整的細菌種群和相應數量的OTUs[39-40]。添加1 mg/L SMX時,唐菖蒲和風車草根際微生物Chao指數大于對照組,而在該濃度下根系活力也有所提高,說明添加1 mg/L 的SMX促進植物根系活力提升的同時也促進微生物物種豐富度增加。Xu等[41]研究表明,低劑量抗生素可刺激微生物群落活性,增加根際細菌群落的豐度和多樣性。但添加50 mg/L 的SMX時,唐菖蒲和風車草根際微生物Chao指數小于添加1 mg/L的SMX。Xie等[40]的研究同樣發現,Chao指數在MFC系統中隨著SMX濃度增加而降低。
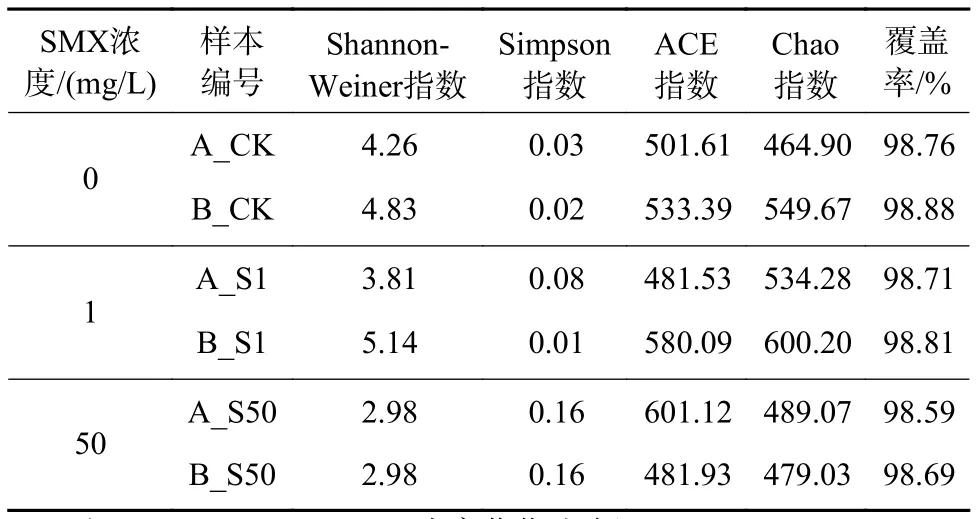
表 1 樣品中微生物群落組成的豐富度指數Table 1 Richness index of microbial community composition in the sample
Shannon-Weiner指數常用于表征物種的多樣性,同時反映物種的豐富度和均勻度[42]。添加1 mg/L的SMX后,唐菖蒲Shannon-Weiner指數從4.26降至3.81,風車草Shannon-Weiner指數從4.83增至5.14。在SMX濃度為50 mg/L 時,唐菖蒲和風車草根際微生物Shannon-Weiner指數相比于SMX為0和1 mg/L 時均顯著降低。其原因可能是在SMX去除過程中起作用的微生物作為優勢種保留下來,而其他微生物被消除,導致物種豐富度降低。同樣的現象在污水處理廠中也被發現,如魏健等[43]研究發現,向污水處理廠的曝氣生物濾池中逐漸通入抗生素廢水,OTUs 從264降至220,微生物多樣性指數從3.06降至3.01。類似的研究還表明,過度的抗生素污染會降低根際微生物的多樣性[44]。
2.4.2 根際微生物群落結構與組成分析
在不同水平上檢測微生物的相對豐度,以確定不同植物-微生物耦合體系處理SMX時微生物群落組成和結構的響應特征(圖5)。
在門水平上〔圖5(a)〕,按相對豐度從大到小選擇11個菌門(相對豐度均大于1%)進行分析。變形菌門(Proteobacteria)是各樣品中的優勢菌門(豐度為72.87%),其次是放線菌門(Actinobacteria,豐度為8.49%)和擬桿菌門(Bacteroidetes,豐度為6.08%),說明SMX的引入增加了變形菌門、放線菌門、擬桿菌門的相對豐度,這3個優勢菌門在處理含抗生素廢水的人工濕地中分布廣泛[45]。其中,變形菌門包括很多與碳、氮和硫循環中相關的細菌,擬桿菌門與有機物的降解密切相關[46-47]。唐菖蒲和風車草根際微生物群落組成在門水平上變化較明顯,隨著SMX濃度增加,變形菌門、厚壁菌門相對豐度有不同程度增加。先前有研究表明,變形菌門包括多種抗生素抗性細菌(ARB),SMX的加入可以促進變形菌門在體外循環中的生長,并且變形菌有助于芳香族化合物的降解[48]。厚壁菌門可以產生芽孢,能夠抵抗外部極端環境,并且厚壁菌門及其附屬菌群能夠分泌一種降解廢水中有機污染物的細胞外酶,如纖維素、脂肪酶和蛋白酶等[42]。此外,系統內放線菌門、擬桿菌門相對豐度隨SMX濃度升高而減小。因此,抗生素脅迫影響根際微生物對污染物和有機物的吸收、降解和功能代謝。
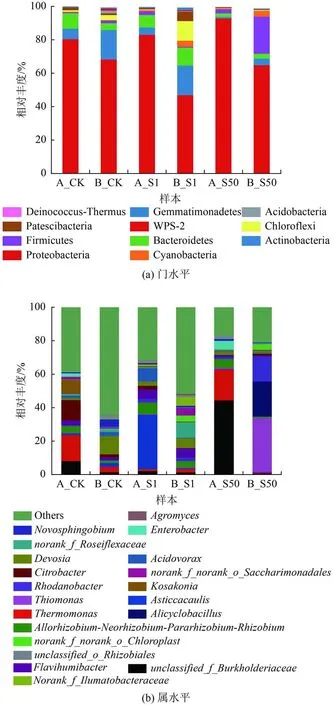
圖 5 不同水平上檢測到的微生物的相對豐度Fig.5 Relative abundance of microorganisms detected at different levels
在屬水平上〔圖5(b)〕,按相對豐度從大到小選擇20個菌屬(相對豐度均大于1%)進行分析。優勢菌屬主要為unclassified_f_Burkholderiaceae(豐度為9.41%)、耐熱單胞菌屬 (Thermomonas,豐度為6.70%)、不粘柄菌屬 (Asticcacaulis,豐度為 6.19%)。SMX濃度為0 mg/L時唐菖蒲根際微生物主要優勢菌屬為耐熱單胞菌屬、檸檬酸桿菌屬 (Citrobacter),風車草根際微生物主要優勢菌屬為德沃斯氏菌屬(Devosia)、鞘氨醇菌屬 (Sphingomonas)。添加1、50 mg/L SMX后,根際微生物群落的菌屬豐度發生不同的變化。唐菖蒲中耐熱單胞菌屬、unclassified_f_Burkholderiaceae的豐度先降低后升高,說明伯克霍爾德氏菌屬逐漸成為磺胺耐藥菌;而檸檬酸桿菌屬的豐度隨著SMX濃度的增加而降低。unclassified_f_Burkholderiaceae作為變形菌門中具有代表性的菌科,其中大部分菌屬具有發酵代謝作用。Qi等[49]在研究中也發現unclassified_f_Burkholderiaceae可能對SMX中的苯環降解起到關鍵作用。在風車草對照組中發現的優勢菌屬,在添加1和50 mg/L的SMX系統內發生了變化,羅河桿菌屬(Rhodanobacter)、硫單胞菌屬(Thiomonas)成為新的優勢菌屬。溫慧洋[50]在研究中發現,A硫單胞菌屬相對豐度的升高可能會導致SMX中S=O雙鍵發生斷裂,進而提高抗生素的去除效率。
2.5 微生物群落代謝功能預測
通過PICRUSt對抗生素脅迫下植物根際微生物群落level2水平代謝功能進行預測,結果如圖6所示。由圖6可知,當SMX濃度為1 mg/L時,唐菖蒲、風車草微生物代謝功能基因豐度大于SMX濃度為50 mg/L時。微生物細菌的生物降解和代謝功能基因隨著SMX濃度升高而降低。Zhang等[51]研究發現,抗生素濃度會顯著影響植物根系中參與無機離子、碳水化合物的轉運及核苷酸和氨基酸的轉化、代謝等功能基因的豐度。微生物群落代謝功能變化是復雜的,結合本研究結果可知,不同濃度的抗生素對于微生物群落代謝功能的影響不同,磺胺甲惡唑對微生物代謝功能變化的影響,是否有利于提高某些微生物的生存能力有待進一步研究。
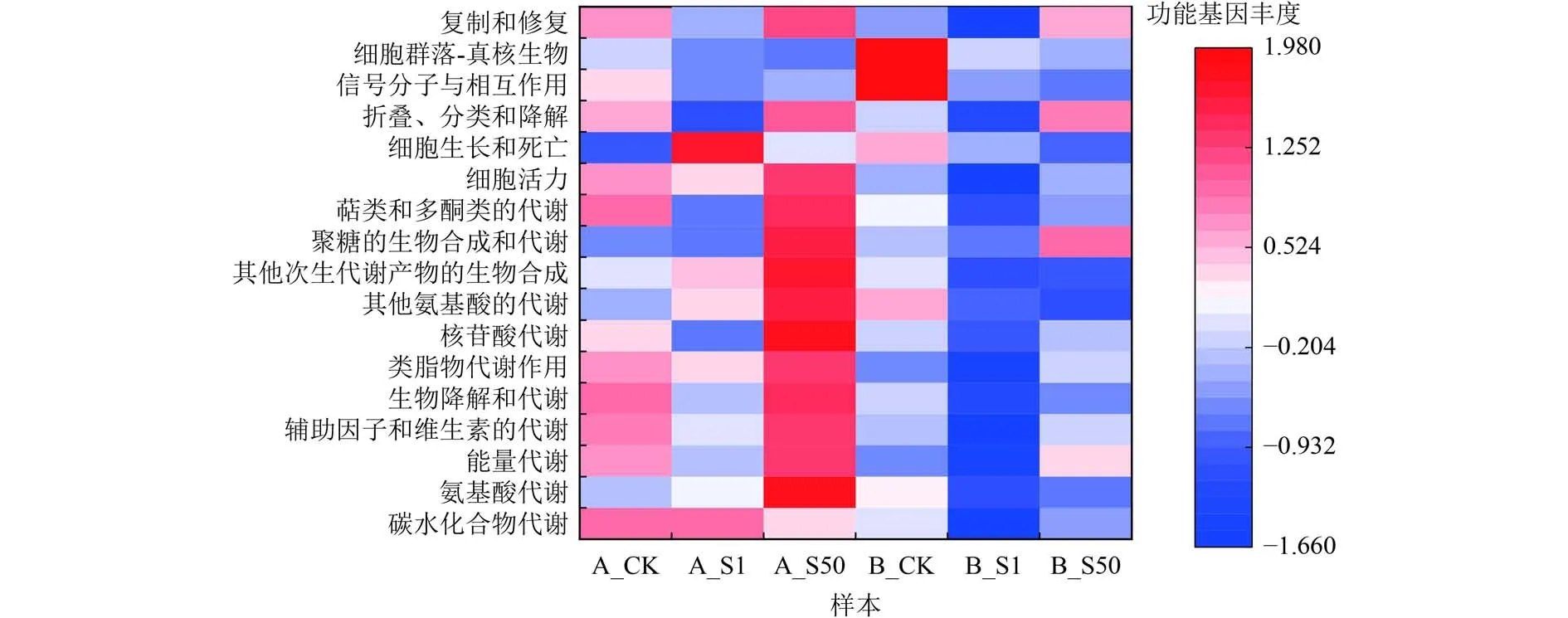
圖 6 微生物群落代謝功能基因豐度Fig.6 Metabolic gene abundance in microbial community
3 結論
(1)5種人工濕地植物中,唐菖蒲和風車草對1~100 mg/L SMX的去除率較高,平均去除率分別為27.45%~45.32%、35.87%~61.48%。二者根系發達,具有較強的耐污能力和較高的地上部分生物量,能夠很好地適應和耐受抗生素環境,生物代謝活性高。
(2)在SMX脅迫下,當SMX濃度高于30 mg/L時,唐菖蒲和風車草的根系活力顯著下降,且SMX濃度越大,根系活力受抑制程度越強。隨著SMX濃度的升高,促進植物體內ROS的產生,抑制植物抗氧化酶系統。低溫脅迫下,植物體內ROS含量逐漸升高,植物抗氧化酶活性逐漸降低,植物抗氧化酶系統受到抑制。
(3)唐菖蒲和風車草根際微生物群落組成在門水平上變化較明顯,SMX濃度升高時,變形菌門、厚壁菌門成為優勢菌門,二者可能對SMX降解起著重要作用;在屬水平上,伯克霍爾德氏菌屬和硫單胞菌屬的富集可能對SMX的降解起到關鍵作用。對微生物群落代謝功能進行預測發現,不同濃度抗生素對微生物群落代謝功能的影響不同,SMX對微生物代謝功能變化的影響是否有利于提高某些微生物的生存能力,尚有待進一步研究。

