高寒草甸不同黃帚橐吾密度斑塊的植物群落結構特征
王玉琴, 宋梅玲, 周 睿, 王宏生, 馬玉壽
(省部共建三江源生態與高原農牧業國家重點實驗室, 青海大學畜牧獸醫科學院, 青海 西寧 810016)
由于草地生態系統本身具有脆弱性,以及在全球氣候變化和過度放牧等人為因素的共同作用下,草地生態系統發生不同程度的退化[1-2]。毒害草的滋生和繁衍是草地退化的早期信號,由于毒害草自身的繁殖優勢,對不良環境有較強的適應能力,以及家畜的拒食行為等,導致其在高寒草地上大面積滋生蔓延,形成了以毒害草為優勢種的毒草型退化草地[3-4]。毒害草型退化草地與其他退化草地不同的是沒有出現地表裸露、水土流失等一般性退化特征,卻出現了地上總生物量、總蓋度不變時,優良牧草減少的情況[5]。據不完全統計,2020年青海省毒害草的發生面積為167×104hm2,危害面積為93×104hm2,主要毒害草有瑞香科的狼毒(Stellerachamaejasme),菊科的黃帚橐吾(Ligulariavirgaurea),豆科的黃花棘豆(Oxytropisochrocephala)以及玄參科的甘肅馬先蒿(Pediculariskansuensis)等[6],其中,黃帚橐吾作為典型的克隆生長植物,已大面積入侵高寒草甸,被認為是指示高寒草甸草地植被退化的重要物種[7-9],嚴重影響高寒草地生態系統及畜牧業的可持續發展。
毒害草的出現是草地植被長期逆向演替的產物,其與其他植物爭奪營養空間,妨礙群落中優良牧草的正常生長,導致草地群落的改變,使草地產量和質量下降[10]。如狼毒影響草地群落優良牧草比例、多樣性指數以及各科植物在群落中的相對重要性[11-12]。黃帚橐吾使雜類草比例上升,而禾草類生物量顯著降低[13]。同時,毒害草通過化感作用在草地群落中獲得競爭優勢,抑制優良牧草的正常生長。如黃帚橐吾體內含有特殊揮發物質萜類化合物等,抑制其他牧草的萌發及生長[14],其水浸提液對高寒草地優勢牧草種子萌發以及幼苗生長具有抑制作用[15];黃帚橐吾種子對本地禾草種子萌發、平均萌發時間和根系生長速率等方面具有潛在的化感作用[16]。另外,隨著生境喪失和草地破碎化程度的日益加重以及環境壓力的不均勻性影響,黃帚橐吾在景觀水平上表現為不同數量及大小的群落斑塊化[13,17]。植物群落的斑塊化是構成植物群落及生物多樣性持續發展的基礎,推動著草地向不同的方向演替[18],研究斑塊的群落特征,是了解植物群落變化過程和格局形成機制的突破口。因此,本研究以不同密度黃帚橐吾微斑塊為研究對象,分析不同密度斑塊的草地群落結構以及生產力的變化情況,探討黃帚橐吾擴散過程中高寒草甸群落的變化動態,為闡述黃帚橐吾入侵后草地群落維持和演替機制提供理論基礎,也為黃帚橐吾危害草地的治理和恢復提供依據。
1 材料與方法
1.1 試驗區概況
本研究試驗樣地位于青海省海北藏族自治州海晏縣青海湖鄉達玉德吉村,地理坐標為37°4′26″N,100°54′34″E,海拔3 250 m左右,氣候屬高原大陸性氣候,春季干旱多風,夏季涼爽短促,冬季寒冷漫長。2016—2021年年均氣溫1.83℃,年均降水量445.38 mm,其中80%以上的降水量集中在5—9月,年均日照2 603.7 h,年蒸發量為1 400 mm左右,無絕對無霜期。采樣點草地類型為高寒草甸草原,草地群落優勢種為黃帚橐吾(Ligulariavirgaurea)、線葉嵩草(Kobresiacapillifolia)、矮嵩草(Kobresiahumilis)、高原早熟禾(Poaalpigena)、垂穗披堿草(Elymusnutans)、異針茅(Stipaaliena)、萹蓿豆(Melilotoidesruthenica)、美麗風毛菊(Saussureapulchra)、秦艽(Gentianamacrophylla)、黑褐苔草(Carexatrofusca)、鈍裂銀蓮花(Anemoneobtusiloba)、矮火絨草(Leontopodiumnanum)等;土壤為高山草甸土。采樣地為全年自由放牧,長期過度放牧導致黃帚橐吾種群密度持續增加。
1.2 樣地設置
選取黃帚橐吾危害嚴重,且植被分布較為均勻,地勢平坦的區域,設置50 m×50 m的樣地4個,在每個樣地內根據密度等級隨機選定6個不同密度黃帚橐吾斑塊,編號分別為D0,D1,D2,D3,D4,D5,具體情況見表1,每個斑塊直徑>100 cm,每個密度斑塊設置3個重復,在8月植株生長旺盛季進行植被調查及樣品的采集工作。

表1 不同斑塊基本植被概況Table 1 Basic condition of each patch
1.3 植被調查和樣品分析
分別在每個密度斑塊中心隨機選擇1個0.5 m×0.5 m的樣方,統計樣方內出現的植物種類,測定植物高度、蓋度,分種收獲后在烘箱中烘至恒重,稱量各物種的地上生物量,并在樣方內采用內徑7 cm的根鉆,沿樣方對角線靠中間打兩鉆,分別采集0~10 cm和10~20 cm土樣,裝網兜后用自來水洗干凈,分離出地下部分,裝入信封袋后在烘箱中105℃殺青30 min,再在65℃下烘至恒重,稱量地下生物量[19]。
1.4 計算方法
1.4.1物種重要值、豐富度指數、多樣性指數和均勻度指數具體計算公式如下:

(1)
豐富度指數
Patrick指數(R):R=S
(2)
多樣性指數
(3)
(4)
(5)
式中,S為樣地樣方的平均物種數;Pi=Ni/N,Pi代表物種i的相對重要值,N代表樣方各物種重要值總和,Ni代表樣方內第i物種的重要值[20]。
1.4.2生態位寬度計算 生態位寬度采用Herbert修正后的Levins生態位寬度(Levins,1968)進行計算:
式中:Bj表示第j個物種的生態位寬度,其值域為[0,1];Pjk表示第j個物種在第k個資源水平下的重要值占該物種在所有資源水平上的重要值總和的比例,t為樣方總數[21]。
1.5 數據分析處理
使用Excel對數據進行整理和初步分析,運用SPSS22.0軟件對黃帚橐吾不同密度斑塊間的植被群落物種多樣性指數、地上和地下生物量等進行單因素方差分析,采用Pearson相關系數進行草地植被物種多樣性指數與草地生物量的相關性分析,顯著性區間定義為95%水平,圖表數據均采用平均值±標準誤表示。繪圖采用SigmaPlot 14.0軟件。
2 結果與分析
2.1 密度斑塊草地群落主要物種重要值及生態位寬度
通過計算重要值發現,各密度斑塊之間群落結構存在顯著不同(表2)。在每個斑塊內,高原早熟禾、矮嵩草和線葉嵩草的重要值均占有較高比例(D0 34.42%,D1 28.79%,D2 30.65%,D3 30.10%,D4 25.68%,D5 20.09%),在該草地群落中占據優勢地位。隨著黃帚橐吾的密度增加,禾本科和莎草科重要值明顯降低,黃帚橐吾逐漸成為建群種,而其他雜類草的重要值小幅度波動,但變化不大。各斑塊物種的生態位寬度也存在差異(表3)。D0生態位寬度排前三的依次是垂穗披堿草(0.998)、米口袋(0.995)、鈍裂銀蓮花(0.969),D1依次是垂穗披堿草(0.979)、黃帚橐吾(0.965)、矮嵩草(0.946),D2依次是異針茅(0.993)、秦艽(0.986)、黃帚橐吾(0.975),D3依次是矮嵩草(0.999)、秦艽(0.995)、高原早熟禾(0.978),D4是狼毒(0.992)、黃帚橐吾(0.989)、鈍裂銀蓮花(0.984),D5是黃帚橐吾(0.986)、垂穗披堿草(0.982)、毛果婆婆納(0.976)。同時,通過對物種重要值與生態位寬度相關性分析發現,在一定范圍內,各斑塊物種生態位寬度與重要值呈顯著正相關(P<0.05)(圖1)。
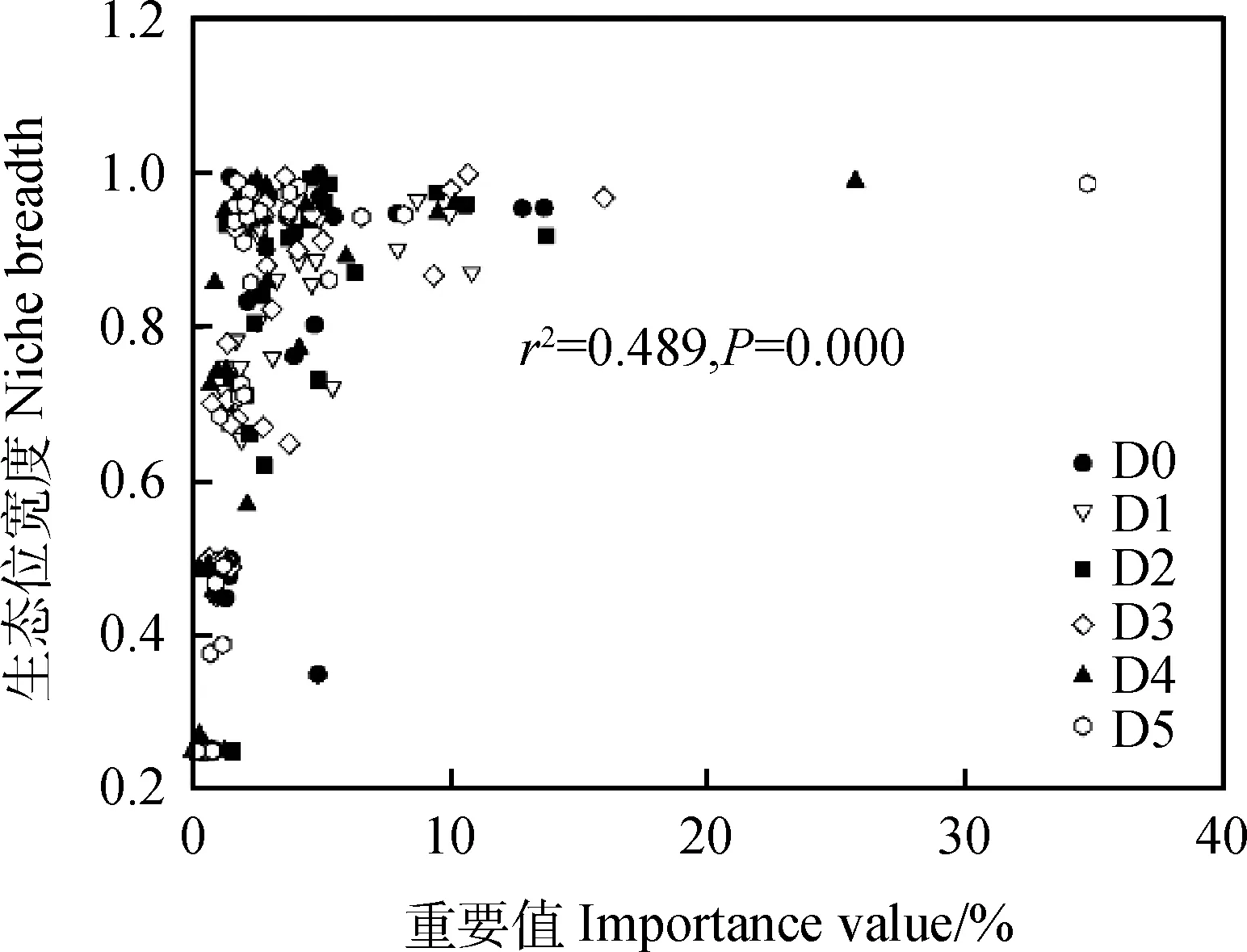
圖1 各密度斑塊重要值與生態位寬度相關性分析Fig.1 Correlation analysis between plant species important value and niche breadth of different density patches
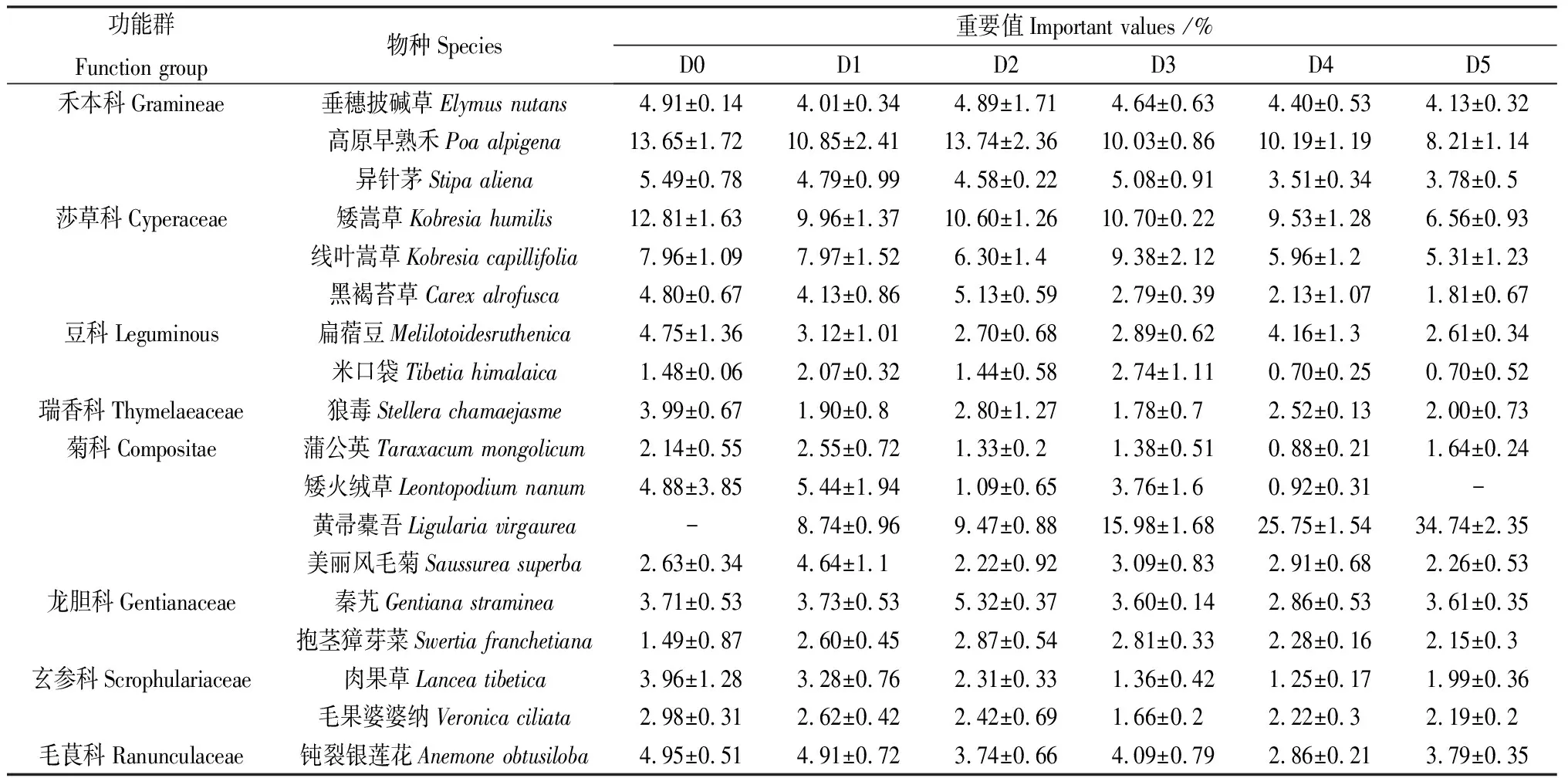
表2 各密度斑塊草地群落主要優勢物種組成及其重要值Table 2 Species composition and important values of grassland community in different density patches
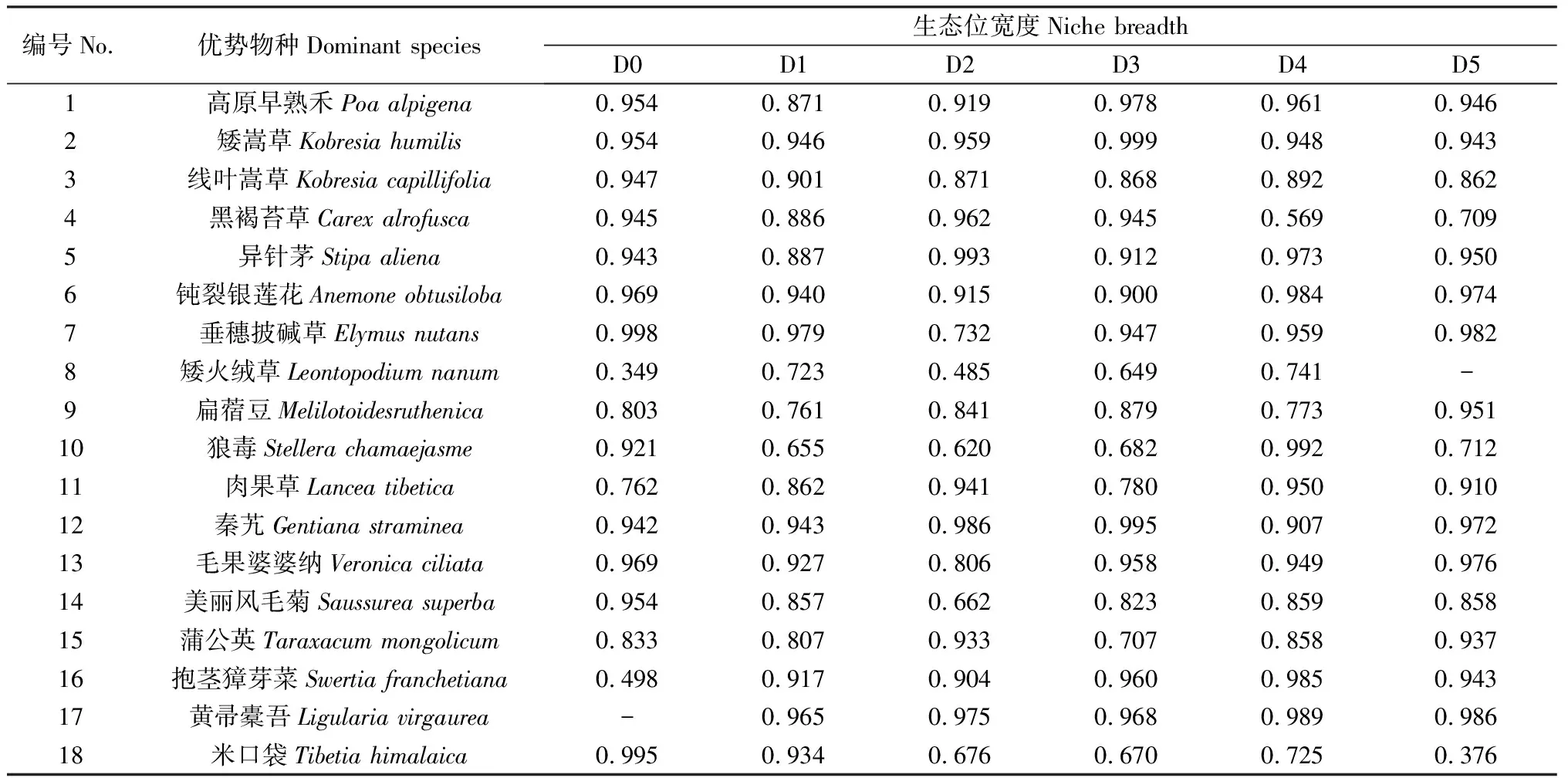
表3 各密度斑塊優勢物種的生態位寬度Table 3 Niche breadth of dominant species in different density patches
2.2 密度斑塊草地群落物種多樣性變化
通過比較黃帚橐吾各密度斑塊物種多樣性得到(圖2),隨著黃帚橐吾密度的增加,各處理的物種多樣性均呈先增加后降低的趨勢,其中香農維納指數表現為D1和D2顯著高于D4和D5(P<0.05),與D0和D3差異不顯著;均勻度指數為D1最高,其次為D2,但與D0和D3差異不顯著,D0~D3 4個處理顯著高于D4和D5(P<0.05);豐富度指數表現為D4>D1=D3>D5=D0,各斑塊間差異不顯著;優勢度指數為D1>D2>D0>D3>D4>D5,D0~D3 4個處理間差異不顯著,但與D4和D5差異顯著(P<0.05)。

圖2 各密度斑塊草地群落物種多樣性變化Fig.2 Changes of species diversity of grassland communities in different density patches注:不同小寫字母表示不同斑塊間差異顯著(P<0.05),下同Notes:Different lowercase letters indicate significant differences between different patches at the 0.05 level,the same as below
2.3 各密度斑塊草地群落地上生物量變化
各密度斑塊植被地上生物量的變化情況如圖3所示。總地上生物量是隨著黃帚橐吾密度的增加逐漸升高,D4和D5顯著高于其他斑塊(P<0.05)。去除黃帚橐吾生物量后的總生物量比較得到D1生物量最高,其次為D4和D2,均顯著高于D5(P<0.05)。禾本科生物量表現為D4顯著高于D5(P<0.05),但與其他斑塊差異不顯著;莎草科生物量為D4>D2>D1>D3>D0>D5,各斑塊間差異不顯著;豆科生物量為D4>D0>D1>D3>D2>D5,各斑塊間差異也不顯著;雜類草生物量表現為逐漸降低趨勢,其中D1顯著高于D3,D4和D5(P<0.05),與D0和D2差異不顯著,同時D0顯著高于D5(P<0.05)。
2.4 各密度斑塊草地群落地下生物量變化
各密度斑塊草地地下生物量變化明顯(圖4),0~20 cm土層的總地下生物量為D1顯著高于D4(P<0.05),其他各斑塊差異不顯著;0~10 cm土層的地下生物量的變化趨勢與總地下生物量的變化趨勢一致,為D1顯著高于D4(P<0.05),其他斑塊間差異不顯著;10~20 cm土層的地下生物量為D4顯著高于D0和D1(P<0.05),D5與D4差異不顯著,但與D1差異顯著(P<0.05),其他斑塊間差異不顯著。
2.5 各密度斑塊草地群落物種多樣性指數與草地生物量的關系
通過相關性分析可知(表4),群落物種多樣性指數與生物量之間存在一定的相關性,總地上生物量與均勻度指數呈極顯著負相關(P<0.01),與優勢度指數呈顯著負相關(P<0.05),豐富度指數與莎草科生物量呈顯著正相關(P<0.05),雜類草生物量與香農維納指數、均勻度指數呈顯著正相關(P<0.05),以及總地下生物量與0~10 cm地下生物量極顯著正相關(P<0.01),10~20 cm地下生物量與雜類草地上生物量顯著負相關(P<0.05)。
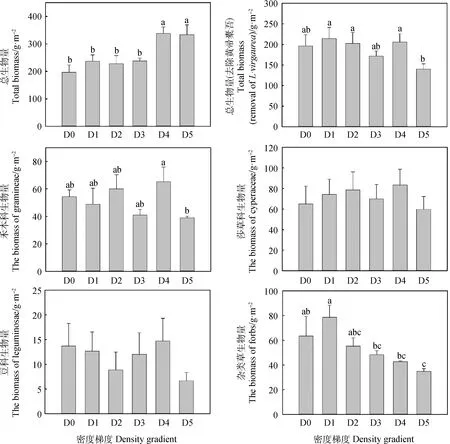
圖3 各密度斑塊草地群落地上生物量的變化Fig.3 Changes of aboveground biomass of grassland communities in different density patches
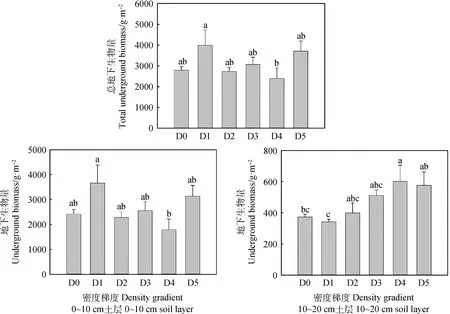
圖4 各密度斑塊草地群落地下生物量的變化Fig.4 Changes of underground biomass of grassland communities in different density patches
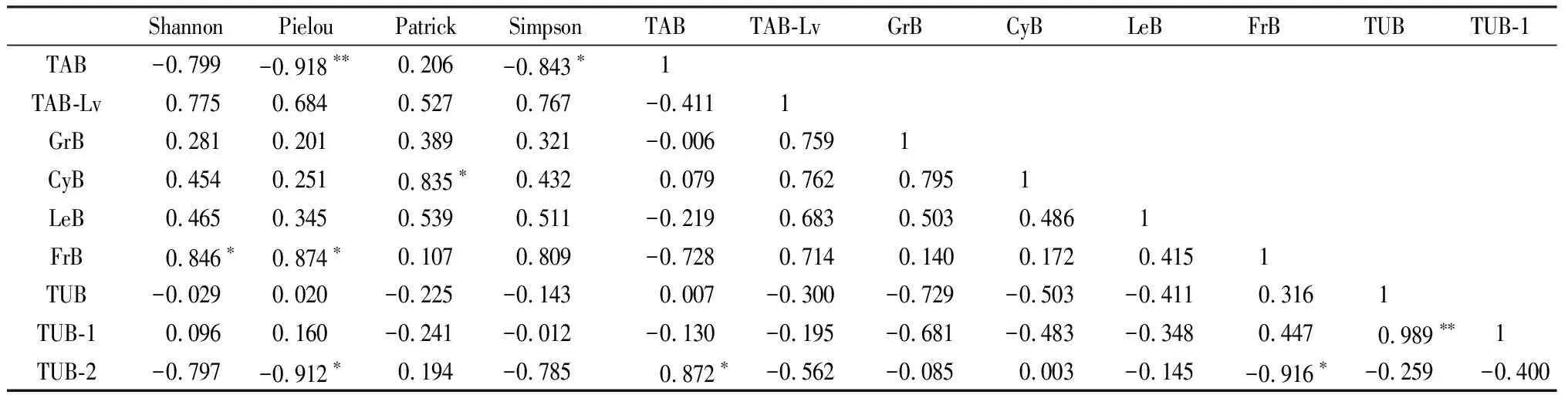
表4 草地群落物種多樣性指數與草地生物量的相關性分析Table 4 Correlation analysis between grassland community diversity index and grassland biomass
3 討論
草地群落中物種的更替是草地退化過程最直接的表現[22]。重要值體現了物種在群落中的優勢程度,其大小能夠反映不同種群在群落中的重要程度及種群所處的地位[23],而生態位寬度則反映了植物種群對環境資源的利用能力,明確各種群的群落地位及結構[24]。在本研究中,高原早熟禾、矮嵩草和線葉嵩草的重要值在D1斑塊中占有較高比例,表明這3種植物對群落的構建具有明顯的控制作用[25],但隨著黃帚橐吾密度的增加,禾本科和莎草科重要值明顯降低,黃帚橐吾逐漸成為建群種,且在黃帚橐吾擴散過程中,高生態位的垂穗披堿草逐漸被替代,取而代之的是黃帚橐吾、狼毒等植物,這一結果說明黃帚橐吾的擴散對垂穗披堿草、矮嵩草等優良牧草形成競爭,造成這種情況的原因可能是黃帚橐吾憑借較快的生長繁殖策略,以及通過分泌化感物質對周圍的優良牧草產生抑制作用[12,15]。另外,在研究中,優良牧草的重要值和生態位寬度結果表現不一致,這與鄭秋敏等[26]的結果一致,說明生態位寬度與重要值反映出的該物種在群落中的地位并非完全一致。通過對物種重要值與生態位寬度相關性分析發現,在一定范圍內,各斑塊物種生態位寬度與重要值呈飽和曲線關系,該結果與盧煒麗等[27]的結果重要值和生態位寬度二者呈線性關系不一致,這說明生態位寬度不僅受重要值的影響,還可能是同一生境內資源狀態不均一,物種分布頻率和分布幅度不一致造成的[28]。
生物多樣性是維持生態系統功能和提供生態系統服務的關鍵,草地物種多樣性是物種豐富度和均勻度的綜合體現,草地物種的多樣性越高,說明系統越穩定,草地越健康[29-31]。在本研究中,隨著黃帚橐吾密度的增加,各斑塊多樣性指數均表現為先增加后降低的趨勢,且在D1~D2之間香農維納指數、均勻度指數和優勢度指數均達到最高值,這說明當黃帚橐吾密度在10~20株·0.25 m-2時,對草地多樣性的維持具有積極作用,但隨著密度的增加,草地多樣性遭到一定破壞,這一結果與尹海燕等[11]的結果一致。毒害草比例的增加,降低了草地多樣性指數,原因可能是隨著密度的增加,黃帚橐吾通過資源競爭和化感作用抑制了禾本科和莎草科等優良牧草的生長,進而使群落物種多樣性降低。通過比較地上生物量得到,隨著黃帚橐吾密度的增加,草地總地上生物量顯著上升,這主要是由于黃帚橐吾密度越大,其生物量越大,當去除黃帚橐吾生物量后,各斑塊生物量表現為D1,D2和D4顯著高于D5,其他斑塊間差異不顯著,這一結果也印證了趙成章[5]的結果,毒害草造成草地植被總量不變,而優良牧草密度下降。
生物量的地上-地下分配反映了植物的生長策略[32],各功能群生物量反映了不同類型植物在群落中的地位和作用[33]。在本研究中禾本科、莎草科和豆科植物的地上生物量在D4時達到最大值,但除了禾本科生物量表現一定的顯著性外,莎草科和豆科在各密度斑塊間差異均不顯著,這說明禾本科牧草對黃帚橐吾密度的響應比較明顯,而雜類草生物量在各斑塊間變化明顯,在D1達到最大值,后隨著密度的增加,雜類草生物量顯著降低,這說明黃帚橐吾對雜類草的影響較大,隨著黃帚橐吾密度的增大,遮擋了下層雜類草植物的光照,使得雜類草生物量降低。地下生物量隨著草地退化呈下降趨勢[34],且地下生物量對草地退化程度的響應比地上生物量更敏感[35]。在本研究中總地下生物量在D1時最大,隨著密度的增加,總地下生物量逐漸降低,這說明隨著黃帚橐吾密度的增加,使地上植被多樣性減少,地下根系隨之減少,而在密度為D5時,總地下生物量有增大趨勢,這可能是由于黃帚橐吾密度的增加,使其地下生物量增加,造成地下生物量的整體增加。0~10 cm土層的地下生物量的變化趨勢與總地下生物量的變化趨勢一致,而10~20 cm土層的地下生物量則與之相反,隨著密度的增大呈顯著增加趨勢,這可能是黃帚橐吾根系主要集中在10~20 cm土層。李軍豪等[36]的研究表明隨著草地退化程度的加劇,地下生物量明顯減少,這進一步說明在本研究中隨著黃帚橐吾密度的增加,草地有退化趨勢。通過分析物種多樣性和草地生物量的關系得到,莎草科和雜類草生物量對草地物種多樣性影響較大,這可能是在各密度斑塊內,莎草科受黃帚橐吾的影響不大,而雜類草受黃帚橐吾的影響比較大,這兩個功能群在群落中起到主要作用。而總地上生物量與10~20 cm土層的地下生物量呈顯著正相關,雜類草地上生物量與10~20 cm土層的地下生物量呈顯著負相關,這也證實了總地上生物量的變化受黃帚橐吾密度影響較大,同時黃帚橐吾的根系主要集中在10~20 cm土層中。
4 結論
隨著黃帚橐吾密度的增加,優勢牧草逐漸被黃帚橐吾替代,成為草地群落的建群種,群落物種多樣性表現為先升高后降低的趨勢,在黃帚橐吾密度介于D1~D2間時多樣性指數具有較高值。去除黃帚橐吾后的總地上生物量、總地下生物量在D1時具有最高值。因此,當黃帚橐吾的密度在10~20株·0.25 m-2左右時,對草地穩定性的維持具有積極作用,而當密度超過80株·0.25 m-2時,草地多樣性和生產力遭到破壞,進而導致草地退化。

