西藏野生垂穗披堿草EnCBL10基因的克隆與功能研究
張慎彤, 高 浩, 張金鵬, 任智慧, 姜惠娜, 其美拉姆, 普布卓瑪, 付娟娟*
(1. 西北農(nóng)林科技大學(xué)草業(yè)與草原學(xué)院, 陜西 楊凌 712100; 2.西藏自治區(qū)拉薩市曲水縣自然資源局, 西藏 拉薩 850000; 3. 西藏自治區(qū)農(nóng)科院草業(yè)科學(xué)研究所, 西藏 拉薩 85000)
垂穗披堿草(ElymusnutansGriseb.)是青藏高原高寒草原和草甸的重要禾本科牧草,是維持高寒地區(qū)生態(tài)平衡的重要植物之一,是青藏高原地區(qū)人工草地的重要飼草,在草地畜牧業(yè)中優(yōu)勢(shì)突出,同時(shí)也是麥類作物的野生近緣種,具有麥類作物和牧草遺傳多樣性的寶貴基因[1]。廣布于高寒缺氧極端生境條件下的西藏野生垂穗披堿草是研究植物抗逆機(jī)理較理想的優(yōu)質(zhì)牧草,具有重要的應(yīng)用價(jià)值。
鈣調(diào)磷酸酶B類蛋白(Calcineurin B-Like Proteins,CBLs)是鈣信號(hào)通路中的重要成員,在植物非生物脅迫應(yīng)答中具有重要作用。在響應(yīng)環(huán)境脅迫時(shí),CBLs蛋白可以感知細(xì)胞中的Ca2+波動(dòng),與蛋白激酶CIPKs相互作用,構(gòu)成植物CBL-CIPK信號(hào)通路,調(diào)控植物體內(nèi)Ca2+信號(hào)的傳遞并誘導(dǎo)下游的防御響應(yīng)[2-3]。Kim等[4]研究發(fā)現(xiàn)CBL10能夠與CIPK24蛋白在液泡膜互作,將Na+隔離在液泡中,從而解毒鹽脅迫對(duì)植物細(xì)胞的損傷。最近的研究也表明CBL10缺失會(huì)引起植物地上部分對(duì)鹽敏感,與cbl4和cbl10單突變體相比,cbl4cbl10雙突變體對(duì)鹽更敏感,表明CBL4和CBL10各自調(diào)控不同的耐鹽途徑[5]。與之相似,番茄(Solanumlycopersicum)中SlCBL10基因通過(guò)調(diào)節(jié)液泡中的Na+和Ca2+平衡,維持過(guò)表達(dá)SlCBL10植株中較低的Na+/Ca2+比例,從而提高其耐鹽性[6]。Kang和Nam[7]研究發(fā)現(xiàn)CBL10基因能夠正向調(diào)控植物的耐鹽性,然而以ABA獨(dú)立的方式負(fù)向調(diào)控植物的水分脅迫抗性。在番茄中的研究也表明SlCBL10基因通過(guò)ABA不依賴的方式負(fù)向調(diào)控植物的耐旱性[5]。我們前期研究發(fā)現(xiàn),鈣信號(hào)在西藏當(dāng)雄野生垂穗披堿草低溫應(yīng)答中發(fā)揮重要作用[8],其中CBL10是鈣信號(hào)通路中的重要基因,但其調(diào)控植物低溫等脅迫應(yīng)答的作用機(jī)制尚不明晰。因此,開(kāi)展西藏野生垂穗披堿草中EnCBL10基因的克隆與功能分析,對(duì)深入研究EnCBL10基因調(diào)控植物的低溫等非生物脅迫脅迫應(yīng)答機(jī)制具有重要意義。
本研究從西藏野生垂穗披堿草中篩選和克隆了EnCBL10基因,并將其異源表達(dá)于煙草中,開(kāi)展轉(zhuǎn)基因植株EnCBL10在不同脅迫條件下(干旱、低溫)的生長(zhǎng)以及生理響應(yīng)的研究,揭示EnCBL10基因調(diào)控植物低溫和干旱脅迫應(yīng)答的作用機(jī)制,為垂穗披堿草的育種和栽培管理奠定理論基礎(chǔ)。
1 材料與方法
試驗(yàn)于2020年9月至2021年6月在西北農(nóng)林科技大學(xué)草地工程實(shí)驗(yàn)室進(jìn)行。
1.1 材料來(lái)源
西藏垂穗披堿草種子采集于西藏拉薩市當(dāng)雄鎮(zhèn)(30°28.535′N,91°06′246″ E,海拔4 618 m)。亞細(xì)胞定位所用本氏煙草(Nicotianabenthamiana)及轉(zhuǎn)基因所用野生型煙草‘SR1’(N.tabacum‘SR1’)均來(lái)自西北農(nóng)林科技大學(xué)草業(yè)科學(xué)技術(shù)實(shí)驗(yàn)室。
1.2 試驗(yàn)方法
1.2.1提取總RNA及反轉(zhuǎn) 利用RNA試劑盒提取西藏野生垂穗披堿草葉片中的總RNA,通過(guò)1%瓊脂糖凝膠電泳檢測(cè)其完整性,利用微量分光光度計(jì)測(cè)定其濃度,采用反轉(zhuǎn)試劑盒反轉(zhuǎn)成cDNA。
1.2.2基因的克隆 在NCBI中將西藏野生垂穗披堿草的轉(zhuǎn)錄組測(cè)序獲得的序列(https://www.ncbi.nlm.nih.gov/Traces/study/?acc=SRP0744 69&go=go)進(jìn)行同源比對(duì),利用snapgene軟件設(shè)計(jì)出EnCBL10全長(zhǎng)引物EnCBL10-F和EnCBL10-R(表1),使用諾維贊高保真擴(kuò)增酶試劑盒(No. P511)進(jìn)行擴(kuò)增,PCR程序?yàn)?5℃ 10 min;95℃ 30 s,60℃ 30 s,72℃ 1 min,30個(gè)循環(huán);72℃ 5 min,12℃保溫。用1.0%瓊脂糖凝膠電泳檢測(cè)PCR產(chǎn)物并進(jìn)行純化,取適量的純化產(chǎn)物連接載體轉(zhuǎn)化大腸桿菌感受態(tài),挑取單一菌落,PCR檢測(cè)為陽(yáng)性的菌液送生物公司進(jìn)行測(cè)序。
1.2.3生物信息學(xué)分析 通過(guò)NCBI網(wǎng)站和DNAMAN等軟件分析EnCBL10對(duì)應(yīng)的氨基酸序列的同源性、蛋白的理化性質(zhì)和蛋白結(jié)構(gòu)域等,使用MEGA 6軟件分析EnCBL10蛋白與其他植物的EnCBL10蛋白的進(jìn)化關(guān)系,構(gòu)建分子進(jìn)化樹(shù)。通過(guò)SignalP4.1 Server網(wǎng)站(http://www.cbs.dtu.dk/services/SignalP/)對(duì)信號(hào)肽進(jìn)行預(yù)測(cè)。通過(guò)CellPLoc 2.0網(wǎng)站(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)預(yù)測(cè)亞細(xì)胞定位。利用ProtParam和ProtScale網(wǎng)站對(duì)EnCBL10進(jìn)行蛋白性質(zhì)分析,用SOPMA(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)進(jìn)行蛋白二級(jí)結(jié)構(gòu)預(yù)測(cè)。
1.2.4EnCBL10基因表達(dá)模式分析 將培養(yǎng)21 d的垂穗披堿草幼苗,分別進(jìn)行4℃低溫處理0,1.5,3,12,24,120 h,和干旱(保持相對(duì)含水量40%)處理0,2,4,6 h,采用LightCycler 480 real-time PCR system分析垂穗披堿草各組織中EnCBL10基因的相對(duì)表達(dá)水平。利用primer 5軟件設(shè)計(jì)EnCBL10特異性引物,以EnTublin為內(nèi)參基因[9-10](表1),實(shí)時(shí)熒光定量試劑盒為諾唯贊(Q311),反應(yīng)程序?yàn)椋?5℃ 30 s;95℃ 10 s,60℃ 30 s,40個(gè)循環(huán);95℃ 15 s,60℃ 60 s,95℃ 15 s。上述試驗(yàn)共設(shè)有4個(gè)生物學(xué)重復(fù)和3個(gè)技術(shù)重復(fù),以上反應(yīng)完全結(jié)束之后,通過(guò)檢測(cè)融解曲線來(lái)確定PCR產(chǎn)物特異性,采用2-ΔΔCT計(jì)算表達(dá)量[11]。

表1 各試驗(yàn)所采用的引物序列表及功能Table 1 List of primers used in different expression and functional analysis of EnCBL10
1.2.5亞細(xì)胞定位分析 將已構(gòu)建好的pCAMBIA1300-EnCBL10-GFP轉(zhuǎn)化入冰上融化農(nóng)桿菌感受態(tài)EHA105,挑取菌檢陽(yáng)性的菌液。采用注射法侵染4周齡的本氏煙草葉片,暗培養(yǎng)24~48 h。在激光共聚焦顯微鏡下觀察亞細(xì)胞定位。初步確定亞細(xì)胞定位后,提取煙草葉片的原生質(zhì)體,進(jìn)一步確定EnCBL10的亞細(xì)胞定位。
1.2.6轉(zhuǎn)基因煙草的獲取 構(gòu)建pARTCAM1300-EnCBL10-GFP過(guò)表達(dá)載體(用Xho I和Xba I雙酶切質(zhì)粒pARTCAM1300-GFP)。轉(zhuǎn)化大腸桿菌,利用基因特異引物進(jìn)行菌落PCR驗(yàn)證陽(yáng)性克隆,送生物公司測(cè)序。將測(cè)序正確的pARTCAM1300-EnCBL10-GFP重組質(zhì)粒利用化學(xué)轉(zhuǎn)化法轉(zhuǎn)化農(nóng)桿菌感受態(tài)EHA105。侵染切下的野生型SR1煙草葉片,侵染5 min,接種于共培養(yǎng)基,暗培養(yǎng)4 d。用滅菌水沖洗3~5遍后,接種于含50 mg·L-1卡那霉素的的篩選培養(yǎng)基中,培養(yǎng)至長(zhǎng)出抗性芽。采用EnCBL10特異性引物EnCBL10-F和EnCBL10-R(表1)通過(guò)RT-PCR鑒定陽(yáng)性苗。
1.2.7轉(zhuǎn)基因煙草的脅迫應(yīng)答分析 選用已鑒定出的EnCBL10-OX-12和EnCBL10-OX-20兩株系的陽(yáng)性苗煙草種子消毒后,置于鋪有濕潤(rùn)濾紙的培養(yǎng)皿中在人工氣候箱萌發(fā),培養(yǎng)條件為光期16 h,光強(qiáng)12 000 lx,溫度為23℃,濕度為80%;暗期8 h,光強(qiáng)0 lx,溫度為20℃,濕度為60%。將培養(yǎng)7 d幼苗,選擇形態(tài)均勻健康的幼苗轉(zhuǎn)移至裝有蛭石的花盆中進(jìn)行培養(yǎng)。將生長(zhǎng)至30 d的幼苗進(jìn)行低溫和干旱的處理。低溫處理為在低溫培養(yǎng)箱里(4℃)適應(yīng)處理3 d后,將溫度降至-10℃處理0.5 h,再緩慢恢復(fù)到4℃處理直至出現(xiàn)表型;干旱處理采用不澆水處理14 d,恢復(fù)處理采用與對(duì)照相同的培養(yǎng)方式進(jìn)行復(fù)水。每個(gè)處理設(shè)置3個(gè)生物學(xué)重復(fù)。分析低溫、干旱脅迫下野生型和EnCBL10轉(zhuǎn)基因種子的表型差異。采用電導(dǎo)法測(cè)定相對(duì)電導(dǎo)率[12]。采用李合生的方法[13]分析低溫和干旱脅迫下野生型和過(guò)表達(dá)植株的抗氧化物酶活性、可溶性糖含量和脯氨酸含量。
1.2.8數(shù)據(jù)分析 采用SPSS 25.0軟件進(jìn)行雙因素方差分析、Duncan’s法對(duì)平均值進(jìn)行比較和Excel軟件進(jìn)行分析和作圖。
2 結(jié)果與分析
2.1 基因序列克隆與生信分析
提取西藏當(dāng)雄野生垂穗披堿草總RNA,以cDNA為模板,CBL10-F和CBL10-R為引物(表1),通過(guò)PCR擴(kuò)增得到目的片段,將PCR產(chǎn)物用1.0%的瓊脂糖凝膠電泳檢測(cè),測(cè)序獲得792 bp的序列(圖1A)。
生物信息學(xué)分析表明,EnCBL10編碼263個(gè)氨基酸,相對(duì)分子質(zhì)量為29 783.96,理論等電點(diǎn)為5.17,屬于疏水性蛋白,無(wú)信號(hào)肽,含有FRQ1保守結(jié)構(gòu)域。同源比對(duì)發(fā)現(xiàn)EnCBL10所編碼蛋白質(zhì)與短芒大麥草(Hordeumbrevisubulatum)、小麥(Triticumaestivum)、水稻(Oryzasativa)、黍(ChenopodiumalbumL.)、高粱(Sorghumbicolor)和大麥(Hordeumvulgare)的一致性達(dá)70%~80%(圖1B)。進(jìn)化樹(shù)結(jié)果顯示,EnCBL10蛋白與多個(gè)單子葉植物蛋白相似度較高,包括短芒大麥草、大麥的同源性在90%以上(圖1C)。

圖1 EnCBL10基因的序列(A)、同源性比對(duì)(B)和進(jìn)化樹(shù)分析(C)Fig.1 Sequence (A),Homology alignment (B) and evolutionary tree analysis (C) of EnCBL10 gene
2.2 EnCBL10基因的表達(dá)模式分析
組織表達(dá)特異性結(jié)果顯示,EnCBL10在垂穗披堿草葉中表達(dá)量最高,為根中表達(dá)量的56.27倍,為莖中表達(dá)量的5.56倍(圖2A)。低溫脅迫處理3 h后EnCBL10基因的表達(dá)量達(dá)到最高水平,為0 h的1.82倍(P<0.05);干旱脅迫下,該基因的表達(dá)水平在4 h最高,為處理前的4.12倍(P<0.05)(圖2B,2C)。以上結(jié)果表明EnCBL10基因參與調(diào)控垂穗披堿草的低溫和干旱脅迫應(yīng)答。
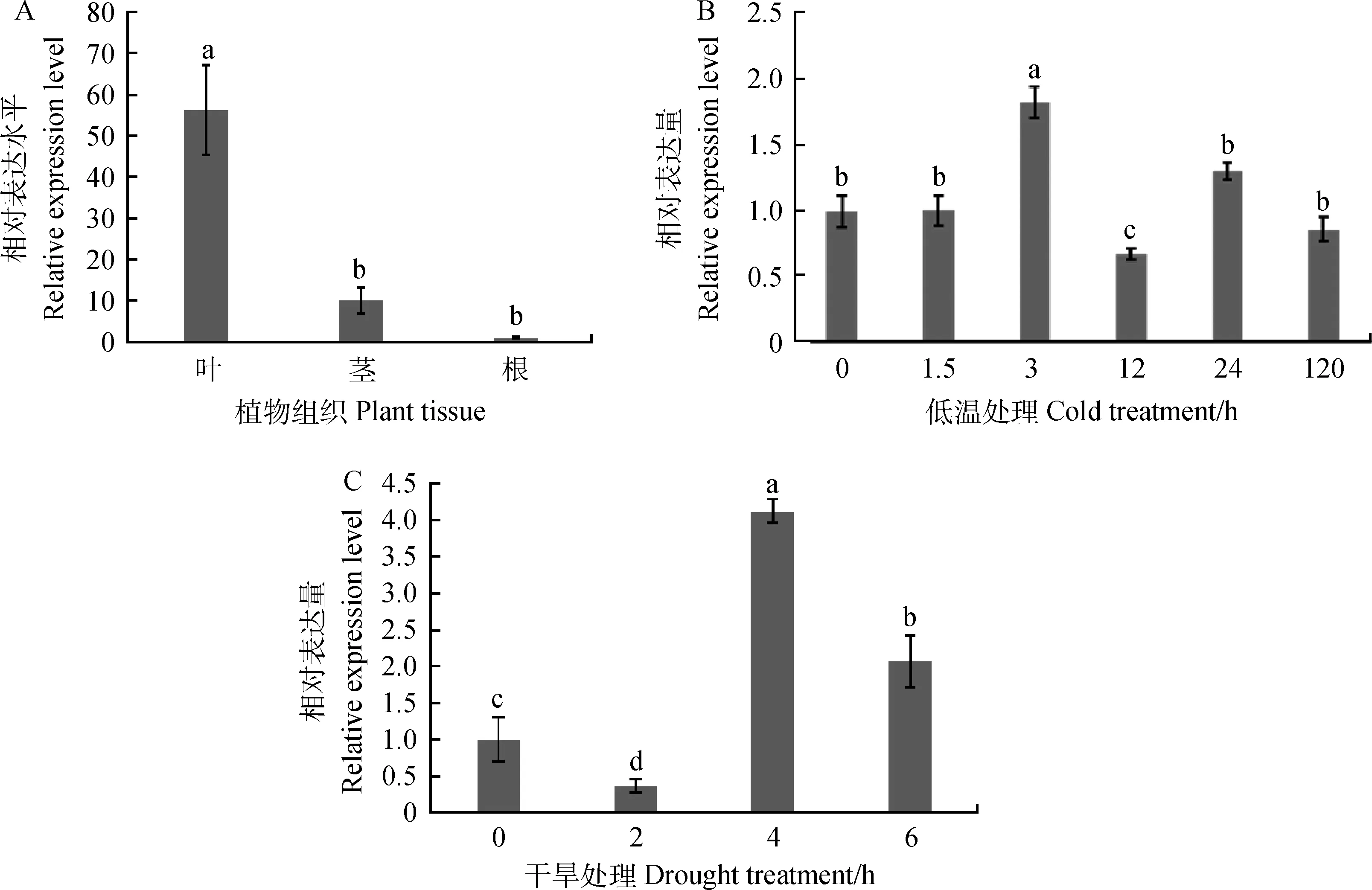
圖2 EnCBL10在西藏野生垂穗披堿草不同組織(A)及在低溫(B)和干旱(C)脅迫下的表達(dá)分析Fig.2 Expression of EnCBL10 gene in different tissues (A),and cold(B) and drought(C) stress注:不同小寫(xiě)字母表示差異顯著(P < 0.05),下同Note:Different small letters are significantly different at the 0.05 level,the same as below
2.3 亞細(xì)胞定位
利用CellPLoc 2.0網(wǎng)站分析亞細(xì)胞定位,結(jié)果顯示西藏野生垂穗披堿草EnCBL10定位于細(xì)胞膜和液泡膜。進(jìn)一步利用構(gòu)建pCAMBIA1300-EnCBL10-GFP表達(dá)載體探究EnCBL10基因編碼的蛋白在細(xì)胞中的定位情況。由圖3可知,pCAMBIA1300-EnCBL10-GFP綠色熒光蛋白信號(hào)分布在細(xì)胞膜中,而pCAMBIA1300-GFP綠色熒光蛋白信號(hào)分布在整個(gè)細(xì)胞,說(shuō)明EnCBL10編碼蛋白定位于細(xì)胞膜上中,這與實(shí)驗(yàn)預(yù)測(cè)結(jié)果大致一致。
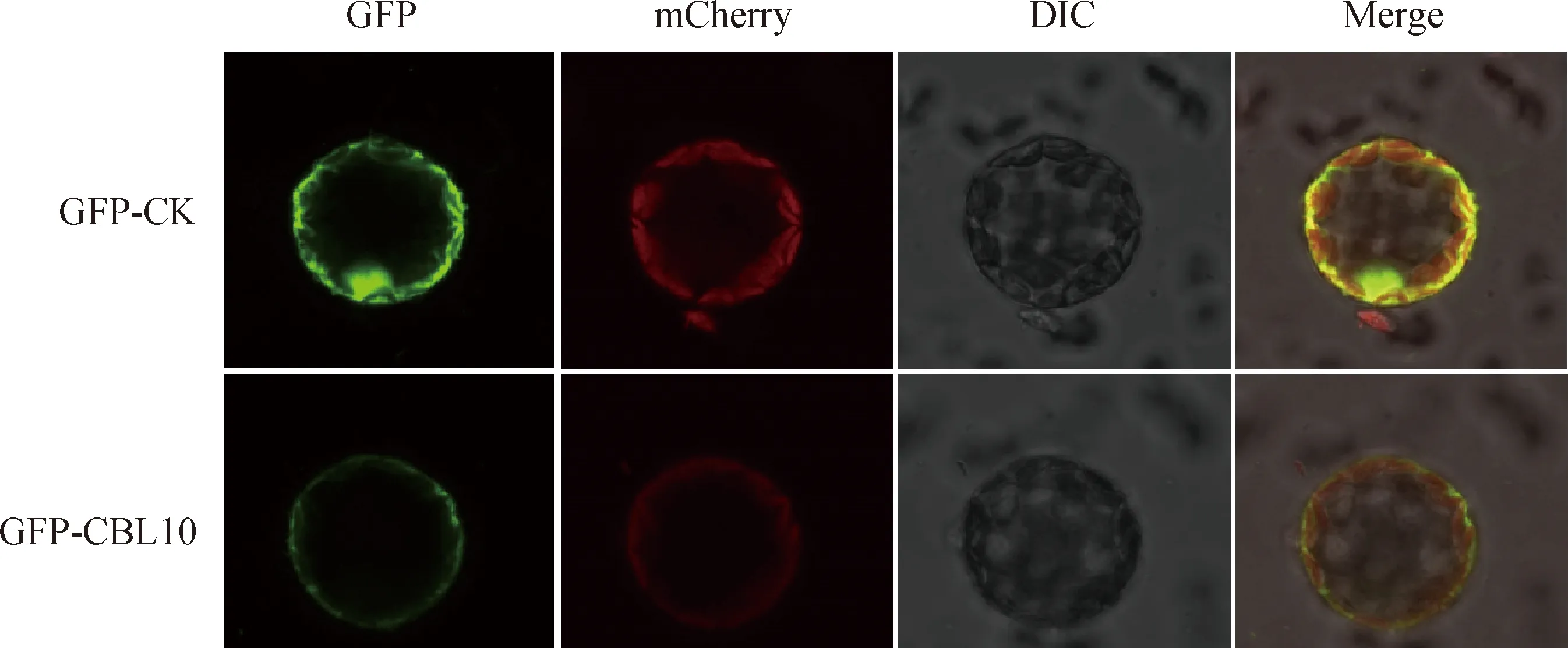
圖3 EnCBL10的亞細(xì)胞定位Fig.3 Subcellular localization of EnCBL10 protein注:標(biāo)尺為10 μmNote:Scale bar,10 μm
2.4 轉(zhuǎn)基因陽(yáng)性苗的鑒定和組織表達(dá)特異性分析
經(jīng)過(guò)30 d的篩選培養(yǎng),共獲得25個(gè)煙草抗性苗培養(yǎng)。提取25個(gè)抗性苗的總RNA,以反轉(zhuǎn)錄成的cDNA為模板,以構(gòu)建過(guò)表達(dá)載體的引物EnCBL10-F,EnCBL10-R為特異性引物,進(jìn)行半定量RT-PCR反應(yīng),以野生型SR1的cDNA為陰性對(duì)照,以煙草的NtUbiquitin基因作為內(nèi)參基因。RT-PCR檢測(cè)結(jié)果顯示,野生型SR1中沒(méi)有檢測(cè)到擴(kuò)增條帶,有6個(gè)株系擴(kuò)增出與陽(yáng)性對(duì)照大小一致的特異條帶,膠回收、克隆測(cè)序表明,所擴(kuò)增條帶為EnCBL10目的基因序列(圖4A)。初步證明EnCBL10基因已成功在煙草轉(zhuǎn)錄水平上表達(dá)。
EnCBL10在過(guò)表達(dá)煙草的根、花、老葉和新葉等器官中有不同的表達(dá)特征,其中新葉中表達(dá)量最高,為根的16.3倍(P<0.05)(圖4B)。
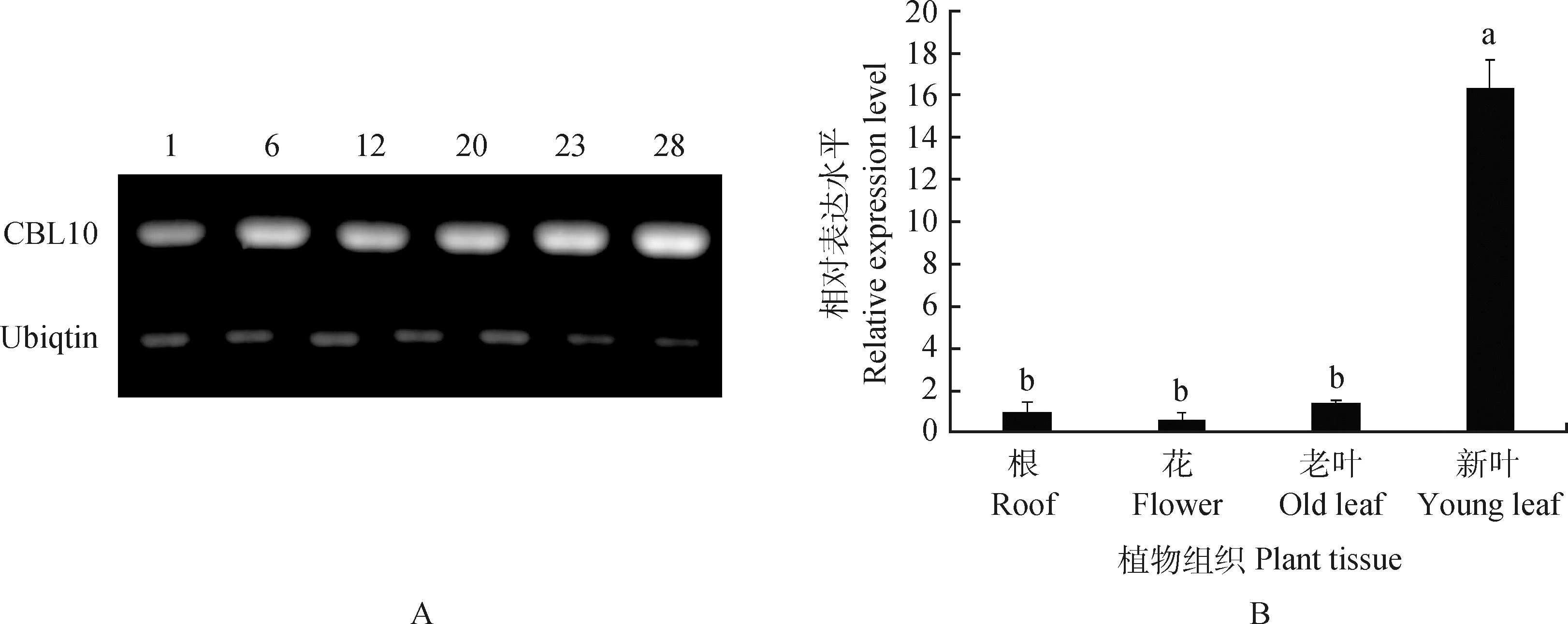
圖4 轉(zhuǎn)基因陽(yáng)性苗鑒定(A)和EnCBL10過(guò)表達(dá)植株(EnCBL10-OX-12)的組織表達(dá)分析(B)Fig.4 PCR identification of transgenic positive seedlings (A) and expression of EnCBL10 (EnCBL10-OX-12) in different tissues in transgenic tobacco (B)
2.5 低溫和干旱脅迫對(duì)過(guò)表煙草和野生型煙草幼苗表型的影響
由圖5A可知,與野生型相比,低溫對(duì)異源過(guò)表達(dá)EnCBL10植株的傷害較小;恢復(fù)處理后過(guò)表達(dá)株系較野生型生長(zhǎng)的更好,表明EnCBL10積極地調(diào)節(jié)植物的抗寒性。干旱脅迫下,野生植株葉片出現(xiàn)明顯的萎蔫,而轉(zhuǎn)基因株系的葉片脫水較輕,長(zhǎng)勢(shì)更好(圖5B),這一結(jié)果表明EnCBL10基因能夠提高植物的抗旱性。
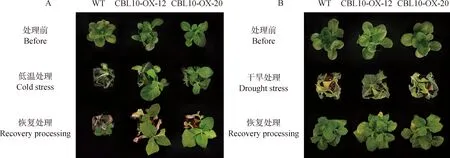
圖5 低溫(A)和干旱(B)脅迫對(duì)過(guò)表達(dá)煙草表型的影響Fig.5 Effects in phenotype of overexpressed tobacco under cold (A) and drought (B) stresses注:標(biāo)尺為5 cmNote:Scale bar,5 cm
2.6 低溫、干旱對(duì)過(guò)表達(dá)轉(zhuǎn)基因煙草與野生型煙草細(xì)胞膜穩(wěn)定性的影響
低溫和干旱脅迫均能不同程度地增加野生型和過(guò)表達(dá)EnCBL10植株葉片中的相對(duì)電導(dǎo)率,說(shuō)明低溫和干旱脅迫對(duì)這兩個(gè)不同基因型的細(xì)胞膜均造成了不同程度的損傷(圖6)。低溫脅迫下,野生型植株的相對(duì)電導(dǎo)率與對(duì)照相比增加259.1%(P<0.05),而過(guò)表達(dá)株系EnCBL10-OX-12和EnCBL10-OX-20分別較對(duì)照中的過(guò)表達(dá)株系EnCBL10-OX-12和EnCBL10-OX-20增加了38.5%和69.2%。與對(duì)照相比,干旱脅迫導(dǎo)致EnCBL10-OX-12植株中相對(duì)電導(dǎo)率增加了123.1%(P<0.05),EnCBL10-OX-20增加了100.2%(P<0.05),而野生型中相對(duì)電導(dǎo)率較對(duì)照增加了181.8%(P<0.05)。
2.7 低溫和干旱脅迫對(duì)轉(zhuǎn)基因煙草葉片中抗氧化酶活性的影響
低溫脅迫下,過(guò)表達(dá)EnCBL10-OX-12和EnCBL10-OX-20株系葉片中抗氧化酶POD,APX和GR活性與對(duì)照下的過(guò)表達(dá)EnCBL10-OX-12和EnCBL10-OX-20株系相比均呈現(xiàn)增強(qiáng)趨勢(shì),分別較對(duì)照增加97.88%,79.5%,265.6%(P<0.05),和492.5%,81.4%,138.1%(P<0.05);干旱脅迫下,轉(zhuǎn)基因株系的POD,APX和GR活性與野生型相比表現(xiàn)出顯著的增強(qiáng)趨勢(shì),過(guò)表達(dá)EnCBL10-OX-12和EnCBL10-OX-20株系的POD,APX和GR活性分別較對(duì)照增加166.9%,400%,146%(P<0.05)和97.8%,351.9%,80.3%(P<0.05)(圖7)。

圖6 低溫和干旱脅迫下過(guò)表達(dá)煙草葉片相對(duì)電導(dǎo)率的變化Fig.6 Changes in relative electrical conductivity in the leaves of transgenic plant under cold and drought stress

圖7 低溫脅迫和干旱脅迫下過(guò)表達(dá)植株葉片POD(A),APX(B)和GR(C)活性的變化Fig.7 Changes in the activities of POD (A),APX (B),and GR (C) in the leaves of overexpressed plant under cold and drought stress
2.8 低溫和干旱脅迫對(duì)轉(zhuǎn)基因煙草葉片中可溶性糖、游離脯氨酸含量的影響
低溫脅迫下,野生型煙草葉片中脯氨酸含量與對(duì)照相比下降45.4%(P<0.05),但兩個(gè)轉(zhuǎn)基因株系葉片中的脯氨酸含量與各自對(duì)照相比分別提高了79.7%和70.8%(P<0.05);在干旱脅迫下,野生型和過(guò)表達(dá)植株中脯氨酸含量均有所降低,但轉(zhuǎn)基因植株比野生型脯氨酸含量下降幅度小(圖8A)。
過(guò)表達(dá)和野生型植株中可溶性糖的含量在低溫脅迫下均顯著增加,與對(duì)照相比過(guò)表達(dá)EnCBL10-OX-12和EnCBL10-OX-20株系的可溶性糖含量分別增加281%和956.6%(P<0.05),且增加幅度超過(guò)野生型;干旱脅迫下,EnCBL10-OX-12的可溶性糖含量略有降低,野生型和EnCBL10-OX-20株系的可溶性糖含量均有所增加,但與對(duì)照相比差異不顯著(圖8B)。
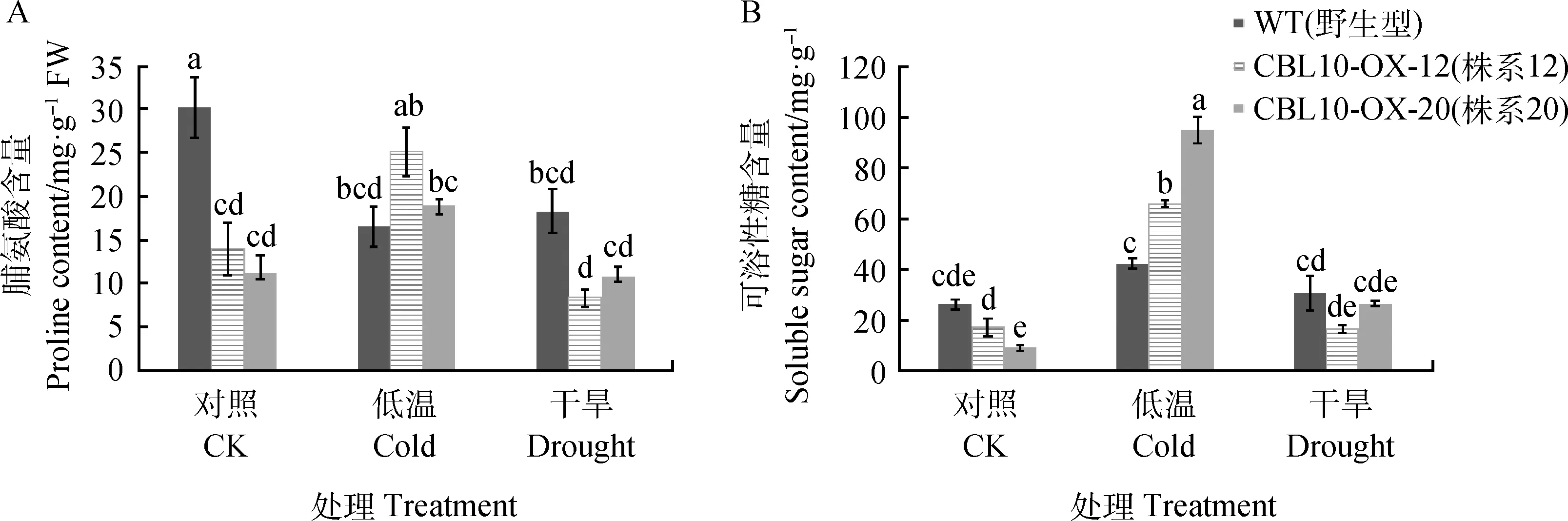
圖8 低溫干旱脅迫下過(guò)表達(dá)植株中游離脯氨酸含量(A)和可溶性糖(B)的變化Fig.8 Changes in free proline content (A) and soluble sugar (B) in the leaves of transgenic plant under cold and drought stress
3 討論
植物中主要有三類鈣信使系統(tǒng),分別為鈣離子-鈣調(diào)蛋白(Ca2+-CaM)、鈣離子-鈣調(diào)磷酸酶B類似蛋白(Ca2+-CBL)和鈣離子-鈣依賴性蛋白激酶(Ca2+-CDPK),這些鈣信號(hào)參與植物對(duì)逆境信號(hào)的感知和傳遞[14]。近年來(lái),CBL-CIPK信號(hào)在調(diào)控植物脅迫應(yīng)答方面受到國(guó)內(nèi)外學(xué)者的普遍關(guān)注[15-19]。前期研究發(fā)現(xiàn)擬南芥、水稻、玉米和楊樹(shù)基因組中含有10個(gè)CBL基因家族成員,其中大多數(shù)參與脅迫信號(hào)傳導(dǎo)途徑[20],CBLs在接收植物細(xì)胞產(chǎn)生的Ca2+信號(hào)后,通過(guò)激活下游CIPKs的激酶活性實(shí)現(xiàn)Ca2+信號(hào)的傳遞[16]。許多研究表明植物CBL10基因受多種逆境脅迫誘導(dǎo)表達(dá)[15,19],說(shuō)明CBL10依賴的鈣信號(hào)網(wǎng)絡(luò)在植物逆境應(yīng)答過(guò)程中起關(guān)鍵作用。然而關(guān)于西藏野生垂穗披堿草CBL基因功能的研究未見(jiàn)報(bào)道。
本研究從西藏當(dāng)雄野生垂穗披堿草中克隆了EnCBL10基因,發(fā)現(xiàn)該基因能夠被低溫和干旱脅迫誘導(dǎo)表達(dá),表明EnCBL10基因可能參與了上述非生物脅迫應(yīng)答。為了更深入研究其調(diào)控機(jī)制,我們進(jìn)行了組織表達(dá)分析、亞細(xì)胞定位并構(gòu)建過(guò)表達(dá)載體,利用農(nóng)桿菌侵染法將EnCBL10基因轉(zhuǎn)入煙草,并對(duì)轉(zhuǎn)基因煙草做了基因的表達(dá)量、表型及生理指標(biāo)等一系列研究。本研究發(fā)現(xiàn)EnCBL10基因在西藏野生披堿草根、莖、葉中都有表達(dá),其中葉中表達(dá)量最高。這與Egea等[5]在番茄(Solanumlycopersicum)中SlCBL10研究結(jié)果類似,該研究指出SlCBL10基因在成熟葉片中表達(dá)最高,在根中表達(dá)最低,且Slcbl10突變體在鹽脅迫下表現(xiàn)出地上部生長(zhǎng)受到抑制,莖頂端壞死。而且在擬南芥Atcbl10突變體中回補(bǔ)SlCBL10能夠提高其脅迫抗性。這表明CBL10主要在植物的地上部組織表達(dá),且在不同物種中其功能可能是保守的[19]。垂穗披堿草EnCBL10蛋白主要定位在液泡膜中,推測(cè)在液泡中EnCBL10與特定CIPKs蛋白結(jié)合形成復(fù)合體激活多種信號(hào)通路。相似的研究也指出擬南芥中CBL10定位在液泡中與CIPK24互作,調(diào)控其耐鹽性[4]。
在正常生長(zhǎng)條件下,植物體內(nèi)的活性氧代謝處于動(dòng)態(tài)平衡的狀態(tài)。但當(dāng)植物處于低溫、干旱等脅迫環(huán)境時(shí),這種代謝平衡被打破,在植物組織中積累了大量活性氧,導(dǎo)致細(xì)胞膜結(jié)構(gòu)和功能受到一定損傷,電解質(zhì)外滲,增加了細(xì)胞膜透性[20-23]。電導(dǎo)率是反映植物細(xì)胞膜受逆境損傷的重要指標(biāo)。植物能夠通過(guò)激活抗氧化酶活性來(lái)抵制活性氧大量積累帶來(lái)的氧化傷害[24]。細(xì)胞中多種抗氧化酶,如POD,CAT和APX等,在活性氧的清除過(guò)程中發(fā)揮重要作用[25-28]。本研究發(fā)現(xiàn),過(guò)表達(dá)EnCBL10植株在低溫和干旱脅迫下相對(duì)電導(dǎo)率降低,POD,APX,GR活性均出現(xiàn)不同程度的提高,這說(shuō)明過(guò)表達(dá)EnCBL10提高了植物體內(nèi)抗氧化酶活性,維持了其細(xì)胞膜的穩(wěn)定性,賦予轉(zhuǎn)基因植株更強(qiáng)的抗逆能力。脯氨酸和可溶性糖作為滲透調(diào)節(jié)物質(zhì),具有較強(qiáng)的水溶性和水合能力,可以促使蛋白質(zhì)結(jié)合更多水分子提升溶解性,有助于維持細(xì)胞的滲透平衡,提高植物的抗逆性[29]。低溫脅迫下,過(guò)表達(dá)EnCBL10導(dǎo)致植物葉片中脯氨酸含量顯著升高,但干旱脅迫下脯氨酸變化較小,這可能是由于干旱時(shí)間過(guò)長(zhǎng),導(dǎo)致脯氨酸含量下降[30]。已有許多研究表明,鈣信號(hào)通過(guò)調(diào)控抗氧化酶的活性和滲透調(diào)節(jié)物質(zhì)來(lái)提高植物的低溫等脅迫抗性[31-33]。Zou等[33]研究發(fā)現(xiàn)擬南芥CPK8通過(guò)磷酸化CAT3增強(qiáng)其蛋白活性,從而調(diào)控干旱脅迫下植物體內(nèi)的H2O2平衡。與之相似,過(guò)表達(dá)OsCPK24提高了水稻中脯氨酸和谷胱甘肽的含量,可維持更高的GSH/GSSG水平,從而提高水稻的抗寒性[32]。與以上研究結(jié)果類似,本試驗(yàn)發(fā)現(xiàn)過(guò)表達(dá)EnCBL10提高了抗氧化酶活性和脯氨酸的含量,這表明EnCBL10可能與上述鈣信號(hào)類似,可能通過(guò)調(diào)控抗氧化酶活性及滲透調(diào)節(jié)物質(zhì)提高植物的抗性,更深層的機(jī)制需要進(jìn)一步挖掘。
4 結(jié)論
本研究成功克隆了西藏野生垂穗披堿草EnCBL10基因的CDS序列。EnCBL10基因含有FRQ1保守結(jié)構(gòu)域,與短芒黑麥草、小麥、水稻等相似性較高,該基因在西藏野生披堿草葉中表達(dá)量最高。EnCBL10蛋白定位于細(xì)胞膜。EnCBL10基因能夠被低溫和干旱等非生物脅迫誘導(dǎo)表達(dá),激活抗氧化防御系統(tǒng)和調(diào)節(jié)植物體內(nèi)的滲透平衡來(lái)抵御脅迫造成的危害。本研究為進(jìn)一步挖掘EnCBL10基因調(diào)控植物的抗寒、抗旱機(jī)制奠定理論基礎(chǔ)。

