乳及乳制品中牛乳鐵蛋白含量測定方法比較研究
陳柔含,韓奕奕,馬穎清,劉 洋,豐東升
上海市農產品質量安全中心曁農業農村部食品質量監督檢驗測試中心(上海),上海 201708
0 引言
牛乳鐵蛋白(Bovine Lactoferrin,bLF)是牛初乳中非常重要的鐵結合型大分子糖蛋白,其分子量為78~80 kDa。由于其氨基酸序列中含有大量的精氨酸與賴氨酸,故其等電點在7.8~8.2,是一種呈堿性的蛋白質[1],主要由動物的乳腺上皮細胞分泌及表達。乳鐵蛋白(LF)與鐵轉運和儲存密切相關,且對免疫功能系統的調節具有正向作用,同時擁有廣譜抗菌性、抗病毒、抗癌、抗氧化等強大的生物功能,因此被媒體報道為“奶黃金”。在自然界中,人的母乳中LF的含量較高,在1.0~3.0 mg/mL的范圍內[2],而牛初乳中的含量相對較低。因此商業上很多乳品企業通常會在乳基的嬰幼兒配方食品中添加營養強化劑LF,使其營養成分更接近于母乳。國家衛生和計劃生育委員會2004年第6號公告首次將LF作為新型食品添加劑,并規定了適用范圍,且設定了最大使用量。《GB 14880—2012 食品安全國家標準 食品營養強化劑使用標準》于2012年3月30日推行,其中明確指出LF可作為食品營養強化劑,可在乳制品及嬰幼兒配方食品中進行強化,并規定其最高使用量不超過1.0 g/kg。市場上也廣泛存在含bLF強化劑的調制乳、發酵乳及含乳飲料等產品。
我國目前尚未出臺食品中bLF測定相關的國家級標準。2019年天津奶業協會發布了團體標準《T/TDSTIA 006—2019 奶及奶制品中乳鐵蛋白的測定液相色譜法》,中國食品科學技術學會于2021年頒布了《T/CIFST 006—2021 食品中乳鐵蛋白的測定酶聯免疫吸附法》,檢測方法的空缺和檢測結果的不一致性仍是限制bLF作為營養強化劑應用和推廣的主要技術瓶頸。同時,據有關的文獻報道,測定食品中bLF含量的方法除了上述提及的酶聯免疫技術(ELISA)[3~5]和液相色譜(LC)[6~9],還有十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)[10]、毛細管電泳技術(HPCE)[11~14]及液相色譜-串聯質譜法(LC-MS/MS)[15~17]等。ELISA法盡管步驟簡單,但靈敏度偏低、重現性較差,容易出現假陽性。蛋白質的分析常常會用到SDS-PAGE進行條帶分離,但操作復雜,耗時久,相鄰組分的條帶其界面存在混淆不清的現象,難以獲得令人滿意的重復性。HPCE則是包括電泳分離與色譜光譜交叉的新型液相微分離技術,快速且靈敏,但易受毛細管與電壓等條件的限制導致重現性較差;LC法采用不同的前處理方法溶解、除雜、純化LF,結果準確,重現性較好。據報道,肝素具有已知生物大分子的最高負電荷密度,因此對各種蛋白質(包括LF)具有很高的特異結合能力,但對β-乳球蛋白、α-乳白蛋白和血清白蛋白沒有很高的結合親和力[18]。不少液相方法的前處理提取純化都是采用肝素親和柱,簡單方便。LC-MS/MS法兼具色譜分離復雜樣品的能力與質譜的高選擇性、高靈敏度及精確確證等優點,在LF的檢測中得到廣泛的應用[19]。該法測定bLF基于蛋白質組學的原理,建立在“蛋白-特征肽段”間穩定的轉換,通過胰蛋白酶將蛋白質酶解后產物即肽段,通過色譜分離、質譜檢測產生的信號,轉換信號為肽段濃度,反推計算出蛋白質濃度[20]。
本文擬通過對比高效液相色譜(H i g h Performance Liquid Chromatography,HPLC)法和超高效液相色譜串聯質譜(Ultra High Performance Liquid Chromatography Tandem Mass Spectrometry,UPLC- MS/MS)法兩種不同原理的檢測方法,測定乳與乳制品中bLF的含量,探討兩種方法差異及優缺點,以期對食品安全國家標準及相關研究人員提供技術參考和數據支持。
1 材料與方法
1.1 材料與試劑
Hi TrapTM Heparin HP肝素親和柱(1mL),美國Cytiva公司;塑料離心管(50 mL/15 mL),CNW,美國;低蛋白吸附槍頭(0.1 mL/1 mL),德國Brand公司;低蛋白吸附離心管(1.5 mL),德國Eppendorf公司;低蛋白吸附進樣瓶,德國CNW公司;低蛋白吸附濾膜(0.22 μm),美國CNW公司。
氯化鈉(NaCl,≥99%)、磷酸(H3PO4,≥99%)、磷酸氫二鈉(Na2HPO4,≥99%)、碳酸氫銨(NH4HCO3,≥99%)、二硫蘇糖醇(Dithiothreitol,DTT,≥99%)、碘代乙酰胺(Iodoacetamide,IAA,≥99%),美國默克公司;牛胰蛋白酶(測序級),美國Promega公司;三氟乙酸(CF3CO2H,≥99%)、乙腈(CH3CN,≥99%,色譜純)、甲酸(HCOOH,≥98%,色譜純),美國Fluka公司;bLF(≥98%),美國Sigma公司,取0.002 g溶于10 mL水中配制成200 μg/mL標準蛋白儲備液;內標肽段VDSAL(13C9,15N)YLGSR,上海吉爾生化有限公司,用水配制成濃度50 μg/mL的內標標準工作液;雞蛋蛋清蛋白粉、奶粉、調制乳、含乳飲料(市售)。
1.2 儀器與設備
高效液相色譜儀(Agilent 1260,配有紫外檢測器),美國Agilent公司;超高效液相色譜-三重四極桿質譜聯用儀:超高效液相色譜(Acquity HClass UPLC),美國Waters公司;三重四極桿質譜(Triple QuadTM 6500),美國SCIEX公司;天平(萬分之一)、pH計,美國Metteler公司;冷凍離心機(Thermo Heraeus X1R),小型冷凍離心機(Thermo Fresco 21),渦旋振蕩器,美國Thermo公司;振蕩水浴鍋(DRHH-D6),常州丹瑞公司;Millipore超純水系統,美國Millipore公司。
1.3 試驗方法
1.3.1 HPLC法
(1) 樣品提取
固體及半固體樣品:稱取5 g(精確至0.01 g)試樣于燒杯中,加預熱過(溫度低于50 ℃)的磷酸氫二鈉溶液(0.20 mol/L),攪拌溶解樣品,分次將樣品轉移至50 mL容量瓶中,用磷酸氫二鈉溶液(0.20 mol/L)定容,渦旋混勻后轉移至塑料離心管中,4 ℃,10 000 r/min離心10 min,取中間層澄清樣液待凈化。
液體樣品:稱取5 g(精確至0.01 g)樣品于50 mL塑料離心管中,加入適量磷酸氫二鈉溶液(0.20 mol/L)混勻,將樣品轉移至25 mL容量瓶中,分次用磷酸氫二鈉溶液(0.20 mol/L)將離心管管壁沖洗干凈轉入容量瓶中,并定容,充分混勻后轉入離心管,4 ℃,10 000 r/min離心10 min,取中間層澄清樣液待凈化。
(2) 樣品凈化
肝素親和柱凈化前,先加入5.0 mL磷酸氫二鈉溶液(0.20 mol/L)平衡。隨后,準確移取10.0 mL樣液,加入肝素柱,控制樣液緩慢穩定下滴,避免由于樣液流出過快,導致目標物無法和肝素柱有效結合。待液面下降至柱填充物的上平面時,用10.0 mL磷酸氫二鈉溶液(0.20 mol/L)淋洗雜質,棄去所有液體,并排空柱內液體。緊接著,用5.0 mL磷酸氫二鈉(50 mmol/L)-氯化鈉(1 mol/L)緩沖溶液對目標物進行洗脫,收集全部流出液,用磷酸氫二鈉(50 mmol/L)-氯化鈉(1 mol/L)緩沖溶液定容至5.00 mL,過膜,供HPLC檢測分析。
(3)標準曲線制備
用磷酸氫二鈉(50 mmol/L)-氯化鈉(1 mol/L)緩沖溶液逐級稀釋定容LF儲備液,配制成LF濃度分別為0.010 mg/mL、0.020 mg/mL、0.050 mg/mL、0.10 mg/mL、0.20mg/mL和0.50 mg/mL的標準工作液,供儀器檢測。
(4) HPLC條件
采用Agilent-C4 反相色譜柱(250 mm×4.6 mm,5 μm,Agilent 美國)。流動相A為0.1%(v/v)三氟乙酸水溶液,流動相B為純乙腈。洗脫梯度如下:0~20 min,85%~15% A;20~22 min,15%~85% A;22~25 min,85% A。流速:1.0 mL/min。進樣體積:50 μL;柱溫:30 ℃。檢測波長:280 nm。
1.3.2 UPLC-MS/MS法
(1)樣品溶解
固體樣品:稱取1 g(精確至0.01 g)樣品于50 mL塑料離心管,加入適量溫熱的水進行溶解,待冷卻后,分次將樣品轉移至25 mL容量瓶,準確定容,充分混勻后轉入離心管。
半固體及液體樣品:無需溶解處理。
(2) 樣品酶解
吸取200 μL樣液于1.5 mL離心管中,添加LF同位素內標工作溶液50 μL,再加150 μL100 mmol/L的NH4HCO3溶液,混勻后,加入10 μL二硫蘇糖醇(500 mmol/L),混勻。在57 ℃下恒溫水浴振蕩1 h。取出冷卻至室溫,加入30 μL 500 mmol/L的碘代乙酰胺,暗處靜置0.5 h,加入50 μL 400 μg/mL的牛胰蛋白酶溶液,渦旋混勻后置于37 ℃恒溫水浴酶解至少10 h。取出后加入10 μL甲酸使反應終止,于室溫下靜置30 min,隨后用水定容至1.0 mL,混勻后于12 000 r/min下離心15 min,移取上清液,或過0.22 μm濾膜,供超UPLC-MS/MS檢測。
(3) 標準曲線制備
以雞蛋清蛋白粉作為空白基質,將標準蛋白儲備液逐級稀釋至1 μg/mL、2 μg/mL、5 μg/mL、10 μg/mL、20 μg/mL、50 μg/mL、100 μg/mL,每個濃度溶液中加入50 μL同位素內標,酶解后供儀器檢測。
(4) UPLC-MS/MS條件
色譜條件:采用UPLC peptide BEH C18色譜柱(100 mm×2.1 mm,1.7 μm,300 ■,Waters,美國);流動相A為0.1%(v/v)甲酸水溶液,流動相B為純乙腈;流速:0.3 mL/min。洗脫梯度程序:0~0.5 min,95%A;0.5~4.5 min, 95%~30%A;4.5~5.5 min,30% A;5.5~6.0min, 30%~95%A;6.0~8.0 min,95%A。柱溫:40 ℃。進樣體積:10 μL。
質譜條件:電噴霧ESI源,正離子模式;離子化電壓(IS):5 500 V;噴撞氣(CAD):Medium;氣簾氣(CUR):30 psi;溫度(TEM):550 ℃;噴霧氣(GS1):55 psi; 輔助加熱氣(GS2):55 psi。質譜檢測參數:特征肽段定量離子對m/z 540.6>595.3,定性離子對m/z 540.6>319.3,內標肽段定量離子對 m/z 547.5>602.3,定性離子對m/z 547.5>319.3。
2 結果與討論
2.1 準確度和精密度試驗結果
選取不同的乳及乳制品作為添加回收的基質。考慮到bLF是營養強化劑,參考了實際樣品中目標物的含量范圍選擇不同的添加濃度水平。其中生鮮乳選擇0.005 mg/kg、0.01 mg/kg、0.05 mg/kg三個濃度水平,調制乳和含乳飲料選擇0.01 mg/kg、
0.02 mg/kg、0.1 mg/kg,奶粉選擇添加三個濃度水平的bLF:0.05 mg/kg、0.1 mg/kg、0.5 mg/kg,分別加入至不同樣品基質中。采用HPLC法和UPLC-MS/MS法進行測定分析,每種濃度測6 次。檢測結果見表1。結果表明,兩種方法從方法學上均能提供有效、準確的定量結果。其中,HPLC法平均回收率在89.27%~106.83%之間,精密度≤9.71%;UPLC-MS/MS法平均回收率在89.37%~102.77%之間,精密度≤8.45%。
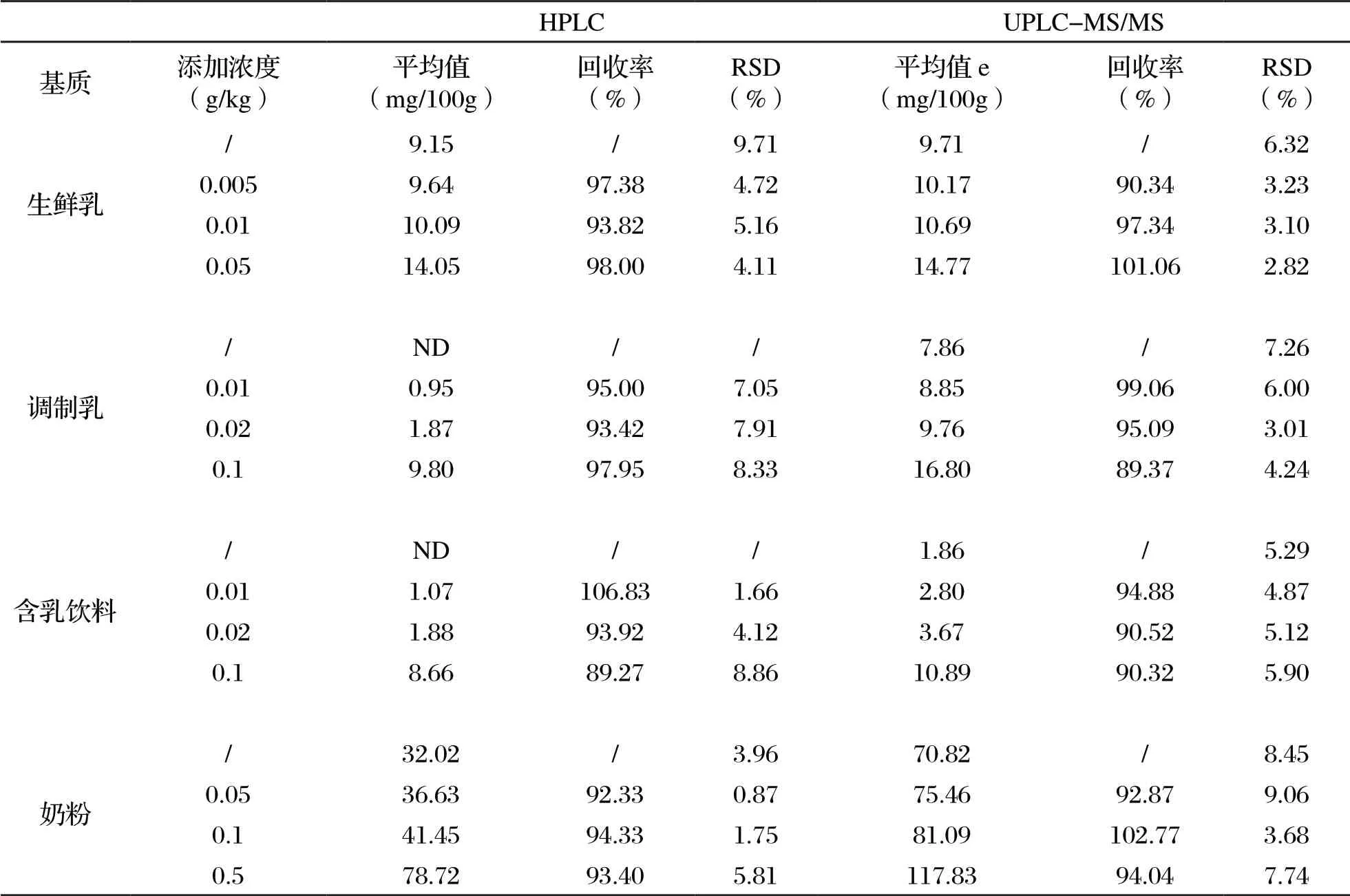
表1 方法準確度和精密度(n=6)
2.2 實際樣品測定結果
采用HPLC法和UPLC-MS/MS法分別測定4批次生鮮乳、3批次調制乳、7批次奶粉、3批次巴氏殺菌乳、2批新型巴氏殺菌乳(ESL)和7批次超高溫瞬時滅菌乳(UHT)中bLF的含量,每批樣品都進行2個平行樣的測定,檢測結果見表2。試驗結果表明,兩種方法在定量生鮮乳中bLF含量的差異性較小;在定量調制乳、UHT乳和ESL乳等經高溫殺菌過的液態奶中bLF含量存在一定差異,UPLC-MS/MS法定量結果高于HPLC法;在定量奶粉中bLF含量上,HPLC法測定奶粉的結果與標簽明示值相似,也就是說,液相方法更接近理論添加值,而UPLC-MS/MS法偏高。這主要原因,歸結于在HPLC法中,前處理是采用肝素親和柱提取、純化和富集樣品中目標物質。肝素親和柱以肝素作為配體,共價偶聯瓊脂糖形成固定相填料。肝素是由己糖醛酸與D-葡糖胺殘疾相互交聯形成的一種硫酸化的糖胺聚糖。由于肝素中大部分基團高度硫化[21],呈酸性的多陰離子結構,因此陰電密度特別高。肝素可作為一方面可以作為親和配體,具有族特異性親和作用,可通過糖苷鍵與LF發生相互作用;另一方面由于肝素表面的硫酸基團,具備大量負電荷,可與帶正電的蛋白質發生離子結合,從而對LF具備高選擇性[22]。LF作為一種結構糖蛋白,在適當的緩沖溶液條件下,可以通過親和層析結合肝素,通過磷酸鹽淋洗和鹽溶液洗脫,實現LF的分離[23,24]。UPLC-MS/MS法測定bLF則是將LF通過胰蛋白酶酶解為肽段,在數據庫中進行肽鑒定進而選擇bLF特征性肽段,經過質譜精確確證,實現“蛋白-肽段-蛋白”的定量轉換[25]。
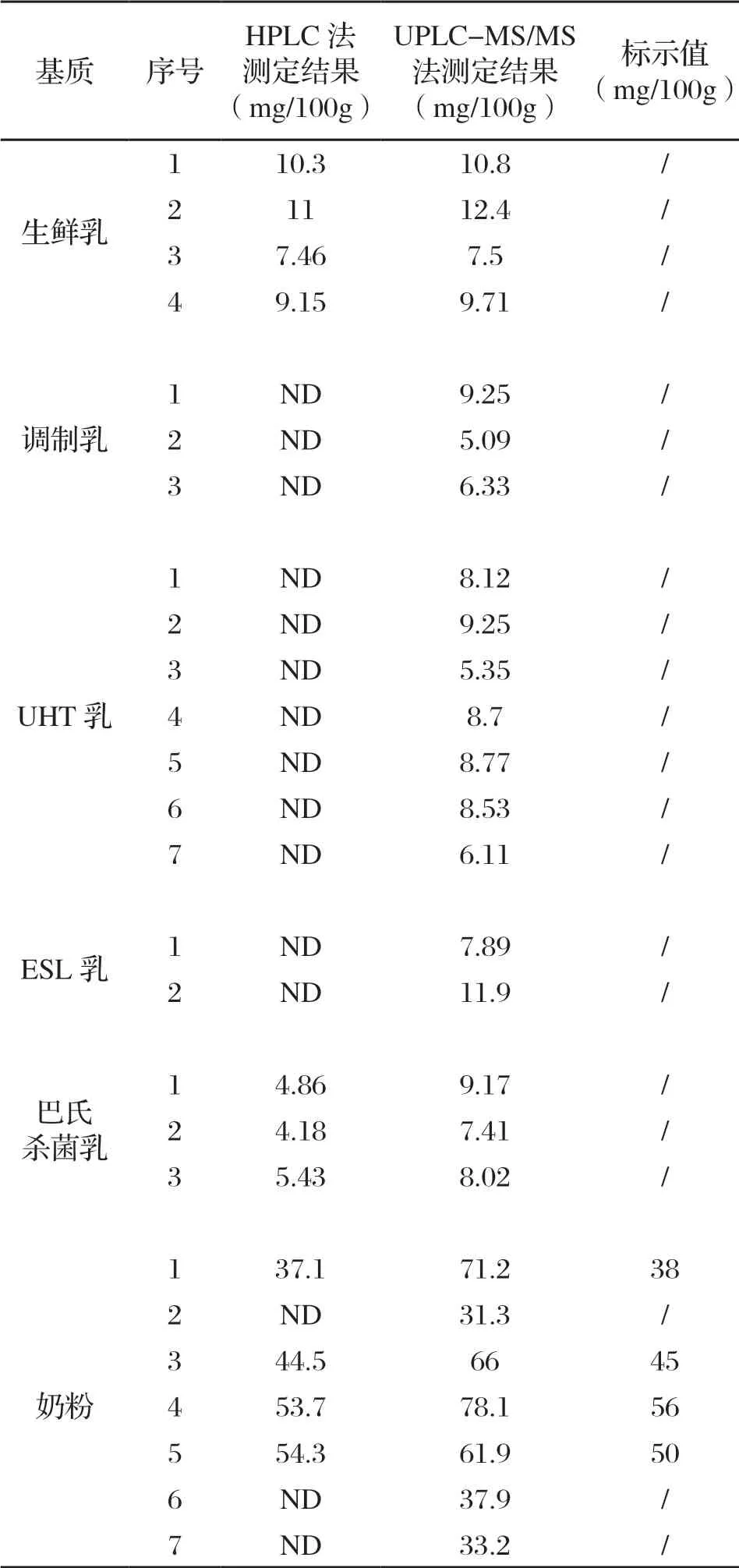
表2 不同方法檢測乳及乳制品中bLF的含量(n=2)
為考察兩個方法差異性來源,選取5 種不同基質,包括生鮮乳、巴氏殺菌乳、ESL乳、UHT乳和奶粉,將HPLC法中過肝素親和柱后棄去的液體用UPLC-MS/MS法經酶解處理后上機,得到結果如表3所示。結果表明,HPLC法的測定結果與過肝素柱后棄去液的結果加和,約等于UPLC-MS/MS法的測定結果。值得注意的是,未經熱加工處理的生鮮乳經肝素柱凈化后,棄去液中不含bLF,這表明熱加工處理會導致bLF和肝素親和柱的結合效果。然而,熱處理只會破壞bLF中蛋白質空間結構,導致部分活性功能的喪失,但不會破壞蛋白質的氨基酸組成,因此對UPLC-MS/MS檢測結果產生影響。
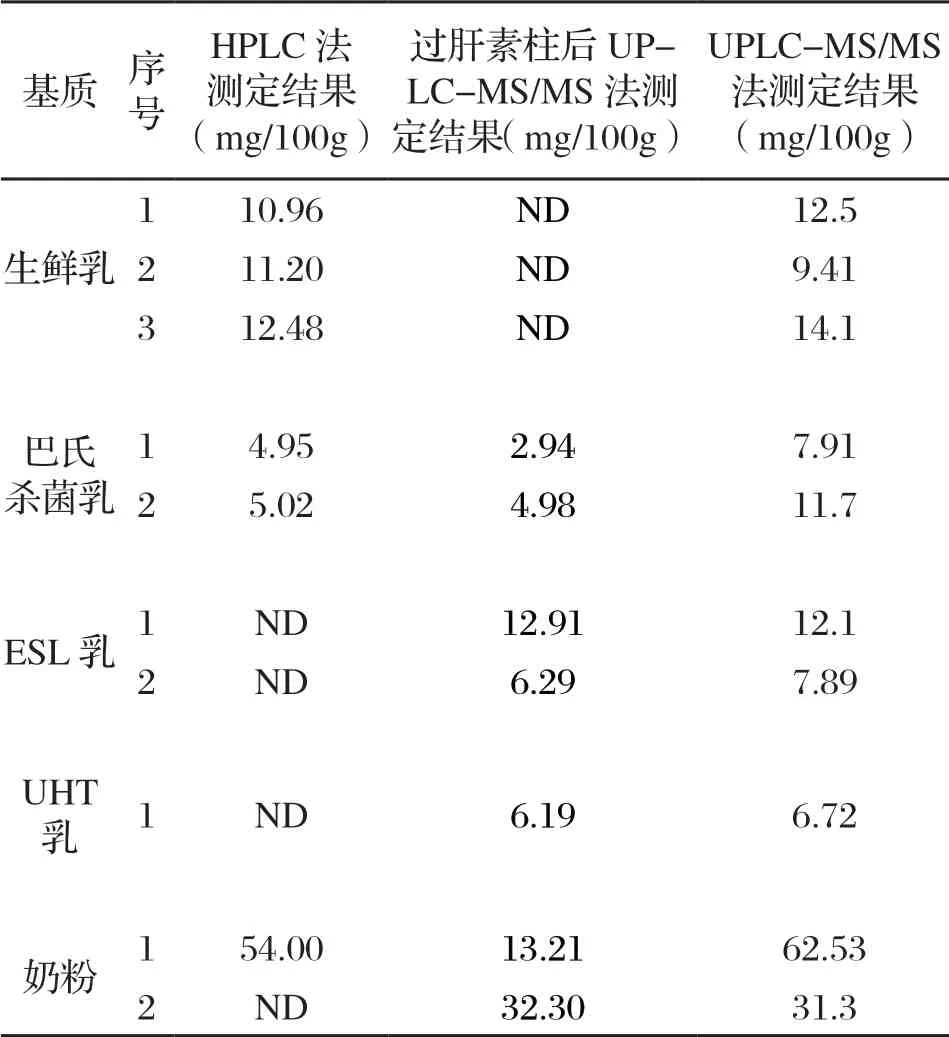
表3 兩種方法差異性來源考察(n=2)
3 結論
對比了HPLC法及UPLC-MS/MS法檢測乳及乳制品中的bLF,兩種方法回收率高、重現性好,均能提供準確、精確的測定結果,滿足乳與乳制品中bLF的定量檢測需求,但兩者方法測定結果具有一定差異性。基于HPLC法測定乳及乳制品中bLF的含量,是通過肝素親和柱純化富集,獲得非熱變性bLF的含量;基于UPLC-MS/MS法測定bLF的含量,通過將大分子蛋白酶解獲得肽段,針對特征性肽段,建立內標法測定熱變性和非熱變性bLF白的含量,不受熱處理加工工藝的影響。可針對不同檢測目的選擇不同方法進行定量研究。

