微球囊壓迫下行PTCA對冠心病患者IP-10、CK-MB水平的影響
張立敏
冠心病作為臨床常見的心血管疾病之一,其主要病理基礎表現(xiàn)為血管內皮受損、動脈粥樣硬化等,若不采取及時有效的治療措施,不僅會形成微球囊壓迫血栓,還會導致一系列急性冠脈綜合征[1]。目前,國內治療冠心病主要采用經皮冠狀動脈腔內血管成形術(percutaneous transluminal coronary angioplasty,PTCA)與經皮冠狀動脈介入治療(percutaneous coronary intervention,PCI)[2]。然而隨著手術方式的逐漸改進,關于PTCA 對患者心臟功能造成的影響研究卻相對較少,鑒于此,本研究對2019 年1 月-2021 年12 月佳木斯市中心醫(yī)院收治的80 例冠心病患者進行觀察治療,并分析其臨床效果,現(xiàn)報道如下。
1 資料與方法
1.1 一般資料 選取2019 年1 月-2021 年12 月本院收治的80 例冠心病患者。診斷標準符合文獻[3]《中國心血管病預防指南(2017 版)》中的診斷標準:(1)心前區(qū)突發(fā)發(fā)作性絞痛或壓榨痛;(2)易感乏力、胃腸道不適;(3)心音減弱、心律失常。納入標準:(1)符合冠心病的診斷標準及PCI 與PTCA的臨床手術指征;(2)未進行過系統(tǒng)性、針對性的治療恢復。排除標準:(1)合并陳舊性心肌梗死、嚴重主動脈狹窄、肥厚性心肌病或病態(tài)竇房結綜合征等危險病況;(2)合并造血系統(tǒng)疾病、肝腎功能損害、先天性免疫缺陷疾病或其他嚴重心理疾病,精神狀態(tài)不穩(wěn)定等;(3)不配合研究,態(tài)度極差或研究過程中退出。按照隨機數字表法將患者分成研究組和對照組,每組40 例。本研究經倫理委員會批準,患者及家屬同意并簽訂知情同意書。
1.2 方法
1.2.1 術前準備 術前由醫(yī)護人員對患者進行凝血指標、藥物過敏反應(皮試)等方面的檢查,并通知禁食禁水,加強手術介紹和心理疏導,提高患者對疾病的了解和手術信心,并緩解其焦慮情緒。此外采用相關超聲設備做好患者心腦血管監(jiān)測,包括冠狀動脈供血、彈性及粗直狀況。
1.2.2 術中 對照組采用PCI,首先將右側橈動脈骨莖突上2 cm 左右確定為手術穿刺點,之后進行局部麻醉,采用利多卡因(生產廠家:濟川藥業(yè)集團有限公司,批準文號:國藥準字H10880008,規(guī)格:10 g*6 支)10 g,之后使用專用橈動脈穿刺針進行穿刺,成功后置入6F 橈動脈鞘,并在鞘內注入3 000 U 肝素鈉注射液(生產廠家:江蘇萬邦生化醫(yī)藥集團有限責任公司,批準文號:國藥準字H32020612,規(guī)格:2 mL∶12 500 單位)與200 μg硝酸甘油注射液(生產廠家:山西康寶生物制品股份有限公司,批準文號:國藥準字H14022197,規(guī)格:1 mL∶5 mg),以防止血管痙攣并減少血栓形成和橈動脈閉塞,手術完成后,拔除橈動脈鞘并使用壓迫器止血,術后1 h 減壓,6 h 后改為普通包扎,進而轉入術后護理。
研究組在微球囊壓迫下行PTCA,先經橈動脈行冠狀動脈造影,患者右手置于平伸外展位,選用利多卡因10 g 進行局部麻醉,用21G 穿刺針尖斜向近端進針,進入動脈后插入0.021 英寸直引鋼絲,并使用球囊沿鋼絲插入狹窄處,連接6F 動脈鞘,鞘內注入硝酸甘油注射液200 μg 與肝素鈉注射液3 000 U,同樣為防止血管痙攣和血栓。造影結束后再通過動脈鞘向球囊中注射7 000 U 肝素鈉,以后根據手術時間每小時追加肝素鈉2 000 U,但需注意手術過程中注入肝素鈉總量不宜超過20 000 U。術后使用葡萄酒軟木塞和止血繃帶進行止血,2 h 內逐漸減壓,2~4 h 內逐步松開緊縛,并撤出球囊,留置鋼絲,12~24 h 內完全松開后轉入術后護理。手術時,選用Jundkins 導管與6F 指引導管,使用球囊直徑為2.80 mm,使用支架(AVE,Biodiviysio,Jomed 公司)直徑為3.20 mm,長度為16.20 mm。
1.2.3 術后護理 患者返回病室后對其予以心電監(jiān)護,監(jiān)測血壓和心率變化,觀察是否出現(xiàn)心律失常、心肌缺血、橈動脈閉塞等急性并發(fā)癥,同時觀察患者穿刺部位是否滲血,肢體是否出現(xiàn)腫脹等情況,在一切穩(wěn)定的狀態(tài)下,指導患者進行術后術側肢體制動,術側腕部保持伸直,防止下垂,避免突然性用力或劇烈運動,以防出血。
1.3 觀察指標及判定標準(1)比較兩組心功能指標。應用自動心血管功能測試診斷儀(ZXG-F 型)分別于術前1 d 和術后1 周進行評估,主要包括左心室射血時間(left ventricular ejection time,LVET)與心臟等容收縮時間(isovolumetric contraction time,ICT)。指標越高表明心功能表現(xiàn)越差[4-5]。(2)比較兩組血小板指標。分別在術前1 d 和術后1 周,應用波球血小板黏附儀(3-991 型,成都電子儀器制造公司)測定兩組血小板黏附率;應用智能全血血小板聚集儀(TYXN-91 型,上海通用機電技術研究所)測定兩組血小板聚集率,測定前需在每份樣品中加入0.3 mL 抗凝劑。兩類指標越高表明血小板黏稠程度越高,發(fā)生血栓的風險越大[6-7]。(3)比較兩組血清因子水平。術前1 d 與術后3 d 分別抽取兩組清晨空腹肘靜脈血1.5 mL,經過3 000 r/min 離心后,進行血漿分離并將之放置在-40 ℃的環(huán)境中進行集中低溫保存等候檢查,經由專業(yè)醫(yī)師采用酶聯(lián)免疫吸附法(ELISA)測定患者血清中趨化因子干擾素誘導蛋白-10(interferon-inducible protein-10,IP-10)和心肌型肌酸激酶同工酶(MB isoenzyme of creatine kinase,CK-MB)水平,水平越低,表明患者體內細胞組織受到損害程度越低[8-9]。
1.4 統(tǒng)計學處理 以SPSS 19.0 軟件分析研究結果,計數資料以率(%)表示,采用χ2檢驗;符合正態(tài)分布的計量資料用()表示,采用t檢驗。P<0.05 為差異有統(tǒng)計學意義。
2 結果
2.1 兩組一般資料比較 研究組女19 例,男21 例;平均年齡(47.50±11.50)歲;平均病程(4.50±0.25)年。對照組女22 例,男18 例;平均年齡(50.00±12.00)歲;平均病程(4.50±0.50)年。兩組一般資料比較,差異均無統(tǒng)計學意義(P>0.05),具有可比性。
2.2 兩組心功能指標比較 術前1 d,兩組LVET、ICT 比較,差異均無統(tǒng)計學意義(P>0.05);術后1 周,研究組LVET 與ICT 均短于對照組,差異均有統(tǒng)計學意義(P<0.05)。見表1。
表1 兩組心功能指標比較[ms,()]
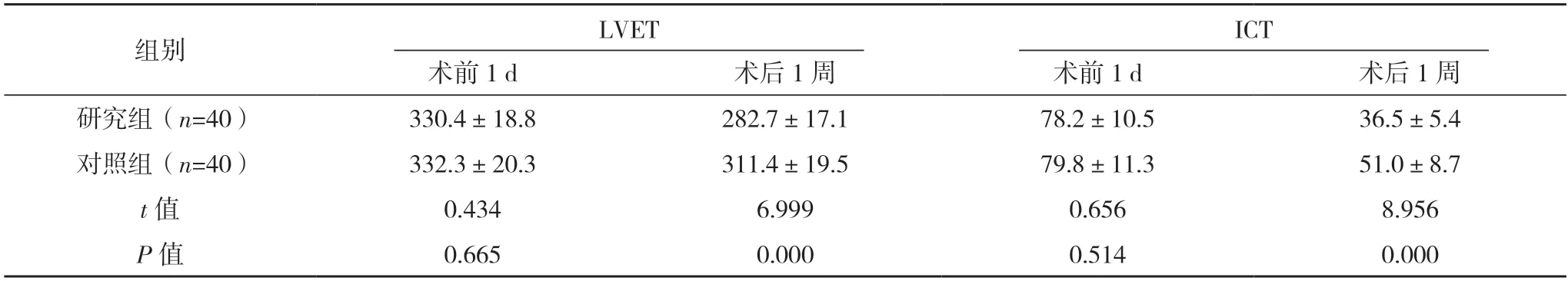
表1 兩組心功能指標比較[ms,()]
2.3 兩組血小板指標比較 術前1 d,兩組血小板聚集率、黏附率比較,差異均無統(tǒng)計學意義(P>0.05);術后1 周,研究組血小板黏附率與聚集率均低于對照組,差異均有統(tǒng)計學意義(P<0.05)。見表2。
表2 兩組血小板指標比較[%,()]
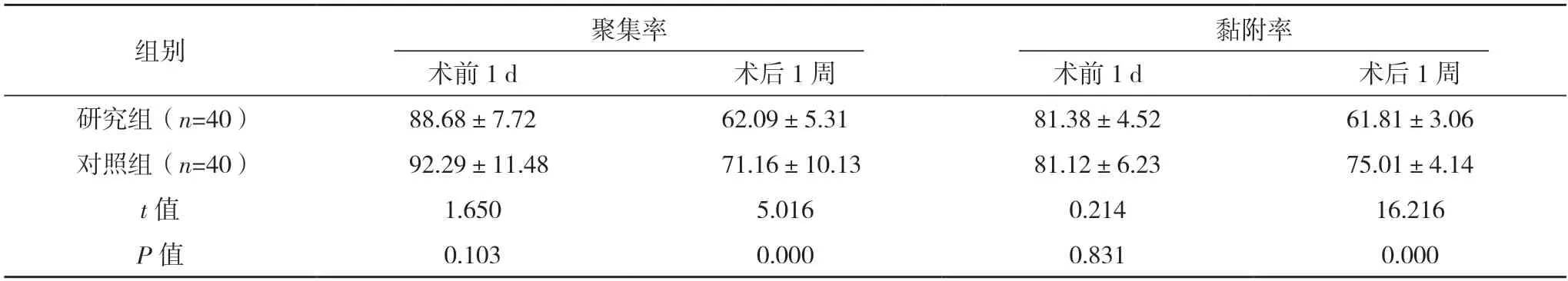
表2 兩組血小板指標比較[%,()]
2.4 兩組血清因子水平比較 術前1 d,兩組血清IP-10 與CK-MB 水平比較,差異均無統(tǒng)計學意義(P>0.05);術后3 d,研究組血清IP-10 與CK-MB水平均低于對照組,差異均有統(tǒng)計學意義(P<0.05)。見表3。
表3 兩組血清因子水平比較()
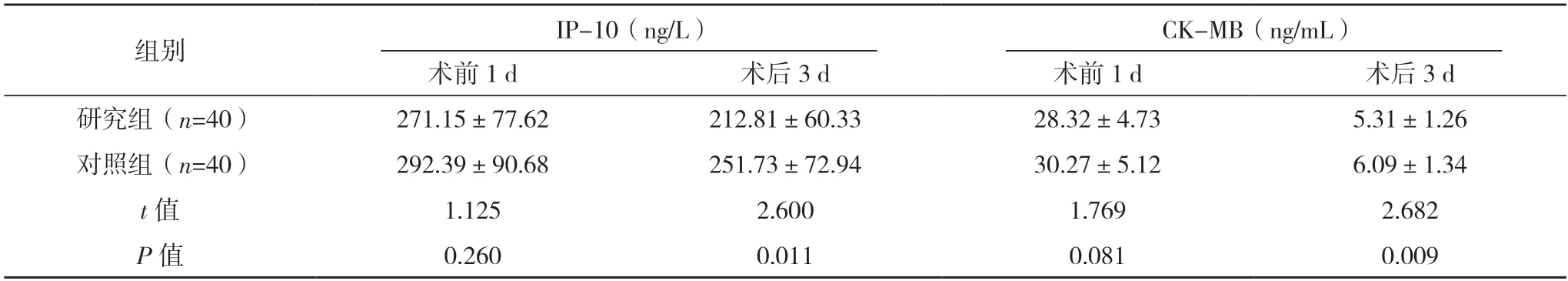
表3 兩組血清因子水平比較()
3 討論
冠心病即冠狀動脈粥樣硬化性心臟病,近年來,已成為威脅人們生命安全的主要心血管疾病之一。由于冠心病時常伴隨多種并發(fā)急癥,且會對患者的生活質量和心理狀態(tài)造成很大影響,所以大多數醫(yī)療機構對于手術介入治療途徑的選擇都是慎之又慎[10]。根據國外研究結果顯示,由于PTCA 具有穿刺損傷小、血管并發(fā)癥少、術后止血方便且恢復快等優(yōu)點,自1989 年起PTCA 便開始替代經股動脈腔內血管成形術成為冠心病介入治療的主要方式[11]。與此同時,探究并分析在微球囊壓迫下進行PTCA手術對患者體內相關因子水平的影響也成了冠心病臨床研究的重點。
冠心病臨床上主要的病理特征為動脈粥樣斑塊形成等,由于其病理特征的特殊性,會對冠狀動脈產生較大影響,當冠狀動脈管徑小于原有管徑70%時,血液循環(huán)能力將大幅下降,屆時便會出現(xiàn)心肌缺氧、缺血等癥狀,病情嚴重時甚至會出現(xiàn)心肌梗死[12]。除此之外,張新才等[13]在研究中發(fā)現(xiàn),在外界誘因的刺激下,患者體內冠狀動脈粥樣硬化程度會逐步加重,而當冠狀動脈由于粥樣硬化而使管徑變窄時,血流會明顯減少,致使病變冠狀動脈供血心肌區(qū)長期處于缺血狀態(tài),并最終形成冬眠心肌,進而發(fā)生心臟排血功能異常,心肌收縮功能下降等現(xiàn)象。由此可見,通過手術方式在減少穿刺損傷的基礎上解除冠狀動脈狹窄及開通閉塞的冠脈,并改善患者的心功能是治療冠心病的根本[14]。基于此理念,郭景紅[15]在研究中表明,PTCA 能夠在膨脹球囊的擠壓下使血管內的粥樣硬化斑塊斷裂,內膜層暴露或出現(xiàn)淺表的縱向撕裂,并可延伸至中層,導致中層永久性的縱伸延長,從而擴大血管腔的橫斷面積,以進一步增加血流量,改善心臟排血及心肌功能。而這一點在本研究結果也得到體現(xiàn),研究組術后1 周LVET 與ICT 指標均短于對照組,說明冠狀動脈狹窄處在裝有球囊的動脈導管的充壓干擾下,局部血管得到擴張,心臟排血功能也得到緩解,并且喚醒了冬眠心肌,使得心肌收縮能力也有所恢復。與此同時,鄭直等[16]在研究中提出,冠狀動脈過于狹窄會激活并引起血小板的黏附聚集,增加形成血栓的風險,同時還會造成一系列血流動力學的改變,導致內皮細胞的損傷與內膜受損,并釋放某些血管活性物質,從而引發(fā)變異性心絞痛、心肌梗死和心源性猝死,而PTCA 則可以顯著改善冠脈的狹窄程度,從而較好地緩解血小板聚集率和黏附率。而這也正與本研究結果基本相符。本研究顯示,術后1 周研究組血小板黏附率與聚集率均有所下降,且低于對照組,進一步說明微球囊壓迫下行PTCA不僅可以緩解冠狀動脈的狹窄程度,提高患者心功能,也能夠改善其體內血小板功能異常的情況,從病理基礎上緩解冠心病及相關病癥。
此外,IP-10 作為一種血管新生抑制因子和趨化因子干擾素誘導因子,能夠選擇性地誘導白細胞釋放細胞因子及內皮細胞表達黏附分子,使病變部位聚集大量炎癥細胞而引起炎癥反應,延緩血管修復進度,也可以誘導巨噬細胞等基質細胞產生各種趨化因子,趨化更多的炎癥細胞到病變部位,加重組織損害[17]。而在細胞組織受到損傷,且無法修復或修復較為緩慢時,CK-MB 便會通過被破壞的細胞膜釋放入血液,進而導致交感神經興奮狀態(tài)下腎素-血管緊張素-醛固酮系統(tǒng)過度激活,對心肌細胞產生直接毒性而加重心肌損傷,形成惡性循環(huán),嚴重影響患者病情恢復[18]。由此可見,對冠心病患者在微球囊壓迫下行PTCA 可以在提高其心功能的同時,改善病變部位所衍生的炎癥反應,并降低心肌細胞的受損程度,從而加快血管修復進程,促進病情恢復[19]。通過本研究也證實了這一理論的可行性。本研究結果表明,兩組術后血清中的IP-10與CK-MB 水平均有所降低,且研究組低于對照組,說明微球囊壓迫下行PTCA 能夠從改善冠脈的狹窄程度出發(fā),降低血小板聚集程度和冠脈粥樣硬化病變部位的炎癥反應,并改善心肌細胞及其周圍組織的損傷-致?lián)p因子釋放-損傷的不良循環(huán),降低患者血清中的IP-10 與CK-MB 水平,減輕其體內細胞組織受到損害程度,對于提高患者術后恢復也具有更加突出的效果[20]。但由于本研究關于冠心病患者在微球囊壓迫下行PTCA 的研究樣本數量較小,研究角度不夠全面,同時受經濟、人力等條件限制,未能對患者進行更長時間的隨訪,因此后續(xù)仍需深入探索手術效果及其帶來的影響。
綜上所述,在冠心病的臨床治療中,微球囊壓迫下行PTCA 能夠有效緩解患者體內的心功能指標,通過降低血清中IP-10 與CK-MB 水平達到緩解病變部位細胞組織的受損程度,進一步提高術后恢復效果,具有更好的治療效果,值得臨床應用和推廣。

