葉綠素熒光成像技術監測苗期小麥白粉病初探
單鼎城, 趙亞男, 張美惠, 馬明慧, 韓志國, 劉 偉*,范潔茹*, 袁軍海, 周益林
(1. 中國農業科學院植物保護研究所, 植物病蟲害生物學國家重點實驗室, 北京 100193; 2. 河北北方學院農林科技學院, 張家口 075000; 3. 慧諾瑞德(北京)科技有限公司, 慧諾表型實驗室, 北京 100096)
小麥白粉病是由禾布氏白粉菌小麥專化型Blumeriagraminisf.sp.tritici引起的氣傳性病害,當小麥葉片受到白粉菌侵染后,葉綠素含量會顯著下降,且感病后不同時間和嚴重度下葉綠素含量的變化有所不同[1-2]。因此,通過葉片中葉綠素含量的變化可以了解植物所受病害脅迫的程度。但傳統上,葉綠素含量的測量主要采用紫外分光光度法,該方法操作繁瑣,而葉綠素熒光技術可以直接、快速地通過葉綠素熒光反映出葉綠素的變化,以此作為生物脅迫檢測的依據。近年來,隨著葉綠素熒光測定和成像技術的進步,尤其是葉綠素熒光成像系統的開發,提出了一種從宏觀上獲取植物熒光的方式,在獲取熒光參數的同時也獲得了快速、直觀和精確的圖像信息,這使得葉綠素熒光成像技術克服了傳統熒光儀有限點測量的缺點,因而逐漸被廣泛應用。陳兵等[3]對棉花黃萎病(Verticillium wilt)脅迫下的棉花葉片進行葉綠素熒光檢測,結果發現利用葉綠素熒光監測棉花黃萎病是可行的;許培磊等[4]的研究發現,葡萄霜霉病菌Plasmoparaviticola侵染離體山葡萄Vitisamurensis葉片后3 d,其光系統活性就發生了顯著變化;Mandal等[5]利用葉綠素熒光技術檢測發現,輕度感染霜霉病與重度染病的圓苞車前Plantagoovata葉片的Fv/Fm值相較于健康葉片分別降低了24.39%和44.90%。已有研究發現,利用葉綠素熒光成像技術可以實現煙草感染辣椒輕斑駁病毒(pepper mild mottle virus)或感染黃瓜炭疽菌Colletotrichumorbiculare后感病程度檢測[6-7];Cen等[8]利用葉綠素熒光成像技術對感染黃龍病菌CandidatusLiberibacter的柑橘葉片進行診斷,診斷準確率最高可達97%;Bauriegel等[9-10]利用葉綠素熒光圖像技術分析了受黃色鐮孢Fusariumculmorum侵染后的麥穗損害程度和病害分布情況。這些研究均表明,利用葉綠素熒光成像技術來監測植物病害脅迫是可行的。
在小麥白粉病方面,利用激光誘導葉綠素熒光(laser-induced chlorophyll fluorescence)監測小麥葉片受白粉病侵染的程度已有研究報道[11],而葉綠素熒光成像技術在小麥白粉病監測研究中鮮有報道。為了探究葉綠素熒光成像技術在小麥白粉病監測中的可行性,本研究在室內對接種6個不同濃度的小麥白粉病菌分生孢子的小麥離體葉段、一葉一心幼苗及二葉一心幼苗進行葉綠素熒光測定,初步明確圖像以及圖像參數與病情嚴重度之間的關系,為該技術在小麥白粉病監測中的應用提供理論依據。
1 材料與方法
1.1 供試材料
供試小麥品種為‘京雙16’(高感小麥白粉病)。小麥白粉病菌菌株為混合菌株,由中國農業科學院植物保護研究所小麥白粉病組提供;多功能植物光合表型測量系統PlantExplorerPro(荷蘭PhenoVation公司)由慧諾表型實驗室提供。
PlantExplorerPro儀器相關參數分別為:相機傳感器類型為CCD,相機分辨率為130萬像素,單張葉綠素熒光圖像獲取時間為20~1 000 μs,激發光強度在25 cm處為1 500~6 000 μmol/(m2·s),在60 cm處為800~3 500 μmol/(m2·s),且強度可調。成像面積為40 cm×53 cm。
1.2 試驗方法
1.2.1試驗設置和接菌濃度梯度處理
本試驗分別選取小麥幼苗期離體葉段、一葉一心期幼苗、兩葉一心期幼苗進行葉綠素熒光成像監測。各時期小麥培養條件基本一致。各時期小麥均在(18±1)℃,光周期L∥D=16 h∥8 h條件下的溫室或培養箱內培養。
小麥幼苗離體葉段的準備:將‘京雙16’小麥品種種植在用玻璃罩罩起的塑料盆內(防止污染),待小麥第1葉完全展開時,在無菌條件下將葉片剪成長約4 cm的葉段,整齊擺放入10 cm×10 cm方形培養皿中的水瓊脂培養基上,每皿15個葉段。
一葉一心期和兩葉一心期小麥幼苗的準備:將‘京雙16’小麥品種種植在用玻璃罩罩起的塑料盆內,每盆按照“一”字形種10株麥苗,待小麥苗長至一葉一心及兩葉一心時備用。
孢子懸浮液的準備:將新鮮的重為4、8、12、16 mg 和20 mg的孢子粉分別置于噴壺中,倒入4 mL 電子氟化液,渦旋振蕩15 s,混勻后進行噴霧接種。
接菌處理:各處理均設置6個濃度的白粉病菌分生孢子懸浮液,用電子氟化液配制的0(對照)、1、2、3、4、5 mg/mL的小麥白粉病菌分生孢子懸浮液,其中離體葉段上每個接菌濃度設置4個重復(4皿),一葉一心、兩葉一心期小麥苗上每濃度設置3個重復(3盆),每個重復噴3 mL分生孢子懸浮液,在無菌操作臺內按濃度梯度由低到高接菌,然后將各處理隨機排列置于(18±1)℃培養箱或溫室內培養。
病害調查:在進行葉綠素熒光成像檢測的當天,逐個對葉片進行白粉病發病情況調查,按病斑面積占葉片面積的百分率記錄嚴重度(0~100%),并計算每個濃度處理的平均嚴重度。
1.2.2葉綠素熒光圖像采集和處理
分別于接菌后的第3、5、7天和第9天利用PlantExplorerPro多功能植物光合表型測量系統對不同時期以及接種不同濃度病菌分生孢子的小麥離體葉段或幼苗進行葉綠素熒光成像檢測(為了減少干擾,提高測量的準確性,盛放參試材料的托臺均用黑色幕布包裹),開始檢測之前,參試材料需在無光的植物測量室內暗適應20 min,測量結束后文件保存為DAT文件格式。
利用PlantExplorerPro系統自帶的Data Analysis Software分析軟件對相應的圖像進行分析,首先利用Mask功能將不發葉綠素熒光的背景去除,主要是將小麥離體葉段的培養皿、一葉一心幼苗和二葉一心幼苗的盆以及背景雜物全部隱去,只在圖像中留下清晰的離體葉段或麥苗。然后利用ROI模塊將植物圖像進行分割,分別導出分割圖像或者全圖像的葉綠素熒光圖像參數。通過Data Analysis Software數據分析軟件分析處理可以得到暗適應下最大光化學量子產量(Fv/Fm)、非光化學淬滅系數(NPQ)、光化學淬滅系數(qP)、葉綠素指數(Chlidx)等4個參數。
1.3 數據分析
病菌分生孢子不同接種濃度梯度下小麥離體葉段、一葉一心幼苗、二葉一心幼苗的葉綠素熒光參數Fv/Fm的多因子方差分析和差異顯著性分析分別采用SAS(9.4)軟件的PROC GLM和PROC ANOVA模塊完成。接種后第5、7、9天的離體葉段、一葉一心期幼苗、二葉一心期幼苗的小麥白粉病病情嚴重度與其對應的葉綠素熒光參數值之間的相關性分析采用SAS軟件的PROC CORR模塊完成。利用SAS軟件的PROC REG模塊建立不同時期下基于Fv/Fm和Chlidx的小麥白粉病嚴重度估計模型,并利用決定系數(R2)和均方根誤差(RMSE)來檢驗擬合程度。
2 結果與分析
2.1 白粉病菌分生孢子不同接種濃度下小麥離體葉段的葉綠素熒光圖像變化
在接種白粉病菌分生孢子后的第3、5、7、9天對小麥離體葉段進行葉綠素熒光圖像采集,獲取Fv/Fm圖像(圖1)。Fv/Fm圖像中的熒光信息分布比較均勻,1 mg/mL分生孢子的接菌處理隨著接菌時間的延長沒有明顯的差異,表明在病菌分生孢子濃度低時,離體葉段的熒光強度保持在一個相對穩定的范圍;而2~5 mg/mL分生孢子處理的Fv/Fm熒光信息在小麥白粉病顯癥之前(接菌后第3天),染病葉段的葉表面Fv/Fm熒光信息變化相對較小;Fv/Fm在顯癥初期(接菌后第5天)開始變化,且在接菌后第7天和第9天(此時葉片已明顯出現癥狀)表現出一定的差異,尤其是在病斑侵染嚴重的區域,熒光信息顯示為紅色,染病葉段的Fv/Fm圖像強度分布會隨著發病程度的增加而出現明顯紅色加深的變化。

圖1 接種不同濃度白粉菌分生孢子后小麥離體葉段的Fv/Fm圖像Fig.1 Fv/Fm-images of detached leaf segments of wheat inoculated with Blumeria graminis f.sp. tritici (Bgt) spores with different concentrations
2.2 小麥不同生長時期和白粉病菌分生孢子不同接種濃度梯度下Fv/Fm的比較
對不同接種濃度下小麥離體葉段、一葉一心幼苗、二葉一心幼苗的葉綠素熒光參數Fv/Fm的多因子方差分析結果表明,分生孢子濃度對Fv/Fm值的影響均達極顯著水平(P<0.01);接種后天數僅對小麥幼苗離體葉段Fv/Fm有顯著影響,而對一葉一心幼苗和兩葉一心幼苗的Fv/Fm無顯著影響;接種濃度和接種后天數兩因子交互作用對離體葉段和一葉一心幼苗Fv/Fm無顯著影響,而對兩葉一心幼苗Fv/Fm影響達到顯著水平(表1)。
接種白粉病菌分生孢子后的第3天時,離體葉段、一葉一心幼苗以及兩葉一心幼苗的Fv/Fm值隨接種濃度的變化規律均不明顯,而在接種后第5、7和9天時,在3個時期下Fv/Fm值均隨接種濃度的增加而下降(圖2)。
通過對離體葉段、一葉一心幼苗、二葉一心幼苗在不同接菌濃度下第5、7、9天時的熒光參數Fv/Fm的差異顯著性分析發現,分生孢子濃度對不同時期小麥葉綠素熒光參數Fv/Fm值有一定影響,除一葉一心幼苗用1~2 mg/mL孢子懸浮液處理時其Fv/Fm值與未接種對照處理沒有顯著差異外,其他處理的Fv/Fm值均顯著低于對照(表2)。
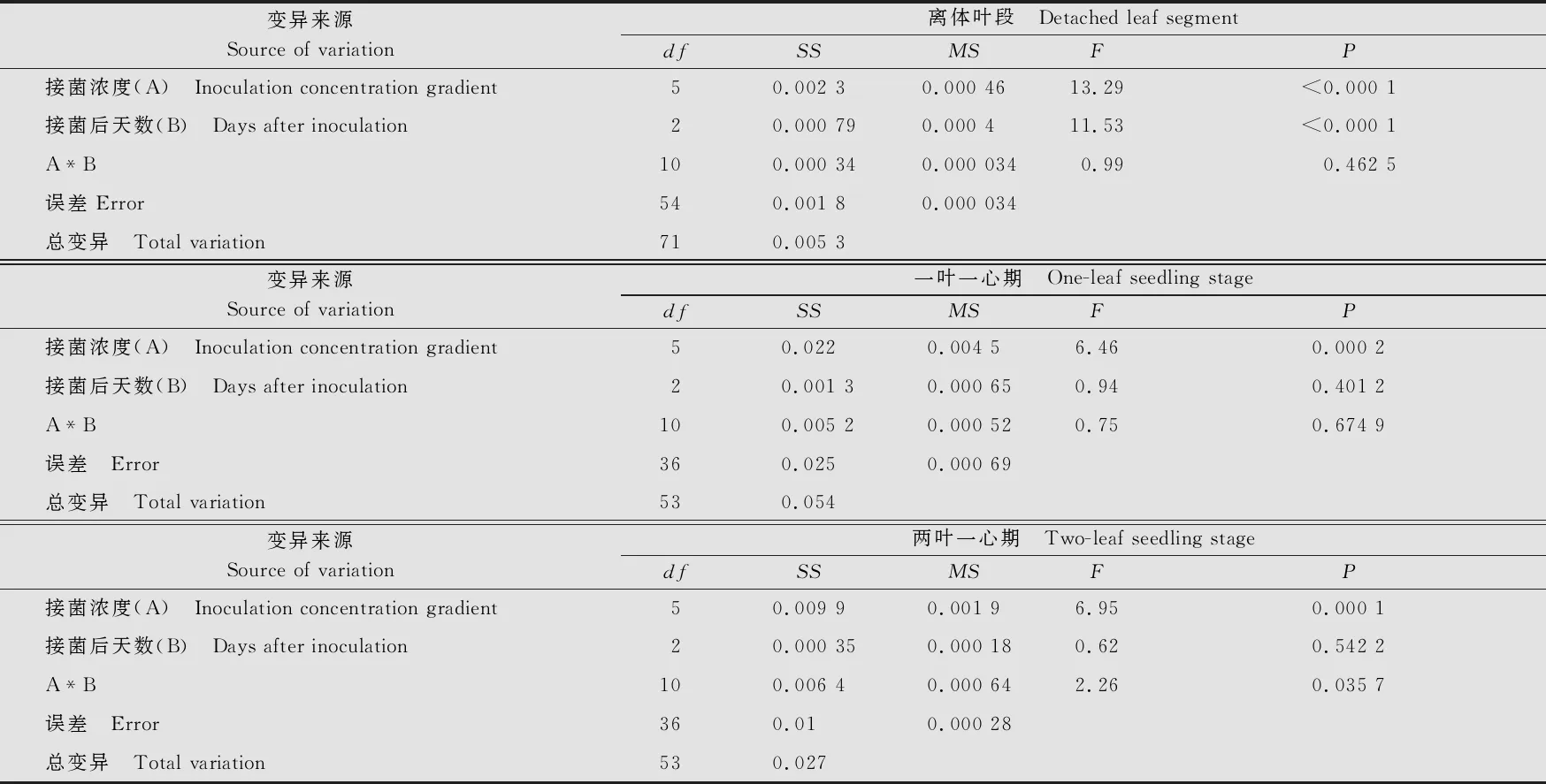
表1 小麥不同生長時期和白粉病菌不同接菌濃度下Fv/Fm的多因子方差分析1)
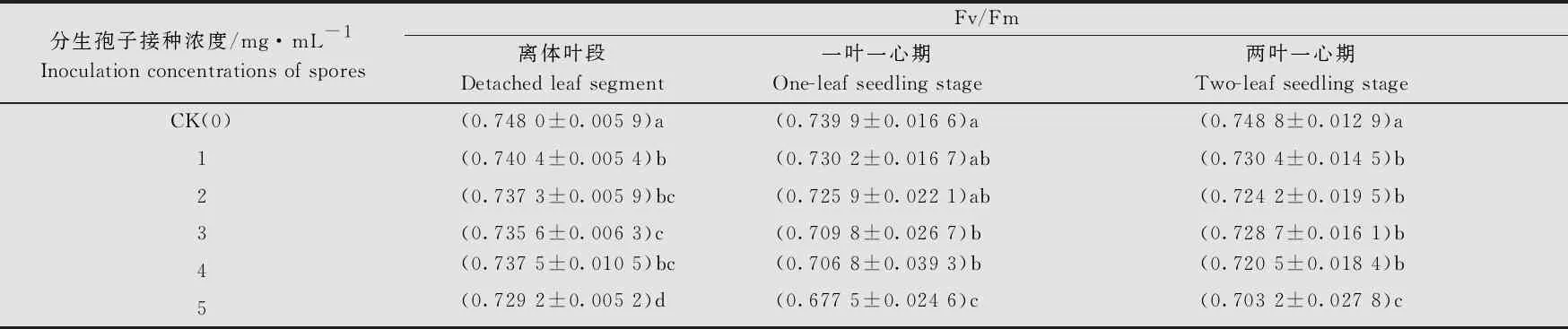
表2 接種不同濃度白粉病菌分生孢子條件下葉綠素的Fv/Fm1)
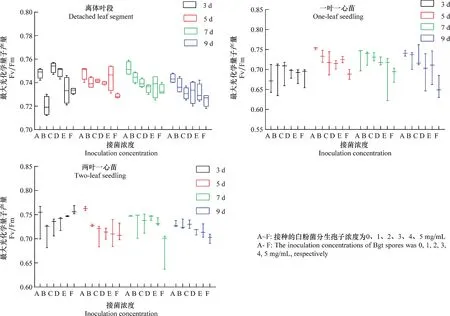
圖2 接種不同濃度白粉病菌分生孢子后不同天數的Fv/Fm箱線圖Fig.2 Fv/Fm boxplot of different days after inoculation with different concentrations of Blumeria graminis f.sp. tritici spores
2.3 小麥白粉病病情嚴重度與熒光參數的相關性
通過分析接種后第5、7、9天的離體葉段、一葉一心幼苗、二葉一心幼苗的小麥白粉病病情嚴重度與其對應的葉綠素熒光參數值(表3)的關系,發現Fv/Fm、Chlidx隨接菌濃度的升高有逐漸降低趨勢;而接菌濃度越高,病情嚴重度越大;qP和NPQ隨接菌濃度變化規律不明顯。
進一步對小麥白粉病病情嚴重度與其對應的葉綠素熒光參數之間的相關性(表4)分析可以看出,所選葉綠素熒光參數Fv/Fm和Chlidx與病情嚴重度之間均存在極顯著負相關關系,且兩個參數在離體葉段和一葉一心幼苗期與病情嚴重度之間的相關系數明顯高于兩葉一心幼苗期。qP在離體葉段和兩葉一心期與病情嚴重度顯著負相關,而在一葉一心幼苗期與病情嚴重度未達到顯著相關性。
2.4 小麥白粉病病情嚴重度與葉綠素熒光參數的關系模型
在相關性分析的基礎上,選取接種后第5、7、9天的葉綠素熒光參數Fv/Fm和Chlidx,分別建立不同時期下基于Fv/Fm和Chlidx的小麥白粉病嚴重度估計模型(表5)。結果可以看出,兩個參數在離體葉段、一葉一心幼苗期、兩葉一心幼苗期所建模型擬合效果均達到極顯著水平(P<0.01),但在兩葉一心幼苗期所建模型擬合效果相較離體葉段和一葉一心幼苗期所建模型略差。
通過對基于兩個參數所建模型擬合效果(圖3)比較發現,在同一時期基于葉綠素熒光參數Fv/Fm或Chlidx所建模型的擬合度相似,所建病害估計模型的R2基本相等,且同一時期分別基于Fv/Fm和Chlidx所建模型的理論值和實際觀察值之間的均方根誤差(RMSE)比較接近,因此,葉綠素熒光參數Fv/Fm或者Chlidx用來估計苗期小麥白粉病病情發生情況是可行的。
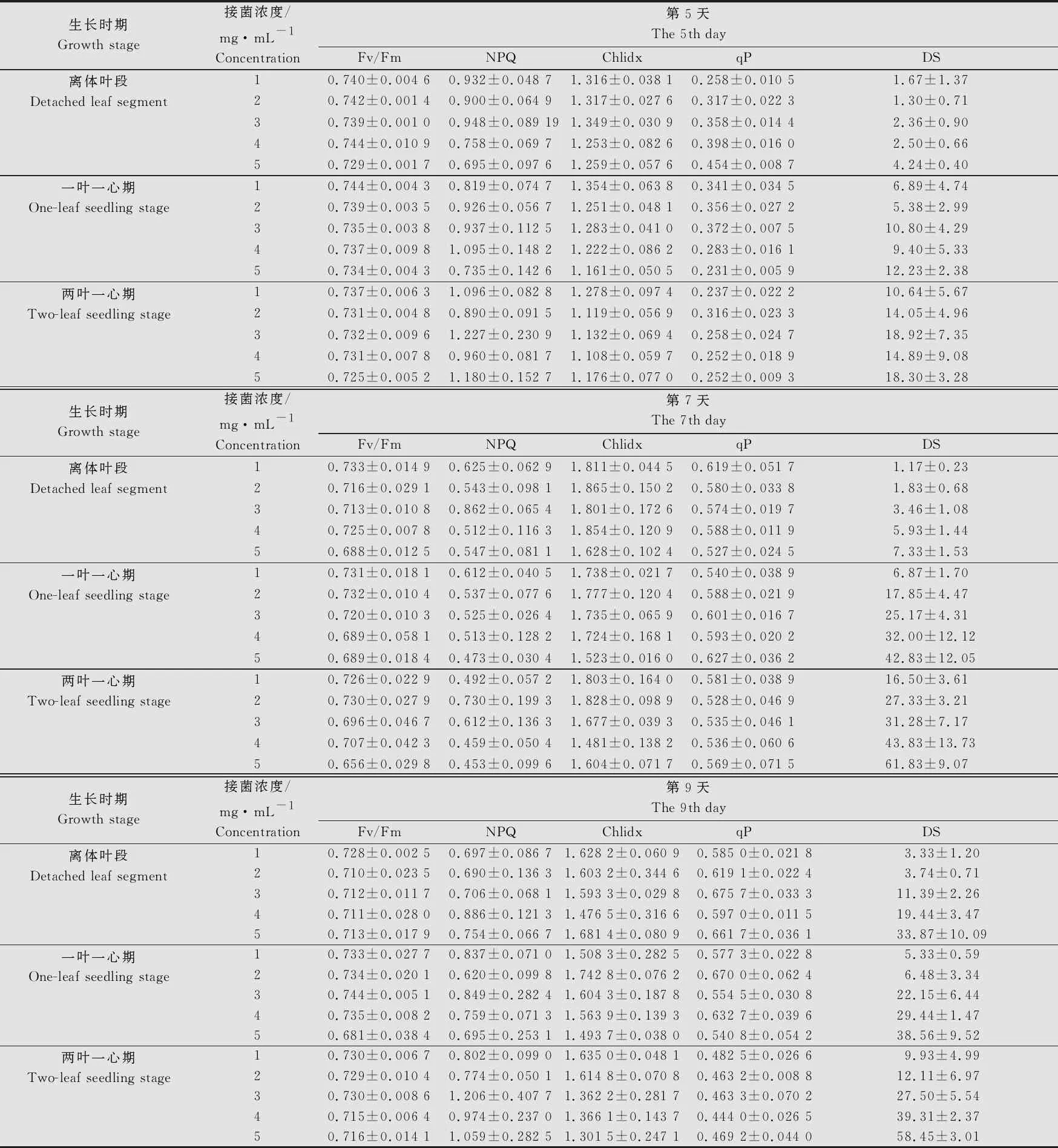
表3 小麥不同生長時期和不同接菌濃度下小麥白粉病病情嚴重度及熒光圖像參數的動態變化1)
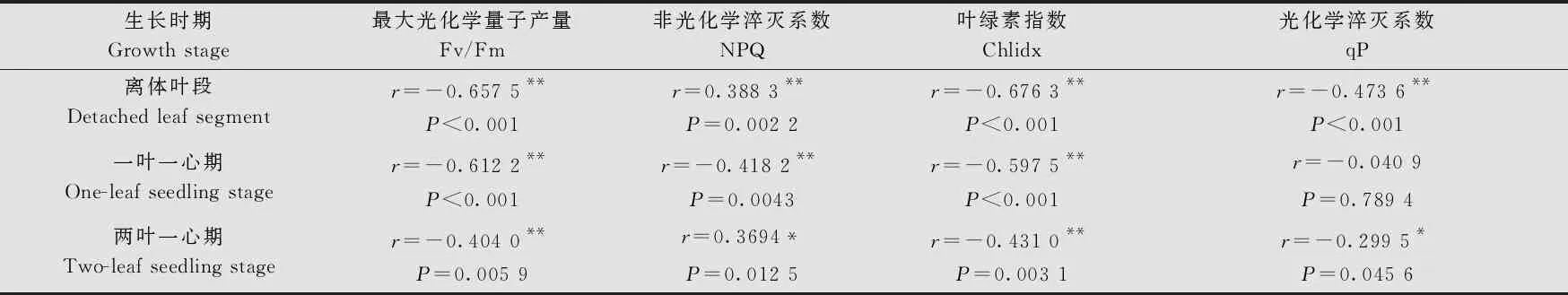
表4 小麥白粉病病情嚴重度與葉綠素熒光參數之間的相關關系1)
3 結論與討論
葉綠素熒光成像技術是一種快速、無損傷研究植物逆境光合生理的理想方法,已有的研究表明,病害脅迫可以降低棉花[3]、山葡萄[4]、煙草[12]等植物葉綠素熒光參數Fv/Fm值。本研究中,小麥葉片受到白粉病菌侵染后其Fv/Fm圖像顏色分布會隨著病害侵染程度的加重而發生改變,且Fv/Fm值顯著低于未接菌葉片,這表明利用葉綠素熒光圖像參數來監測小麥白粉病的嚴重程度是可行的。
小麥白粉病病情嚴重度與葉綠素熒光參數Fv/Fm和Chlidx之間均存在極顯著負相關關系,這是因為白粉病菌的侵染會造成小麥葉片葉綠素含量的下降[1],從而導致Chlidx的下降;已有研究發現,病菌的侵染會使PSⅡ(光系統Ⅱ)受到傷害,造成葉片PSⅡ潛在活性中心受損,光合電子由PSⅡ反應中心向電子受體A、B及質體醌庫的傳遞過程受到很大的影響,從而表現為Fv/Fm值降低[3, 7]。兩個參數在離體葉段和一葉一心幼苗期與病情嚴重度的相關系數明顯高于兩葉一心幼苗期,這可能是因為兩葉一心麥苗葉片相對較長,且第2葉與第1葉有一定的重疊或者遮擋,從而產生干擾所致。進一步通過對Fv/Fm與Chlidx參數所建模型擬合效果比較發現,所建病害估計模型的R2基本一致,因此,葉綠素熒光參數Fv/Fm或者Chlidx用來估計小麥苗期白粉病病情發生情況具有一定的應用前景。
葉綠素熒光成像技術在研究植物病害脅迫以及在病害檢測和監測方面具有巨大的應用潛力,與傳統的人工調查等病害診斷方法相比,葉綠素熒光成像技術具有快速、客觀、無損傷等特點,而且可以早期檢測到病菌的侵染及程度。本研究發現,在接菌后第3天進行葉綠素熒光檢測時Fv/Fm值變化不明顯,而在接菌后第5天(開始顯癥期)時Fv/Fm值表現出隨接菌濃度的增加而下降的趨勢,表明葉綠素熒光成像技術對于還未顯癥,尚處于潛育期的小麥白粉病菌可能也有一定的檢測能力,但具體在病菌侵染后第幾天可以檢測到以及檢測能力的大小,還有待于進一步研究。

