鋅濕法冶煉系統脫除鈣鎂的研究進展
馬少衛
(山東恒邦冶煉股份有限公司, 山東 煙臺 264100)
0 前言
鋅濕法冶煉過程中鈣鎂結晶,對鈣鎂的脫除是一個長期以來未得到解決的世界難題。鈣鎂飽和后會在鋅濕法系統管道、溜槽、濾布處結晶,嚴重危害設備的正常運行,同時使電解液黏度增大,阻礙Zn2+的遷移、增加能耗、降低電流效率。國內外只有少數技術和管理水平較高的企業才采取脫除措施,但是效果不理想。隨著濕法煉鋅技術的不斷發展,以及現代煉鋅技術對環境保護、能源消耗以及資源的綜合利用等方面提出了更高的要求,使得濕法煉鋅過程結晶的危害變得不能忽視,成為企業和從事濕法煉鋅技術的研究人員共同關注的問題,尋找合理的濕法煉鋅過程除鈣鎂工藝已成為亟待解決的問題。
1 鋅濕法冶煉系統脫除鈣鎂方法
本文綜述了國內外學者從鋅濕法冶煉系統中脫除鈣鎂的相關研究,根據脫除機理的不同主要分為精礦酸洗法、溶劑萃取法、氟化沉淀法、冷卻結晶法、開路溶液法,其中精礦酸洗法、冷卻結晶法與開路溶液法因工藝簡單,成本較低已經實現工業化。
1.1 精礦酸洗法
文獻[1]指出,自然界礦石中鎂主要以MgCO3、CaMg(CO3)2、(Mg,Fe,Ni)3Si2O5(OH)4形式存在,鈣則主要以CaCO3、CaMg(CO3)2、CaSO4·2H2O、CaF2、Ca5(PO4)3F物相存在,在鋅精礦焙燒前使用稀硫酸對鋅精礦進行酸洗,鎂可被有效脫除,由于硫酸鈣溶解度不高,約有10%的鈣可被酸洗脫除,脫鈣效果較差。
王乾坤等[2]利用白云石易溶于稀硫酸,而閃鋅礦及其它硫化礦物常壓下難以浸出的特性,對某高鎂硫化鋅精礦進行稀酸酸洗預處理,在溫度25 ℃、液固比5∶1、始酸50 g/L的條件下,鎂脫除率可達75%,而鋅、銅、鎘等有價金屬則沒有明顯浸出,可進行有效綜合回收。
Piot等[3]控制鋅精礦中Zn、Mg、Fe的含量,通過焙燒將鎂轉化為難以酸浸的ZnxMgyFe1-x-yFe2O4形式,可減少Mg進入濕法鋅冶煉后續系統。馬啟坤[4]對酸性溶液中的可溶性Si、MgSO4等熱力學計算,熱力學計算結果表明某高硅含鎂鋅精礦進行酸性浸出,可溶性硅與溶液中的MgSO4可形成MgSiO3沉淀析出,在SiO2>10 g/L,溫度65 ℃條件下即可得到較好的脫鎂效果。
精礦酸洗法脫鎂效果好、工藝簡單、成本較低,但延長了工藝流程,產生的廢水量大,當鋅精礦中氧化鋅、碳酸鋅含量較高時,鋅進入酸洗液,無法得到有效回收,因此不適用于含氧化鋅、碳酸鋅高的鋅精礦。
1.2 溶劑萃取法
溶劑萃取法主要從鋅電積廢液中分離鈣鎂,將鋅電積廢液中的硫酸使用N235進行萃取,使得鋅電積廢液pH降至2~3,利用金屬萃取率在不同pH下的差別,采用P204選擇性地將Zn2+與Ca2+、Mg2+分離(如圖3所示),溶劑萃取法分離鈣鎂的原理如下式所示:
2R3N+H2SO4=(R3NH)2SO4
(1)
(R3NH)2SO4+H2SO4=2(R3NH)HSO4
(2)
2HR+Zn2+=Zn·2R+2H+
(3)
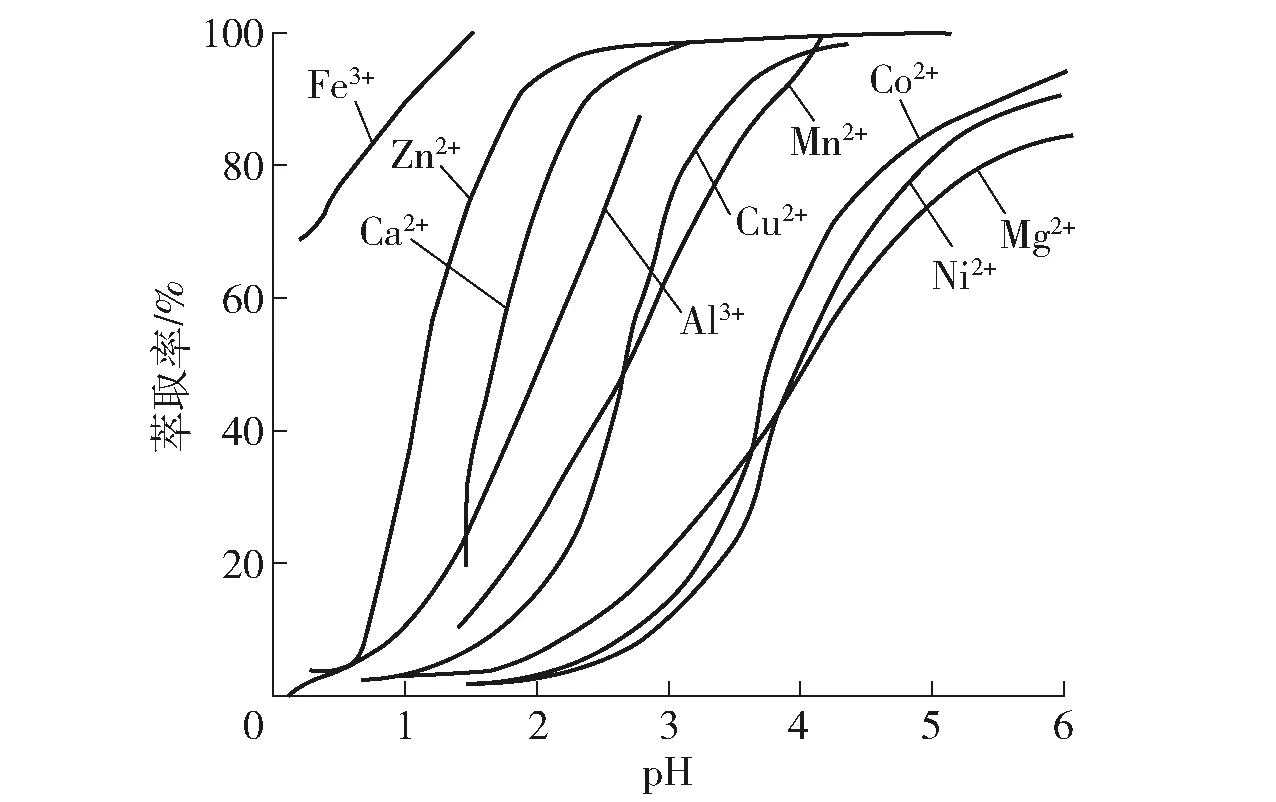
圖1 金屬萃取率與pH值的關系[5]
李春等[6]使用30%N235溶液進過3級逆流萃取,20%的P204 6級逆流萃取,結果表明硫酸的萃取率為99.84%,Zn2+的萃取率為98.32%,鈣鎂幾乎不被萃取,有效地從鋅電積廢液中脫除鈣鎂,但該工藝流程較長,工藝中使用大量有機試劑,成本較高,需要進一步研究。
1.3 氟化沉淀法
硫酸鋅溶液鈣鎂含量較高時,加入適量的ZnF2、NaF2等含氟化合物可使溶液中的Ca2+、Mg2+形成溶解度較小的MgF2(25 ℃時Ksp=6.4×10-9)和CaF2(25 ℃時Ksp=3.95×10-11),實現鈣鎂的開路脫除[7-9]。
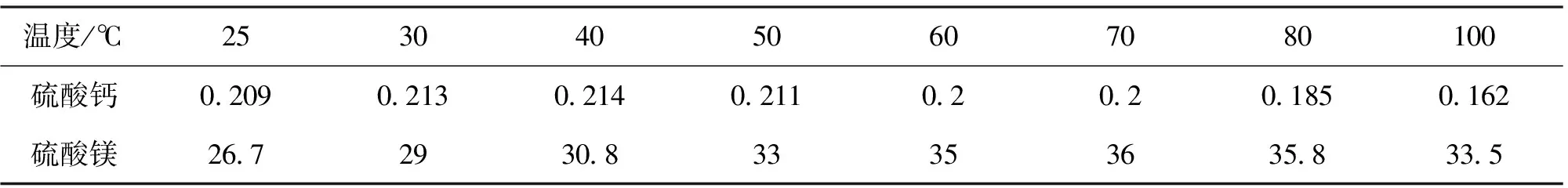
沈強華等[10]繪制了不同溫度下的Mg- F-H2O系φ-pH圖并進行了熱力學分析,分析結果表明,在3.65 ZnF2溶解度較小(20 ℃時為1.62%)易沉在底部,增加生產成本。因此,BOOSTER等[11]以ZnF2作為沉淀劑,讓鎂以MgF2的形式析出,過濾得到的濾渣使用NaOH堿洗使得Mg以Mg(OH)2形式開路出去,堿洗液中的NaF采用隔膜電解重新生成ZnF2和NaOH從而實現了循環使用,降低了生產成本。 Wang等[12]使用NaF為沉淀劑,通過單因素試驗得到從硫酸鋅溶液中脫鎂的最佳條件,在NaF用量為理論量的0.8~1.0倍、pH值為4.0~4.5、反應時間60~75 min、反應溫度60~75 ℃,轉速400 r/min的條件下,硫酸鋅溶液中85.5%的鎂可被脫除。 氟化沉淀法脫鎂效果顯著,但是引入濕法鋅系統中的F-難以控制,易腐蝕陰極板,導致陰極鋅片難以剝離,增加陰極板的損耗,目前還難以工業化。 如表1所示,硫酸鈣與硫酸鎂高溫或低溫狀態下,溶解度都有所降低,因此鈣鎂離子在濕法煉鋅系統中達到飽和點后,調整溫度即可結晶析出。而濕法煉鋅系統溫度在20~90 ℃范圍內波動,為鈣鎂結晶創造了條件[13]。 高健雄等[14]對濕法煉鋅過程中鈣鎂結晶進行了機理研究,研究表明溫度的降低是Ca、Mg結晶析出的主導因素;溶液中Ca2+與Mg2+在結晶析出過程中存在高鹽分作用下的競爭反應,高溫下溶液中Ca2+易于Mg2+優先以CaSO4·2H2O形式結晶析出,低溫下溶液中Mg2+易于Ca2+優先以MgSO4·H2O形式結晶析出。 表1 硫酸鈣、硫酸鎂溶解度(g/100溶液)[13] 孫明生[15]采用冷卻結晶法脫除新液中的鈣鎂,結果表明冷卻結晶法是一種節能、高效的方法,控制溫度25 ℃、pH 3.8~4.5、晶種加入量4 g/L、沉降時間100 min即可將新液中的Ca2+濃度控制在200~300 mg/L。新液冷卻結晶后,可去除部分雜質,有利于系統穩定性。 冷卻結晶法工業簡單有效,國內鋅濕法冶煉企業多在新液儲槽進行自然冷卻結晶,新液儲槽底流定期排空來開路系統中的鈣鎂,但是Ca2+、Mg2+的結晶析出同時可誘導Zn2+的結晶析出,降低了鋅的直收率。 開路廢電解液生產七水硫酸鋅產品和水解選擇性沉鋅開路排鎂,國內鋅濕法冶煉企業普遍采用此方法。 (1)生產七水硫酸鋅實現鈣鎂開路 開路出來的廢電解液調節pH至5.0,使用鋅粉置換雜質Cu、Cd后,濾液經蒸發濃縮、冷卻結晶、離心過濾后得到外觀潔白的七水硫酸鋅產品[16]。由于該方法制備的七水硫酸鋅是基于飽和或者過飽和溶液中冷卻結晶析出原理得到的,制備時需嚴格控制開路的廢電解液中Mg2+含量,該含量會影響七水硫酸鋅產品質量,且造成鋅的損失,因此,Mg2+含量過高的廢電解液不適合此方法。 (2)開路用于鉛冶煉制粒 鉛冶煉系統底吹爐產生的煙灰通常經過配礦制粒后返回熔煉,部分鉛冶煉企業使用鋅冶煉開路出的廢電解液代替新水用于制粒,從而達到開路Ca2+、Mg2+的目的,鈣在鉛冶煉系統后大部分進入富鉛渣,鎂經過煙灰爐吹煉后進入水淬渣,而Zn2+經過還原和煙化爐后以氧化鋅煙灰的形式得到回收[17]。 (3)選擇性沉淀法 國內主要通過加入氧化鋅煙灰或者石灰調節溶液pH至5.0以上,使硫酸鋅生成堿式碳酸鋅或者堿式碳酸鋅沉淀析出,鈣鎂等雜質留在溶液中外排,沉淀返回浸出凈化工序。云南馳宏鋅鍺股份有限公司2005—2009年采用石灰中和部分廢電解液,處理量80 m3/d,每年開路鈣7.92 t、鎂528 t、鋅1 320 t、硫酸4 620 t[17]。但此方法沒處理1 m3廢電解液產生石膏渣0.28 t,環保壓力大,石膏渣含鋅高,2010年6月以后已不再使用此方法。 國外某些研究者[18]往電解液中加入丙酮與Mg2+生成Mg(AA)2沉淀析出,但需要進一步研究,尚未工業化,澳大利亞某電鋅企業[19]SZP法可以控制溶液中Ca2+、Mg2+含量且保證水平衡,但是需要高昂的專利費。 綜上所述,Ca+、Mg2+的飽和結晶已經影響國內外鋅濕法冶煉企業的正常運行,現有的鈣鎂脫除工藝只能緩解鈣鎂結晶給系統運行帶來的壓力,均存在一定的不足。因此,企業、高校和科研機構需加大鋅濕法冶煉鈣鎂脫除技術的研發投入,在鈣鎂結晶、鈣鎂脫除的技術研究方面開展更多的深入研究,從跨行業、全產業鏈的角度認識,尋求協同解決鋅濕法冶煉鈣鎂結晶的綜合利用問題。1.4 冷卻結晶法
1.5 開路溶液法
2 結論

