金銀花醇提物抗炎、降血脂作用實驗研究*
周慧敏,馬秀梅,曾海生,黃俞盛,譚 方
(1.桂林市中醫醫院,廣西 桂林 541002;2.廣西中醫藥大學,廣西 南寧 530200)
金銀花是臨床常用中草藥,《中華本草》記載其是忍冬干燥花蕾或帶初開的花,屬于忍冬科忍冬屬植物[1-2]。金銀花主要的功效是清熱解毒、抗炎等,臨床上常用于治療溫病發熱和熱毒癰瘍等病癥[3-5]。金銀花主要含有黃酮類、有機酸類、三萜皂苷等化學成分[6-9]。現代藥理研究表明,金銀花作為常用中藥既能宣散風熱,還具有清熱解毒,抗炎、降脂和利膽保肝等作用,用于治療各種感染、炎癥、高脂血癥等[7,10]。金銀花抗炎、降血脂作用及機制通路的相關研究報道較少,因此本研究通過研究金銀花醇提物的抗炎、降血脂作用,為該藥材的進一步研究和開發應用提供實驗依據。
1 材 料
1.1 實驗動物6周齡健康SPF級雄性昆明種小鼠360只,體質量18~22 g;7周齡SPF級雄性SD大鼠60只,體質量180~220 g,均購買于廣西醫科大學實驗動物中心,動物生產許可證號:SCXK(桂)2019-0002。實驗前在實驗室適應性飼養4 d,實驗動物使用許可證號:SYXK(桂)2018-0014。實驗鼠分籠飼養于空調室內,濕度(68±5)%,室溫(23±2)℃,照明時間隨同自然晝夜變化,常規飼養,自由進食和飲水。實驗方案經廣西中醫藥大學倫理委員會批準。實驗過程中對所有動物的處置符合國家科學技術部頒發的《關于善待實驗動物的指導性意見》的要求。
1.2 藥物與試劑角叉菜膠(批號:YY19754)購自上海源葉生物科技有限公司;醋酸地塞米松(批號:190119,規格:0.75 mg)購自浙江仙琚制藥股份有限公司;伊文思藍(批號:20190725)購自國藥集團化學試劑有限公司;辛伐他汀片(批號:20190405)購自涿州東樂制藥有限公司,臨用前使用純水配置成0.4 mg/mL溶液用于灌胃;丙二醛(MDA)試劑盒(批號:201901)、超氧化物歧化酶(SOD)試劑盒(批號:201905)、一氧化氮(NO)試劑盒(批號:201903)、甘油三酯(TG)試劑盒(批號:1904101)、總膽固醇(TC)試劑盒(批號:1904101)、低密度脂蛋白膽固醇(LDL-C)試劑盒(批號:1904062)、高密度脂蛋白膽固醇(HDL-C)試劑盒(批號:1904091)均購自南京建成生物工程技術研究所。
1.3 主要儀器酶標儀(Tecan Austria GmbH);UV-1780型紫外可見分光光度計[島津儀器(蘇州)有限公司];LRH-300-S型恒溫恒濕培養箱(韶關市泰宏醫療器械有限公司);BS-280型全自動生化分析儀(邁瑞醫療);BSA224S型電子天平[賽多利斯科學儀器(北京)有限公司];YXQ-50A型立式壓力蒸汽滅菌器(上海迅博實業有限公司醫療設備廠)。
2 實驗方法
2.1 金銀花醇提物的制備及高脂飼料的配方及配制取金銀花粗粉6 kg,加80%乙醇回流提取2次,第一次提取時間為1.5 h,溶劑倍量為10倍,第二次提取時間為1 h,溶劑倍量為8倍,過濾,合并濾液,減壓濃縮,再置水浴鍋上揮干溶劑,稱質量,計算得膏率。
高脂飼料購于廣西醫科大學實驗動物中心,由10%豬油、1.0%膽固醇、0.2%膽酸鈉、3.0%蔗糖和5.0%蛋黃粉組成,在80℃烘箱內烘干。
2.2 金銀花醇提物對二甲苯致小鼠耳腫脹的影響隨機取雄性昆明種小鼠72只,按隨機數字表法分為空白對照組、模型對照組、陽性對照組(地塞米松5 mg/kg)、金銀花醇提物高劑量組(40 g/kg)、金銀花醇提物中劑量組(25 g/kg)、金銀花醇提物低劑量組(15 g/kg),每組12只。按照藥理實驗規程,給藥體積是1 mL/50 g,空白對照組和模型對照組小鼠灌胃給予等體積純凈水,1次/d,連續給藥7 d。最后一次給藥1 h后,除空白對照組外,其他各組在小鼠右耳正反兩面涂上10 μL二甲苯致炎,15 min后處死小鼠,剪下小鼠兩耳,在兩耳相同部位用6 mm打孔器等面積打下圓耳片,精密稱質量,計算腫脹度和腫脹抑制率。計算公式:腫脹度(mg)=右耳質量(mg)-左耳質量(mg)。腫脹抑制率=[(模型組平均腫脹度-給藥組平均腫脹度)/模型組平均腫脹度]×100%。
2.3 金銀花醇提物對小鼠腹腔毛細血管通透性的影響隨機選取雄性昆明種小鼠72只,分組、給藥方法同“2.2”項。最后一次灌胃給藥1 h后,除空白對照組外,其他各組小鼠給予0.3%伊文思藍溶液(1 mL/100 g)尾靜脈注射,同時給予0.6%冰醋酸溶液(0.2 mL/20 g)腹腔注射;空白對照組小鼠給予生理鹽水(1 mL/100 g)尾靜脈注射,同時給予生理鹽水(0.2 mL/20 g)腹腔注射。15 min后處死小鼠,注射6 mL生理鹽水沖洗腹腔,輕揉腹部1 min,剪開小鼠腹腔吸取腹腔液,2 500 r/min離心12 min,吸取上清液至比色皿中,在590 nm處,使用紫外可見分光光度計測定其吸光度[11]。
2.4 金銀花醇提物對角叉菜膠致小鼠足趾腫脹及踝關節的影響隨機選取雄性昆明種小鼠72只,分組、給藥方法同“2.2”項。最后一次灌胃給藥1 h后,除空白對照組外,其他各組小鼠右后足趾部皮下注射1%角叉菜膠溶液0.02 mL致炎,空白對照組小鼠右后足趾部皮下注射生理鹽水0.02 mL,致炎16 min后處死小鼠,剪取后雙足相同部位,稱質量。計算公式:腫脹度(mg)=右后足趾質量(mg)-左后足趾質量(mg),并計算腫脹抑制率。腫脹抑制率=[(模型組平均腫脹度-給藥組平均腫脹度)/模型組平均腫脹度]×100%。實驗結束后,剖取組織,經4%多聚甲醛溶液固定脫鈣、脫水、包埋、切片、HE染片后封片,觀察踝關節病理改變情況并拍照。
2.5 金銀花醇提物對二甲苯致摘除雙側腎上腺小鼠耳腫脹的影響隨機選取雄性昆明種小鼠72只,手術前1 d用頭孢克肟(60 mg/kg)灌胃給藥。術前用120℃的壓力蒸汽對手術器械進行滅菌15 min,用75%酒精對手術臺及手套消毒,用5%水合氯醛(10 mL/kg)對小鼠進行麻醉,減去背上鼠毛,75%酒精對皮膚局部消毒。沿背部正中線開約0.5 cm長的肌肉切口。用鑷子小心撥開切口,小心分開小鼠腹腔組織與臟器,用鑷子夾住腎臟與腎上腺之間的組織,摘除小鼠腺體。同法摘除小鼠另一側腎上腺。用棉球稍止血后縫合,涂以適量的碘伏,術后第2天以頭孢克肟灌胃給藥,術后第3天以5%葡萄糖生理鹽水溶液代替純凈水飼養術后小鼠[11]。之后按“2.2”項方法進行小鼠耳腫脹實驗。
2.6 金銀花醇提物對角叉菜膠致摘除雙側腎上腺小鼠足趾腫脹,足趾MDA、NO含量和SOD活性,以及踝關節的影響取剩余雄性昆明種小鼠72只,摘除小鼠雙側腎上腺方法同“2.5”項。分組、給藥方法同“2.2”項。隨后剪碎右足,取4 mL生理鹽水浸泡[11-12]。手動研磨勻漿后,3 000 r/min離心12 min,取離心后的上清液凍存于-20℃。使用ELISA法測定MDA、NO含量和SOD活性,實驗操作參照試劑盒說明書。實驗結束后,剖取組織,經4%多聚甲醛溶液固定脫鈣、脫水、包埋、切片、HE染片后封片,觀察踝關節病理改變情況并拍照。
2.7 金銀花醇提物對SD雄性大鼠高脂血癥的影響取SD雄性大鼠60只,隨機分為空白對照組、模型對照組、陽性對照組、金銀花醇提物高劑量組、金銀花醇提物中劑量組、金銀花醇提物低劑量組,每組10只。除空白組對照外,其余各組大鼠以高脂飼料飼養并飲用自來水;空白對照組大鼠以基礎飼料飼養并飲用自來水。28 d后,禁食不禁水12 h,腹主動脈取血,3 000 r/min離心10 min分離血清,按照試劑盒說明書,使用全自動生化儀測定血清中指標TC、TG和HDL-C的含量水平。與空白對照組比較,造模大鼠體質量、TC、TG明顯升高,HDL-C明顯降低,差異均有統計學意義(P<0.05),表明大鼠高脂血癥模型造模成功。判斷模型復制成功后開始給藥,陽性對照組大鼠根據體質量每天以10 mL/kg的量給予辛伐他汀溶液(0.4mg/mL);金銀花醇提物高、中、低劑量組大鼠以每天10 mL/kg的量分別給予金銀花醇提物的CMC-Na溶液,40、25、15 g/kg;模型對照組和空白對照組大鼠按體質量給予10 mL/kg的CMC-Na溶液[13-14]。每3天稱1次體質量,28 d后,禁食不禁水12 h,腹主動脈取血,3 000 r/min離心10 min分離血清,按照試劑盒說明書測定血清中指標TC、TG、LDL-C和HDL-C的含量。
2.8 統計學方法采用SPSS 21.0統計學軟件進行分析,計量資料以“均數±標準差”(±s)表示,經正態性檢驗和方差齊性檢驗,多組比較用單因素方差分析,進一步兩兩比較采用LSD-t檢驗。P<0.05為差異有統計學意義。
3 結 果
3.1 各組小鼠耳腫脹度及腫脹抑制率比較與空白對照組比較,模型對照組小鼠耳腫脹度明顯升高(P<0.05);與模型對照組比較,陽性對照組和金銀花醇提物低、中、高劑量組小鼠耳腫脹度均明顯降低(P<0.05);與陽性對照組比較,金銀花醇提物低劑量組小鼠耳腫脹度明顯升高(P<0.05);金銀花醇提物高、中劑量組小鼠耳腫脹度與陽性對照組比較,差異無統計學意義(P>0.05)。陽性對照組、金銀花醇提物高劑量組、金銀花醇提物中劑量組、金銀花醇提物低劑量組小鼠耳腫脹抑制率分別為55.10%、53.88%、50.61%、37.55%。(見表1)
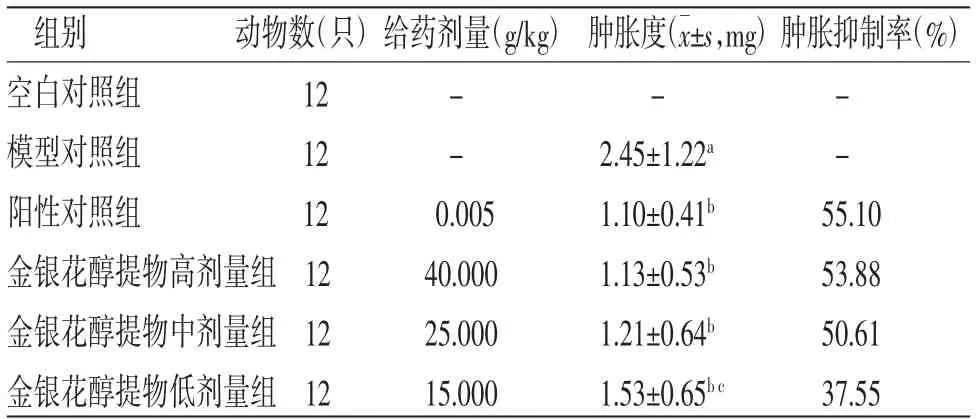
表1 各組小鼠耳腫脹度比較
3.2 各組小鼠腹腔毛細血管通透性比較與空白對照組比較,模型對照組小鼠腹腔毛細血管通透性明顯增加(P<0.05);與模型對照組比較,陽性對照組和金銀花醇提物低、中、高劑量組小鼠腹腔毛細血管通透性均明顯減輕(P<0.05);與陽性對照組比較,金銀花醇提物低劑量組小鼠腹腔毛細血管通透性明顯增加(P<0.05);金銀花醇提物高、中劑量組小鼠腹腔毛細血管通透性與陽性對照組比較,差異無統計學意義(P>0.05)。(見表2)
表2 各組小鼠腹腔毛細血管通透性比較(±s)
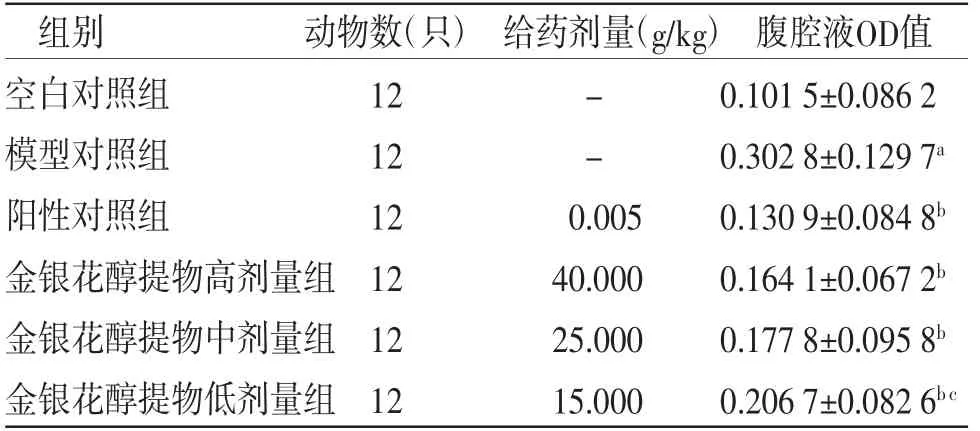
表2 各組小鼠腹腔毛細血管通透性比較(±s)
注:與空白對照組比較,aP<0.05;與模型對照組比較,bP<0.05;與陽性對照組比較,cP<0.05
組別 動物數(只) 給藥劑量(g/kg) 腹腔液OD值空白對照組 12 - 0.101 5±0.086 2模型對照組 12 - 0.302 8±0.129 7a陽性對照組 12 0.005 0.130 9±0.084 8b金銀花醇提物高劑量組12 40.000 0.164 1±0.067 2b金銀花醇提物中劑量組12 25.000 0.177 8±0.095 8b金銀花醇提物低劑量組12 15.000 0.206 7±0.082 6b c
3.3 各組小鼠踝關節病理情況比較空白對照組小鼠踝關節軟骨表面光滑,關節腔無滲出物,滑膜細胞排列整齊;模型對照組小鼠踝關節滑膜組織結構異常,膠原纖維排列紊亂(紅色箭頭所示),少量炎癥細胞浸潤(黑色箭頭所示);陽性對照組小鼠踝關節軟骨光滑,關節腔內見少量滲出物,滑膜細胞整齊,見少許炎癥細胞浸潤;金銀花醇提物中、低劑量組小鼠踝關節膠原纖維排列整齊(黑色箭頭所示),可見少量脂肪細胞;金銀花醇提物高劑量組小鼠踝關節軟骨較光滑,關節腔見少許滲出物,滑膜細胞大體整齊排列,見少許炎癥細胞浸潤。(見圖1)
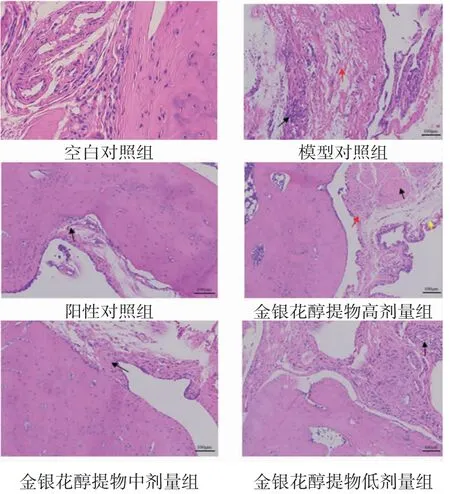
圖1 各組小鼠踝關節病理切片圖(HE,×200)
3.4 各組小鼠足趾腫脹度及腫脹度抑制率比較與空白對照組比較,模型對照組小鼠足趾腫脹度明顯增加(P<0.05);與模型對照組比較,陽性對照組和金銀花醇提物低、中、高劑量組小鼠足趾腫脹度均明顯減輕(P<0.05);與陽性對照組比較,金銀花醇提物低劑量組小鼠足趾腫脹度明顯增加(P<0.05);金銀花醇提物高、中劑量組小鼠足趾腫脹度與陽性對照組比較,差異無統計學意義(P>0.05)。陽性對照組、金銀花醇提物高劑量組、金銀花醇提物中劑量組、金銀花醇提物低劑量組小鼠足趾腫脹抑制率分別為58.48%、54.08%、46.30%、20.61%。(見表3)
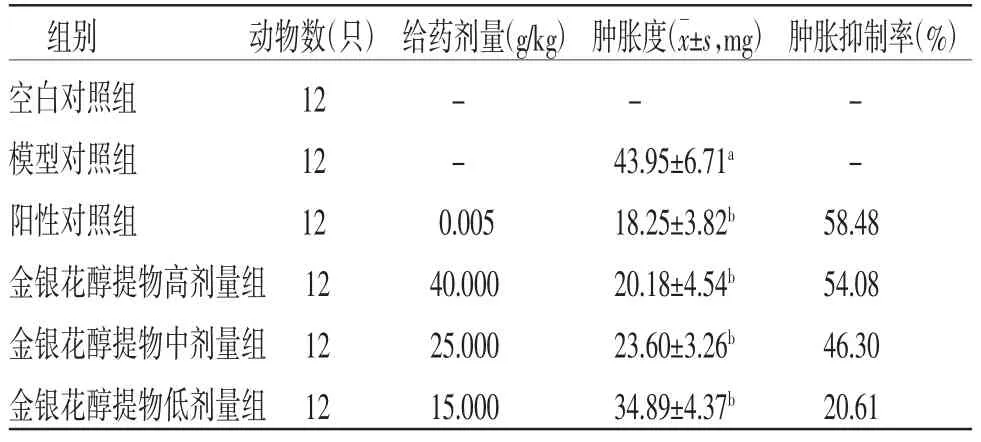
表3 各組小鼠足趾腫脹度比較
3.5 各組摘除雙側腎上腺小鼠耳腫脹度及耳腫脹抑制率比較與空白對照組比較,模型對照組小鼠耳腫脹度明顯升高(P<0.05);與模型對照組比較,陽性對照組和金銀花醇提物中、高劑量組小鼠耳腫脹度明顯降低(P<0.05);與陽性對照組比較,金銀花醇提物低劑量組小鼠耳腫脹明顯升高(P<0.05),而金銀花醇提物高、中劑量組小鼠耳腫脹度與陽性對照組比較,差異無統計學意義(P>0.05)。陽性對照組、金銀花醇提物高劑量組、金銀花醇提物中劑量組、金銀花醇提物低劑量組小鼠耳腫脹度抑制率分別為56.45%、39.17%、33.79%、11.39%。(見表4)
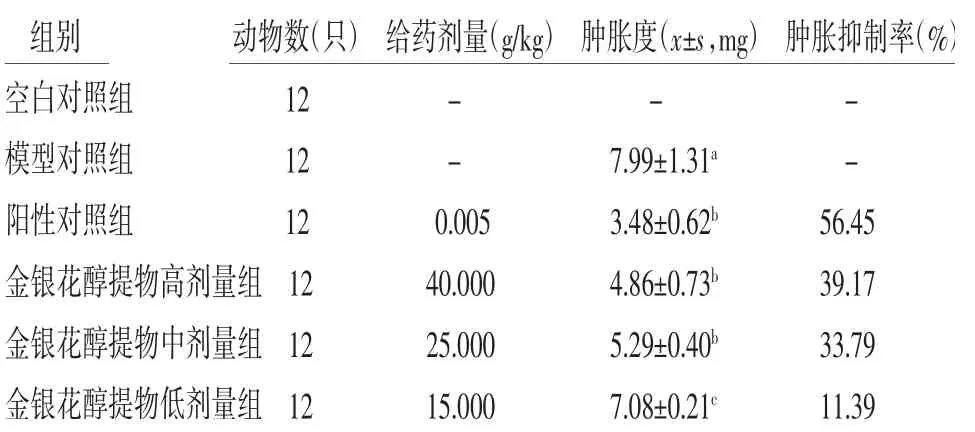
表4 各組摘除雙側腎上腺小鼠耳腫脹度比較
3.6 各組摘除雙側腎上腺小鼠足趾腫脹度及腫脹度抑制率比較與空白對照組比較,模型對照組小鼠足趾腫脹度明顯升高(P<0.05);與模型對照組比較,陽性對照組和金銀花醇提物中、高劑量組小鼠足趾腫脹度明顯降低(P<0.05);與陽性對照組比較,金銀花醇提物低劑量組小鼠足趾腫脹度明顯升高(P<0.05),而金銀花醇提物高、中劑量組小鼠足趾腫脹度與陽性對照組比較,差異無統計學意義(P>0.05)。陽性對照組、金銀花醇提物高劑量組、金銀花醇提物中劑量組、金銀花醇提物低劑量組小鼠足趾腫脹抑制率分別為50.42%、42.88%、36.34%、18.24%。(見表5)
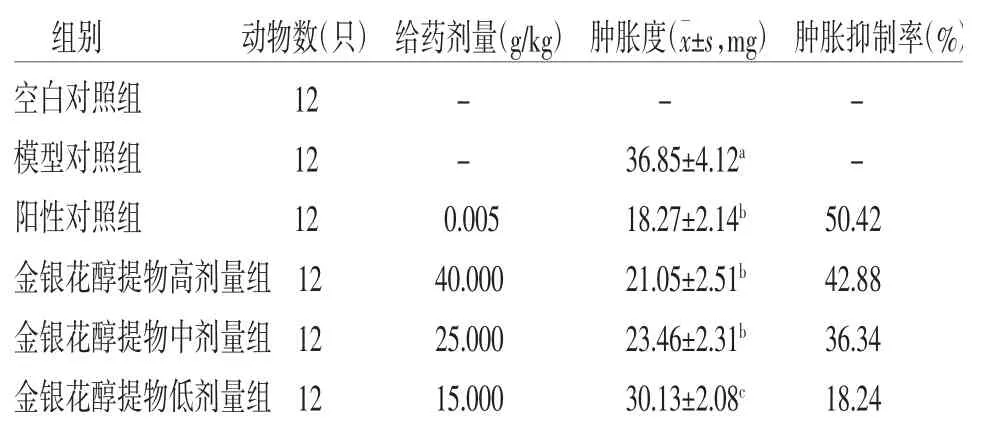
表5 各組摘除雙側腎上腺小鼠足趾腫脹度比較
3.7 各組摘除雙側腎上腺小鼠足趾炎性部位中MDA、NO含量及SOD活性比較與空白對照組比較,模型對照組小鼠足趾部位MDA、NO含量及SOD活性明顯升高(P<0.05);與模型對照組比較,陽性對照組和金銀花醇提物中、高劑量組小鼠足趾炎性部位MDA、NO含量及SOD活性均明顯降低(P<0.05);與陽性對照組比較,金銀花醇提物低劑量組小鼠足趾炎性部位MDA、NO含量及SOD活性均明顯升高(P<0.05);而金銀花醇提物高、中劑量組小鼠足趾炎性部位MDA、NO含量及SOD活性與陽性對照組比較,差異無統計學意義(P>0.05)。(見表6)
表6 各組摘除雙側腎上腺的小鼠足趾炎性部位MDA、NO含量及SOD活性比較(±s)

表6 各組摘除雙側腎上腺的小鼠足趾炎性部位MDA、NO含量及SOD活性比較(±s)
注:與空白對照組比較,aP<0.05;與模型對照組比較,bP<0.05;與陽性對照組比較,cP<0.05
組別 動物數(只)給藥劑量(g/kg)MDA(nmol/L)SOD(pg/mL)NO(μmol/L)空白對照組 12 - 1.20±0.15 10.12±1.32 9.92±1.20模型對照組 12 - 2.71±0.22a 21.45±1.27b 21.67±1.25a陽性對照組 12 0.005 1.85±0.14b 12.21±2.01a 13.91±0.82b金銀花醇提物高劑量組12 40.000 2.15±0.11b 15.99±1.20b 14.27±1.02b金銀花醇提物中劑量組12 25.000 2.26±0.13b 15.13±1.18b 16.24±1.01b金銀花醇提物低劑量組12 15.000 2.37±0.21c 14.40±1.15c 17.01±1.13c
3.8 各組摘除雙側腎上腺小鼠踝關節病理情況比較空白對照組小鼠踝關節軟骨表面光滑,關節腔無滲出,滑膜細胞排列整齊;模型對照組小鼠踝關節滑膜組織結構異常,膠原纖維排列有些紊亂,有少許炎癥細胞浸潤;陽性對照組小鼠踝關節軟骨光滑,關節腔內見少量滲出物,滑膜細胞整齊,可見少許炎癥細胞浸潤;金銀花醇提物高劑量組小鼠踝關節軟骨略光滑,關節腔見少許滲出物,滑膜細胞大體整齊排列,可見少許炎癥細胞;金銀花醇提物中、低劑量組小鼠踝關節膠原纖維排列整齊,可見少量脂肪細胞。高、中、低劑量金銀花醇提物對炎癥的影響,隨著金銀花醇提取物劑量的增加,癥狀有一定緩解。(見圖2)
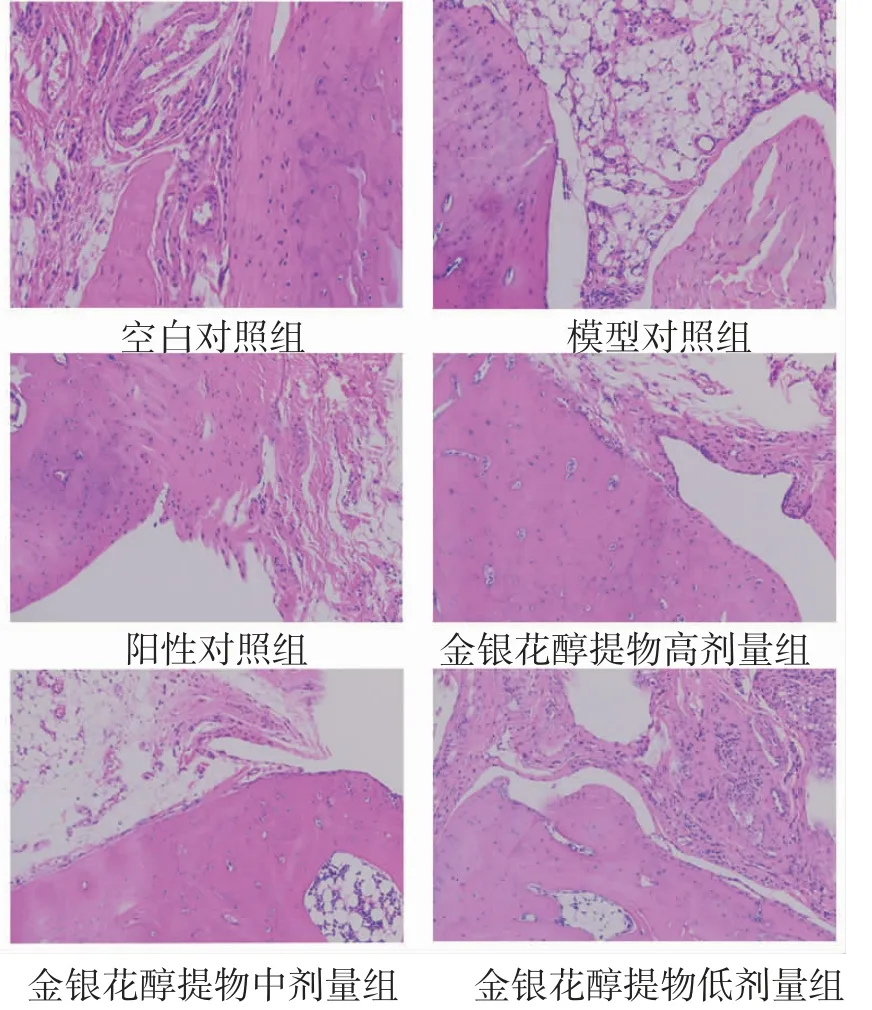
圖2 各組摘除雙側腎上腺小鼠踝關節病理切片圖(HE,×200)
3.9 大鼠高脂血癥模型建立大鼠高脂飼料飼養28 d后,模型對照組、陽性對照組及金銀花醇提物高、中、低劑量組大鼠體質量、TC、TG明顯高于空白對照組(P<0.05或P<0.01),而HDL-C明顯低于空白對照組(P<0.05),表明大鼠高脂血癥模型造模成功。(見表7)
表7 各組大鼠體質量增值及TC、TG、HDL-C含量比較(±s)
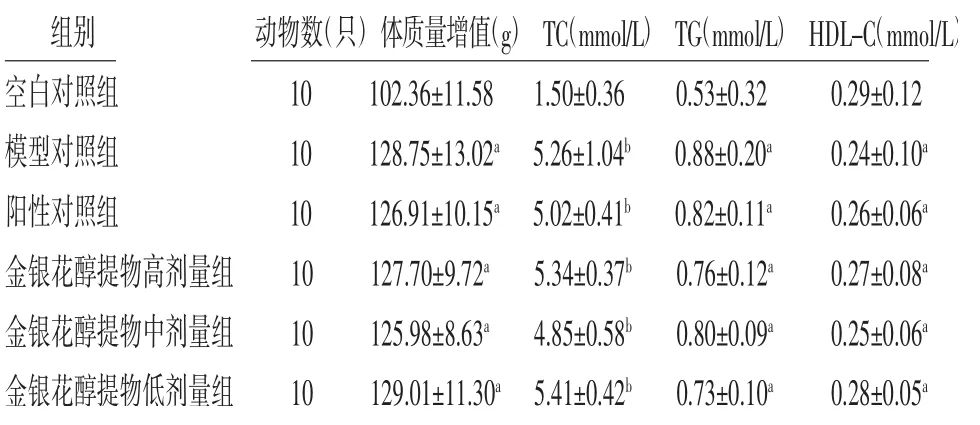
表7 各組大鼠體質量增值及TC、TG、HDL-C含量比較(±s)
注:與空白對照組比較,aP<0.05,bP<0.01
組別 動物數(只)體質量增值(g)TC(mmol/L)TG(mmol/L)HDL-C(mmol/L)空白對照組 10 102.36±11.58 1.50±0.36 0.53±0.32 0.29±0.12模型對照組 10 128.75±13.02a 5.26±1.04b 0.88±0.20a 0.24±0.10a陽性對照組 10 126.91±10.15a 5.02±0.41b 0.82±0.11a 0.26±0.06a金銀花醇提物高劑量組 10 127.70±9.72a 5.34±0.37b 0.76±0.12a 0.27±0.08a金銀花醇提物中劑量組 10 125.98±8.63a 4.85±0.58b 0.80±0.09a 0.25±0.06a金銀花醇提物低劑量組 10 129.01±11.30a 5.41±0.42b 0.73±0.10a 0.28±0.05a
3.10 各組大鼠血清TC、TG、HDL-C、LDL-C含量比較與空白對照組比較,模型對照組大鼠血清TC、TG、LDL-C含量明顯升高(P<0.05);與模型對照組比較,陽性對照組和金銀花醇提物高、中、低劑量組大鼠血清TC、TG、LDL-C含量均明顯降低(P<0.05);金銀花醇提物高、中、低劑量組大鼠血清TC、TG、LDL-C含量與陽性對照組比較,差異均無統計學意義(P>0.05)。6組大鼠血清HDL-C含量比較,差異無統計學意義(P>0.05)。(見表8)
表8 各組大鼠血清TC、TG、HDL-C、LDL-C含量比較(±s)
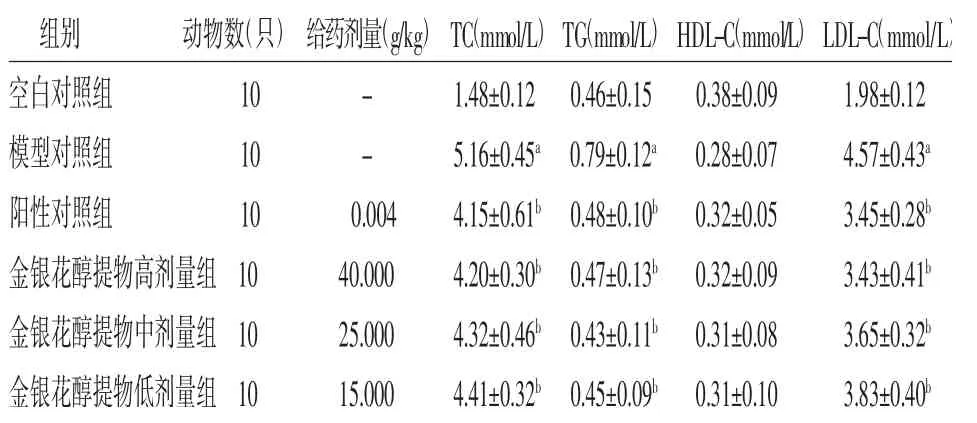
表8 各組大鼠血清TC、TG、HDL-C、LDL-C含量比較(±s)
注:與空白對照組比較,aP<0.05;與模型對照組比較,bP<0.05;與陽性對照組比較,cP<0.05
組別 動物數(只)給藥劑量(g/kg)TC(mmol/L)TG(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)空白對照組 10 - 1.48±0.12 0.46±0.15 0.38±0.09 1.98±0.12模型對照組 10 - 5.16±0.45a 0.79±0.12a 0.28±0.07 4.57±0.43a陽性對照組 10 0.004 4.15±0.61b 0.48±0.10b 0.32±0.05 3.45±0.28b金銀花醇提物高劑量組10 40.000 4.20±0.30b 0.47±0.13b 0.32±0.09 3.43±0.41b金銀花醇提物中劑量組10 25.000 4.32±0.46b 0.43±0.11b 0.31±0.08 3.65±0.32b金銀花醇提物低劑量組10 15.000 4.41±0.32b 0.45±0.09b 0.31±0.10 3.83±0.40b
4 討 論
一氧化氮(NO)是一種重要的炎癥介質,能夠誘導機體促炎因子的產生,如白介素-1β(IL-1β)、腫瘤壞死因子-α(TNF-α)等[15]。超氧化物歧化酶(SOD)具有特殊的生理活性,是生物體內的抗氧化酶,能清除自由基。本研究通過檢測去腎上腺小鼠足趾腫脹部位炎癥因子水平發現,金銀花醇提物通過降低MDA、NO含量,提高SOD含量發揮抗炎作用,且抗炎作用可能依賴下丘腦-垂體-腎上腺軸(HPAA)系統。金銀花醇提物具有明顯的抗炎作用。與空白對照組比較,高、中劑量金銀花醇提物對小鼠耳腫脹有明顯的抑制作用(P<0.05);高、中、低劑量金銀花醇提物對小鼠腹腔毛細血管通透性及對角叉菜膠致小鼠足跖腫脹均有明顯抑制作用(P<0.05);與空白對照組比較,在摘除雙側腎上腺小鼠模型中,高、中劑量金銀花醇提物可顯著抑制二甲苯致該模型小鼠耳腫脹和角叉菜膠致該模型小鼠足跖腫脹(P<0.05);高、中、低劑量金銀花醇提物均能夠顯著降低足趾中MDA、NO水平和SOD活性(P<0.05);高、中、低劑量金銀花醇提物能夠明顯降低高血脂癥模型大鼠血清中TC、TG和LDC-C水平。提示金銀花醇提物對實驗性高脂血癥有一定的防治作用。
炎癥的發生發展過程一般分為3期,早期以毛細血管擴張、通透性亢進為主,中期為血小板吸附及白細胞游走,晚期為肉芽組織增生[16]。炎性反應是由機體中多種炎癥介質參與,炎癥因子與機體不斷斗爭直至達到一個動態平衡的過程,而中藥是通過多途徑,多環節發揮抗炎作用的[17-19]。目前國內外在中藥抗炎、降血脂方面而進行的研究也越來越廣泛和深入,對于開發具有新作用靶點和高效低毒的新型抗炎、降血脂中藥,闡明抗炎、降血脂中藥的物質基礎及作用機制有著重大意義。目前金銀花藥材的應用廣泛,為了在臨床上安全有效地利用該藥材,我們對金銀花藥材提取物抗炎、降血脂作用進行了相關研究。在前期研究工作中,我們發現金銀花提取物有明顯的抗炎、降血脂調節作用。金銀花醇提物能明顯降低大鼠血清中的TC、TG和LDL-C含量水平。課題組結合前期研究基礎推測金銀花可能含有某種或者某一類活性成分能刺激免疫系統、促進血液的凈化能力,加快清除血液垃圾,對生物組織產生的降血脂作用起著很好的機體調節功能。
下丘腦-垂體-腎上腺(HPAA)系統是人體重要的神經內分泌軸,其對機體的炎癥具有重要的調節作用[20-22],本研究發現,金銀花醇提取物具有明顯的抑制小鼠足趾腫脹、改善機體炎癥作用。本實驗通過建立去雙側腎上腺小鼠模型,在切除機體內分泌系統的影響下,考察金銀花醇提取物對小鼠耳腫脹度、小鼠足趾腫脹度的影響以及SOD、MDA、NO水平的變化。實驗結果表明,金銀花醇提取物對小鼠耳腫脹度、足趾腫脹度有一定的抑制作用,且小鼠足趾部位MDA、SOD、NO水平發生明顯的變化。金銀花醇提物具有抗炎活性,其抗炎作用的發揮可能依賴下丘腦-垂體-腎上腺(HPAA)系統,同時金銀花醇提物的抗炎作用機制與降低MDA、NO含量和SOD活性有關。

