藜麥蛋白提取工藝優化及其功能特性研究
權帆,王文斌,朱玲麗,方建華,付成麗,崔宏偉,鄭斌麗,吳淑清*
(1.長春大學 食品科學與工程學院,長春 130022;2.浙江李子園食品股份有限公司,浙江 金華 321031)
藜麥(ChenopodiumquinoaWilld.)也稱奎藜、灰米、金谷子,是藜科一年生草本開花植物[1],含有豐富的碳水化合物、蛋白質、礦物元素等營養物質,同時具有酚類、三萜皂苷、γ-氨基丁酸等多種生物活性成分[2]。因其營養全面、比例均衡的特點,藜麥引起了越來越多的關注[3]。
藜麥富含其他谷物無法比擬的高品質全蛋白[4],平均含量在12.5%~16.7%[5]。藜麥蛋白是由清蛋白、球蛋白、谷蛋白和醇溶蛋白構成的,其中清蛋白和球蛋白含量占總蛋白質的44%~77%,谷蛋白和醇溶蛋白相對較少[6]。目前,蛋白質提取方法有堿溶酸沉法、酶法、超聲提取法、鹽析法等[7],以堿溶酸沉法為主要提取方法;對藜麥蛋白的功能特性研究較少,而pH對蛋白的功能特性有顯著影響,直接影響食品的感官品質。
本試驗采用堿溶酸沉法從藜麥粉中提取蛋白質,通過單因素試驗結合響應面優化試驗,確定藜麥蛋白的最佳提取條件,同時研究不同pH值對其功能特性的影響。為利用藜麥蛋白研究開發新型食品奠定了基礎,也為后期改善特定的功能特性提供了理論依據。
1 材料與方法
1.1 材料與試劑
藜麥:山西綠色山區農副產品銷售公司;大豆油:益海嘉里食品營銷有限公司。
牛血清蛋白(BSA)、考馬斯亮藍G-250、氫氧化鈉:國藥集團化學試劑有限公司;石油醚、無水乙醇:分析純,天津市富宇精細化工有限公司;磷酸:分析純,天津市大茂化學試劑廠;鹽酸:北京市大興區安定鎮工業總公司。
1.2 設備與儀器
HH-4型數顯恒溫水浴鍋 常州天瑞有限公司;721型可見分光光度計 上海菁華科技有限公司;TG16G型高速離心機 金壇區白塔新寶儀器廠;PHS-3C型pH計 上海浦春計量儀器有限公司;ZIRBUS VaCo 5型冷凍干燥機 吉林省華業科教儀器設備有限公司;MF0910P型馬弗爐 華港通科技(北京)有限公司;FSH-2A型可調高速勻漿機 常州萬合儀器制造有限公司。
1.3 方法
1.3.1 藜麥基礎成分的測定
蛋白含量按照GB 5009.5-2016測定;水分含量按照GB 5009.3-2016測定;脂肪含量按照GB 5009.6-2016測定;膳食纖維含量按照GB 5009.8-2014測定;灰分含量按照GB 5009.4-2016測定。
1.3.2 藜麥預處理
挑選顆粒飽滿、大小均一的藜麥浸泡30 min,于烘箱中45 ℃烘制8 h,冷卻后粉碎,過80 目篩,用石油醚脫脂(藜麥粉∶石油醚為1∶4,g/mL),攪拌2 h后,靜置12 h過濾,棄掉上清液,于烘箱中45 ℃烘制2 h,將脫脂后的藜麥粉放在通風處24 h以揮發殘留的石油醚,之后置于干燥環境下保存,備用。
1.3.3 藜麥蛋白提取流程
對預處理后的藜麥粉加水溶解,按照一定的料液比,用0.5 mol/L NaOH調溶液至適宜pH,在適宜溫度下提取一定時間后,5000 r/min 離心10 min,收集上清液后,用0.5 mol/L HCl調pH至4.5,10000 r/min離心15 min,收集沉淀,水洗沉淀,調pH至中性,經真空冷凍干燥后得到藜麥蛋白。
1.3.4 藜麥蛋白提取率的測定
1.3.4.1 繪制標準曲線
分別吸取0.0,0.06,0.12,0.24,0.48,0.72 mL的0.1 mg/mL蛋白質標準溶液于10 mL試管中,對應加入1,0.94,0.88,0.76,0.52,0.28 mL蒸餾水,再分別加入5 mL考馬斯亮藍G-250溶液,充分混勻,靜置2 min。用蒸餾水作空白對照,在595 nm處測其吸光度,以標準蛋白質濃度(mg/mL)為橫坐標、吸光度為縱坐標繪制蛋白質標準曲線,得到方程y=0.5753x+0.0075(R2=0.996)。
提取液蛋白含量測定:吸取1 mL提取液,再加入5 mL的考馬斯亮藍G-250溶液,充分混勻,靜置2 min。用蒸餾水作對照組,于595 nm處測其吸光度,根據標準曲線計算提取液的蛋白質含量。
樣品蛋白含量測定:按照GB 5009.5-2016進行。
1.3.4.2 提取率的測定
藜麥蛋白質提取率(%)=提取液蛋白質含量/樣品蛋白含量×100%。
1.3.5 單因素試驗
藜麥蛋白提取基本條件:料液比1∶10,pH 10.5,溫度 45 ℃,提取時間 2 h。研究料液比(1∶8、1∶10、1∶12、1∶14、1∶16,g/mL)、提取時間(1.0,1.5,2.0,2.5,3.0 h)、提取溫度(35,40,45,50,55 ℃)、pH 值(9.0,9.5,10.0,10.5,11.0)對蛋白提取率的影響。以蛋白提取率為指標,每個水平進行3次重復試驗取平均值。
1.3.6 響應面優化設計
在單因素試驗基礎上,對料液比、提取時間、提取溫度及pH值進行優化,以藜麥蛋白提取率為響應值,設計響應面試驗因素水平表,見表1。
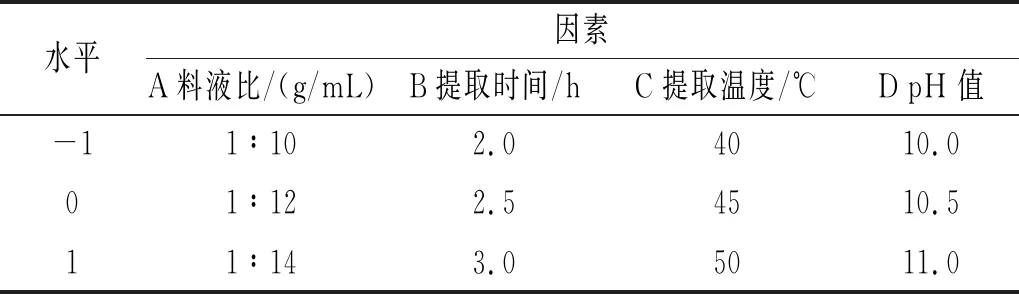
表1 響應面試驗因素水平
1.3.7 藜麥蛋白純度的測定
精確稱取適量藜麥蛋白粉并記錄質量,按照GB 5009.5-2016《食品中蛋白質的測定》,重復3次試驗取平均值得蛋白純度。
1.3.8 藜麥蛋白功能特性研究
1.3.8.1 溶解性研究
參照高艷慧[8]的方法并略作調整,稱量0.1 g藜麥蛋白粉充分溶于10 mL蒸餾水中,用0.5 mol/L的HCl和NaOH分別調節樣品溶液pH值至2,4,6,8,10,12,于磁力攪拌器中攪拌30 min,8000 r/min離心10 min,用考馬斯亮藍法測所得上清液的蛋白質含量。
溶解性(%)=上清液蛋白含量/樣品蛋白含量×100%。
1.3.8.2 乳化性與乳化穩定性研究
a.乳化性
參照呂凱波等[9]的方法并略作調整,稱量0.1 g藜麥蛋白粉溶解于10 mL蒸餾水中,用0.5 mol/L的HCl和NaOH分別調節樣品溶液pH值至2,4,6,8,10,12,分別加入等體積的大豆油,快速攪拌1 min后以2000 r/min離心10 min。
乳化性(%)=乳化后高度/離心管樣液總高度×100%。
b.乳化穩定性
將上述離心后的樣品溶液于80 ℃恒溫水浴30 min,待樣液完全冷卻后以2000 r/min離心10 min。
乳化穩定性(%)=乳化后高度/乳化前高度×100%。
1.3.8.3 起泡性和泡沫穩定性研究
參照張思思[10]的方法并略作調整,稱取一定量的藜麥蛋白粉,配制1%的蛋白溶液,用0.5 mol/L的HCl和NaOH分別調節樣品溶液pH值至2,4,6,8,10,12,用高速勻漿機以15000 r/min攪打2 min,隨后倒入離心管中,記錄上層泡沫體積,靜置30 min后,再次記錄上層泡沫的體積。計算蛋白的起泡性和泡沫穩定性。
起泡性(%)=攪拌停止時泡沫體積/蛋白溶液體積×100%。
泡沫穩定性(%)=30 min后泡沫體積/起初泡沫體積×100%。
1.3.8.4 持水性研究
參照楊希娟等[11]的方法并略作調整,用蒸餾水配制濃度為10 mg/mL的藜麥蛋白溶液,用0.5 mol/L的HCl和NaOH分別調節樣品溶液pH值至2,4,6,8,10,12,常溫靜置1 h后,以4000 r/min的轉速離心10 min,除去上清液,稱取離心管和沉淀物的質量。
持水性(g/g)=(離心管沉淀物質量-樣品質量)/樣品質量。
1.3.8.5 持油性研究
參照Mohammed等[12]的方法并略作調整,稱量0.1 g藜麥蛋白粉加入10 mL大豆油,用0.5 mol/L的HCl和NaOH分別調節樣品溶液pH值至2,4,6,8,10,12后靜置1 h,以4000 r/min離心10 min,棄去上清液后,稱量樣品的質量。
持油性(g/g)=(離心管沉淀物質量-樣品質量)/樣品質量。
2 結果與分析
2.1 藜麥基本營養成分的測定
藜麥基本營養成分的測定見表2。

表2 藜麥基本營養成分測定表
2.2 單因素試驗
2.2.1 料液比對藜麥蛋白提取率的影響
由圖1可知,隨著料液比的增加,蛋白提取率呈現先上升后下降的趨勢,料液比為1∶12 (g/mL)時,藜麥蛋白提取率達到最大。當料液比為1∶8~1∶12 (g/mL)時,隨著料液比的增加,藜麥蛋白提取率顯著上升;當料液比為1∶14~1∶16 (g/mL)時,藜麥蛋白提取率基本不變。這是由于料液比過小時,藜麥溶解不充分,不利于蛋白質的溶出;增大料液比,藜麥粉與水充分溶解,有利于蛋白分子溶出;但料液比過大時,蛋白溶出量達到飽和,藜麥蛋白提取率變化不大。因此,選擇料液比1∶10~1∶14 (g/mL)進行響應面試驗。

圖1 料液比對藜麥蛋白提取率的影響
2.2.2 提取時間對藜麥蛋白提取率的影響
由圖2可知,在提取時間為2.5 h時,藜麥蛋白提取率達到最大;當提取時間為1.0~2.5 h時,隨著提取時間的增加,藜麥蛋白提取率顯著上升。這是由于溶液長時間攪拌,藜麥蛋白溶解更加完全,蛋白質溶出量增加;當提取時間大于2.5 h時,藜麥蛋白提取率略微下降,可能是因為提取時間過長,增加了非蛋白物質浸出,進一步影響蛋白質的沉淀和純度[13],同時耗能增加,生產成本也隨之增加。因此,選擇提取時間2.0~3.0 h進行響應面試驗。
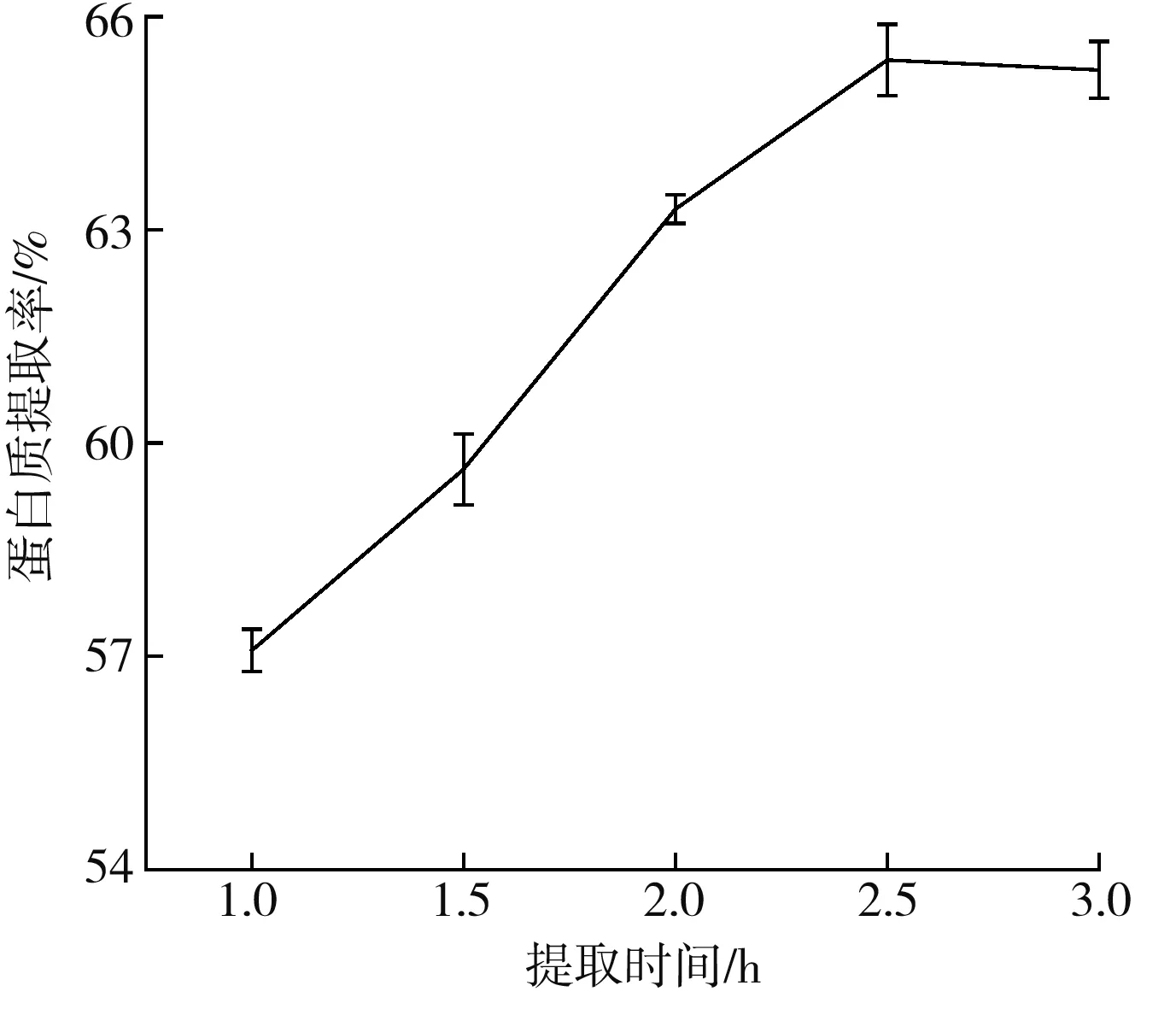
圖2 提取時間對藜麥蛋白提取率的影響
2.2.3 提取溫度對藜麥蛋白提取率的影響
由圖3可知,蛋白提取率隨著提取溫度的增加呈先上升后下降的趨勢,在45 ℃時達到最大。當提取溫度為35~45 ℃時,隨著提取溫度的增加,藜麥蛋白提取率顯著上升;當提取溫度為45~55 ℃時,藜麥蛋白提取率下降。這是由于升溫使蛋白質分子運動加劇,有利于蛋白質的溶解;但溫度過高,蛋白質的內部疏水基團會產生反應,從而影響蛋白質的提取率[14]。因此,選擇提取溫度40~50 ℃進行響應面試驗。

圖3 提取溫度對藜麥蛋白提取率的影響
2.2.4 pH值對藜麥蛋白提取率的影響
由圖4可知,當pH值為9.0~10.5時,藜麥蛋白的提取率顯著增加;當pH值大于10.5時,藜麥蛋白的提取率增加緩慢。這是由于隨著pH的升高,帶負電荷的蛋白質使分子間排斥力增強,增加蛋白質溶出量;但pH過高可能會使蛋白分子間的氫鍵、離子鍵及空間結構遭到破壞,使部分蛋白質變性[15]。綜合考慮,選擇pH 10.0~11.0進行響應面試驗。
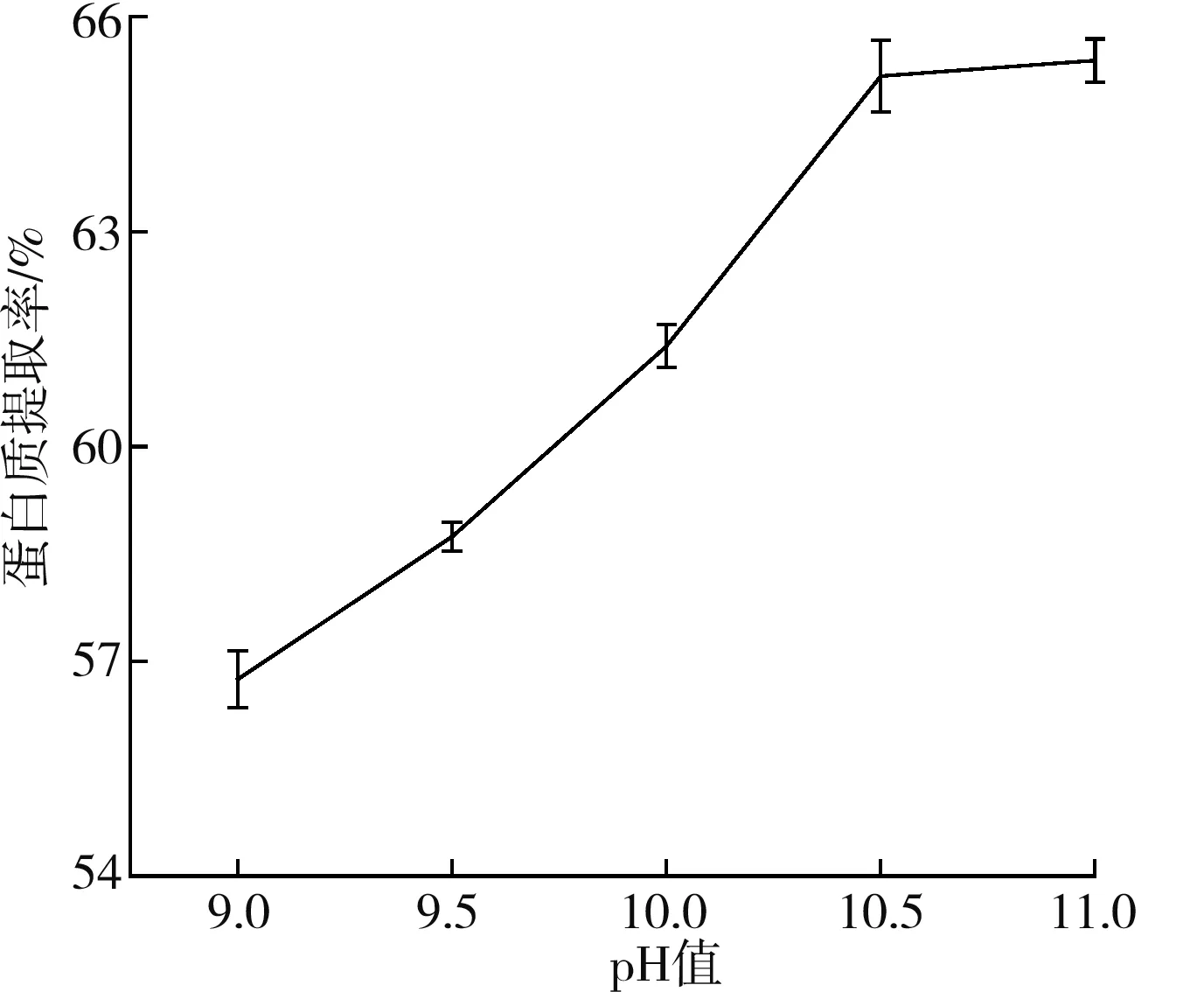
圖4 pH值對藜麥蛋白提取率的影響
2.3 響應面試驗
2.3.1 響應面試驗設計及結果
對料液比、提取時間、提取溫度、pH值進行優化,以藜麥蛋白提取率為響應值,進行響應面優化試驗。利用 Design Expert V8.0.6.1軟件設計試驗,結果見表3。
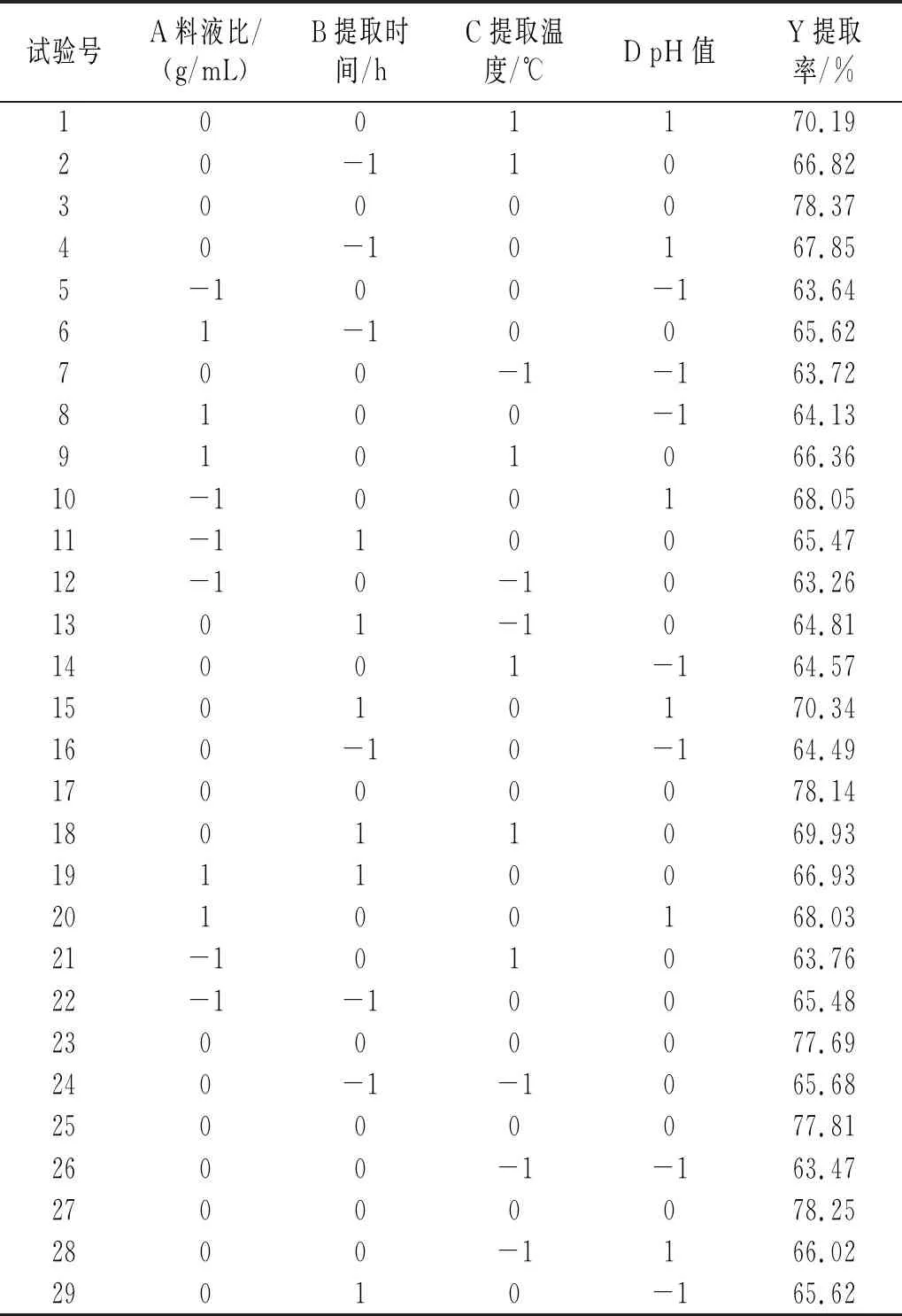
表3 響應面試驗設計及結果
2.3.2 回歸模型擬合及方差分析
對表3結果進行回歸方程擬合,得到響應面回歸方程:Y=+78.05+0.41A+0.57B+1.20C+2.03D+0.33AB+0.60AC-0.13AD+0.93BC+0.34BD+0.83CD-7.00A2-5.18B2-6.49C2-5.44D2。
回歸模型方差分析見表4。
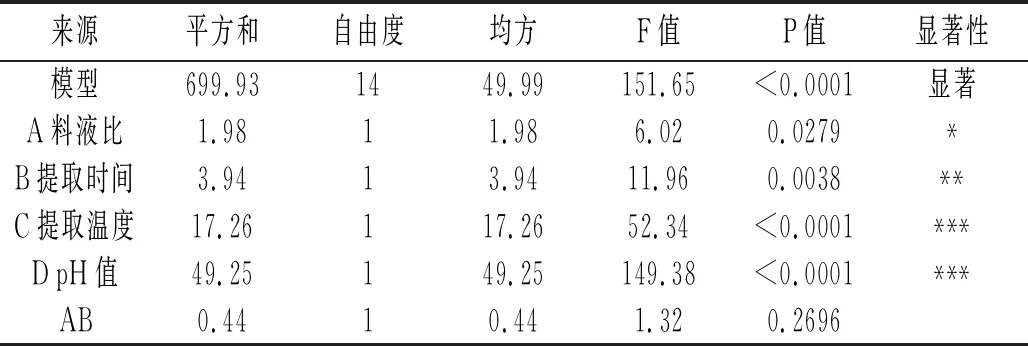
表4 回歸模型方差分析
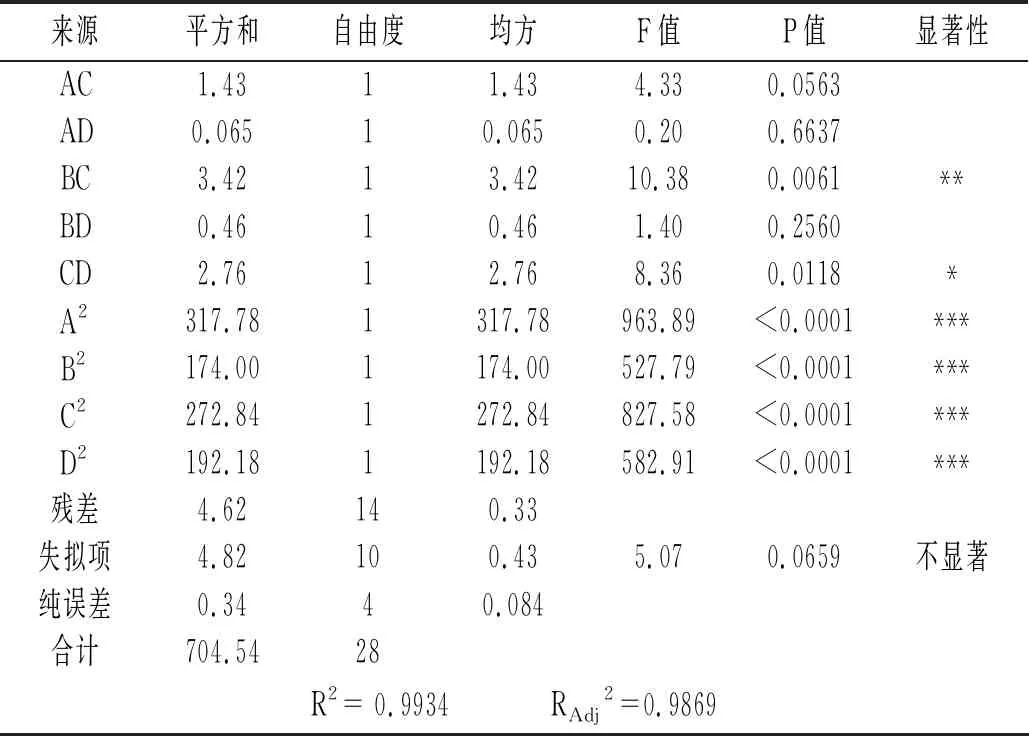
續 表
由表4可知,該模型的P值<0.0001,失擬項不顯著(P=0.0659>0.05),相關系數R2=0.9934,說明模型極其顯著,可較好地反映藜麥蛋白提取中各因素與響應值的關系并預測最佳提取條件。由P值大小可知,C、D影響極顯著,A影響顯著,B影響較顯著。由F值可知,影響藜麥蛋白提取率的因素主次順序為pH值>提取溫度>提取時間>料液比。
2.3.3 響應面分析
利用Design Expert V8.0.6.1軟件,得到AC、BC和CD的交互作用對藜麥蛋白提取率影響的等高線圖及3D響應面圖,見圖5。

圖5 AC、BC和CD交互作用對藜麥蛋白提取率的影響
由圖5可知,AC、BC和CD交互作用的等高線圖均變化較明顯,且BC和CD等高線呈橢圓形,說明AC、BC和CD的交互作用對藜麥蛋白提取率的影響較顯著;3D圖中,AC、BC和CD交互作用的曲線較陡峭,且隨著因素水平的增加,藜麥蛋白提取率呈現先上升后下降的趨勢。
2.3.4 驗證試驗
分析響應面試驗結果,得到藜麥蛋白的最佳提取條件為:料液比1∶12.07 (g/mL)、提取時間2.54 h、提取溫度45.56 ℃、pH 10.60,預測蛋白提取率為78.35%。在實際操作過程中,將最佳提取條件調整為:料液比1∶12.0 (g/mL)、提取時間2.5 h、提取溫度46 ℃、pH 10.5,進行3次驗證試驗,得到蛋白提取率為(78.86±0.79)%,與預測值接近,說明該模型能夠較好地反映藜麥蛋白提取率。采用凱氏定氮法對藜麥蛋白粉的純度進行測定,結果為87.58%。
2.4 藜麥蛋白功能特性的研究
2.4.1 溶解性
溶解性是蛋白質的重要功能特性之一,與其乳化性、持水性、起泡性等多項功能特性有關。由圖6可知,當pH值為4時,溶解性最差,僅為35.11%;當 pH值大于4時,溶解性顯著提高。這是因為溶液在堿性環境中蛋白遠離等電點,可能是較高的pH值導致蛋白質內部因靜電排斥而造成分子伸展,進而提高了蛋白溶解性[16]。
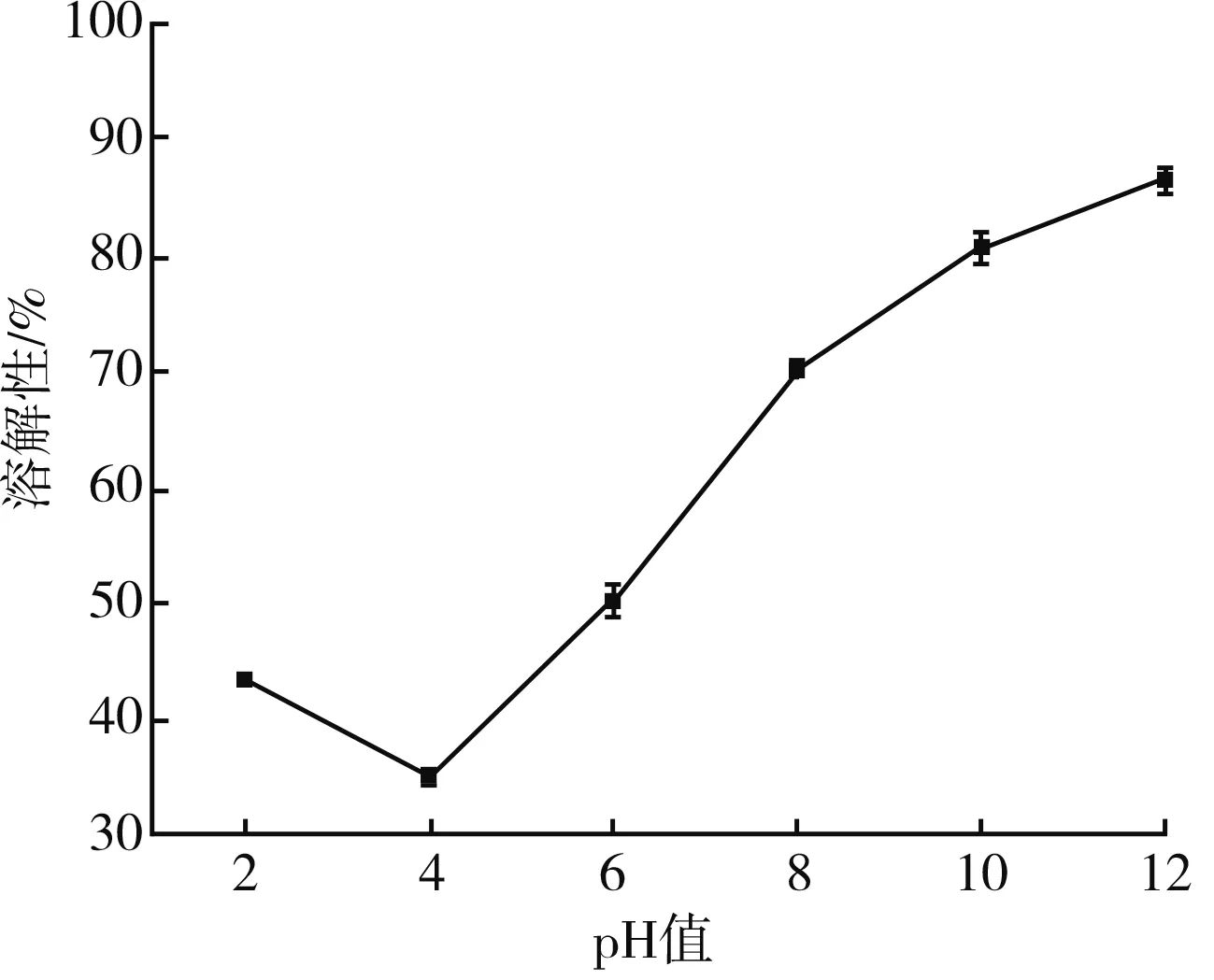
圖6 pH值對藜麥蛋白溶解性的影響
2.4.2 乳化性與乳化穩定性
乳化性是指蛋白質在單位質量下能維持油水界面的面積;乳化穩定性是指蛋白質維持穩定狀態且與水或油混合不產生兩相分層不穩定現象的特性。由圖7可知,隨著pH的增加,藜麥蛋白的乳化性與乳化穩定性均為先下降后上升,當pH為4時達到最小。這是由于蛋白在等電點處的溶解度最低,導致溶液不能迅速固定在油與水界面上;之后隨著pH值增加,蛋白表面的負電荷增加,使其排斥作用增強,致使蛋白水化層厚度也增加,從而增加了蛋白的乳化穩定性[17]。
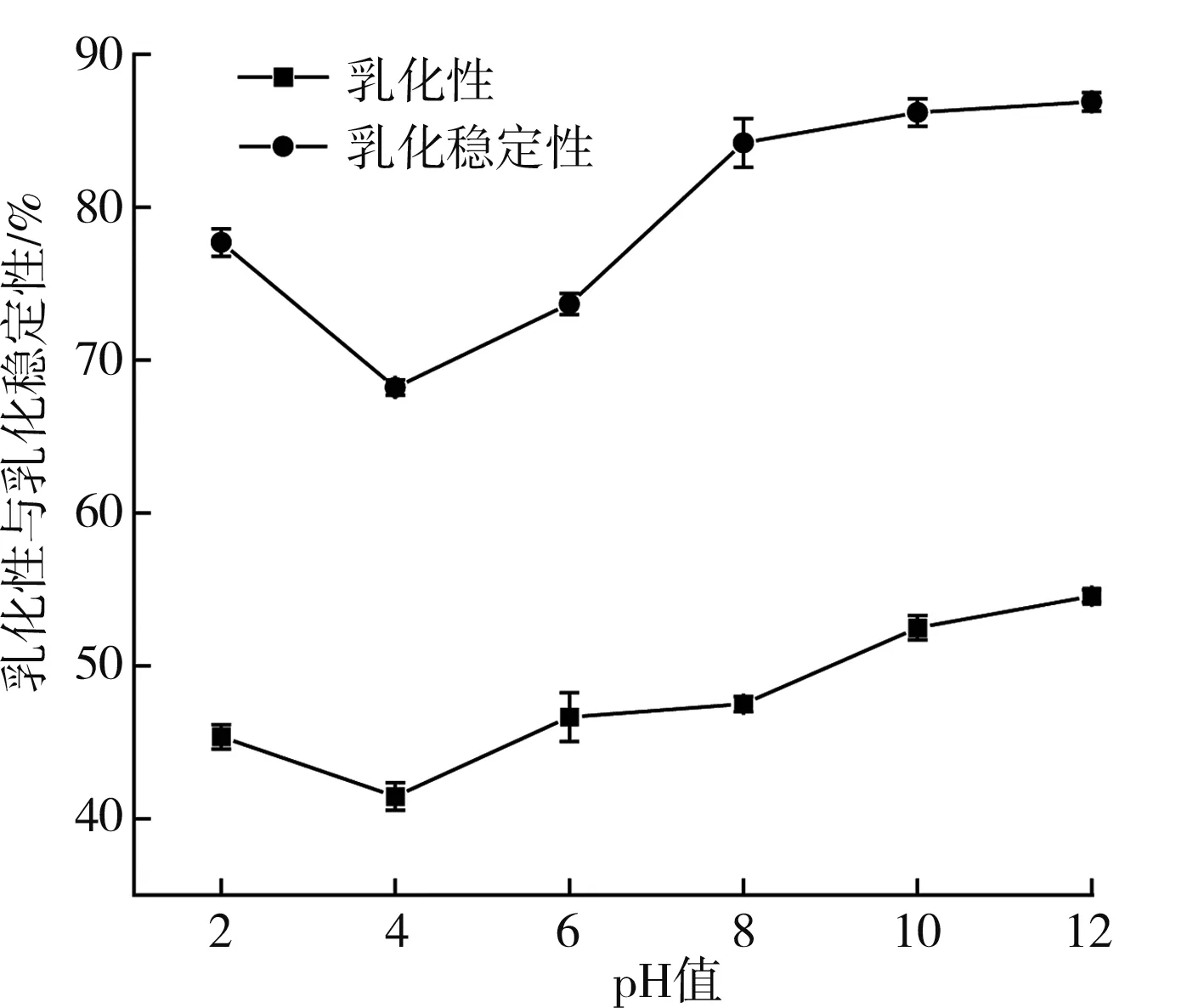
圖7 pH值對藜麥蛋白乳化性與乳化穩定性的影響
2.4.3 起泡性與泡沫穩定性
蛋白質的起泡性是指蛋白質起泡的能力,泡沫穩定性是指維持穩定泡沫的能力。由圖8可知,當pH為4時,起泡性與泡沫穩定性都達到最低;之后隨著pH的增加,起泡性與泡沫穩定性都有不同程度的增加。這是因為在堿性環境中,蛋白質的凈電荷增加,減弱了疏水相互作用力,使得蛋白質容易分散到水與空氣界面,使界面得以加強,促進泡沫的形成和穩定[18]。

圖8 pH值對藜麥蛋白起泡性與泡沫穩定性的影響
2.4.4 持水性
蛋白質持水性是指蛋白質截留水、阻止水滲出的能力。由圖9可知,當pH為4時,持水性達到最低,為1.84 g/g;當pH為4~10時,蛋白的持水性明顯升高,之后趨于平穩。這是由于當pH值處于等電點時,蛋白質分子總電荷為零,分子間相互作用最大,使蛋白質締合和收縮,呈現最低的膨脹和水化,pH值增加,蛋白質膨脹和水化性能也增加,使持水能力變強[19]。
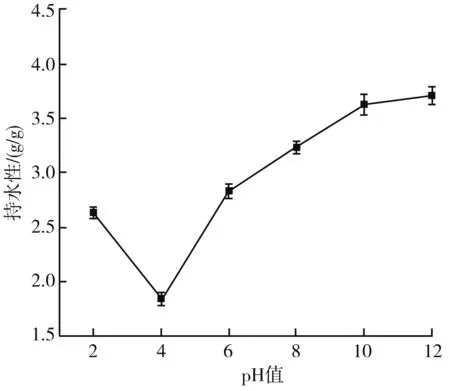
圖9 pH值對藜麥蛋白持水性的影響
2.4.5 持油性
持油性是指蛋白質結合脂質的能力。由圖10可知,pH為4時持油性最低;隨著pH的增加,蛋白的持油性升高。這是由于當pH在蛋白等電點附近時,蛋白容易聚集沉淀,持油性最小;隨著pH的升高,蛋白分子發生伸展、解離,內部非極性鍵暴露,進而增加與油脂結合能力[20],使蛋白持油性提高。

圖10 pH值對藜麥蛋白持油性的影響
3 結論
通過單因素試驗并結合Box-Behnken試驗設計的方法,得到藜麥蛋白最佳提取條件為:料液比1∶12.0 (g/mL)、提取時間2.5 h、提取溫度46 ℃、pH 10.5,此時蛋白提取率為(78.86±0.79)%,純度為87.58%。此外,藜麥蛋白有較好的溶解性和起泡性,一定的持水(油)性和乳化穩定性,較差的乳化性。pH值對藜麥蛋白的功能特性有顯著影響,即當溶液pH在藜麥蛋白等電點附近時,蛋白的溶解性、乳化性、乳化穩定性均較差;當pH偏離等電點時,上述功能特性均得到不同程度的提高,該研究對藜麥相關產品的加工或貯藏過程有著重要作用,可增加藜麥蛋白利用率。

