脊椎動物神經管背-腹圖式形成中形態素的調控作用綜述
劉聰,徐鵬飛
(浙江大學醫學院,杭州 310058)
早在19 世紀末,Hans DRIESCH 發現從海膽胚胎中分離的2 個細胞可以發育成尺寸較小但結構完整的海膽胚胎,由此認為在早期發育的胚胎中存在能夠指定每個細胞位置的坐標系統。1969 年,WOLPERT 構建了“法國國旗”模型,首次提出了胚胎發育過程中存在位置信息的概念[1],同時,該模型從分子水平上揭示了一種介導細胞位置調控和圖式形成的信號,這種信號(形態素)能夠通過給予位置信息來調控細胞命運,并進一步驅動大范圍的形態發生。目前的研究對形態素已經有了一定的了解:形態素從局部組織分泌,通過擴散等方式形成濃度梯度,細胞響應不同濃度的形態素并被誘導表達相應的下游基因,從而進一步調控細胞命運的決定及其空間排布;同時,形態素下游的信號也可進一步通過調控細胞增殖、分化和遷移等過程來調控不同細胞群之間邊界的形成。
脊椎動物中樞神經系統的前體——神經管的形成是一個復雜而有序的發育過程,需要正確的細胞命運誘導和空間位置調控。科學家們已經證實許多形態素參與調控神經管的發育,包括參與神經管前-后圖式形成的維甲酸(retinoic acid,RA)、成纖維細胞生長因子(fibroblast growth factor, FGF)、生長分化因子(growth differentiation factor,GDF),以及參與神經管背-腹圖式細胞分化和位置決定的Wingless-Int(Wnt)、骨形成蛋白(bone morphogenetic protein,BMP)和音猬因子(Sonic hedgehog,Shh)[2](圖1)。
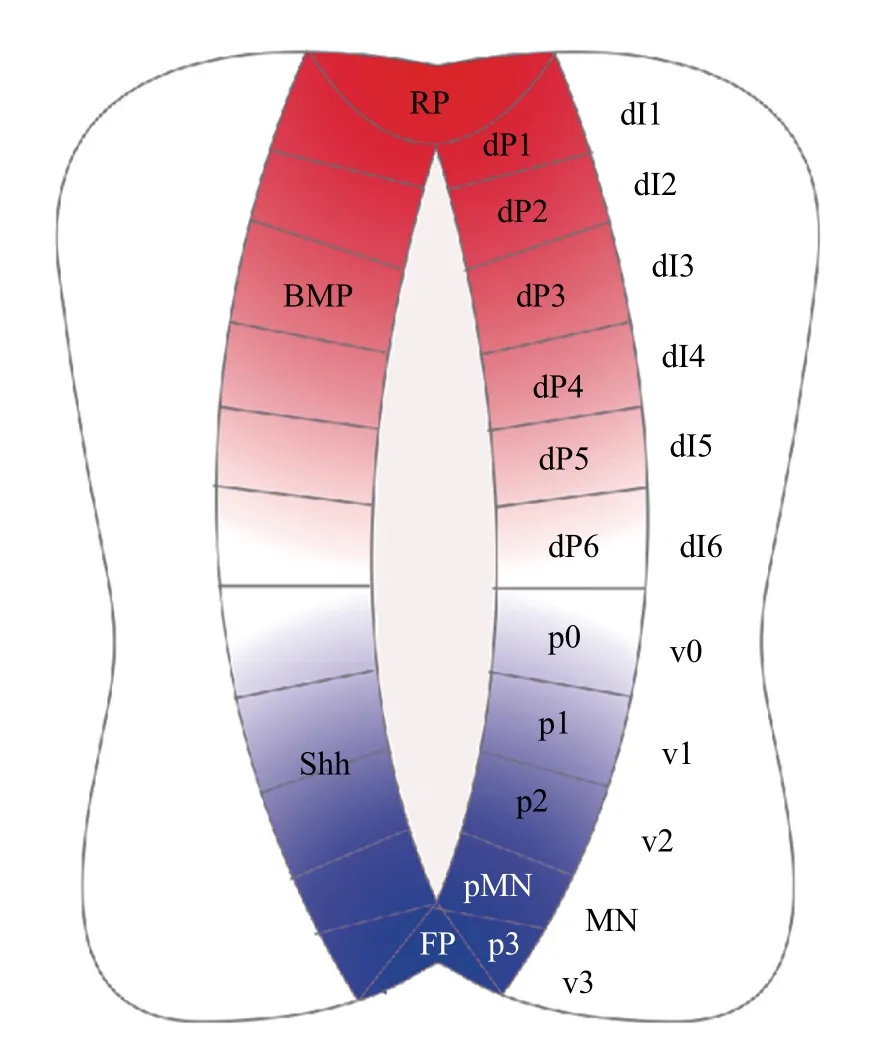
圖1 脊椎動物神經管背-腹圖式Fig.1 Dorsal-ventral pattern of vertebrate neural tube
Shh信號源自脊索并參與早期胚胎發育和身體圖式的形成。實驗證明,Shh信號負責調控神經管腹側的細胞圖式,抑制Shh信號會導致雞、斑馬魚和小鼠胚胎中嚴重的神經管背-腹圖式缺陷[3-4]。另外,體外實驗表明,當神經前體細胞暴露于不同濃度的Shh蛋白中時,神經管腹側細胞特異性基因的表達會顯著增加[5]。BMP信號在早期胚胎發育中也發揮重要作用,它與其自身拮抗基因相互作用,將胚胎的3個胚層細分為具有不同發育命運的區域。在神經管發育過程中,不同濃度的BMP信號會沿著背腹軸誘導神經管不同區域細胞命運的形成。抑制BMP 信號會導致雞和斑馬魚胚胎神經管背側細胞圖式的嚴重缺陷[6],BMP信號(如BMP4/7)或其受體的過表達則會導致大量的背側神經祖細胞產生[7]。
近年來,類器官培養技術的興起進一步推動了對脊椎動物神經管形成中BMP和Shh這2種信號的研究。類器官作為一種在體外由全能/多能干細胞培養的三維細胞組織,具有相應體內器官的主要特征和一定的功能,其為探索形態素濃度梯度在胚胎發育中的作用提供了理想的體外模型。2019 年,LORENZ 實驗室通過模擬Shh 信號濃度梯度,成功誘導產生了多種前腦細胞類型,這些細胞具有與體內前腦圖式類似的空間分布,在一定程度上形成了前腦的背-腹和前-后圖式[8],為探究前腦發育提供了優秀的體外模型。
在本綜述中,我們主要從BMP和Shh配體的產生及濃度梯度的形成、信號轉導和細胞應答、圖式建成的調控機制這3 部分出發,討論BMP 和Shh 信號作為形態素在脊椎動物神經管發育中的作用。盡管這3 部分在神經管發育過程中緊密相連,不能單獨考慮,但我們希望這種劃分能夠為脊椎動物神經管發育中BMP 和Shh 信號的系統研究提供方便的框架。同時,我們也總結了近年來利用形態素構建神經管類器官的一些研究工作。
1 神經管發育中BMP 信號和Shh 信號反向平行濃度梯度的形成
神經管來源于早期胚胎的神經板或神經上皮。在胚胎發育的原腸胚階段,BMP配體濃度梯度呈現為腹側較高而背側較低。這種從腹側至背側的BMP 濃度梯度的建立依賴于胚胎中表達于背側的BMP 抑制蛋白的作用,主要為背組織者(dorsal organizer)分泌的Noggin[9]、Chordin[10]和Follistatin[11]等。背側BMP 信號的抑制使得神經外胚層從原始外胚層中特化產生[12],然后在原腸運動過程中細胞向背中線匯聚,導致外胚層增厚并產生神經管的前體——神經板,隨后神經板通過稱為神經發生(neurulation)的形態重塑過程形成神經管。
脊椎動物中兩棲類、鳥類和哺乳類等的神經管形成方式可分為2 種類型:一種是初級神經發生(primary neurulation),產生體軸前部的神經管,在未來發育為中樞神經系統的腦;另一種是次級神經發生(secondary neurulation),作為體軸后部神經管的形成方式,在未來發育為中樞神經系統的脊髓[13]。
初級神經發生包括神經板的折疊以及在中線處的融合(圖2A~C,H)。神經板在原腸運動的匯聚作用下彎曲折疊形成神經褶(neural fold)[13],這種形態的發生依賴于神經板上的特殊結構——鉸鏈點:一種是中線鉸鏈點(median hinge point,MHP),位于神經板的腹側中線,是存在于底板的一組特定細胞,可使神經板從中線處彎曲而產生具有V 形橫截面的神經溝(neural groove);另一種是成對的背外側鉸鏈點(dorsolateral hinge point, DLHP),位于神經板兩側,依賴于DLHPs的折疊,神經板形成縱向溝,且神經板兩側末端在背中線處彼此相對。隨后,神經褶的邊緣在中線處匯合并融合,形成封閉的中空神經管[13]。
次級神經發生形成未來中樞神經系統的脊柱尾部到骶骨中部的部分(圖2A,D,E,H)。次級神經發生與初級神經發生差異較大,前者不是通過神經板折疊的方式形成,而是神經板細胞在原腸運動的匯聚作用下向中間聚集,并排列成與初級神經管相連的實心柱狀結構——髓索,而與初級神經管相連的中央管腔的形成依賴于髓索中多個小腔的進一步擴大和隨后的融合[13]。
然而,在斑馬魚等硬骨魚(teleost fish)中,其神經管的形成不同于上述2 種神經發生方式,而是采用一種類似于次級神經發生的方式(圖2A,F~H)。首先,神經板細胞在原腸運動的匯聚作用下向背中線聚集并內化,形成實心的神經龍骨(neural keel)。然后,神經龍骨進一步發育為堅固的神經條(neural rod);而神經管中央空腔的形成依賴于神經條中線兩側的神經管細胞頂端特化以及隨后沿著中線的對稱分裂。最后,神經管前部發育為腦,后部發育為脊髓,從而形成完整的中樞神經系統[14]。
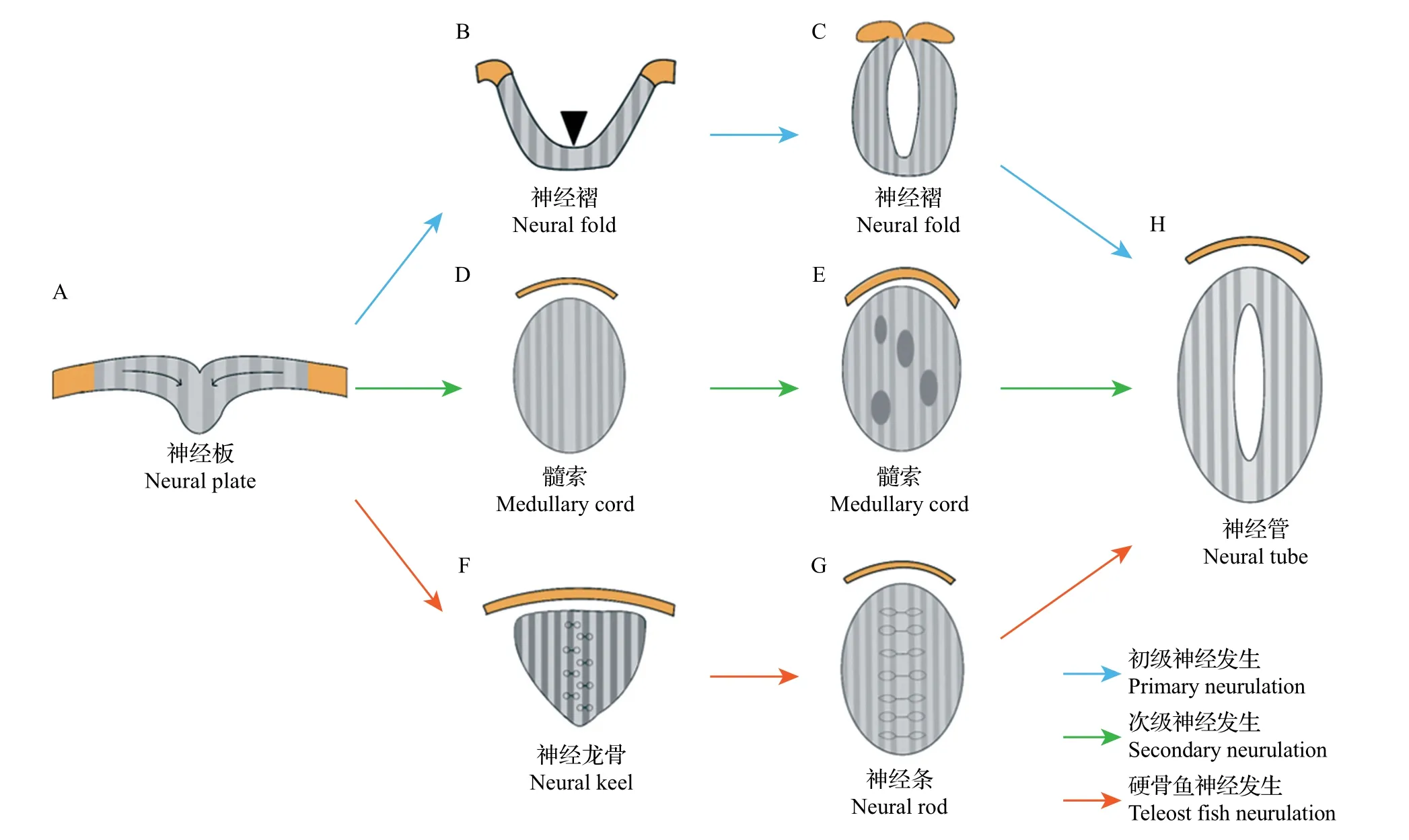
圖2 神經管的形成過程Fig.2 Formation process of neural tube
這3種神經發生方式最初都是由原腸胚時期的匯聚延伸運動驅動的。在這種強烈的細胞遷移過程中,最初胚胎中從腹側到背側(從高到低)的BMP濃度梯度轉變為神經管中從背側到腹側(從高到低)的濃度梯度[13-14](圖3)。而在神經管形成過程中,Shh從腹側脊索中分泌出來并擴散,建立了神經管中從腹側至背側的濃度梯度。BMP和Shh這2種形態素在神經管中形成了反向平行的濃度梯度,并進一步對神經管的背-腹圖式進行誘導。在神經管形成之后,頂板和底板作為神經管中新的信號源,分泌形態素并維持其濃度梯度,沿著背-腹軸將神經祖細胞誘導劃分為11個區域(圖1),包括6個背側祖細胞域(dP1~dP6)和5 個腹側祖細胞域(p0~p3和pMN),且分別進一步分化為相應的背側中間神經元群(dI1~dI6)和腹側中間神經元群(v0~v3 和MN)[15]。
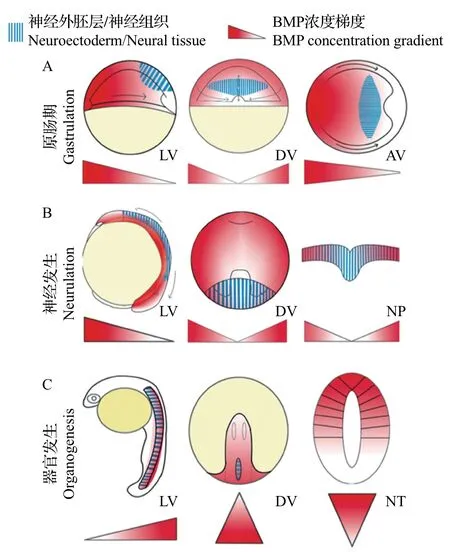
圖3 斑馬魚早期發育中BMP濃度梯度轉換過程Fig.3 BMP concentration gradient shifting process during the zebrafish early development
2 BMP 信號與神經管背側細胞命運
BMP 是轉化生長因子-β(transforming growth factor-β,TGF-β)家族的成員之一,在胚胎發育(如細胞增殖、分化和遷移等過程)中起著重要作用[16]。有關證據表明,BMP信號參與了從神經外胚層產生階段開始的整個神經管的形成過程,以及對神經祖細胞和下級神經元的分化和空間排布的調控[17]。以下部分將重點總結BMP 信號在脊椎動物神經管圖式形成中的作用及調控機制。
2.1 BMP 信號的產生
在神經管中,BMP配體由位于神經管背中線的頂板分泌產生,并通過擴散形成濃度梯度。頂板作為BMP配體的信號源,形成于神經板的折疊閉合過程。隨著神經板的折疊,神經板邊界(神經外胚層和非神經外胚層之間的較寬區域)移動到神經管的背側[18](圖4),同時,頂板祖細胞也向神經板邊界遷移,到達未來神經管最背側中線位置。神經板邊界具有較高水平的BMP 活性[19],在這種細胞運動中,頂板祖細胞暴露于活性水平更高的BMP信號中,從而分化為成熟的頂板細胞[18,20]。較高濃度的BMP信號誘導頂板細胞表達Hairy 1蛋白,該蛋白可以通過抑制Foxd3(神經嵴細胞標記物)的表達來鞏固頂板的細胞命運,促進其退出細胞周期和上皮-間質轉化[18,20]。
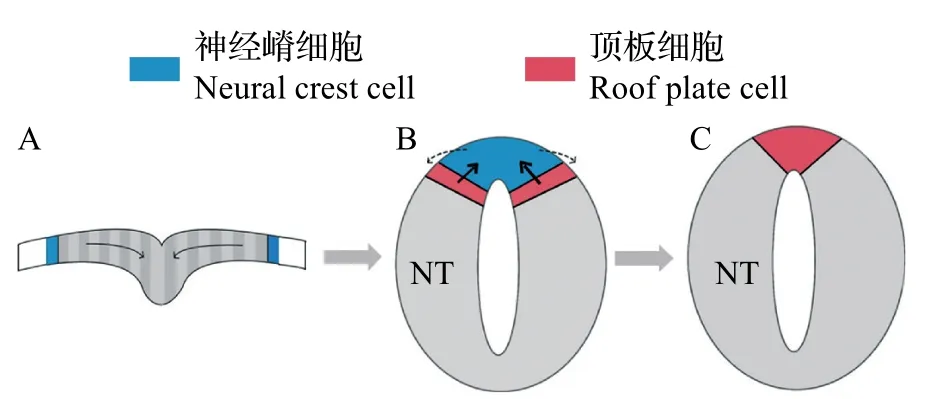
圖4 神經管頂板的形成過程Fig.4 Formation process of roof plate in neural tube
2.2 BMP 信號轉導和細胞應答
2.2.1 BMP 配體
在BMP 信號轉導過程中,BMP 配體通過二硫鍵之間的共價鍵連接,以二聚體的形式發揮作用[21](圖5)。細胞培養實驗表明,BMP 的異二聚體比同二聚體具有更高的活性[22]。同時,分子遺傳學研究表明,斑馬魚胚胎中同時存在BMP同二聚體和異二聚體,但只有Bmp2b/Bmp7a 異二聚體可以磷酸化TGF-β信號轉導途徑中的關鍵信使Smad1/5[22]。并且Bmp2b/Bmp7a 異二聚體可以通過與Alk3/6 和Alk2形成復合物來參與神經管背-腹圖式的形成。
2.2.2 BMP 受體復合物
BMP 信號由胞外向胞內的轉導依賴于細胞膜上的Ⅰ型和Ⅱ型受體復合物[23],這2 種類型的受體都包含作為配體結合位點的細胞外結構域和具有絲氨酸/蘇氨酸激酶(serine/threonine kinase,STK)活性的細胞內結構域。在與BMP配體結合后,Ⅱ型受體會磷酸化Ⅰ型受體[23],而磷酸化的Ⅰ型受體可以激活細胞內的下游介體[16](圖5)。
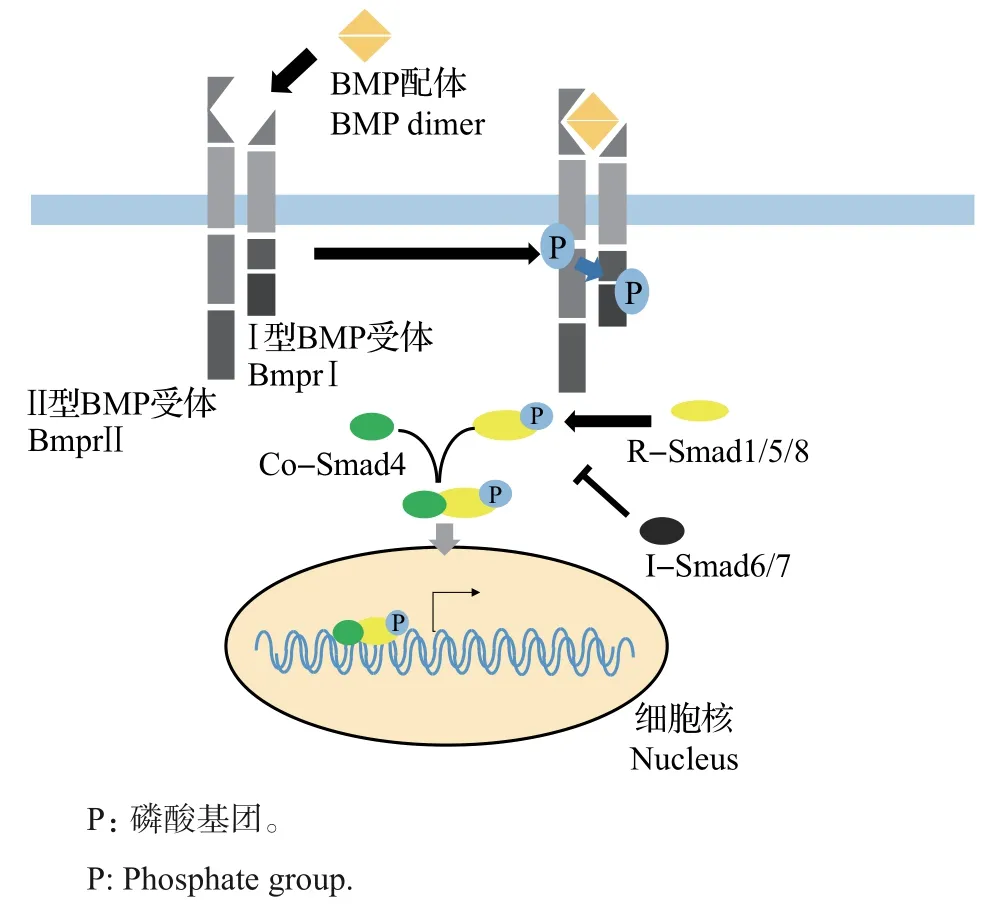
圖5 BMP信號轉導Fig.5 BMP signaling transduction
目前,已經鑒定出6種不同的BMP信號通路受體,包括Ⅰ型受體BmprⅠ(BmprⅠa 或BmprⅠb)和ActRⅠA,Ⅱ型受體BmprⅡ和ActRⅡ(ActRⅡA 或ActRⅡB)[24]。研究表明,在神經管發育中主要的功能性BMP受體復合物是BmprⅡ/BmprⅠ,在BmprⅠ突變體小鼠中存在dP1祖細胞域的缺失及dP2祖細胞域的明顯減少[25],而過表達BmprⅠ則會導致雞或小鼠背側和中部神經元命運的增加及腹側神經元命運的減少[26-27]。
2.2.3 Smads 蛋白
Smads蛋白作為BMP信號通路中的胞內組分,參與BMP 信號的胞內轉導。目前,已經鑒定出的Smads蛋白共有3種,包括激活受體的Smads(receptor activated Smads,R-Smads)、抑制性Smads(inhibitory Smads,I-Smads)和輔助型Smads(common mediator Smads,Co-Smads)[23]。
R-Smads 蛋白作為胞內介體,負責進行細胞內信號轉導,具有2 個結構域:N 端的MH1 結構域和C 端的MH2 結構域。作為R-Smads 在信號轉導過程中行使功能的核心,這2 個結構域都非常保守。其中,MH1 結構域具有DNA 和蛋白質結合功能,MH2 結構域具有受體識別功能并能夠被Ⅰ型受體磷酸化,從而協助Smads 復合物入核[16]。當RSmads 蛋白的C 端被磷酸化后,MH1-MH2 自抑制結構被破壞,暴露出核定位序列,隨后與Co-Smad4結合并作為復合物遷移到核中,從而調控下游基因的表達[16](圖5)。
特定于BMP信號通路的R-Smads包括Smad1、Smad5 和Smad8[28]。有實驗發現,不同的R-Smads在神經管圖式形成中具有不同的功能。在雞胚胎中敲低Smad1 或Smad5 可以減少dI1~dI6 中間神經元的命運,其中最為明顯的是dI1、dI3和dI5中間神經元[2],而使用短發夾RNA(short hairpin RNA,shRNA)敲降雞胚胎中的Smad8 僅能減少dI1 中間神經元的命運[28]。在小鼠的功能喪失實驗中,背部神經元命運需要Smad5,而Smad1 在dI1 軸突生長中起重要作用[28]。
I-Smads 在BMP 信號通路中起負調控作用[29](圖5),已被鑒定出的I-Smads包括Smad6和Smad7。Smad6 被發現是幾乎在所有脊椎動物中保守的I-Smads,能夠競爭性地與磷酸化R-Smads結合,從而阻止其與Co-Smad4形成復合物。而Smad7能夠通過與R-Smads競爭來激活BmprⅠ,從而抑制BMP信號向胞內轉導。同時,Smad6 和Smad7 都可以與Smuf1 綴合以促進BMP 受體的降解[29]。實驗發現,在神經管的不同神經元中表達的不同的I-Smad 似乎具有不同的功能:在雞神經管發育過程中,Smad7在脊髓中部新分化的神經元中高表達,而Smad6在脊髓背部和中部的成熟神經元中高表達;在背側激活Smad7能夠抑制dI1和dI3中間神經元的分化,而Smad6的異位表達能夠導致dI1軸突生長的缺陷[30]。
對于Co-Smads 在神經管發育方面的研究非常有限,僅有實驗表明,通過小干擾RNA(small interfering RNA, siRNA)敲降雛雞中的Smad4 會導致dI1和dI3中間神經元的缺失[6]。
2.3 BMP 調控背-腹圖式形成的機制
2.3.1 BMP 濃度梯度模型
關于BMP 信號調控神經祖細胞產生具有空間性的命運決定和排布的機制,最被認可的觀點是BMP作為一種形態素,其濃度梯度會影響背側神經祖細胞命運的決定并調控3 種感覺神經元(dI1、dI2和dI3)的分化[4]。
在BMP 濃度梯度模型中,高水平的BMP 活性有利于背側神經祖細胞命運的產生,而低水平的BMP活性則有利于靠近腹側的神經祖細胞的命運決定。2002年,NISWANDER實驗室的體內功能獲得性實驗結果支持了這一模型,他們在實驗中成功利用不同濃度的BMP 信號分別誘導了dI1、dI2 和dI3神經元的產生[27]。大量實驗結果也表明,正確的BMP濃度梯度是維持神經管背側和腹側神經元之間的平衡所必需的。在雛雞或小鼠胚胎中過表達BmprⅠa和BmprⅠb會導致背側和中間區域神經元數量的增加及腹側神經元的缺失[26-27],而BmprⅠa 和BmprⅠb 的缺失則會導致背側dI1 中間神經元的完全喪失及dI3 和dI4 中間神經元的增加[25]。Noggin作為BMP信號通路的抑制基因,能夠在胞外競爭性地結合BMP 配體。Noggin的過表達會導致dI1 中間神經元的缺失和dI2~dI4 中間神經元的增加[6]。Follistatin作為另一種BMP 信號通路的抑制基因,其過表達能夠導致dP1~dP3 祖細胞域命運的減少[31]。Bmp4/7 或激活的BmprⅠ轉基因過表達則會導致dI1中間神經元的增加[7]。
2.3.2 BMP 配體誘導模型
不同物種中參與神經管背-腹圖式形成的BMP配體是不同的,并且有實驗發現,在雞的神經組織外植體中,BMP4 轉染的COS 細胞能夠誘導dI1 神經元命運的產生,而用稀釋的BMP4 條件培養基處理卻不能有效地誘導dI3神經元的命運[32-33],表明低濃度的BMP4可能無法誘導dI3神經元。因此,研究人員提出了BMP配體誘導模型來解釋神經管背-腹圖式的形成。該模型認為不同的BMP 配體參與誘導不同神經祖細胞域的產生和空間排布,如BMP4和BMP7 在雞神經管發育中發揮作用,而在小鼠神經管發育中則是BMP5、BMP6 和BMP7 發揮作用[32-33]。同樣,在雞胚胎中敲低BMP4僅導致dI1 神經元的減少,而敲除BMP7則明顯減少了dI1、dI3和dI5 神經元的數量[17,34]。該機制可以通過顯性負型Ⅰ型BMP受體實驗來解釋:通過電轉激酶結構域截斷形式的BmprⅠ發現,不同的BMP 配體可以激活不同的Ⅰ型受體并調節細胞周期,從而參與神經元分化的調控。小鼠中BMP6和雛雞中BMP7誘導頂板的形成均是通過BmprⅠa發揮作用。在小鼠和雛雞中,dP1 祖細胞都由BMP4 和BMP7 通過BmprⅠa或BmprⅠb 誘導,而dI1 神經元則只能由BMP4 誘導。雛雞中dI2神經元只能由BMP4誘導,而dI3神經元可以由所有BMP配體誘導,但dI4~dI6在任何BMP配體作用下都未能被誘導,說明可能存在其他機制來誘導偏向于神經管中部的神經元命運[33]。
2.3.3 時間形態素誘導模型
一些研究發現,對于神經管這樣一個復雜的三維組織,不僅BMP 信號的空間分布參與背-腹圖式的形成,靶細胞在信號中的暴露時間也參與細胞命運的調節。在雛雞神經板外植體誘導實驗中,長時間的Bmp4信號暴露會導致較多的背祖細胞命運的產生,而在體內,在不同階段抑制BMP 信號會導致不同的缺陷表型,早期抑制BMP 信號會導致整個dI1~dI3 神經元的缺失,而后期抑制則能夠依次產生dI3和dI2神經元[35]。
3 Shh 信號與神經管腹側細胞命運
Shh 是經典刺猬(hedgehog)信號中最重要的糖蛋白之一,在脊椎動物肢體、神經系統、胃腸道及心臟等各種重要系統、器官的發育過程中起著關鍵作用。此外,相關研究表明,Shh的激活也參與了腫瘤的轉移以及血管的生成和存活[36]。在本綜述中,總結了Shh在脊椎動物神經管發育中的作用及調控機制。
3.1 神經管中Shh 蛋白的表達
在脊椎動物神經管發育過程中,Shh 蛋白由位于神經管腹側的脊索和底板分泌產生[37]。在原腸胚時期,Shh在中胚層處表達,隨著中線處中胚層形成實心棒狀的脊索,Shh 開始在脊索中表達[37]。在羊膜動物中,由脊索分泌的Shh 在神經管中誘導了底板的形成,且其是Shh 產生和分泌的第2 個中心[37]。然而在其他脊椎動物中,底板的形成機制似乎與脊索衍生的Shh信號的相關性較小[38]。
3.2 Shh 濃度梯度的形成
與其他形態素相似,Shh 信號濃度梯度的形成涉及3 個主要問題:1)如何以活性形式產生和分泌Shh 配體;2)Shh 配體如何在組織中擴散;3)過量的Shh 如何降解并從組織中去除。其中,每個過程都有特定的分子途徑進行精確調控,并構成了復雜的Shh濃度梯度形成和維持系統。
3.2.1 Shh 的產生和擴散受脂化作用的影響
活性Shh 配體的產生是一個復雜的過程。Shh蛋白最初在分泌細胞中被翻譯成45 kDa 的Shh 前體,隨后經過蛋白酶的水解作用產生2個較短的肽,即19 kDa的N端區域(Shh-N)和26 kDa的C端區域(Shh-C)(圖6),抑制這種蛋白酶水解切割能夠使Shh信號失活[39]。在水解切割過程中,羧基末端會連接膽固醇,這是Shh-N的分泌、遷移和膜插入所必需的[39],缺乏膽固醇修飾的Shh會更快地在組織中擴散和滲透[40]。水解切割之后,Shh-N與Shh-C分離,酰基轉移酶Skn會催化棕櫚酰基與Shh-N的N末端結合[39],從而增強Shh信號的誘導能力[41]。非棕櫚酰化形式的Shh活性較低[41],同時,這種修飾對于脊椎動物神經管的發育是必需的,因為Skn-/-小鼠胚胎表現出與Skn-/-小鼠相似的畸形——神經管中存在嚴重的背-腹圖式混亂[41-42]。Shh的雙重脂化作用(圖6)確保了其在脊椎動物神經管發育過程中的擴散性和對遠距離信號轉導的活性[40-41],為誘導神經管腹側細胞圖式提供了支持。
3.2.2 Shh 的分泌依賴Disp1 跨膜蛋白的協助
脊索和底板細胞中活性Shh配體的分泌需要跨膜蛋白Disp1的協助(圖6)。Disp1上存在固醇感應結構域(sterol-sensing domain,SSD),可以識別膽固醇修飾的Shh-N,從而促進其分泌以及在組織中的長距離信號轉導[43]。在純合的Disp1突變小鼠中,神經管的背-腹圖式,尤其是腹側部分被嚴重破壞,并且沒有檢測到呈活性狀態的Shh配體[43]。然而也有實驗檢測出存在缺乏膽固醇修飾的Shh配體的非Disp1依賴性分泌途徑[44],對此的解釋是:Disp1可以促進具有長距離和高活性信號轉導能力的活性Shh的組裝,而在短距離信號轉導中,非Disp1依賴的途徑被激活,可調控神經管腹側部分高濃度的Shh信號[40]。
3.2.3 硫酸乙酰肝素蛋白聚糖協助Shh 擴散
Shh沿著神經管背-腹軸的擴散受幾種細胞外蛋白的調節,這些蛋白可以與Shh配體結合,從而限制雙脂質修飾的Shh-N 的擴散,并改變其降解速率。硫酸乙酰肝素蛋白聚糖(heparan sulfate proteoglycan,HSPG)是細胞外基質的一種保守成分,被認為是調控Shh 擴散的胞外蛋白[45]。功能性HSPG 的形成依賴于由多種催化酶驅動的復雜翻譯后修飾過程,硫酸酯酶1作為催化過程中的關鍵酶,能夠催化HSPG的硫酸化,具有與高濃度的Shh蛋白和Nkx2.2(脊椎動物腹側神經管中的保守標記基因)相同的表達模式[45]。
3.2.4 神經祖細胞上的膜蛋白協助Shh 濃度梯度的建立
在Shh 從神經管腹側擴散到背側的過程中,其與幾種跨膜蛋白之間的相互作用被認為是協助其濃度梯度形成的不可忽略的因素(圖6)。根據這些跨膜蛋白對Shh 信號轉導的作用,可將其分為2 種類型:1)抑制性蛋白,包括Patch1 和Hhip1;2)促進性蛋白,包括Cdo、Boc(Cdo的同族)和Gas1[46-48]。
Patch1 在神經祖細胞膜上表達,是Shh 蛋白的受體,可通過螯合配體和促進配體降解的方式引起Shh信號的細胞自主性抑制[49]。隨著Shh蛋白在組織中的擴散,螯合作用會逐漸降低Shh配體的利用率,導致受體細胞接收到的Shh配體減少,從而使其信號轉導能力減弱[49]。當這些由Patch1 和Hhip1 介導的配體依賴性拮抗作用(ligand-dependent antagonism,LDA)被阻斷時,呈現出p0~p2 神經祖細胞的缺失及p3 和pMN 神經祖細胞的增加[49]。在Shh 配體擴散過程中,內吞作用和降解作用在遠離信號源的區域中增強,減弱了Shh信號的相對強度,與螯合作用一起維持Shh的濃度梯度[50]。
上述Shh信號的轉導和濃度梯度形成的調控機制都是通過細胞自主途徑進行的。然而,近年來的研究發現,Hhip1 存在通過硫酸乙酰肝素相互作用對Shh 信號轉導進行調控的非細胞自主抑制途徑[51]。這一發現表明,盡管Shh 在胚胎發育過程中的作用機制已被很好地理解,但仍可能存在其他調節Shh信號轉導的新機制。
針對作用于Shh信號轉導途徑的3種促進性蛋白Cdo、Boc和Gas1,它們能夠促進腹側細胞命運的決定,協助Shh 對腹側細胞圖式形成的調控。Cdo最初是在神經管的腹側中線外表達,并與底板特化有關,敲除小鼠的Cdo基因會導致底板細胞減少[48]。而Gas1基因的缺失會導致胚胎的神經管腹側細胞圖式的缺陷,并且這種缺陷在敲除Shh的胚胎中更為嚴重[47]。此外,Gas1-/-和Cdo-/-雙突變小鼠胚胎的底板、p3或pMN祖細胞域的缺失表明這2種蛋白對神經管發育具有協同作用[47]。Cdo、Boc和Gas1基因突變小鼠已經證實了這3種膜蛋白在神經管腹側細胞圖式形成中的必要性[46-48],并表明這3種蛋白可能在功能上存在相互補償作用[47-48]。同時,這3種蛋白的表達均受到Shh 信號的抑制作用,表明存在Shh信號的負反饋調節來為局部Shh濃度的波動提供補償機制,從而為形成和維持腹-背濃度梯度提供了一定程度的穩定作用。此外,還發現了一些分子(如Scube2)參與調節Shh的擴散以及濃度梯度的形成[52],但關于其功能的研究仍然有限。一個非常有趣的發現是,Scube2 可以在Shh 分泌細胞的細胞膜上與硫酸乙酰肝素形成釋放復合物,以協助Shh的分泌[52]。
由于有關Shh結合伴侶及其相應機制的大量研究都是基于腫瘤模型,因此,后續應更關注在神經管器官發生中驗證Shh 信號的這些已知結論,以對Shh 信號進行更全面的探究。此外,動物模型實驗和數學建模的結合將有助于對Shh濃度梯度的形成過程進行更好地概括。
3.3 Shh 信號的轉導和細胞應答
當Shh信號在神經管中形成從腹側到背側的濃度梯度后,神經前體細胞可以感知并響應Shh信號,從而產生整齊排列的腹側細胞圖式。其中,信號轉導和細胞應答的誘導是一個高度調節的過程,Shh配體的濃度和持續時間都可以參與神經前體細胞命運的調控。
3.3.1 細胞內信號轉導的開關——Smo 蛋白
在信號轉導的開始,胞外Shh 配體能夠與受體細胞上的跨膜蛋白Patch1 結合,從而解除對另一個跨膜蛋白Smo 的抑制作用[53]。隨后,Smo 的激活將細胞外Shh信號轉導過程與其細胞內信號轉導途徑的激活聯系起來(圖6)。Smo激動劑和拮抗劑在神經細胞中的協同應用表明,Smo 的逐級激活(階梯式)而不是漸進激活(連續式)可能是細胞對Shh 濃度梯度響應的重要機制[5]。
在脊椎動物中,纖毛對Shh細胞內信號轉導具有重要作用[54]。在沒有Shh信號的情況下,位于纖毛底部的Patch1受體會抑制Smo向胞內轉運,從而阻止下游信號激活。而當活性Shh配體與Patch1結合后,Patch1 會發生內化和降解,從而解除對Smo 的抑制作用,并進一步在初級纖毛膜上積聚更多的Smo[54]。
為了更好地理解Shh的細胞內信號轉導過程,仍需要對Smo激活后的下游機制做更多的研究。在過去的20年中,已經確定了位于Smo下游的幾個關鍵成分[54]。Cos2(Costal 2)是果蠅中一種與微管相關的驅動蛋白樣蛋白,可以直接與Smo的胞內結構域相互作用[55],在沒有Shh信號的情況下,Cos2可以阻斷Smo 下游的信號轉導。此外,Cos2 還可以激活Gli(glioma-associated oncogene)家族鋅指蛋白直系同源物Ci(cubitus interruptus),這是Shh轉錄激活功能所需的細胞質鋅指蛋白[56]。但是,脊椎動物中的2 個Cos2直系同源基因Kif和Kif27似乎并不參與Shh信號轉導。在哺乳動物細胞中使用shRNA進行的敲低實驗進一步支持了這種差異[57],表明哺乳動物中Cos2相關蛋白的功能與Shh信號轉導無關,這可能是因為脊椎動物的Smo含有與果蠅的Smo截然不同的Cos2相互作用的結構域。然而,在某些脊椎動物(如斑馬魚)中,通過對反義嗎啉代(morpholino)寡核苷酸介導的Kif7(Cos2直系同源物)的敲低實驗發現,Kif7-KD魚系與野生型斑馬魚之間存在一定差異[58]。類似地,當通過抑制Gli 入核及調節基因表達時,Sufu(suppressor of fused)可以與Cos2 一起發揮作用,進一步抑制下游信號的轉導[59]。
3.3.2 分級Gli 活性介導分級Shh 信號的轉導
Shh信號通過Smo在細胞內進行轉導后,能夠催化不同類型的Gli作為轉錄因子進入細胞核并調節基因表達,以實現Shh信號對細胞命運的調控作用[56](圖6)。在脊椎動物中,介導Shh 信號轉導的Gli 有3種(Gli1~Gli3)[60-61]:Gli1為依賴于Shh信號的促進型轉錄因子;Gli3能夠抑制Shh信號的轉導和相關基因的表達;與Gli1和Gli3不同,Gli2具有強大的基因激活和抑制功能,作為促進型轉錄因子,Gli2能夠被催化成抑制形式,但其阻遏物活性不受Shh的調節,從而具有獨立的抑制Shh信號轉導的能力[60]。目前的實驗表明,Gli2 在神經管中的主要作用是激活性的,在Gli2-/-小鼠胚胎中,神經管腹側,尤其是底板中的細胞類型受到嚴重破壞[61]。Gli3 在Shh 信號轉導中起劑量依賴性的轉錄抑制子的作用,在Gli3突變體小鼠中觀察到神經管細胞強烈的腹側化表型,這支持了Gli3對Shh信號轉導具有抑制作用的結論[62]。
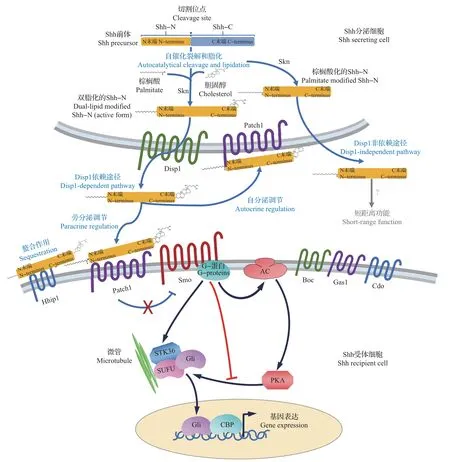
圖6 Shh信號的產生、分泌和轉導Fig.6 Production,secretion and transduction of Shh signaling
在Shh 配體濃度梯度作用下,在神經管中也誘導出了相似的Gli濃度梯度[63],這種濃度梯度對于腹側細胞圖式的產生是必需的。功能獲得實驗進一步支持了這一結論,該實驗通過逐漸改變Gli 的活性成功地重現了部分背-腹圖式[64]。
3.3.3 Shh 信號的時間調控機制
與BMP相似,神經管腹側圖式的精確形成不僅取決于Shh 的濃度梯度,還與細胞暴露于Shh 配體的階段和持續時間有關[5,49,64]。2007 年,DESSAUD等[5]提出了Shh調控神經管背-腹圖式形成的時間模型,該模型結合了Shh 信號的濃度作用和持續時間作用,認為受體細胞的敏感性將經歷逐漸降低的過程。最初,由于細胞對Shh配體具有高敏感度,所以較低的Shh濃度即可激活足夠水平的Gli活性,以用于調控基因表達和細胞命運決定。而隨著神經管的發育,脫敏的神經祖細胞在與初始階段相同的Shh濃度作用下只能誘導較低的細胞反應。在這種機制的作用下,相同濃度的Shh 信號實現了在不同的發育階段誘導出不同細胞命運的能力[65]。該模型和脫敏假設獲得了Patch1 響應實驗的支持:在Shh的誘導下,反應細胞傾向于表達更多的抑制性蛋白,如Patch1[66],而為了補償這些抑制性相互作用以實現正常的信號轉導和細胞反應,就需要更高濃度的Shh配體[5]。
4 神經管類器官的研究與應用現狀
類器官是在體外構建的含有多種器官特異性細胞類型的自組織結構,并具有相應器官的特定功能。近年來,類器官技術發展迅速,已成為研究器官發育、信號調控和疾病發生的重要手段。類器官通常由胚胎干細胞、器官祖細胞或誘導性多能干細胞組織并分化而成。目前比較成熟的類型包括腦、腸、肝、胰和上皮類器官等,已廣泛應用于發育生物學探索和疾病研究。
近年來,神經系統類器官廣泛發展,并被應用于神經發生和疾病方面的研究。2013 年建立的利用hPSC 誘導神經類器官的培養系統,部分真實地再現了人類大腦的發育和組織過程[67],同時,該培養系統將神經系統類器官從傳統的二維組織培養體系轉變為復雜的三維細胞培養系統,實現了對體內環境的較好模擬。其他培養方式包括培養具有早期神經命運的類器官球、無血清培養的類胚體樣聚集體(SFEBq)等,以及LANCASTER 實驗室構建的最新的腦類器官培養體系及其進一步的改進,都能夠獲得極為復雜的三維結構,甚至是培養出難以通過離體獲得的星形膠質命運的細胞[67-70]。對于神經管這樣一個模式化且復雜的重要結構,其類器官的培養經歷了不斷發展的過程,然而培養出能夠重現體內類似的細胞空間分布(每種細胞類型和細胞外基質沿著3個體軸位于其對應的位置處)的類器官已成為目前整個類器官技術發展所面臨的棘手挑戰。
2013年初,SASAI提出了一個想法:為通過細胞自組織培養的三維類器官提供與在胚胎發育過程中位置和濃度相同的形態素,以誘導具有更高體內類似性的類器官模型[71]。令人高興的是,近年來,對形態素濃度梯度的深入研究和先進生物工程技術的發展,為克服這一挑戰提供了樂觀的前景。例如:將含有不同濃度形態素的微珠遞送至特定區域來實現在單細胞水平上誘導不對稱的干細胞分裂[72],或是利用微流體裝置在類器官中產生時空可調節的形態素濃度梯度,以及通過模擬Shh和BMP的反平行濃度梯度和其他2個相關信號(Wnt和視黃酸)的轉導,以在小鼠胚胎干細胞的不同區域誘導不同類型的神經細胞命運[73]。這些技術為人們以正確的方式誘導特定細胞的自組織提供了足夠的信心。除了利用這些技術,最近,CEDERQUIST 等使用能夠誘導表達Shh的轉基因hPSC模擬信號源,利用產生并擴散的Shh 在類器官中形成了適當的濃度梯度,并在這種Shh 濃度梯度下成功地誘導了具有高度體內相似性細胞命運和空間排布的獨特的人前腦類器官[8](圖7)。

圖7 利用Shh濃度梯度體外指導前腦類器官的形成示意圖Fig.7 Schematic description of applying Shh concentration gradient to instruct forebrain organoid formation in vitro
5 小結與展望
本綜述主要總結了2 個關鍵的形態素(BMP 和Shh)在脊椎動物神經管背-腹圖式形成過程中的作用。在神經管形成過程中,位于神經管最背側區域的頂板分泌的BMP 及位于腹側的脊索和底板分泌的Shh形成反平行濃度梯度,以誘導背-腹圖式的形成。Shh 可以通過分泌、擴散和降解的不同調控機制形成腹-背濃度梯度,而BMP 的背-腹濃度梯度的形成和維持方式尚待確定。建立濃度梯度后,這2個形態素都可以通過時空調節機制和相應的信號轉導途徑進一步調控細胞命運。近年來,越來越多的體內研究揭示了形態素濃度梯度在器官發生中的作用,并被逐步應用于構建類器官的研究中。
然而,要真正通過構建形態素濃度梯度模仿生物體發育過程并進行深入研究仍然存在一些挑戰。第一,基于當前的技術,在特定時間和特定位置直接測量體內形態素的絕對濃度非常困難;第二,要在體外建立適當的形態素濃度梯度,不僅要考慮形態素的產生,還要考慮其擴散和降解;第三,由自組織產生的極高局部濃度極大地增加了形態素濃度梯度的復雜性;第四,由于細胞圖式的產生不僅依賴于形態素的空間調節,還與暴露于形態素的時間相關,因此,對細胞的誘導時間需要精確控制;第五,對于某些形態素(如BMP),圖式的誘導可能依賴于由不同配體組合成的二聚體,并且對于不同的二聚體,其功能是否依賴于濃度梯度仍有待驗證。但我們相信,利用形態素濃度梯度并結合三維打印等生物工程方法是指導胚胎干細胞或誘導多能干細胞在體外產生具有正確結構和功能的類器官的最有前景的策略,克服這些挑戰必將大力推動整個發育生物學和再生醫學的發展。

