含鐵氰化物和亞鐵氰化物及草酸鹽混合廢水的處理
袁 琦,仇雅麗,賴 浪,胡 琴,劉勇奇,鞏勤學,劉更好
(湖南邦普循環科技有限公司,湖南 長沙 410600)
氰化物經常以不同形式存在于如電鍍、冶金、焦化、金屬加工等多種工業廢水中。因其對人體及自然水體生態系統的毒害性,國家在污水綜合排放標準(GB8978-1996)中規定一般企業排放污水中總氰化物濃度不得超過0.5 mg/L[1]。目前處理氰化物的方法主要有化學氧化法、物理化學法、生物處理法、自然降解法、高壓水解法、膜分離法、輻射法及離子交換法等[2]。在不同形態的氰化物中,與金屬離子絡合的氰化物如鐵氰化物、亞鐵氰化物等毒性相對較小,有著極強的穩定性,一般的化學氧化方法很難將其去除,生物處理法中的微生物也很難將其分解[3]。若這些含氰絡合物進入復雜環境水體中,遇到稀酸或者更強的絡合劑,則會發生反應釋放劇毒的CN-。因此尋求經濟且高效的鐵氰化物、亞鐵氰化物的處理方法,是目前眾多學者研究的重點。
草酸在化工、醫藥行業中常被用作絡合劑、還原劑等,其在廢水中以有機物形式影響廢水的COD。有機物也是廢水處理中經常被關注的對象。常規處理有機物的方法有化學氧化法[4]、物理吸附法[5]、生物處理法[6]等。但一般化學氧化法和物理吸附法處理成本較高,生物法處理周期較長,尤其當廢水中含有氰化物或重金屬等抑制微生物的生長的成分時,生物法處理有機物的效率較低。
本文針對鐵氰化物和草酸鹽混合的化工廢水,設計一套技術方案,為后期鐵氰化物和草酸鹽混合的化工廢水處理產業化提供重要的參考意義。
1 實驗部分
1.1 實驗用水及特性
1.2 試劑與儀器
試劑:FeSO4·7H2O(AR);Ca(OH)2(AR);NaOH(AR);濃H2SO4(AR);Na2SO3(AR)。
儀器:A3AFG火焰原子吸收光譜儀,普析;5B-3C(V8))COD快速測定儀,連華科技;5B-1(V8)智能多參數消解儀,連華科技;PHS-3CpH計;JHS-1電子恒速攪拌機、SHZ-88水浴恒溫振蕩器;分析天平,梅特勒。
1.3 分析方法
總氰化物含量測定采用硝酸銀容量法[7],COD測定用分光光度法[8],Mn2+含量測定用火焰原子吸收分光光度法[9]。
1.4 處理工藝及方法

圖1 處理工藝流程圖Fig.1 Process flow chart of treatment
具體實驗方法:取一定體積的含鐵氰化物和亞鐵氰化物及草酸鹽的混合廢水,在室溫下往其中加入適量的Ca(OH)2固體,攪拌反應1 h,絮凝沉淀過濾。取一定體積的濾液,往其中加入稀硫酸調節濾液pH,然后再往其中加入適量的FeSO4·7H2O固體,攪拌反應0.5 h,絮凝沉淀過濾。取濾液進行分析。
2 結果與討論
2.1 重金屬和COD聯合處理實驗
根據草酸根離子的性質,使用Ca(OH)2固體對含鐵氰化物和亞鐵氰化物及草酸鹽的混合廢水中草酸根離子和重金屬離子進行處理,重點研究了Ca(OH)2投加量對反應后濾液中COD和Mn2+濃度的影響。其結果分別如圖2和如圖3所示。

圖2 Ca(OH)2投加量對反應后濾液中COD的影響Fig.2 The influence of Ca(OH)2 dosage on COD in filtrate after reaction

圖3 Ca(OH)2投加量對反應后濾液中Mn2+含量的影響Fig.3 The influence of Ca(OH)2 dosage on the content of Mn2+ in the filtrate after reaction

從圖3可以看出,廢水中的Mn2+與添加的Ca(OH)2固體作用非常明顯。當Ca(OH)2投加量僅為10 g/L時,反應后濾液中的Mn2+濃度可降至0.5 mg/L以下,Mn2+的去除率接近100%。在堿性條件下,廢水中的Mn2+可與游離的OH-結合,生成難溶于水的Mn(OH)2沉淀,從而達到去除重金屬離子的目的。
從去除效率與處理成本考慮,針對COD在2000~2500 mg/L的含鐵氰化物、亞鐵氰化物及草酸鹽混合廢水,優選Ca(OH)2投加量為40 g/L。經過此投加量的Ca(OH)2處理后,濾液中COD在500 mg/L以下,Mn2+濃度在0.5 mg/L以下。
2.2 鐵氰化物和亞鐵氰化物處理實驗
根據Fe(CN)63-、Fe(CN)64-的特性,選擇使用FeSO4·7H2O固體對廢水中的鐵氰化物和亞鐵氰化物進行處理。谷芳芳等[10]對含鐵氰化物和亞鐵氰化物廢水處理的研究,是先調節pH至10,然后加入適量亞硫酸鈉攪拌反應30 min,再加入適量硫酸亞鐵,調節pH至6~7,加熱至50~60 ℃攪拌反應30 min,最后靜置。本實驗在此基礎上,研究亞硫酸鈉投加量和溫度以及FeSO4·7H2O固體投加量對廢水中鐵氰化物和亞鐵氰化物處理的影響。
2.2.1 亞硫酸鈉投加量的影響
調節經40 g/L氫氧化鈣處理后的濾液的pH,改變亞硫酸鈉固體投加量,投加過量FeSO4·7H2O固體,在55 ℃進行反應,平行量取4個水樣進行實驗,反應完成后過濾,檢測濾液中的總氰化物含量。實驗結果如表1所示。
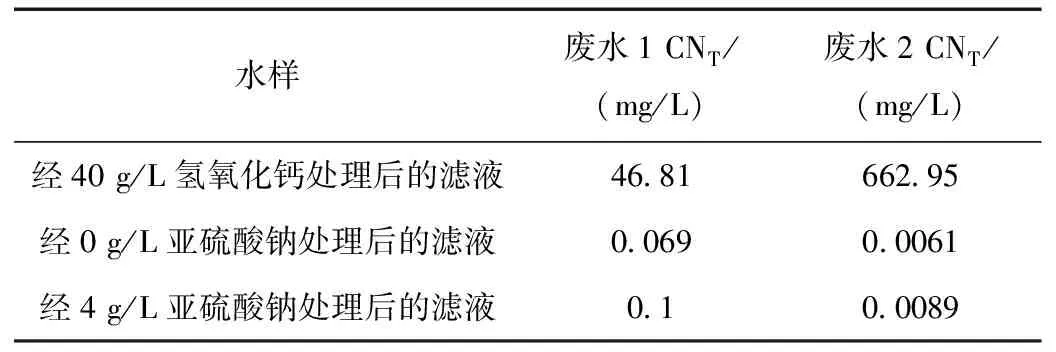
表1 亞硫酸鈉投加量對鐵氰化物和亞鐵氰化物處理的影響Table 1 The influence of sodium sulfite dosage on the treatment of ferricyanide and ferrocyanide

2.2.2 溫度的影響
調節經40 g/L氫氧化鈣處理后的濾液的pH至6~7,投加過量FeSO4·7H2O固體,改變溫度進行反應,平行量取2個水樣進行實驗,反應完成后過濾,檢測濾液中的總氰化物含量。實驗結果如表2所示。

表2 溫度對鐵氰化物和亞鐵氰化物處理的影響Table 2 The influence of temperature on the treatment of ferricyanide and ferrocyanide
從表2中可以看出,在FeSO4·7H2O固體投加過量,Fe2+與 Fe(CN)63-、Fe(CN)64-充分結合的情況下,常溫條件下攪拌也能使高氰化物濃度的廢水中氰化物被處理至0.5 mg/L以下。考慮廢水實際處理成本的問題,后續實驗在常溫條件下進行。
2.2.3 硫酸亞鐵投加量的影響
調節經40 g/L氫氧化鈣處理后的濾液的pH至6~7,改變FeSO4·7H2O固體的投加量,常溫條件下進行反應,平行量取3個水樣進行實驗,反應完成后過濾,檢測濾液中的總氰化物含量。實驗結果如圖4所示。
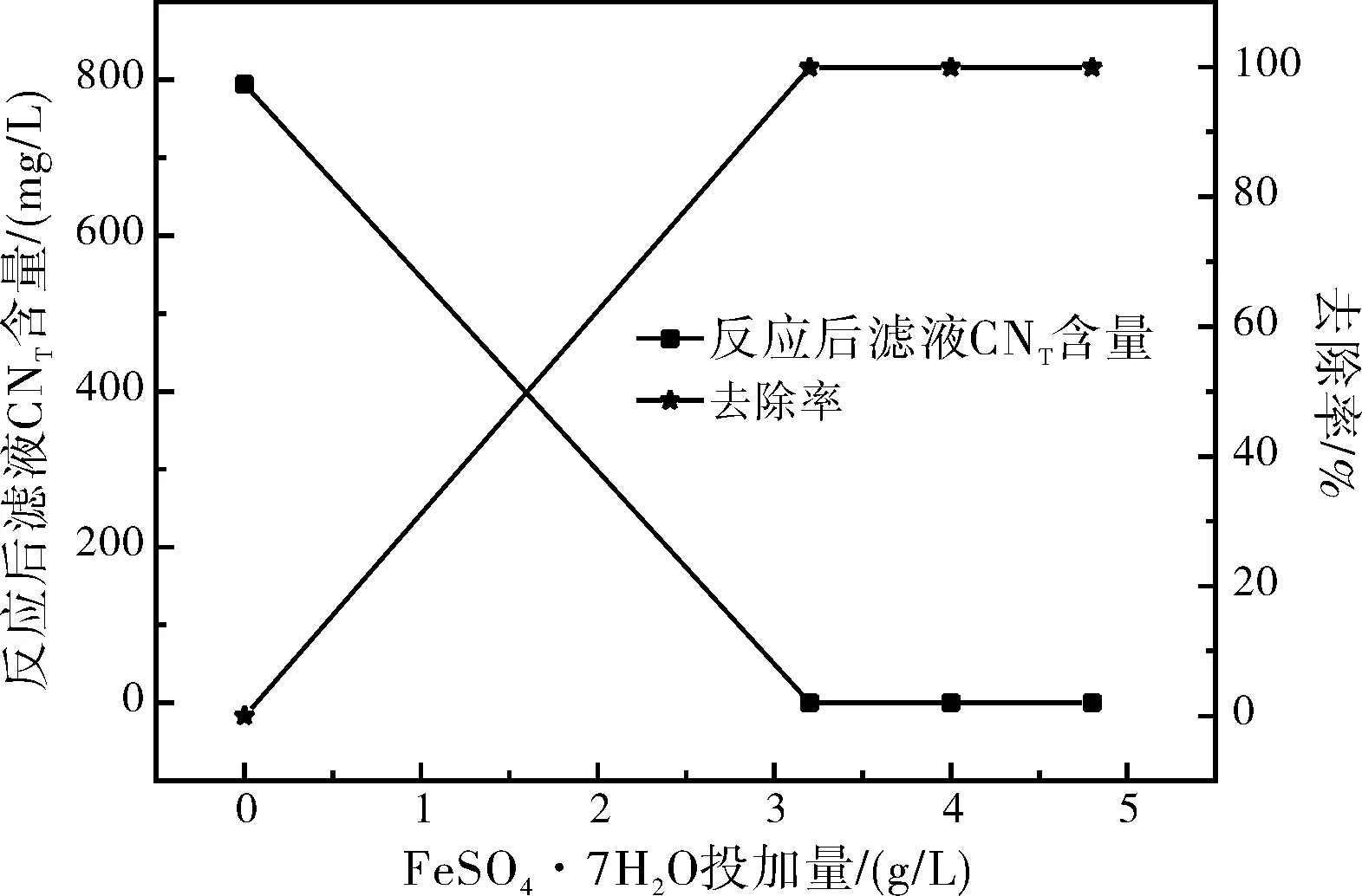
圖4 FeSO4·7H2O投加量對反應后濾液中CNT含量的影響Fig.4 The effect of FeSO4·7H2O dosage on the content of CNT in the filtrate after the reaction

3 結 論
本處理工藝可在常溫常壓的條件下,通過40 g/L的Ca(OH)2固體同時處理含鐵氰化物和亞鐵氰化物及草酸鹽的混合廢水中COD和重金屬離子,3.2 g/L的FeSO4·7H2O固體處理廢水中的鐵氰化物和亞鐵氰化物,使廢水滿足污水綜合排放標準(GB8978-1996)中COD<500 mg/L、Mn2+<1 mg/L、 CNT<0.5 mg/L的排放要求。

