化學實驗易錯試題分析及變式練習
湖南 戴儒儉 田萬福
【易錯典例1】
1.下列操作能達到實驗目的的是
( )
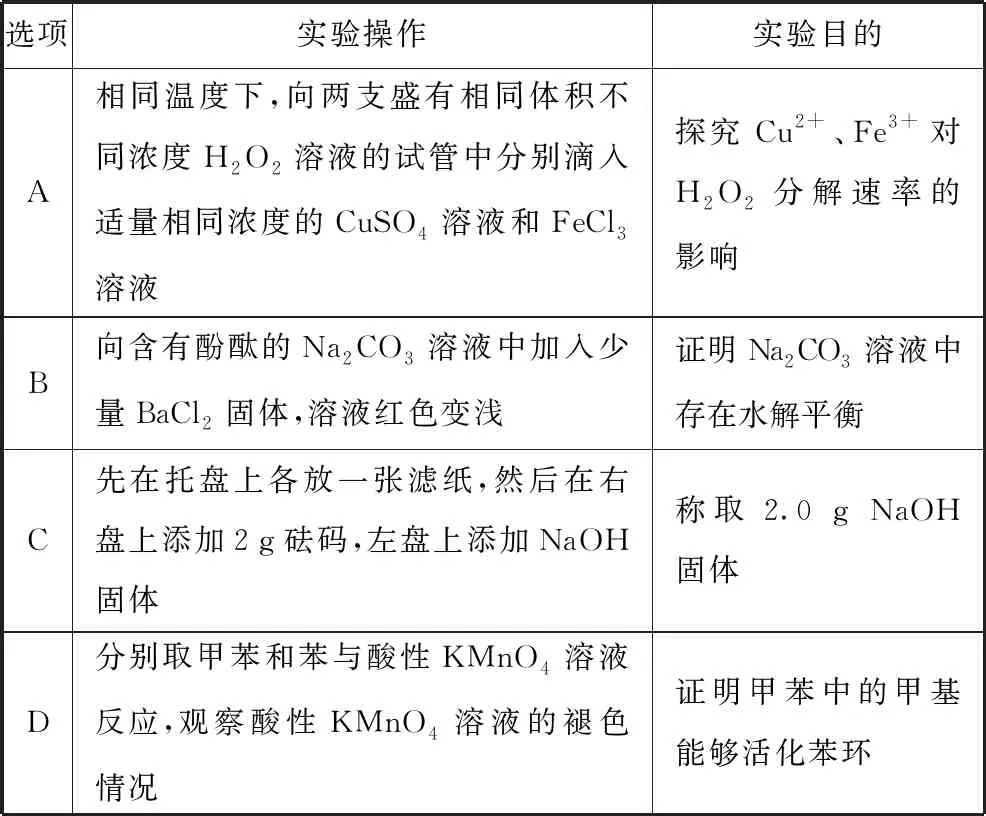
表1
【參考答案】B

【錯題人數】選A 8人次;選C 13人次;選D 25人次
【易錯點撥】D選項,烷烴基不能被酸性高錳酸鉀氧化,但是烷烴基連接苯環后,且與苯環相連的碳上有氫,烷烴基將被氧化成羧基,體現了苯環對烷烴基的影響。烷烴基對苯環的影響主要體現在,苯環上有了烷烴基后,鄰位和對位容易發生取代反應。
【要點梳理】烷烴基與苯環的相互影響關系
1.“控制變量”思想在“探究影響化學反應速率因素”中的應用可能結合探究型化學實驗題進一步綜合考查
(1)確定變量。解答此類題目時,要認真審題,清楚實驗目的,弄清要探究的外界條件有哪些。
(2)控制變量。在探究時,應先確定一個變化的量,控制其他量不變,研究這個變化量對實驗結果的影響進而總結出影響規律,然后用同樣的方法再進一步確定其他變量對實驗結果的影響規律。
(3)數據有效。解答時應注意選擇數據(或設置實驗)要有效,且變量統一,否則無法做出正確判斷。
2.建立化學平衡的觀點,用平衡的觀點解釋現象
3.常見的化學實驗
(1)以實驗基本操作的正誤判斷為載體,考查藥品保存、氣體凈化、儀器使用和實驗安全等內容
(2)以不同實驗的裝置圖為載體,考查物質性質、實驗操作、制備裝置等內容
(3)以表格形式進行考查,具體的考查角度包括實驗目的、實驗操作、實驗現象和實驗結論中的兩項或三項
4.化學變化之間相互影響的邏輯關系
【變式練習組1】
1.實驗探究乙醛溶液和新制氫氧化銅反應的有關信息,記錄如下:
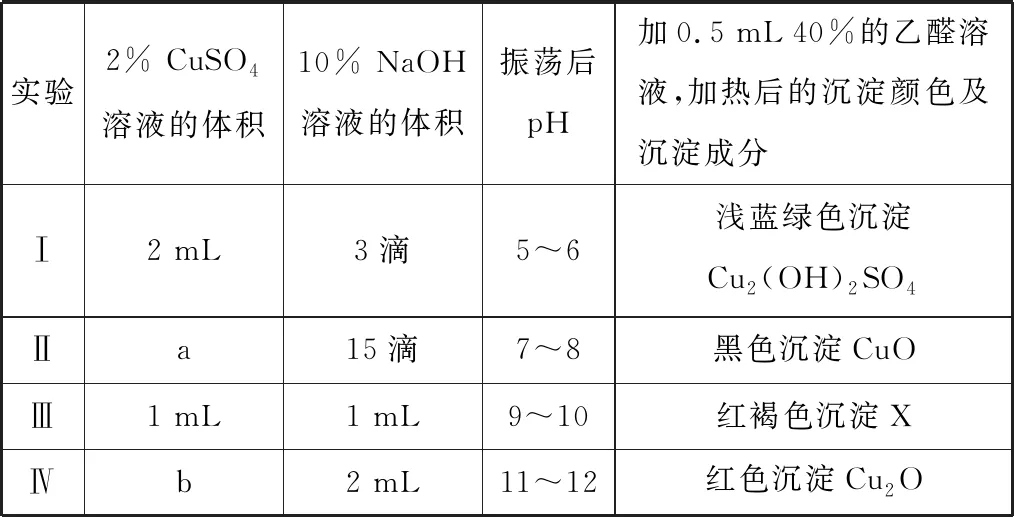
表2
下列推斷錯誤的是
( )
A.a、b應為2 mL、1 mL
B.實驗Ⅱ中部分乙醛被氧化
C.X可能是CuO和Cu2O的混合物
D.實驗表明,在pH>11時可檢測出醛
【參考答案】B
【解題思路】實驗探究氫氧化鈉用量對反應產物的影響,實驗Ⅰ和Ⅱ、實驗Ⅲ和Ⅳ中氫氧化鈉的量不同則硫酸銅的量必須相同,故a、b應為2 mL、1 mL,A項正確;實驗Ⅱ中氫氧化鈉用量逐漸增多,產生氫氧化銅,若氫氧化銅一部分和乙醛反應則會生成紅色氧化亞銅,若一部分受熱分解生成黑色氧化銅,實驗中沉淀成分為黑色氧化銅,說明乙醛未參加反應,B項錯誤;X為紅褐色沉淀,可能是黑色CuO和紅色Cu2O的混合物,C項正確;由實驗Ⅳ可知生成紅色氧化亞銅沉淀,此時pH為11~12,則Cu(OH)2氧化乙醛,溶液應pH>11,D項正確。
2.下列方案設計、現象和結論都正確的是
( )
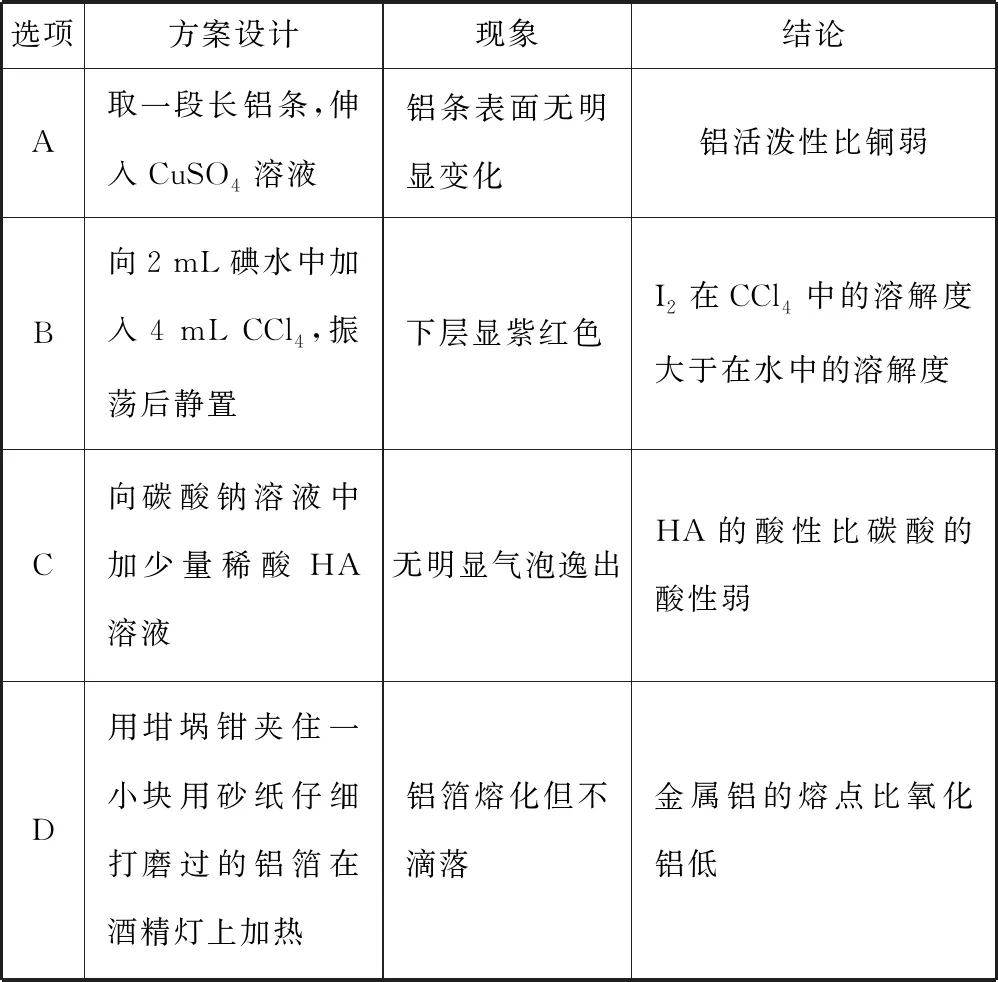
表3
【參考答案】D
【解題思路】鋁的活潑性大于銅,取一段長鋁條,伸入CuSO4溶液,鋁條表面無明顯變化,是因為鋁表面有一層氧化膜,故A項錯誤;向2 mL碘水中加入4 mL CCl4,振蕩后靜置,形成碘的CCl4溶液的濃度比碘水的濃度還小,所以下層溶液不可能顯紫紅色,故B項錯誤;向碳酸鈉溶液中加過量稀酸HA溶液,無明顯氣泡逸出,才能證明HA的酸性比碳酸的酸性弱,故C項錯誤;用砂紙仔細打磨過的鋁箔在酒精燈上加熱,表面馬上會生成三氧化二鋁,鋁箔熔化但不滴落說明表面的三氧化二鋁的熔點高于單質鋁,故D項正確。
3.(湖南師大附中月考)下列實驗操作、實驗現象、解釋或結論都正確且有因果關系的是
( )
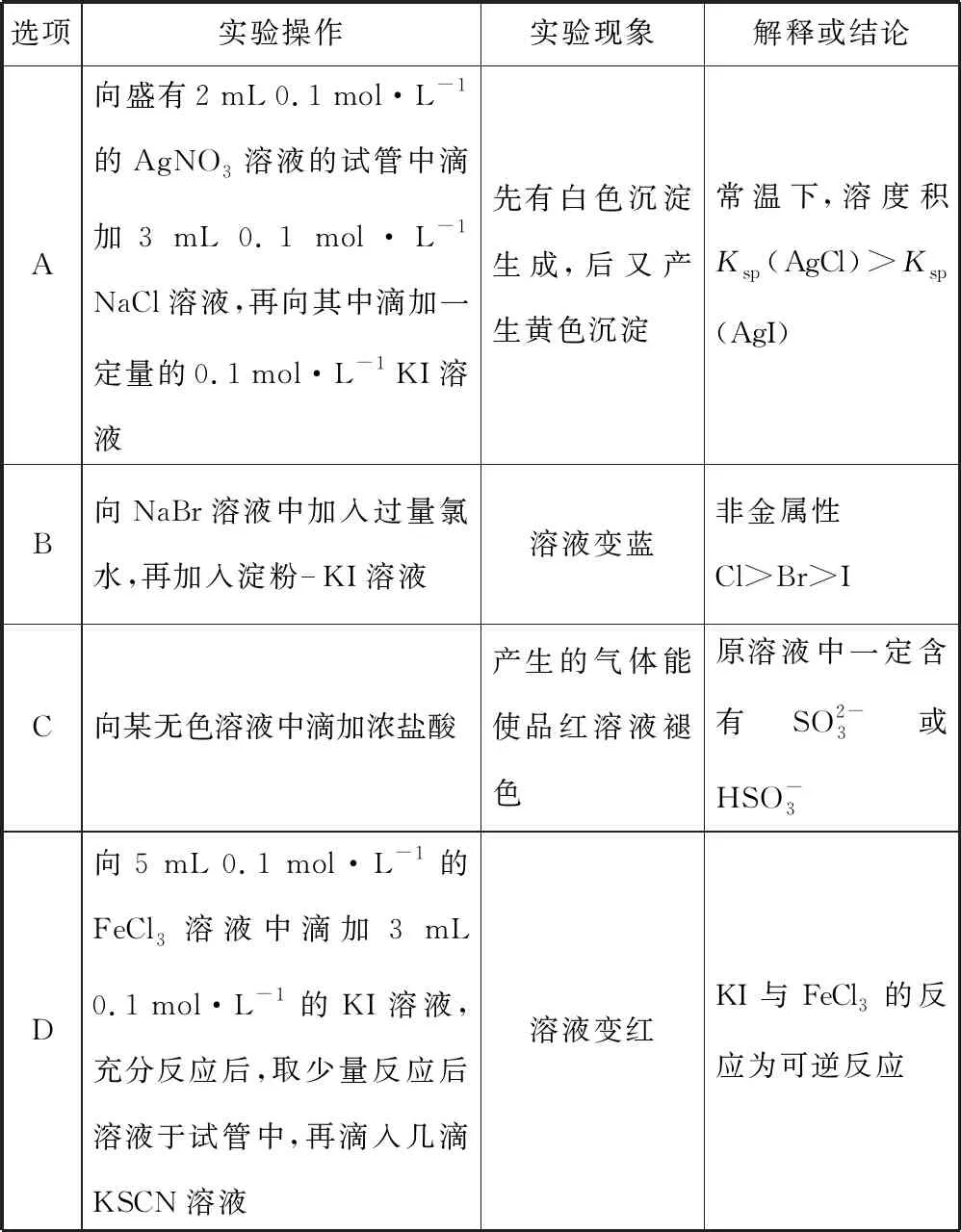
表4
【參考答案】A

【變式練習2】
1.關于下列各實驗裝置的敘述中,不正確的是
( )
A.裝置①:a口進氣可收集CO2,b口進氣可收集NH3
B.裝置②:配制一定物質的量濃度溶液時,轉移溶液
C.裝置③:模擬鐵銹蝕
D.裝置④:證明CH3CH2OH發生消去反應生成了乙烯
【參考答案】AD
【解題思路】CO2的密度大于空氣的,收集時應該是b進a出,A項不正確;B項正確;左邊是析氫腐蝕,生成氫氣壓強變大,右邊是吸氧腐蝕,吸收氧氣,壓強變小,紅墨水兩邊因為壓強差出現高低不同,C項正確;④是溴乙烷的消去反應,乙醇揮發能使高錳酸鉀溶液褪色,D項不正確。
2.某實驗小組進行濃硫酸和銅的反應并對反應產物進行探究,下列裝置或操作正確的是
( )
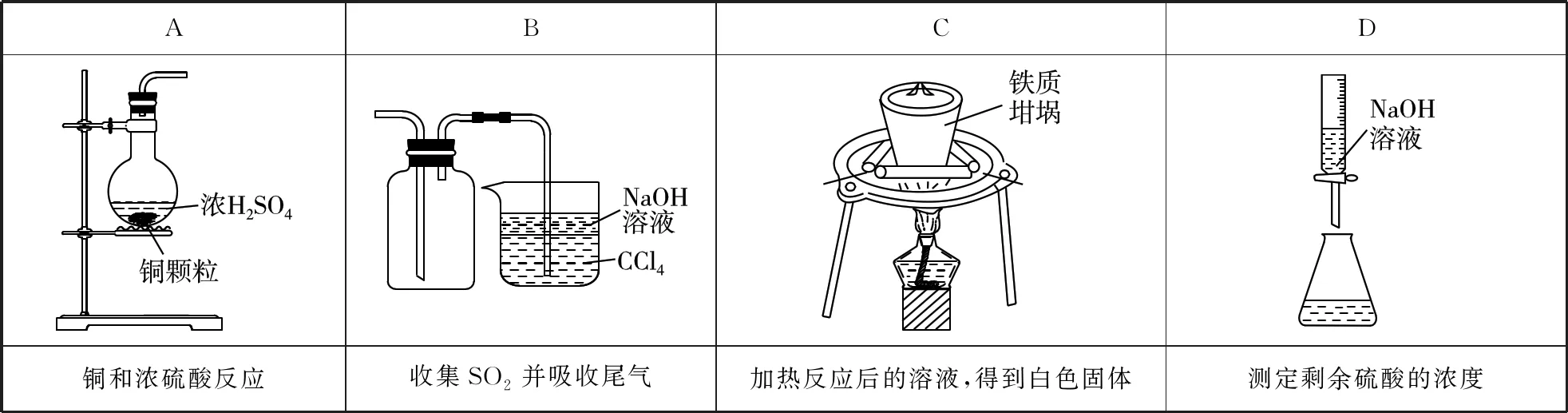
表5
【參考答案】B
【解題思路】銅與濃硫酸反應需加熱,故A項錯誤;SO2的密度比空氣的密度大,集氣瓶中導管長管進短管出,且SO2不溶于四氯化碳,但溶于NaOH溶液,則該裝置能收集二氧化硫并吸收尾氣,且有防倒吸作用,故B項正確;加熱CuSO4溶液應在蒸發皿中進行,膽礬失水得到CuSO4晶體在坩堝中進行,故C項錯誤;測定剩余硫酸的濃度應用堿液進行滴定,NaOH溶液為堿性溶液,應用堿式滴定管盛裝,故D項錯誤。
3.(湖南師大附中月考)用下列實驗裝置能達到相關實驗目的的是
( )
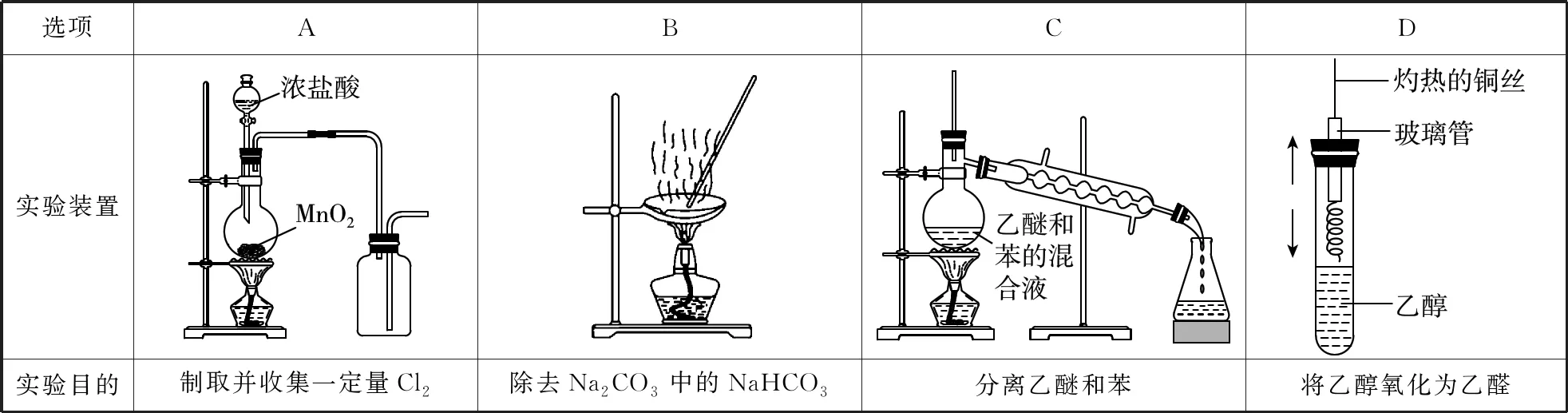
表6
【參考答案】D
【解題思路】氯氣的密度比空氣密度大,應長導管進氣收集,A項錯誤;圖中為蒸發裝置,應在坩堝中加熱除去碳酸氫鈉,B項錯誤;乙醚的易燃燒,不能用明火加熱蒸餾,最好用熱水浴,C項錯誤;上下移動銅絲可控制反應的發生和停止,乙醇可催化氧化生成乙醛,圖中裝置合理,D項正確。
【易錯典例2】利用如表7中所示裝置進行實驗,將液體X逐滴加入到固體Y中。下列有關實驗現象或結論正確的是
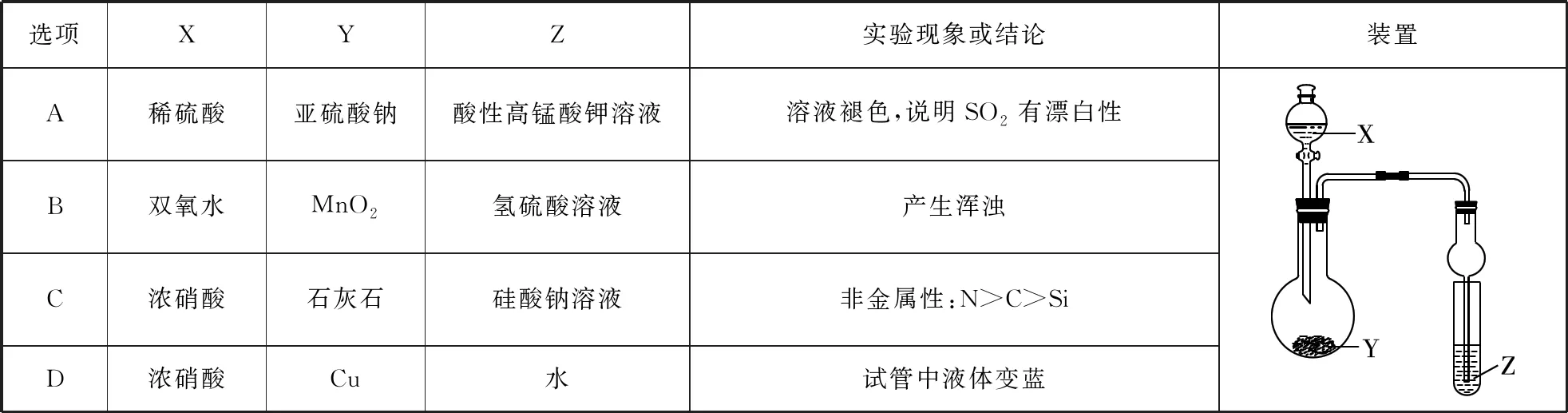
表7
( )
【參考答案】B
【解題思路】酸性高錳酸鉀有強氧化性,二氧化硫使酸性高錳酸鉀溶液褪色,是基于二氧化硫的還原性,A項錯誤;二氧化錳催化過氧化氫分解生成氧氣,氧氣可氧化氫硫酸反應生成單質硫,則產生渾濁,故B項正確;濃硝酸易揮發,濃硝酸與硅酸鈉反應,二氧化碳中混有硝酸,在有硝酸干擾的情況下,不足以說明碳酸的酸性一定強于硅酸,也就不能比較C、Si的非金屬性,故C項錯誤;Cu與濃硝酸反應生成二氧化氮,二氧化氮與水反應生成硝酸和NO,則試管中液體為無色,故D項錯誤。
【錯題人數】選A 3人次;選C 12人次;選D 15人次
【易錯點撥】整套裝置包括氣體的制備,氣體性質檢驗,需要對氣體制備的反應條件精準掌握并記牢,減少失誤。在沒有進行洗氣除雜的情況下,科學分析可能存在的雜質對性質的檢驗的影響;對性質要理解透徹,避免機械記憶。
錯選A項,多為學生對二氧化硫漂白性記憶不準確,理解不深刻,二氧化硫漂白性只是針對某些特定有色物質且生成的是不穩定的無色物質,具有可逆性;錯選C項,是因為學生忽視硝酸的揮發性,導致低級錯誤出現;D項是因為圓底燒瓶中發生銅與硝酸的反應生成藍色銅離子,試管中液體為二氧化氮吸收液,無藍色銅離子,學生審題理解辨識出錯。
【要點梳理】
1.氣體制備實驗的基本思路
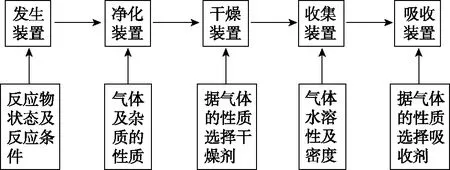
圖2
2.重要氣體的發生裝置
依據制備氣體所需的反應物狀態和反應條件,可將制備氣體的發生裝置分為三類:
制備氣體:O2、NH3、CH4等。
發生裝置:
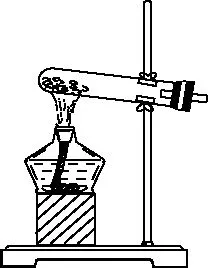
制備氣體:Cl2、C2H4等。
發生裝置:
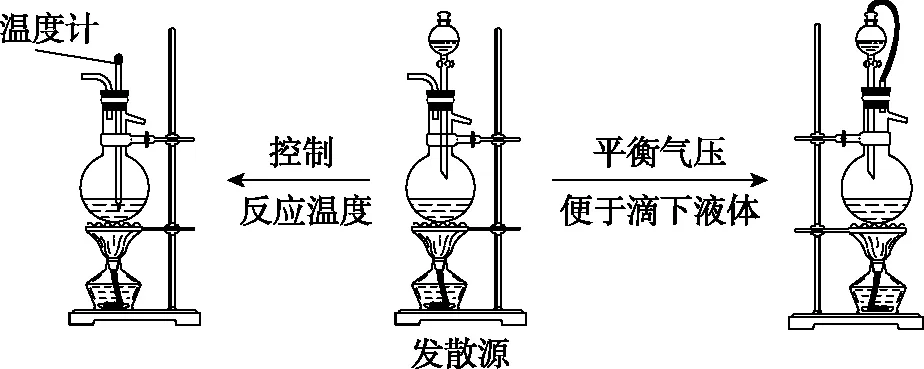
發生裝置:
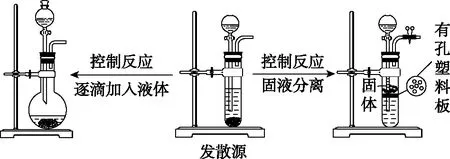
制備氣體:選擇合適的藥品和裝置能制取中學化學中常見的氣體。
【變式練習】
1.利用如圖3所示裝置將①中溶液滴入②中,現象與結論不相符的是
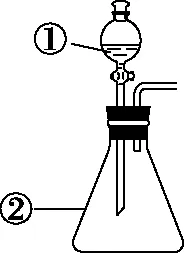
圖3
( )
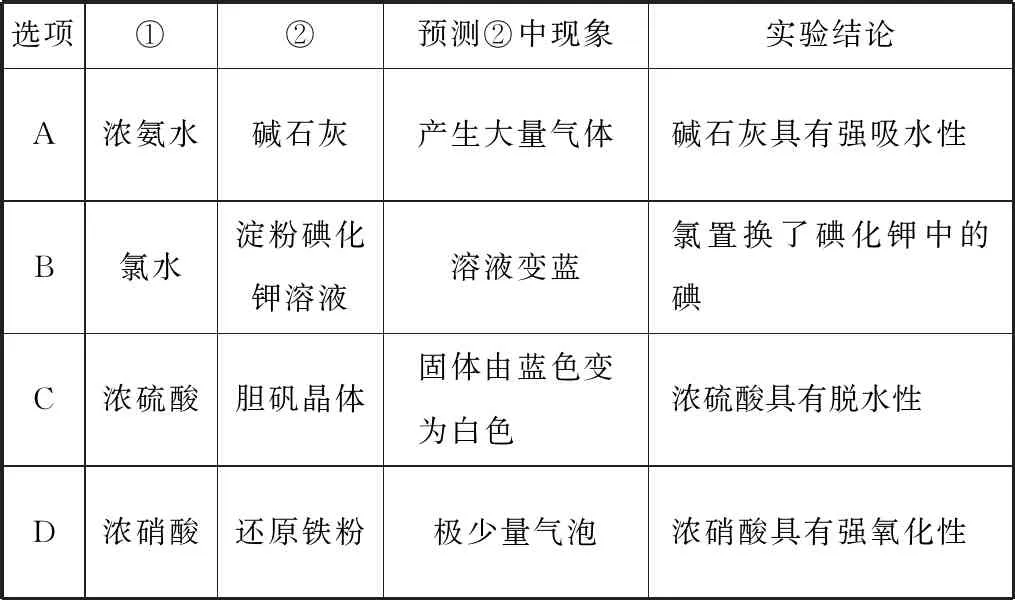
表8
【參考答案】C
【解題思路】濃氨水滴入堿石灰中產生的大量氣體為氨氣,因為堿石灰中CaO與NaOH固體溶于水放出大量熱量且溶液呈強堿性,既抑制氨分子溶于水又使體系溫度升高將氨氣蒸出,所以A項正確;碘化鉀中的碘元素為負一價,被氯所置換生成0價碘單質與氯化鉀,淀粉遇到碘單質變藍色,故B項正確;膽礬即CuSO4·5H2O,為藍色晶體,膽礬遇到濃硫酸后失去結晶水,變為白色無水CuSO4,體現濃硫酸的吸水性,故C項現象與結論不相符;常溫下,濃硝酸遇到還原性鐵粉發生鈍化,故D項正確。本題C項誤選,是學生對濃硫酸的吸水性與脫水性混淆或認識模糊導致的,濃硫酸的脫水性針對含C、H、O的有機物,如含纖維素的紙張,紙張遇到濃硫酸后分子內的H、O元素按2∶1的原子個數比被脫去生成水,脫水后紙張碳化變黑;而吸水性指存在由濕變干的過程,即以水分子形式被濃硫酸吸走。
2.如表9中裝置可用于制取、提純并收集表格中的四種氣體(a、b、c表示相應儀器中加入的試劑),其中可行的是
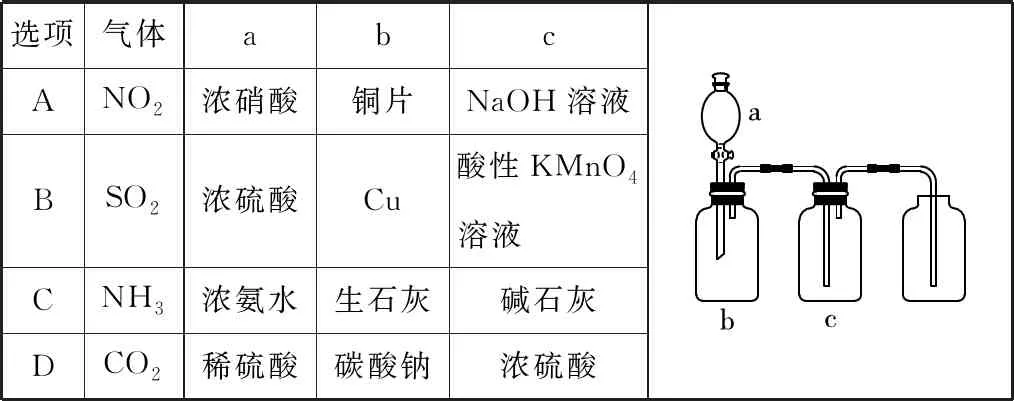
表9
( )
【參考答案】D
【解題思路】該裝置屬于固液混合不加熱型制氣體裝置,所以制取氣體時不能加熱、反應物是固體和液體,洗氣裝置中物質和氣體不反應,且為液體,采用向上排空氣法收集,說明該氣體密度大于空氣且常溫下和氧氣不反應,銅和濃硝酸反應生成二氧化氮,但二氧化氮和NaOH反應,所以C裝置中不能是NaOH溶液,故A項錯誤;濃硫酸和銅反應制取二氧化硫需要加熱,該裝置沒有酒精燈,故B項錯誤;氨氣密度比空氣小,能用向下排空氣法收集,與該裝置不符,故C項錯誤;碳酸鈉和稀硫酸反應制取二氧化碳時是固液混合且不需加熱的反應,濃硫酸具有吸水性且和二氧化碳不反應,故D項正確。
該裝置屬于固液混合不加熱型裝置,所以制取氣體時不能加熱、反應物是固體和液體,洗氣裝置中物質和氣體不反應,且為液體,采用向上排空氣法收集,說明該氣體密度大于空氣且常溫下和氧氣不反應,據此分析解答.本題考查氣體的制取、收集,根據物質狀態和反應條件確定反應裝置,根據氣體的性質及密度確定收集裝置,熟練掌握氯氣、氨氣的制取和收集、檢驗,題目難度不大.
【易錯典例3】(八省八校一聯)(不定項選擇題)常溫下,氯化鐵為棕黑色固體,易升華。實驗室欲證明H2能在加熱的條件下還原FeCl3,設計了如下實驗。
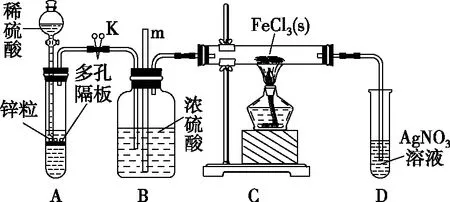
圖4
下列說法錯誤的是
( )
A.裝置A中發生的反應為復分解反應
B.裝置D中產生白色沉淀,可證明H2能還原FeCl3
C.實驗結束后,應先熄滅酒精燈,待硬質玻璃管冷卻后再關閉K
D.導管m的作用是平衡壓強,可觀察裝置C中導管口是否堵塞
【參考答案】AB

【錯題人數】只選A 23人次;選AC 12人次;只選D 5人次
【易錯點撥】對這種呈現完整實驗過程所需實驗儀器示意圖的實驗題先要弄清各個部分的作用,在理解反應原理的基礎上進行逐一分析。分析時需要有多重思維,如安全意識,實驗前進行氣密性檢查,處理尾氣的環保意識,防止倒吸的意識等等。
本題B項易漏選,學生對所給信息未解讀吸收或未領悟,D中檢測出有Cl-也可以是FeCl3(s)受熱升華變為FeCl3(g)后被H2(g)流帶入D中的。欲證明是否發生反應,還得結合裝置C中的變化;部分考生以為先熄滅C處酒精燈會發生倒吸,其實裝置A中還在繼續反應,讓C中產物在H2(g)流保護下冷卻,既防止外面空氣“乘虛而入”將熱產物氧化,又因為有H2(g)在流動使導管內外不至于存在大的壓強差而產生倒吸,導致C項誤選;學生對產生堵塞的原因不明;對長導管的作用不理解,既然FeCl3(s)受熱易升華變為FeCl3(g)就有可能隨氣流在裝置C中末端遇冷而凝化為FeCl3(s)使導管口產生堵塞,堵塞后裝置B上方空間氣壓增大,m管液面上升,m管既有示警作用,又有平衡壓強的作用,導致D項誤選。
【要點梳理】
2.其中裝置B有以上指出的多重作用,分析時需要有遷移思維,如裝置A中長頸漏斗要液封,有隨開隨用、隨關隨停的功能(相當于啟普發生器);氣體與固體反應時,即使氣體過量,因二者接觸面積有限,固體也不太可能反應完全;因此主要是過量固體殘留對產率的影響;進入裝置D中的氣體還有過量的H2。
【變式練習】
1.某學習小組設計實驗探究NO與銅粉的反應并檢驗NO,實驗裝置如圖5所示(夾持裝置略)。實驗開始前,向裝置中通入一段時間的N2,排盡裝置內的空氣。
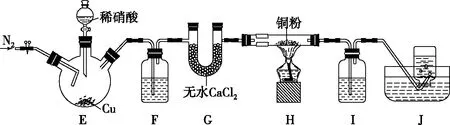
圖5

( )
A.裝置F、I中的試劑依次為水、硫酸亞鐵溶液
B.若觀察到裝置H中紅色粉末變黑色,則NO與Cu發生了反應
C.實驗結束后,先熄滅酒精燈,再關閉分液漏斗的活塞
D.裝置J收集的氣體中一定不含NO
【參考答案】D
【解題思路】根據實驗裝置圖,在裝置E中Cu與稀硝酸反應制備NO,實驗開始前向裝置中通入一段時間的N2來排盡裝置內的空氣,防止其對實驗產生干擾。由于HNO3具有揮發性,用稀HNO3制得的NO中混有HNO3(g)和H2O(g),裝置F用于除去NO中的HNO3(g),裝置G中的無水CaC12用于干燥NO,裝置H用于探究NO與Cu粉的反應,裝置Ⅰ用于檢驗NO。

2.已知:濃鹽酸的濃度約為37%。用CuCl2·2H2O晶體制取無水CuCl2的實驗裝置如圖6所示,下列說法錯誤的是
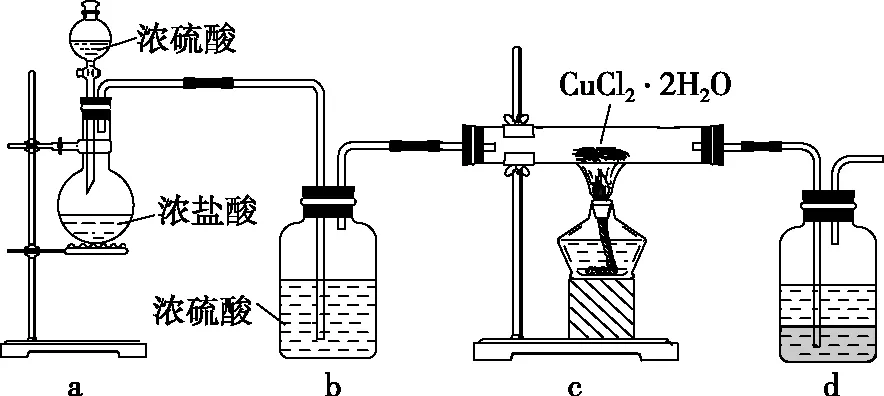
圖6
( )
A.通入HCl可以抑制CuCl2的水解
B.先滴入濃硫酸,再點燃c處酒精燈
C.硬質玻璃管內部右側會出現白霧
D.裝置d中上層為苯,下層為NaOH溶液
【參考答案】D
【解題思路】通入HCl抑制Cu2+水解,故A正確;先滴入濃硫酸,濃硫酸遇濃鹽酸里水后吸水放熱,促使HCl揮發出來,再點燃c處酒精燈,故B正確;硬質玻璃管內部HCl遇水蒸氣出現白霧,故C正確;若上層為苯,下層為NaOH溶液,裝d中會倒吸,應上層為NaOH溶液,下層為CCl4,故D錯誤。


