氟代溶劑在鋰金屬電池中的應用
何子旭,陳亞威,黃凡洋,揭育林,李新鵬,曹瑞國,焦淑紅
中國科學技術大學,中國科學院能量轉換材料重點實驗室,材料科學與工程系,合肥微尺度物質科學國家研究中心,合肥 230026
1 前言
自上世紀九十年代初鋰離子電池(Lithium ion battery,LIB)發明以來,鋰離子電池憑借能量密度高、循環壽命長、無記憶效應等優勢,掀起了一場儲能技術革命,逐漸占據了儲能市場的主導地位,并且極大地推動了消費類電子產品和電動汽車等的應用和發展1,2。然而,近十年來,隨著儲能市場對于電池能量密度的需求不斷增長,采用石墨作為負極的傳統鋰離子電池能量密度逐漸不能滿足市場需求,有必要發展能量密度更高的儲能電池體系3–5。相比于鋰離子電池中的石墨負極,鋰金屬負極(Lithium metal anode,LMA)具有更高的理論比容量(~3860 mAh·g?1)和更低的還原電位(?3.04 V vs. SHE),有望能夠大幅提升電池的能量密度,因此鋰金屬電池(Lithium metal battery,LMB)成為目前儲能技術研究的前沿研究熱點6。鋰金屬電池的正極可以采用傳統鋰離子電池的正極材料,也可以采用氧氣或者單質硫等轉化型正極材料。本文只討論采用傳統鋰離子電池正極材料的鋰金屬電池,這類鋰金屬電池一般具有較高的工作電壓,也稱為高電壓鋰金屬電池。
鋰金屬電池與鋰離子電池的顯著區別在于負極反應機制不同。鋰離子電池采用石墨作為負極,在循環過程中Li+在石墨負極的層間進行插入/脫出反應,這種“搖椅式”電池結構本身具有較好的循環穩定性7,8。而鋰金屬電池采用金屬鋰作為負極,在充放電過程中,Li+在鋰金屬負極表面進行電化學沉積/剝離轉化反應;由于金屬鋰具有極高的電化學活性,電解液在鋰金屬表面的副反應嚴重,并且在沉積過程中容易產生鋰枝晶,導致電池內部短路和熱失控等安全問題9–11。因此,發展鋰金屬電池面臨一系列重大挑戰:(1)鋰金屬負極在充放電過程中有巨大的體積變化,沉積過程中體積膨脹容易導致SEI (Solid electrolyte interphase)破裂,暴露的新鮮鋰金屬不斷與電解液發生副反應,引發電池庫侖效率(Coulombic efficiency,CE)降低、電解液干涸、電池壽命縮短等問題12;(2)金屬鋰不均勻沉積/剝離產生的鋰枝晶可能刺穿隔膜造成內短路,引起電池燃燒甚至爆炸13;(3)鋰枝晶容易從根部剝離,致使部分鋰金屬脫離與基底的連接形成“死鋰”,“死鋰”累積導致電池活性成分不斷減少和電池界面阻抗的急劇增大14,15。
電解液是鋰金屬電池的核心,發展穩定的電解液體系,是解決鋰金屬電池問題的有效手段和策略。如圖1a所示,電解液不僅起到傳導鋰離子的作用,同時電解液與負極/正極界面直接接觸,由于大多數電解液在鋰金屬負極和高電壓正極界面的熱力學穩定性較差,會與電極在界面處發生副反應,從而在負極和正極界面分別形成SEI和CEI(正極電解質界面膜,Cathode electrolyte interphase),從而進一步影響電池的工作電壓區間和循環穩定性16。電池的電化學窗口通常是由電解液溶劑化結構的最低未占據分子軌道(Lowest unoccupied molecular orbital,LUMO)和最高占據分子軌道(Highest occupied molecular orbital,HOMO)決定。理想情況下,電池工作電壓區間在電解液LUMO和HOMO范圍內,電解液作為一種化學惰性介質僅傳輸離子維持電荷平衡18。但是,對于鋰金屬電池而言,由于鋰金屬負極的化學勢往往高于一般電解液的LUMO能級,因此電解液會在鋰金屬表面被還原;還原生成的固態副產物會形成SEI,SEI的組成和結構很大程度上決定了鋰金屬負極的穩定性和安全性。在正極一側,高電壓正極材料會導致電解液氧化分解,在正極界面形成CEI,其成分和結構對正極材料的結構穩定性發揮著關鍵作用19–21。由此可見,電解液的組分及其溶劑化結構決定了電解液與電極界面的反應性,進而影響了SEI和CEI的組成和結構,并最終決定了電池的電化學性能。因此,通過開發新型電解液體系或者新型功能添加劑的策略,能夠有效調控電解液與正負極界面化學/電化學反應,優化CEI和SEI的組分和結構,從而保證鋰金屬電池能夠安全、穩定、高效循環22–30。
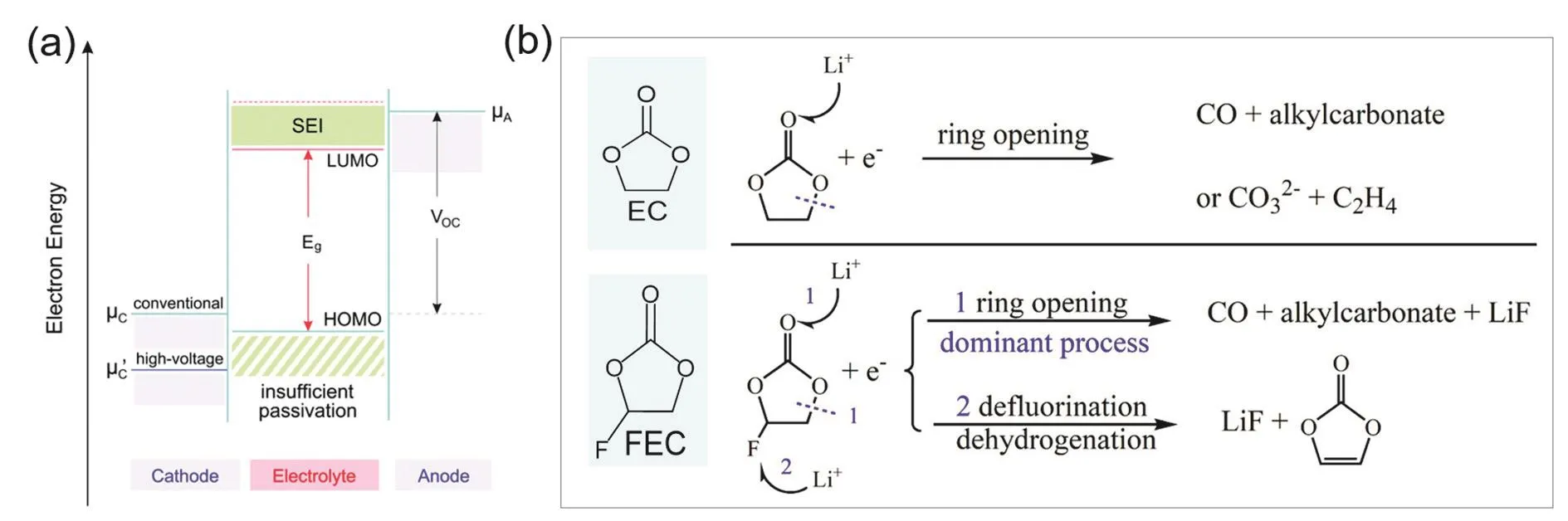
圖1 (a)鋰金屬電池電極與電解液能級示意圖16;(b) EC與FEC溶劑分解路徑差異17Fig. 1 (a) Schematic diagram of energy levels of electrodes and electrolytes of LMB 16;(b) the decomposition path differences between EC and FEC solvents 17.
氟代溶劑在鋰離子電池電解液中已經有廣泛的應用和研究,目前氟代溶劑被證明能夠有效改善電極界面穩定性、提升電解液的電壓窗口。如圖1b,使用氟原子取代碳酸乙烯酯(Ethylene carbonate,EC)中的一個氫原子,形成氟代碳酸乙烯酯(Fluoroethylene carbonate,FEC);由于溶劑分子結構和極性的變化,其在電極界面的分解路徑會發生改變,得到成分和結構完全不同的SEI,進而影響電極材料的電化學性能31–33。文獻研究表明,未經過氟取代的EC會在鋰金屬一側分解產生較多乙烯(C2H4);而FEC分解產生的C2H4較少,且分解產物中含有較多氟化鋰(LiF),后者在形成穩定的SEI中起到重要作用17。此外,將碳酸甲乙酯(Ethyl methyl carbonate,EMC)進行氟取代形成甲基三氟乙基碳酸酯(Methyl (2,2,2-trifluoroethyl)carbonate,FEMC)34,也可以有效提升溶劑的氧化穩定性,使得電池能夠在更高的電壓情況下安全運行35。
在鋰金屬電池中,氟代溶劑對電極界面性質的影響更大,因此對電池安全性和循環穩定性起到更為重要的作用。相比于鋰離子電池,鋰金屬電池的界面穩定性更差,而氟代溶劑的加入在電極表面形成含有氟化鋰的界面層(SEI和CEI),對提升鋰金屬電池的穩定性起到關鍵作用。最近,文獻報道了多種基于氟代溶劑的鋰金屬電池電解液體系,有效提升了鋰金屬電池的循環性能,推動了鋰金屬電池的發展。例如,局域超濃電解液中的稀釋劑多為高度氟代的溶劑分子36,對常用溶劑進行結構設計形成部分氟代溶劑23,將特定氟代官能團引入溶劑分子中37等,這些策略都在不同程度上改善了鋰金屬電池的循環性能,提升了電池的安全性。本文綜述了近年來應用于鋰金屬電池中的主要新型氟代溶劑,并分析了其在電解液中的作用,以及與電池性能之間的構效關系;進而總結了構建氟代溶劑分子的策略和思路,期望能對電解液溶劑分子的設計與開發起到一定的借鑒啟發作用。
2 氟代溶劑作為電解液稀釋劑
2.1 超濃電解液與局域超濃電解液
基于電解液的電導率、粘度、成本等多方面考慮,鋰電池的電解液濃度一般選擇在~1 mol·L?1左右,其綜合性能最優。在這種常用的低濃度電解液中,大部分溶質被完全解離,因而Li+的第一溶劑化鞘層中僅存在溶劑分子,形成溶劑分離離子對結構(Solvent-separated ion pair,SSIP,圖2a);并且電解液中存在著大量游離的自由溶劑分子和陰離子。當進一步提升電解液中鋰鹽的濃度,形成超濃電解液(High concentration electrolyte,HCE)體系,這類電解液的溶劑化結構與低濃度電解液有較大的差別。在超濃電解液中,溶劑分子數量的急劇下降,造成大量溶質不能完全解離,形成接觸離子對結構(Contact ion pair,CIP,圖2b)以及多個溶質和溶劑分子共同作用形成的聚集體結構(Aggregate,AGG,圖2b)38,39。
超濃電解液以其獨特的溶劑化結構表現出與低濃度電解液完全不同的性質,因而相較于后者具有諸多優點:(1)溶劑化結構的改變降低了陰離子的LUMO能級,同時Li+會傾向攜帶更多陰離子到達負極表面,因而陰離子在鋰金屬表面優先被還原,形成陰離子分解主導的SEI,對鋰金屬負極具有更好的保護作用41–43;(2)溶劑分子的減少降低了Li+的屏蔽作用,大幅提升了Li+遷移數;(3)幾乎所有的溶劑分子都將孤對電子部分給出參與配位,游離的自由溶劑分子減少,因此提升了電解液的熱穩定性,增強了電解液氧化穩定性44–46(圖2d)。
然而,超濃電解液仍存在較多問題,尤其是其粘度較大且鋰離子電導率較低,嚴重影響了電池的倍率性能和工作溫度區間。隨著濃度的增加,溶質與溶劑之間的相互作用增強,電解液粘度增加、潤濕性降低,電解液存在難以浸潤隔膜、電解液動力學變差等問題47。另外,從經濟成本的角度來看,增加電解液中鹽的比例會導致成本上升,不適于大規模生產48。針對上述問題,Zhang團隊49在2017年首次提出通過向超濃電解液中加入一種高度氟代的鏈狀醚,1,1,2,2-四氟乙基-2,2,3,3-四氟丙基醚(TTE),在較好地保持超濃電解液溶劑化結構的同時,解決了超濃電解液粘度大、電導率低的問題。如圖2c所示,氟代醚的加入,分割了超濃電解液的網絡結構,形成局部聚集的溶劑化結構,即局域超濃電解液(Localized high concentration electrolyte,LHCE)。自此局域超濃電解液成為鋰金屬電池的研究熱點,近年來有大量相關文獻報道該類型電解液用于鋰金屬電池的研究。
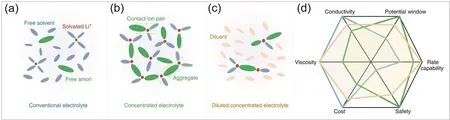
圖2 (a)傳統電解液、(b)超濃電解液、(c)局域超濃電解液溶劑化結構示意圖;(d)三種電解液性能比較40Fig. 2 (a–c) Solvation structure diagram and (d) performance comparison of conventional electrolyte, HCE and LHCE 40.
為了獲得電化學性能和理化性質俱佳的電解液體系,對稀釋劑的選擇有一定的要求。Yamada等40提出,稀釋劑需要具備以下特征:(1)低粘度,能夠顯著降低超濃電解液的粘度;(2)成本低,能夠降低電解液的總成本;(3)適當的介電常數和配位能力,使超濃電解液具有高溶解度,同時不改變超濃電解液的局部配位環境;(4)足夠的惰性/穩定性,不影響超濃電解液的電化學窗口;(5)不易燃且揮發性低,能夠保證超濃電解液的安全性。氟代溶劑是目前報道最多的稀釋劑,氟元素的電負性在所有元素中最大,并且其原子半徑較小、空間位阻較低。通過對溶劑分子進行氟取代或者多氟取代,氟原子強烈的吸電子作用使得溶劑分子難以給出電子進行配位而成為一種惰性溶劑。因此,氟代溶劑能夠與其他溶劑互溶但并不解離溶質分子,也不改變電解液的局部配位環境。同時,氟代溶劑自身的惰性使得其具有粘度低、穩定性高等優點,很好地滿足了稀釋劑的要求。近年來開發的局域超濃電解液與稀釋劑的結構如圖3與表1所示。
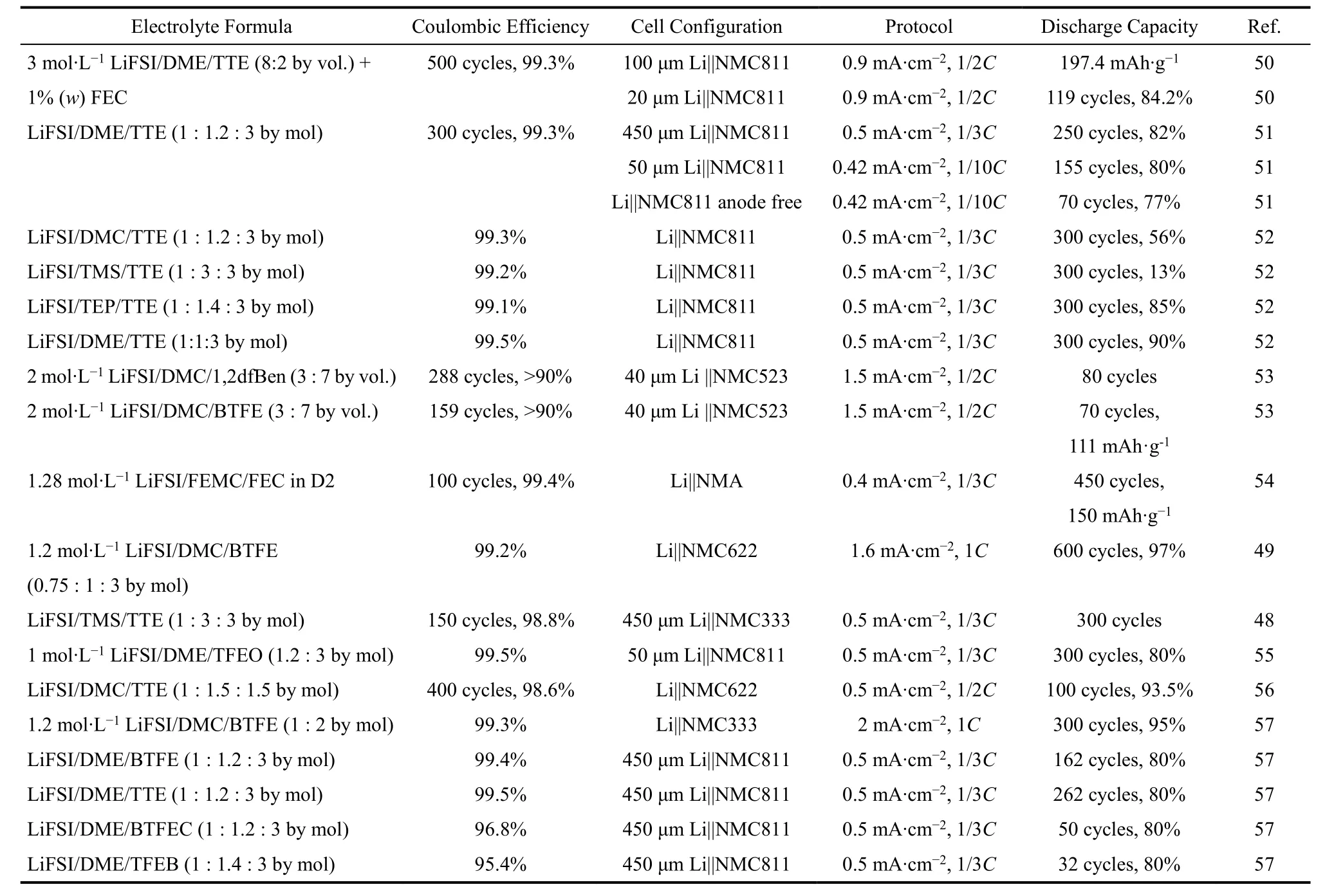
表1 局域超濃電解液配方與性能Table 1 Localized high-concentration electrolytes formula and the battery performance.
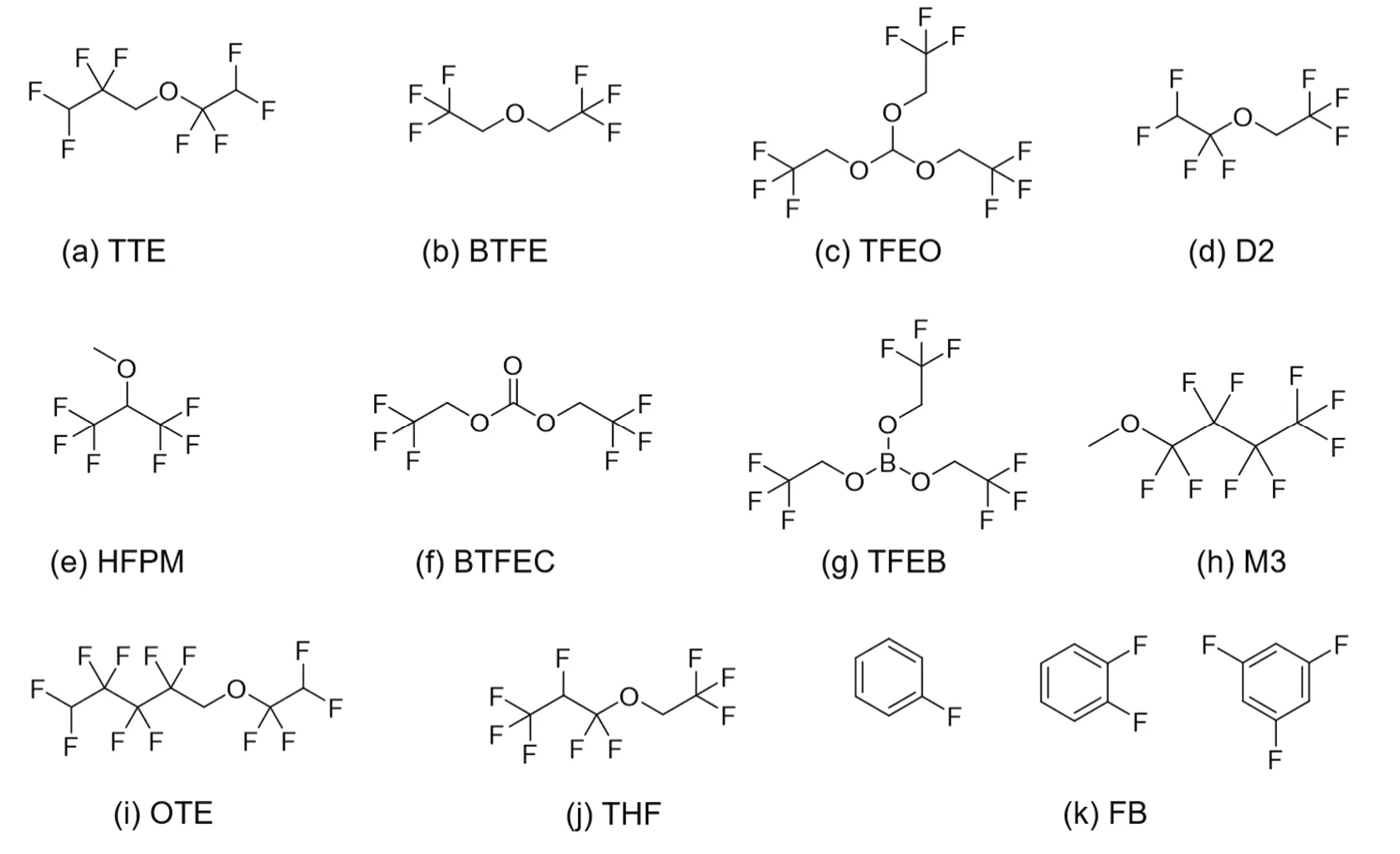
圖3 稀釋劑分子結構示意圖Fig. 3 Schematic diagram of diluent molecules.
2.2 稀釋劑的作用
稀釋劑作為一種高度氟代溶劑,其溶劑分子結構上F取代的位點較多,并且距離官能團位置較近,F強烈的吸電子能力使得官能團難以給出電子與Li+配位,導致難以溶解Li鹽。在電解液中加入稀釋劑,不會改變原有的溶劑化結構,稀釋劑更多地出現在溶劑化鞘層的外圍,在調制電解液理化性質的同時參與SEI和CEI的構建。因此,稀釋劑不僅作為惰性溶劑起到“稀釋”的作用,還對電解液的理化性質、電解液溶劑化結構、電池正負極界面性質有重要影響。
2.2.1 對電解液理化性質的影響
Piao等56研究了不同比例的LiFSI/DMC/TTE電解液(LiFSI:雙氟磺酰亞胺鋰;DMC:碳酸二甲酯)的理化性質與電池性能,提出稀釋劑是一種反溶劑(在工業中可以通過向溶液中加入與溶劑互溶而不能溶解溶質的反溶劑來析出溶質)。圖4a為不同比例LiFSI/DMC/TTE電解液的一些理化性質;從圖中可以看出隨著稀釋劑比例的上升,溶液逐漸飽和,甚至出現渾濁現象。稀釋劑的加入可以顯著降低電解液的粘度,維持電解液的電導率。對電解液與隔膜(Celgard 3501)之間的接觸角測試發現:1 mol·L?1LiPF6/EC/DMC、LiFSI/DMC (摩爾比1 : 1.5)、LiFSI/DMC/TTE (摩爾比1 : 1.5 : 1.5),以上三種電解液的接觸角分別為51.8°、62.4°、32.5°,說明稀釋劑的加入改善了電解液對隔膜的潤濕能力。同時,燃燒測試也表明LiFSI/DMC/TTE電解液具有良好的阻燃性。
Yao等58利用分子動力學模擬對超濃電解液和局域超濃電解液的介電常數進行了研究,發現鋰鹽濃度的增加使得電解液中具有CIP溶劑化結構的比例上升,并且提升了介電常數;由于相應的自由溶劑比例下降會降低電解液的介電常數,因而介電常數對于鋰鹽濃度的曲線呈現出火山圖狀。而對于LiFSI/DMC/TTE和LiFSI/DME/TTE (DME:乙二醇二甲醚)體系,隨著稀釋劑TTE比例從0%增加到71.4%,電解液的介電常數呈線性增長趨勢(圖4b)。其原因在于稀釋劑的介電常數大于溶劑分子的介電常數,并且稀釋劑不參與配位,因此加入較多的稀釋劑會將超濃電解液體系的三維網絡結構分割開,因而在稀釋劑比例較高(> 50%)時,曲線變得平緩。Ding等59進一步將稀釋劑的介電常數以及稀釋劑與Li+的結合能作為評價稀釋劑優劣的參數,該研究發現:與DME相比,具有更低介電常數和更大結合能的稀釋劑能有效地增強Li+與陰離子的結合強度,從而導致電解液中更多聚集體結構(AGG)的出現,有利于陰離子的完全分解(圖4c)。介電常數代表電介質對外界電場的反應,而電導率代表電解液中電荷流動的難易程度。在局域超濃電解液中,隨著稀釋劑的比例上升,電解液中傳導電荷的離子數減少,電導率會有一定程度的下降。

圖4 (a)不同比例LiFSI/DMC/TTE電解液理化性質56;(b)介電常數隨稀釋劑比例的變化曲線58;(c)不同溶劑與Li+的結合能和介電常數59;(d,e)電解液電導率與磁化率隨溫度變化曲線54Fig. 4 (a) Physicochemical properties of LiFSI/DMC/TTE in different proportions 56; (b) curves of dielectric constant as a function of diluent ratio 58; (c) binding energy and dielectric constant of different solvents with Li+ 59;(d, e) conductivity and magnetic susceptibility of electrolyte vary with temperature 54.
普通電解液的熔點較高、去溶劑化能較高,致使電池低溫性能衰減嚴重,難以在低溫下工作60。但稀釋劑極化能力弱、分子間相互作用力較小,因此熔沸點一般較低。將稀釋劑引入到電解液體系中,可以降低電解液的熔點,使得電解液能夠在低溫條件下穩定運行。如圖4d–e,Fan等54開發了兩種 局 域 超 濃 低 溫 電 解 液 : 1.28 mol·L?1LiFSIFEC/FEMC/D2 (D2:1,1,2,2-四氟乙基-2,2,2-三氟乙 基 醚 ) 和 0.7 mol·L?1LiBETI-FEC/DEC/M3(LiBETI:雙(五氟乙基磺酰基)亞氨基鋰;DEC:碳酸二乙酯;M3:甲基九氟丁醚)。以上兩種電解液的電導率隨溫度降低而緩慢降低并維持在較高水平,但普通電解液則出現明顯拐點(當溫度低于一定值后電導率迅速降低)61。通過測量電解液的磁化率隨溫度的變化曲線發現,兩種電解液的熔點均低于?120 °C,這也是兩者在低溫下仍能保持較高電導率的主要原因。
2.2.2 稀釋劑對溶劑化結構的調控
有些稀釋劑分子由于氧原子的存在,具有一定的鋰離子配位能力,因此對電解液的溶劑化結構具有一定的調節作用。通過拉曼光譜,可以測量分子的振動、轉動能級,從而獲得電解液體系的結構信息。在電解液中,SSIP、CIP、AGG結構的溶劑化結構不同,分子間相互作用力存在差異,因而拉曼峰值會有稍許偏移。如圖5a–b,Cao等30在對LiFSI/DME/TFEO (TFEO:三(三氟乙氧基)甲烷)體系中稀釋劑TFEO的含量進行調控時發現,隨著電解液中TFEO比例上升,在拉曼光譜中幾乎沒有出現游離DME溶劑的峰,并且電解液中AGG結構的含量略有上升。Ding等59在LiFSI/DME/D2體系的研究中通過對拉曼光譜中FSI?的峰值分析也得出了相似結論:在加入稀釋劑后,陰陽離子之間的相互作用更加強烈,FSI?主要存在于AGG結構中。但是Ren等62的研究(圖5c)發現,在LiPF6/DMC/HFPM(HFPM:1,1,1,3,3,3-六氟異丙基甲基醚)體系中,隨著稀釋劑比例的上升,拉曼光譜數據中出現了自由溶劑的峰,同時CIP結構比例增加、AGG結構比例減少;并且將稀釋劑替換為TTE或者在LiFSI/DME/TTE體系中都有相同趨勢。作者認為這是由于稀釋劑與溶劑之間的偶極與偶極相互作用,將AGG結構分割成了CIP結構,并且出現了完全由稀釋劑包圍的自由溶劑分子。
2019年,Ren等51開發了LiFSI/DME/TTE體系,并深入研究了該電解液體系的溶劑化結構。通過對電解液進行了NMR-17O測試發現,隨著TTE稀釋劑的加入,DME中氧原子的化學位移減小,而陰離子FSI?和稀釋劑TTE中氧原子的化學位移無明顯變化。該研究結果證明TTE稀釋劑不會干擾FSI?和Li+在高濃電解液中的強相互作用,而且會使更多的FSI?陰離子進入內溶劑化鞘層。LiFSI/DME/TFEO體系30也有相同現象,稀釋劑分割大團簇,并與DME之間存在相互作用,從而引起DME化學位移的改變(圖5b)。Amanchukwu等63進行NMR-7Li測試也發現加入TTE稀釋劑會使得Li+的化學位移減小,從另一方面驗證了稀釋劑能夠增強陰陽離子間的相互作用。
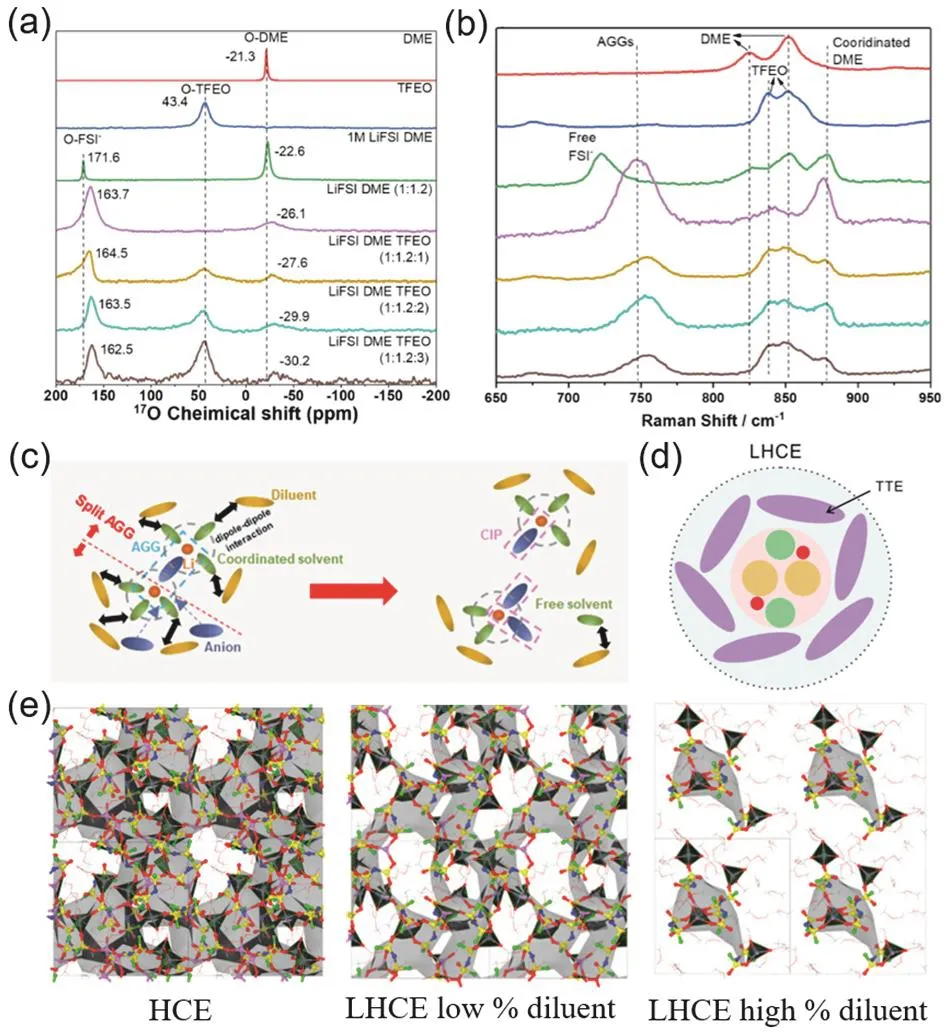
圖5 (a,b)不同比例LiFSI/DME/TFEO電解液的拉曼光譜和NMR-17O數據30;(c)稀釋劑將AGG結構分割為CIP結構示意圖62;(d) LHCE溶劑化結構示意圖51;(e)理論模擬HCE、LHCE電解液結構64Fig. 5 (a, b) Raman spectra and NMR-17O data of LiFSI/DME /TFEO electrolyte in different proportions 30;(c) thinner divides the AGG structure into CIP schematic 62; (d) schematic diagram of solvation structure of LHCE 51; (e) structure of HCE and LHCE electrolyte under theoretical simulation 64.
實驗中對電解液進行拉曼光譜、核磁共振譜的分析能夠提供電解液的整體信息,實驗數據表明稀釋劑存在于溶劑化鞘層周圍但不參與溶劑化結構,對溶劑化層提供保護和屏蔽作用(圖5d)51。如圖5e,Zhang團隊64對局域超濃電解液LiFSI/DMC/BTFE (BTFE:2,2,2-三氟乙醚)49進行理論計算模擬,發現當電解液體系中稀釋劑比例不高(LiFSI : DMC : BTFE = 0.94 : 1.10 : 0.65,摩爾比)時,由陰離子FSI?主導的三維結構網絡不會被破壞而是被稀釋劑撐開;但當稀釋劑增加到一定比例(LiFSI : DMC : BTFE = 0.64 : 1.10 : 1.65,摩爾比),三維網絡結構會被分割成島狀溶劑化結構,部分Li+保持超濃電解液中的AGG結構,但部分Li+僅與一個FSI?配位,甚至出現Li+與稀釋劑分子BTFE配位的現象。該現象能夠解釋加入稀釋劑后電解質的溶解度降低,說明稀釋劑與Li+、溶劑分子、陰離子之間都存在相互作用。該團隊對LIFSI/DME/TTE體系的分子模擬研究發現65,TTE無法通過O原子但可以通過F原子與Li+發生相互作用而參與配位,但TTE分子與Li+的相互作用力相較于陰離子或溶劑較弱,因此容易從溶劑化鞘層中脫出。在稀釋程度較高的局域超濃電解液中,兩個島狀三維網絡之間無溶劑分子,也幾乎無Li+。該研究認為Li+可以通過短暫地與稀釋劑TTE中F原子作用,形成由TTE包圍的溶劑化結構;但隨后TTE迅速脫去,Li+進入到另一個島狀網絡結構中,該現象類似于Li+在電解液的兩個島狀網絡結構中進行跳躍,從而實現Li+的傳輸。
2.2.3 稀釋劑對正負極界面的影響
超濃電解液中陰離子與Li+發生相互作用,使得LUMO能級降低,因而產生陰離子分解主導的SEI。XPS (X射線光電子能譜)等實驗數據表明:陰離子分解主導的SEI中含有大量的LiF等無機成分并且分布均勻,導致SEI具有較高的機械強度和較大的表面能;因而在SEM、TEM的形貌觀察中,超濃電解液中鋰金屬的沉積形貌呈現大塊狀并且十分平整41。由于稀釋劑是高度氟代的溶劑分子,具有強烈的吸電子能力,因此其LUMO能級較低,容易與鋰金屬負極發生副反應。
Lee等50對LiFSI/DME/TTE電解液體系的研究發現:LiFSI/DME/TTE電解液的首圈庫侖效率僅有40%,但卻表現出優異的循環穩定性和較長的電池壽命。實驗中驗證在首圈鋰沉積的過程中,TTE分解消耗大量Li+和電子而形成穩定均勻的SEI。通過飛行時間-二次離子質譜(TOF-SIMS)進一步證明在沒有電場的條件下,TTE也能夠在鋰金屬表面迅速形成一層富含LiF的界面層。如圖6a,對LiFSI/DME和LiFSI/DME/TTE兩組的XPS數據進行對比分析發現:LiFSI/DME/TTE體系中出現了獨有的C-F和C-F2峰,也證明了TTE會參與SEI形成過程,此現象在Dong等66的研究中也被證實。
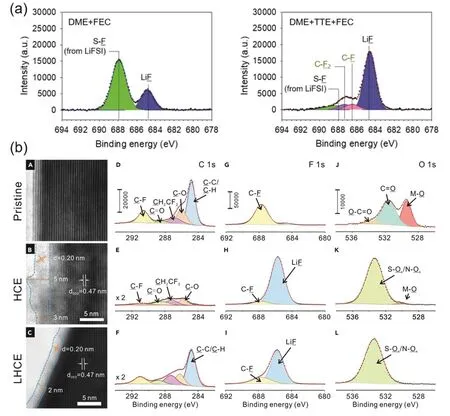
圖6 (a) XPS證實稀釋劑參與SEI構建50;(b) Li||NMC811在LiFSI/DME與LiFSI/DME/TTE中循環50圈后正極界面TEM圖與XPS 51Fig. 6 (a) Diluents involved in SEI construction confirmed by XPS 50; (b) TEM image and XPS of the Li||NMC811 in LiFSI/DME and LiFSI/DME/TTE after 50 cycles 51.
Zheng等67運用理論計算詳細模擬分析了LiFSI/DME/TFEO體系中電解液的分解過程,并給出了分解反應的機理與步驟。該研究推測鋰鹽LiFSI通過四電子分解機理,早期產生含有F和N(SO2)2等基團的產物,并主導著SEI的成分。稀釋劑TFEO的分解一般需要六個電子,比LiFSI更為穩定,但也會參與構建SEI。該研究還闡明了在陰離子攻擊下TFEO脫氫反應的機理,說明稀釋劑與陰離子間存在相互作用。值得注意的是,溶劑分子DME在整個過程中都十分穩定,并沒有發生化學反應的傾向。
如圖6b,Ren等51對在LiFSI/DME/TTE體系中循環50圈后的NMC811正極表面進行研究發現:相比于超濃電解液中形成的CEI,局域超濃電解液中形成的CEI更薄(2 nm)且更均勻。從XPS數據也可以看出局域超濃電解液中正極表面的C―H、C―C鍵的成分明顯增加,并且有更多的C?F信號,推測稀釋劑在正極表面發生分解,更好地保護了正極界面。
Cao等57對于電解液中稀釋劑的作用有十分系統的研究。該研究以LiFSI/DME體系為基礎電解液,選用五種稀釋劑BTFE、TTE、BTFEC (二(2,2,2-三氟乙基)碳酸酯)、TFEB (三(2,2,2-三氟乙基)硼酸酯)、TFEO。實驗研究表明:稀釋劑不僅可以保持高濃電解液體系的溶劑化結構,對界面鈍化層也有顯著影響,圍繞在溶劑化鞘層周圍的稀釋劑可以通過共同參與SEI的形成,從而加速或者減緩陰離子的分解。由于BTFEC是氟代碳酸酯,其碳氧雙鍵的極化能力較強,仍具有一定溶解鹽的能力,因而在理論計算中出現在溶劑化鞘層中;但是BEFEC參與溶劑化結構破壞了原有電解液中陰陽離子部分解離的結構,造成電解液性能大幅下降和鋰金屬沉積形貌不均勻,是一種不良稀釋劑。由此可知,不同的稀釋劑與鋰金屬的作用存在差異,在TTE-LHCE中形成的SEI富含Li2O,且厚度分布最為均勻,穩定鋰金屬表面的效果最好。除此之外,不同稀釋劑對正極也有不同的影響。在TFEBLHCE的SEI中,可以檢測到Ni元素的存在,說明在該電解液中正極結構中的Ni溶出較為嚴重。結合對正極的XPS和TEM等數據的分析,發現TFEB顯著加速了富鎳NMC811材料的氧釋放,并且由于B元素的缺電子性質,導致了正極的快速衰變;而BTFE、TTE和TFEO表現十分良好,在正極界面形成了薄且均勻的CEI,因而基于BTFE、TTE和TFEO的LHCE分別表現出99.4%,99.5%和99.5%的高庫侖效率。Li||NMC811全電池的容量保持率順序為TFEO-LHCE > TTE-LHCE > BTFE-LHCE >BTFEC-LHCE > TFEB-LHCE。Ren等52在LiFSI/DME/TTE體系中,替換多種不同溶劑進行比較,從另一個角度闡述了稀釋劑與陰離子、溶劑會發生協同作用,參與SEI與CEI的構建。
上文所提及的稀釋劑大多數為氟代醚,而苯及其衍生物由于低極性、高對稱性等優點也可以作為稀釋劑。Xie團隊68,69將苯進行氟取代合成氟苯(FB)、Yoo等53對苯進行雙位點氟取代成為鄰二氟苯等,成為除氟代醚外的重要稀釋劑。氟代苯容易制備且經濟成本低,且對苯進行氟取代可以進一步提升苯的抗氧化性。同時,氟代苯使得其對稱性被破壞,對苯分子的共軛鍵有一定影響,因此其C―F鍵比一般的C―F鍵更加活潑。通過能量色散X射線光譜(EDS)元素分析發現,在氟苯中浸泡的鋰金屬表面出現了氟元素,并且該電解液在循環中產生的SEI也富含LiF。Yoo等在文中也提及除鄰二氟苯以外,間二氟苯、對二氟苯、甲苯等都能夠提升LiFSI/DMC體系的電池性能。
綜上所述,通過精細的分子結構設計F原子取代的位置與數量,或者通過調控溶劑與稀釋劑的比例等手段,都可以進一步優化含有稀釋劑的電解液,從而提升鋰金屬電池的循環穩定性和安全性。但稀釋劑在鋰金屬電池中的應用也存在一些問題:(1)加入稀釋劑存在反溶劑效應而導致電解液溶解鹽的能力下降,不利于電解液的儲存;(2)稀釋劑對參與構建SEI和CEI界面層的影響目前沒有明確機理,作用存疑;(3)大多數稀釋劑成本較高,需要大量氟化物進行合成,現有的稀釋劑種類較少。
3 氟代醚作為電解液的主溶劑
超濃電解液最大的亮點在于其獨特的溶劑化結構,即提升電解液中CIP、AGG分子團簇的比例,構建離子的三維網絡。近年來,發展了諸多新方法構建類似的溶劑化結構,例如向溶液中加入金屬有機框架材料(MOF等),構建完全由CIP結構組成的電解液70,71;向局域超濃電解液中加入特殊的添加劑,可以穩定AGG結構72等。超濃電解液中AGG結構形成的本質是由于溶劑量較少,Li+與陰離子無法被完全解離。因此,選用弱溶劑化能力的溶劑具有一定溶解鹽的能力,但不至于使鋰鹽完全解離,例如乙醚73、1,4-二氧六環74等,也能夠構建具有離子通道的三維網絡。
增加碳鏈長度可以增加電解液的穩定性,并維持電解液溶解鋰鹽和傳導鋰離子的能力。對于醚類溶劑分子來說,需要由其分子中O原子上的孤對電子與鋰離子進行配位,從而溶解鋰鹽。通過對醚類溶劑分子進行選擇性氟代,可以調節醚類溶劑分子的溶劑化能力,從而構建不同類型的溶劑化結構。值得注意的是,由于F原子的強吸電子能力,僅有和O原子有一定距離的位置上(β-C)進行部分F取代,才能維持電解液溶解鹽的能力。Bao和Cui團隊將常見醚類溶劑的碳鏈增長并部分氟代,在這方面做了大量的建設性工作,開創了電解液設計的新領域。其所用主要配方與溶劑結構見表2與圖7。
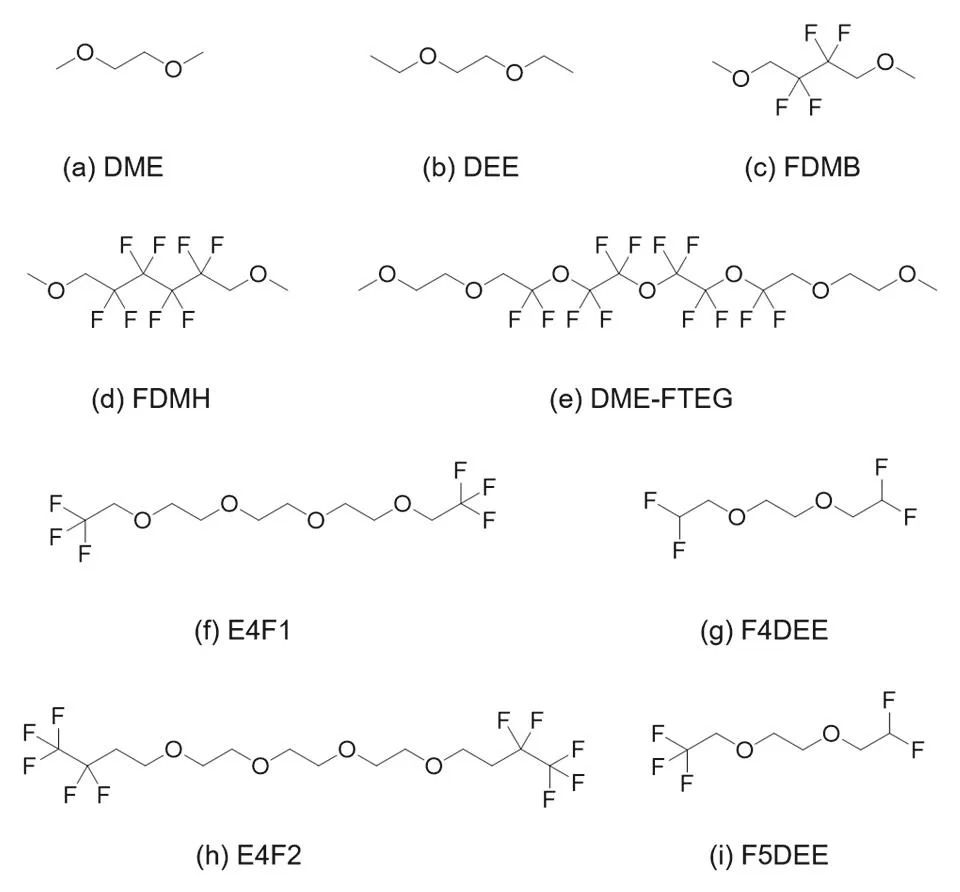
圖7 部分氟代溶劑分子結構Fig. 7 Molecular structure of partially fluorinated solvents.
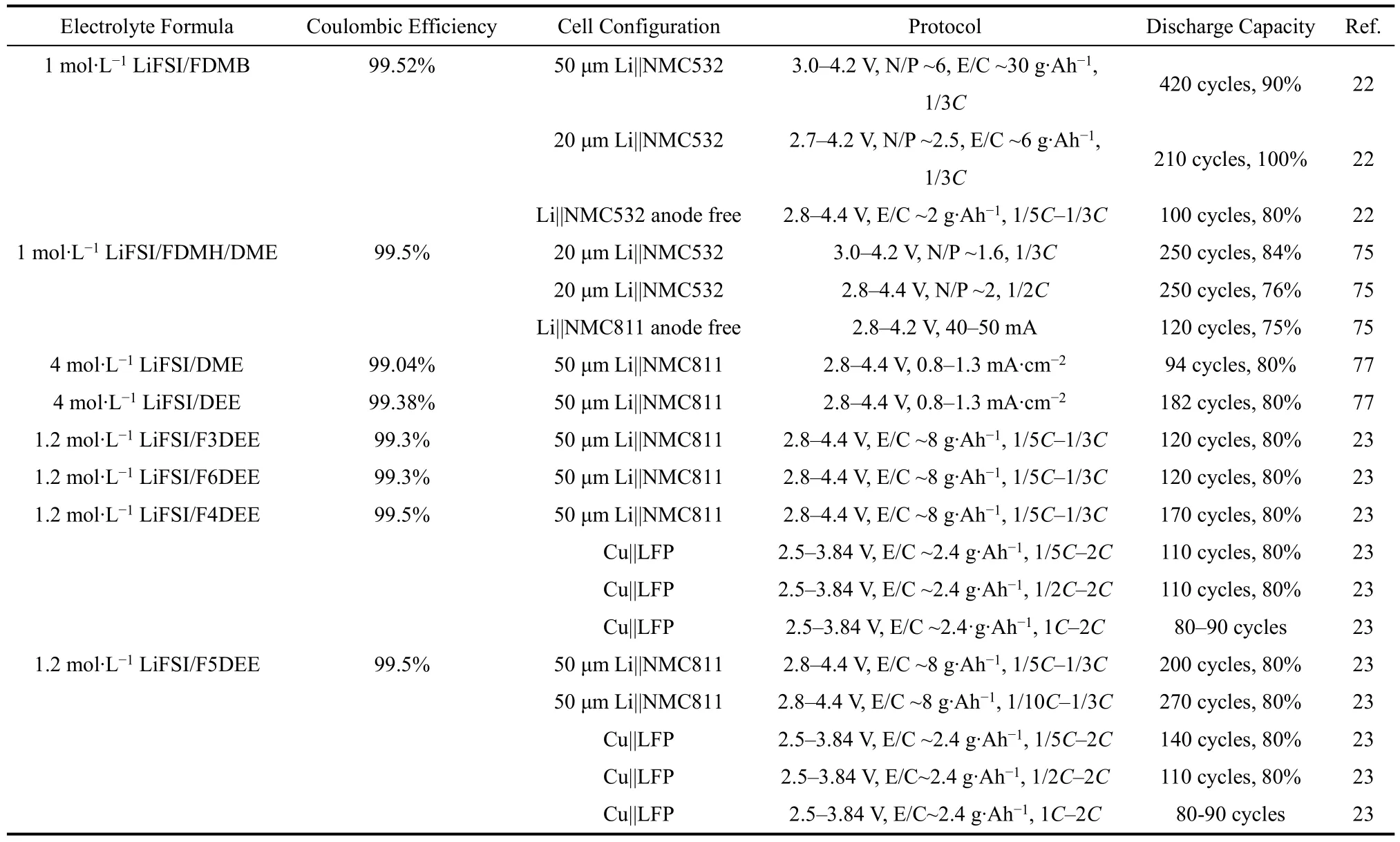
表2 部分氟代溶劑電解液配方及其電池性能Table. 2 Partially fluorinated solvent electrolytes formula and battery performance.
3.1 中間碳鏈增長并部分氟取代
2020年,Bao和Cui團隊22設計了氟代醚FDMB分子(圖7c)用于鋰金屬電池電解液中。該分子設計中將DME分子的中間碳鏈增長,并在新增的C原子位置上進行F取代,得到了FDMB分子。1 mol·L?1LiFSI/FDMB電解液中,鋰金屬負極的首圈庫侖效率高達~97.6 %,隨后僅在5個充放電循環內庫侖效率快速上升至> 99%,并且該電解液能夠很好與正極匹配。該研究通過分子模擬、核磁、紫外-可見光光譜等手段分析了溶劑化結構,發現FDMB中的―O―和β-C上的F可以共同作用于Li+,構成一個五元環,因此電解液呈現特有的棕色(FDMB分子本身呈無色)。但F原子與Li+的作用相較于DME中兩個―O―的螯合作用較弱,降低了Li+的溶解能力。如圖8所示,在1 mol·L?1LiFSI/DME體系中,出現在Li+周圍的陰離子和溶劑比例為FSI?: DME =2.31 : 1,而在1 mol·L?1LiFSI/FDMB體系中該比例為3.29 : 1,即FDMB分子使得更多的FSI?出現在內溶劑化鞘層。該電解液類似于局域超濃電解液,產生陰離子主導的SEI。而對Li沉積形貌和SEI的分析發現FDMB體系產生的SEI主要成分中含有F、S、O等元素,SEI厚度均勻而且非常薄。該研究證明1 mol·L?1LiFSI/FDMB中形成的SEI中更多的由陰離子分解產生,并且有更強的自限制能力,能更好地保護鋰金屬。但是在LiFSI/FDMB體系中,鋰金屬的沉積過電勢稍有增加,這可能與氟化導致的離子電導率下降和高SEI阻抗相關,也可能是由于鋰沉積形貌表面積較小造成的。
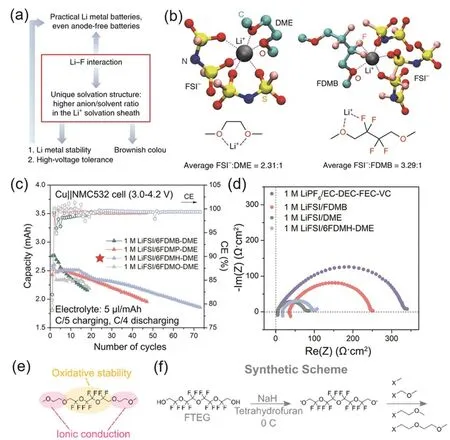
圖8 (a) FDMB中Li-F作用示意圖22;(b) LiFSI/DME和LiFSI/FDMB體系Li+配位情況的理論優化結果22;(c,d) LiFSI/6FDMH-DME系列電解液性能與阻抗75;(e) DME-FTEG分子構效關系76;(f) DME-FTEG系列分子合成方法76Fig. 8 (a) Diagram of Li-F interaction in FDMB 22; (b) theoretically optimized structures of ligands of LiFSI/DME and LiFSI/FDMB systems Li+ 22; (c, d) performance and impedance of LiFSI/6FDMH-DME series electrolytes 75;(e) structure-activity relationships of DME-FTEG molecular 76; (f) synthesis methods of DME-FTEG series moleculars 76.
Li+在電極界面需要進行去溶劑化過程才能到達電極界面發生反應,這個過程需要跨越勢壘。不同電解液的溶劑化結構不同,因而去溶劑化能不同。Kim等78通過特殊電極、鹽橋等手段,巧妙地平衡了諸如擴散、電極差異等影響電勢的因素,使得所測得的電勢能夠反映不同電解液相對于標準電解液(DME)的溶劑化結構差異。LiFSI/FDMB電解液電勢較低,代表去溶劑化能較高,有較多AGG溶劑化結構,這也是LiFSI/FDMB體系具有優異電池性能的重要原因。最近,Cui等79首次通過玻璃化冷凍手段,將含有電解液的SEI原位快速凍結在鋰金屬電極表面,通過冷凍電鏡觀測到更接近原位狀態的SEI結構。研究人員發現,這種“濕態”的SEI與一般測試方法中“干態”的SEI具有明顯的差異,“濕態”SEI具有明顯更大的厚度,說明在原位狀態下,SEI中含有大量的溶劑分子,從而導致SEI膨脹。但是,對于FDMB體系,“濕態”和“干態”SEI的厚度差別最小,說明該體系SEI的致密性和均勻性較好,能夠更好地保護鋰金屬負極。
為了解決電解液動力學差的問題,該團隊75于2021年將FDMB分子中的―CF2―鏈增長,構建出一系列分子如FDMH (圖7d)。隨著―CF2―鏈的增長,分子溶解鋰鹽的能力逐步下降,可以作為稀釋劑與DME搭配而形成局部超濃電解液體系。LiFSI/DME/FDMH體系能夠實現高庫侖效率(99.5%)和良好的Li||NMC532電池性能(圖8c),并且有極高的氧化穩定性(6 V vs. Li+/Li)。該體系在保持FDMB分子優良性能的同時,解決了FDMB阻抗較高的問題(圖8d),這也說明稀釋劑設計與部分氟代的分子設計方法有共通之處。
與上述方法類似,為了能在分子結構設計上同時滿足溶劑分子和稀釋劑的結構要求,該團隊76構建了一系列分子,如DME-FTEG (圖7e)等,其分子結構類似于兩端為醚而中間為稀釋劑的高度氟代醚結構。如圖8e所示,DME-FTEG通過兩端的―O―提供溶解鹽的能力,而通過中間部分來起到抗氧化性和穩定結構的作用。而且改變端基―CH2O―的數量(圖8f),可以對電解液性能進行更精確地調控和篩選。
3.2 端基碳鏈增長并進行F取代
眾所周知,DME以其獨特的分子結構可以類似于鉗子與Li+配位,具有良好的溶解鋰鹽的能力。Bao和Cui團隊77揚長避短,保持中間部分乙二醇的結構而延長兩端碳鏈,構建了DEE分子(圖7b)。該研究中4 mol·L?1LiFSI/DEE電解液,相較于4 mol·L?1LiFSI/DME,表現出了更強的抗氧化穩定性,匹配NMC正極的全電池在180圈循環后容量保持率高達~80%。從總體來看,增加溶劑碳鏈長度可以增加電解液的氧化穩定性:碳鏈增長導致溶劑結構變形性增大,空間位阻增大,不利于其與Li+配位,因而使得更多的陰離子出現在溶劑化鞘層。中間碳鏈的增長使得DME與Li+無法再形成五元環的配位結構,直接改變了溶劑與Li+的配位方式,但端基的增長卻無此后果。而向其中引入F原子取代,其作用與稀釋劑類似,但精確調控F原子的數量與位置可以優中選優。
Ma等80構建了一系列端基氟代醚E4F1、E4F2等(圖7f、h),對端基上的氟取代進行了研究。其中間結構為不同數量的乙二醇脫水形成醚,端基為β-C連有―CF3或―CF2CF3。該設計中同樣利用了醚基官能團能夠使鋰鹽解離,同時氟化基團可以增強電解液氧化穩定性的策略。研究發現,該氟代醚分子具有較高的離子電導率(1.3 mS·cm?1),但離子電導率并不與醚鏈長度呈線性相關。另外,值得一提的是,研究發現這些電解質的氧化穩定性隨著氟含量的減少而增加,這一現象在其他氟代醚中未被發現。
基于以上的理解,該團隊23利用DEE的端基即為β-C的特點,對端基進行F取代以達到庫侖效率、氧化穩定性和離子傳導之間的平衡。該研究中作者根據溶劑分子上F原子數的不同命名為FXDEE(X = 3,4,5,6,圖7g、i),X = 6時即為F完全取代端基C上的H原子。此類分子既是DEE的氟代衍生物,又在結構上與FDMB相似,兩者看似不可協調的優點可以在同一個分子上實現,并達到了很好的平衡,同時實現了高電導率和低過電勢。如圖9a所示,在―CF3基礎上構建了不對稱的―CHF2,實現了更好的性能。正因如此,圖9b中F6DEE并不是性能最好的溶劑,其循環過電位明顯高于其他衍生溶劑;圖9c中F4DEE和F5DEE氧化穩定性甚至高于F6DEE。在XPS分析中發現F3DEE體系、F6DEE體系中SEI表面存在SOxF,表明陰離子未完全分解或鈍化。通過理論計算發現,―CHF2與―CF3相比與Li+作用更強,這可能是由于減少一個F原子使得參與配位的F原子更傾向于提供孤對電子,或者存在更小的空間位阻效應。同時,較多的F取代已經很好地保證了溶劑的抗氧化穩定性,因此如圖9d中F4DEE體系與F5DEE體系的性能最為優異,F4DEE體系有稍好的傳導動力學,而F5DEE體系有較好的循環性能。綜上所述,通過對溶劑的精細調控,能夠在高氧化穩定性、良好的溶解性與電導率之間達到很好的平衡(圖9e)。
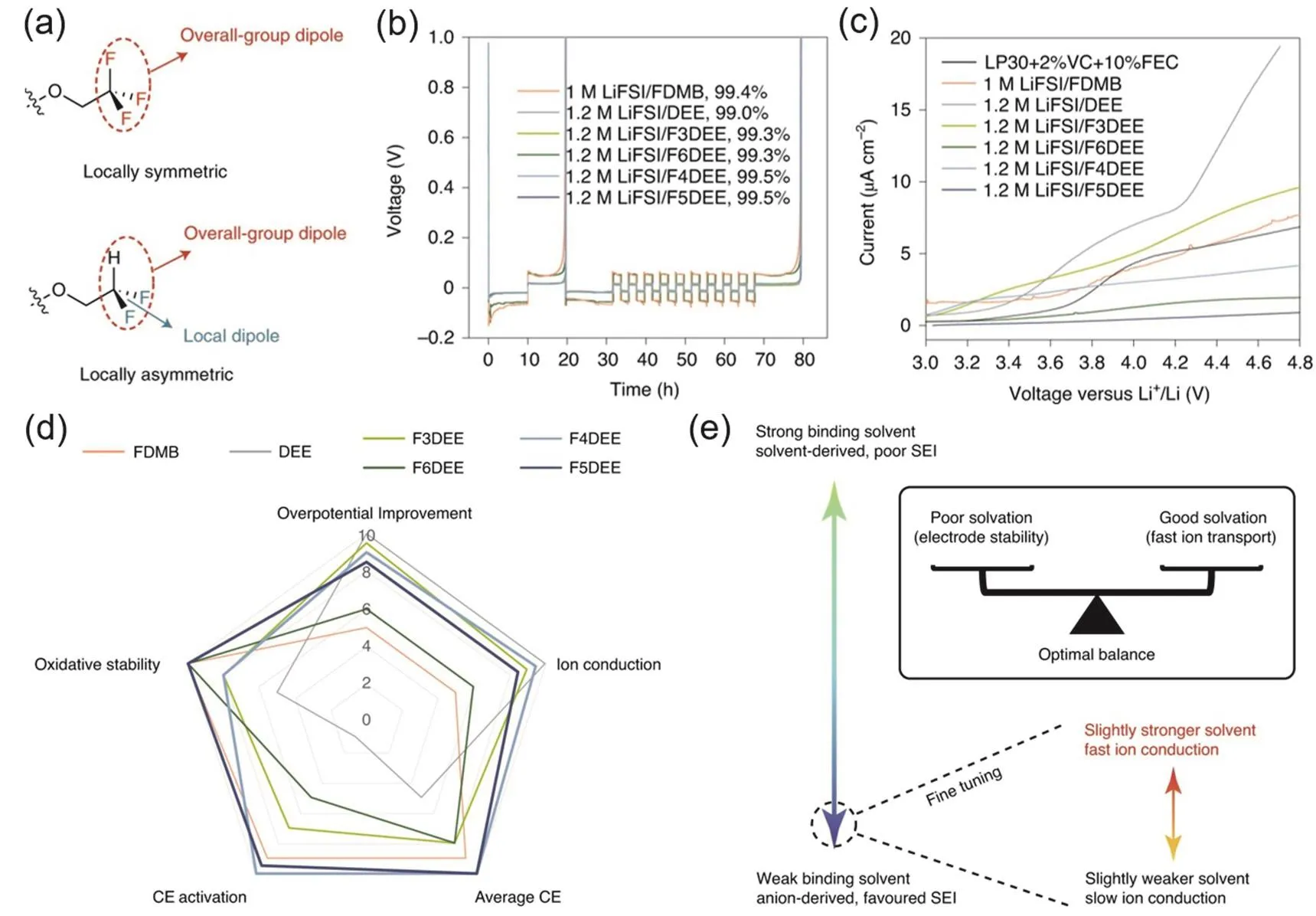
圖9 (a) FXDEE系列分子中的―CF3基團和―CHF2基團;(b,c) FXDEE系列電解液的Li|Cu半電池性能與氧化穩定性;(d) FXDEE系列電解液性能對比;(e)電解液中氧化穩定性與溶解鹽能力的平衡關系示意圖23Fig. 9 (a) ―CF3 group and ―CHF2 group in FXDEE series molecules; (b, c) Li|Cu half-cell performance and oxidation stability of FXDEE series electrolytes; (d, e) schematic diagram of the equilibrium relationship between oxidative stability and ability to dissolve salts in electrolytes 23.
4 其他氟代分子
4.1 氟代磺胺分子
LiFSI81、LiTFSI82等鋰鹽能在電解液中大放異彩,離不開其陰離子的官能團氟代磺胺所具有的優點,即該官能團與Li+相互作用強度適中,具有良好的化學穩定性,分解產物穩定等。利用這種官能團進行分子設計,獲得氟代磺胺分子作為溶劑,已在Li-S電池83和Li-O2電池84中得到了應用,并展現了良好的效果。Xue等85將該分子引入鋰金屬電池電解液中,利用LiFSI和FSA (N,N-二甲基氨基磺酰氟,圖10a)組合成全氟代磺胺電解液。對于鋰金屬負極,其首圈庫侖效率為91.1%,在10圈內迅速達到99%,而且能夠很好地適配NMC622和LMO正極。2021年該團隊37進一步研制出1 mol·L?1LiFSI/DMTMSA (1,1,1-三氟-N,N-二甲基甲磺酰胺,圖10a)。如圖10b所示,該電解液可以有效抑制在碳酸酯電解液體系中出現的鋰枝晶、產氣、正極過渡金屬離子溶出、正極裂紋等問題。在該電解液中,電池放電容量超過230 mAh·g?1,100圈循環庫侖效率超過99.65%;對于NMC 811正極甚至可以充電至4.7 V (vs. Li+/Li),90圈循環后容量保持率 大 于88%。 XPS數 據 分 析 表 明 , 1 mol·L?1LiFSI/DMTMSA電解液體系中形成的CEI含有更多的LiF無機成分和更少的有機成分。利用FXI的X射線吸收近邊緣結構(XANES)模式,測量滿電狀態下正極中的Ni氧化態可以看出,1 mol·L?1LiFSI/DMTMSA體系中Ni的氧化態更高。該團隊86還將1 mol·L?1LiFSI/DMTMSA匹配高電壓(> 4.5 V,vs. Li+/Li)的LCO正極,當充電電壓達到4.55 V時循環200圈后電池容量保持率高達89%,當充電到4.6 V時循環100圈后電池容量保持率為~85%。

圖10 (a)氟代酰胺鹽與氟代酰胺溶劑分子結構;(b) DMTMSA電解液相比于碳酸酯電解液優勢示意圖37;(c)氟代環狀碳酸酯分子結構與全電池性能88Fig. 10 (a) Molecular structure of fluorinated amide salt and fluorinated amide solvent; (b) schematic diagram of the advantages of DMTMSA electrolyte compared to carbonate electrolyte 37; (c) molecular structures of fluorinated cyclic carbonates and full cell test performance 88.
4.2 氟代碳酸酯分子
和醚類分子比較,碳酸酯分子在鋰金屬界面反應性更強,并且生成的SEI疏松多孔不穩定,庫侖效率較低;但碳酸酯分子的抗氧化穩定性較強,可以匹配高電壓正極材料,因此仍是十分重要的研究方向87,89,90。Zhang等87通過理論計算模擬,研究了不同位點F取代的直鏈碳酸酯溶劑對鋰金屬電池性能的影響。該研究的模擬結果表明,碳鏈長度對LiF產生具有重要影響,鋰金屬晶面對溶劑的反應活性也有重要作用。另外,鋰鹽的存在以及―CF3基團的數量與分布都是影響反應活性的重要因素。從總體來看,含有較少―CF3基團和較短氟化烷基鏈的直鏈碳酸酯溶劑可能有助于形成更多的LiF,生成富含LiF的SEI。
而對于環狀碳酸酯EC,不同位置和數量的F取代也有不同效果。Su等88于2019年首次報道了DFEC (雙氟代碳酸乙烯酯),是一種新型的穩定溶劑。與傳統的碳酸乙烯酯相比,DFEC還原分解形成的穩定SEI顯著了提升了鋰金屬電池的循環性能。如圖10c所示,Li||NMC622電池體系在1.2 mol·L?1LiPF6/DFEC/EMC電解液中能夠穩定循環400圈以上;但若將―CF3基團取代至EC上形成TFPC (4-三氟代甲基碳酸乙烯酯),其配制的電解液性能與EC組十分相近,無明顯提高。而Zhang等91利用密度泛函理論(DFT)對FEC和DFEC兩種溶劑分解路徑進行模擬,發現兩者的分解路徑不同導致產生SEI組分也有差異。FEC的一種分解路徑導致產生碳酸鋰和氟代乙烯,另一種分解路徑則導致產生一氧化碳和氟化鋰。對于DFEC體系,理論模擬計算預測,一種機制導致碳酸亞乙烯酯和氟化鋰的形成,另一種機制導致一氧化碳、氟化鋰和乙二醛的形成。并且FEC分解傾向形成低聚合物,而DFEC傾向分解產生長鏈聚合物,因而FEC生成的SEI更加致密。Zhu等92也對EC、FEC、DFEC、TFEC等溶劑進行對比研究,用來揭示SEI的設計原理。研究發現由DFEC體系形成的SEI中LiF的含量最高(10.6%,原子分數),但TFEC體系形成的SEI中僅含有少量的LiF (1.7%)。并且由于分子結構中F原子數量的增加,DFEC分子和TFEC分子的反應性下降,溶劑分子分解不完全,導致所形成的SEI結構不夠致密,因而在含有FEC的電解液中電池的綜合性能最好。
最近文獻也報道了將鏈狀碳酸酯分子與環狀碳酸酯聯合使用,能夠協同提升電池性能,例如上文中提到的1.28 mol·L?1LiFSI/FEC/FEMC/D2和0.7 mol·L?1LiBETI/FEC/DEC/M354。Su等93報道了三元電解液1.2 mol·L?1LiPF6/FEC/DFEC/FEMC (溶劑體積比3 : 3 : 14),該電解液匹配NMC811正極在3.0–4.4 V電壓下能夠穩定循環200圈,容量保持率> 90%。在該電解液體系中DFEC分解形成良好的SEI,而FEMC擁有優異的負極穩定性,并且通過FEC的溶劑化保護作用減輕FEMC分解產生的有害影響。Xiao等94開發了一種不易燃的高電壓電解液1 mol·L?1LiPF6/FEC/BTFEC,該電解液設計中主要利用氟代碳酸酯為溶劑,大幅提升了電池性能。該電解液在Li|Cu半電池循環中表現了較高的庫侖效率,300圈平均庫侖效率為~98.8%。并且該電解液能夠在?30 – 70 °C低溫情況下正常運行,Li||NCM全電池在高電壓4.7 V下能夠穩定循環160圈,容量保持率為95.1%。
5 總結與展望
Li與F,分別位于元素周期表第一周期的兩端,注定發生奇妙的反應35。將F引入到溶劑中的優點主要有:(1)提升電解液的氧化穩定性、阻燃性、浸潤性等,使電池運行更安全;(2)電解液在正負極界面分解產生LiF,形成強健、均勻、致密的SEI和CEI,有效保護鋰金屬負極和高壓正極界面95;(3)改變電解液中Li+的配位結構,產生獨特的溶劑化鞘層,進而影響電池性能。綜上所述,氟代溶劑對鋰金屬電池的作用明顯,應用廣泛。
F原子在溶劑分子中的位置與數量不同,會發揮出不同的作用:(1)將溶劑分子高度F取代,不能溶解鋰鹽,利用其穩定性和惰性形成稀釋劑;(2)對于醚類溶劑而言,由于誘導效應,對α-C位置進行F取代會大幅降低Li+的溶解度,但對β-C位置進行F取代既可以保持一定的溶解度又能很好地發揮F的作用;但這對碳酸酯溶劑并不適用,α-C位置進行F取代對碳酸酯效果更佳;(3)溶劑分子在有一定數量F原子的前提下,對于端基C位置的F取代,―CHF2比―CF3表現出更好的動力學優勢,且保持了溶劑分子良好的氧化穩定性。
鋰金屬電池的發展已經進入了嶄新的階段,不斷有新的研究方法出現96、對機理研究愈發深入97、研究目標開始向CE > 99.9%逼近98,面向實用化的軟包鋰金屬電池也進展迅速99。實現鋰金屬電池更高效、更安全的大規模商業化應用,是幾代科研人的追求。而對溶劑進行氟取代,對溶劑結構進行合理設計無疑是一種行之有效的方法。雖然目前已開發出的氟代電解液種類并不多,但對電解液進行氟取代的作用與規律正在逐漸明晰,且溶劑的選擇也多種多樣,期待將來會有新型高效氟代溶劑的出現,使得鋰金屬電池真正走向大眾。

